基于高通量测序的磷石膏上芒草内部细菌多样性分析
2023-09-06李剑峰郭欣杨张淑卿倪明秀张煜冕郭金梅
周 炀,李剑峰*,郭欣杨,张淑卿,倪明秀,张煜冕,郭金梅
[1.贵州省高等学校生物资源开发利用重点实验室,贵州贵阳 550018;2.贵州师范学院喀斯特生境土壤与环境生物修复研究所,贵州贵阳 550018;3.贵州磷化(集团)有限责任公司,贵州贵阳550000]
磷石膏是湿法磷酸生产过程中的副产物,主要成分为二水硫酸钙,除此之外还有部分重金属元素、可溶性磷酸盐及氟化物等杂质[1]。经计算每生产1 t 湿法磷酸,将排放出约5 t 的磷石膏废渣[2]。目前,国内对于磷石膏利用率不足40%,大部分是通过堆存方式处理,这种处理方式不仅占据了大量的土地资源,而且其潜在的污染物泄露和垮堆风险也会对当地居民的身体和生态环境造成威胁[3]。磷石膏的低成本处理与有效利用始终是我国磷化工业的一大难题。
芒草(Miscanthus Sinensis)为禾本科(Gramineae)芒属植物[4],通常分布在热带、亚热带及温带亚洲地区。芒草在我国分布较广,其对于环境的适应能力非常强,在各种恶劣环境下都能够生存[5]。目前已有将芒草应用于重金属土壤修复的相关研究报道,并发现芒草能够耐受一种甚至多种高浓度重金属元素的胁迫[6]。贵州作为磷石膏生产排放的集中区域,且磷石膏的产出量在逐年增长,对于磷石膏的有效处理已成为当今贵州乃至全国的热点问题。目前,有关利用芒草植株修复磷石膏堆渣污染的相关研究报道还较为少见,因此具有较大的研究意义。
1 材料与方法
1.1 材料
2021 年7 月,在贵州省贵阳市开阳县龙景湾贵州磷化集团开阳露天堆场(东经106.852 3°,北纬27.151 3°)采集磷石膏上生长的芒草植株和种子样品,采集时芒草呈深绿色,群落单一,株高在0.4~1.2 m。
1.2 方法
1.2.1 样品处理
将植株根系挖出,用无菌水清洗表面后放入阴凉通风处自然风干,待植株风干后与种子一同装入无菌自封袋内放入4 ℃冰箱暂存。
1.2.2 DNA提取及测序
根据试剂盒要求提取样本的DNA,利用1%的琼脂糖凝胶电泳测定DNA 纯度。采用16SrDNA 对于V3-V4 引物进行扩增,引物序列为(上游引物338F:ACTCCTACGGGAGGCAGCAG,下游引物 806R:GGACTACHVGGGTWTCTAAT)PCR 反应参数:a.1×(3 min at 95 ℃)b.循环数×30 s at 95 ℃;30 s at 55 ℃;45 s at 72 ℃)c.10 min at 72 ℃,10 ℃until halted by user。根据各样品的测序量,将其配置成对应的配比,送至生工(上海)生物工程有限公司,利用Illumina 公司的Miseq PE300,对其进行高通量测序。
2 结果与分析
2.1 细菌多样性分析
2.1.1 测序数据处理结果
如表1所示,样品经过高通量测序共获得124 097条原始序列,经对原始数据初步处理,获得了123 363条有效的序列。供试样本有效序列条数在51 383~71 980 条,其中phps(芒草种子)有效序列条数大于php(芒草植株)。通过聚类一共获得274个OTUS,通常将相似性值≥97%的序列定义为同一个OTUS。为了比较直观地分析和统计,对于测序样本的共有OTUS和特有OTUS 进行分析比较,结果显示,php 与phps的共有OTUS 有138 个,php 特有OTUS 为66 个,phps特有OTUS 为70 个,即php 与phps 的微生物群落组成较为相似。

表1 芒草植株及种子有效序列数据统计
2.1.2 α多样性
样品稀释曲线倾斜度在不断降低逐渐趋于平缓(见图1),同时样品中测序覆盖度均为1(见表2),说明测序数据量比较合理,基本上能够反映出样品细菌群落的组成情况[7]。通过计算Ace指数、Chao指数、Shannon指数等三个指标结果表明,php细菌多样性大于phps。
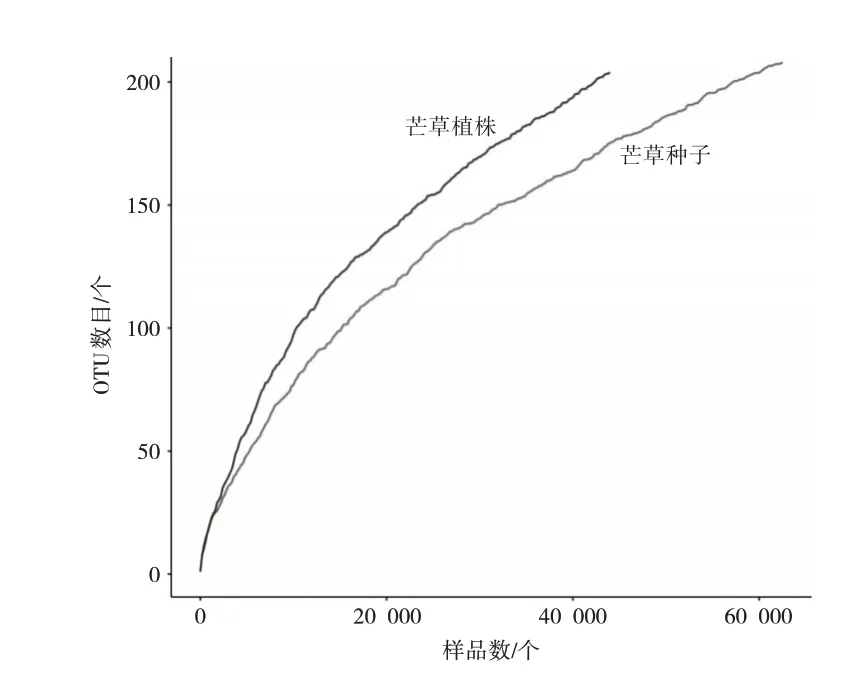
图1 基于OTUS丰度的样品微生物群落稀释曲线

表2 芒草植株及种子的细菌α多样性
Rank Abundance 曲线图能够直观明确地展示各样本中OTUS 的均匀度及丰富度,如图2 所示,当OTU数量小于100时,php与phps的物种相对丰度较高,但曲线下降速度比较快,说明php 与phps 的分布均匀程度较低。当OTU 数量超过100 的情况下,物种的相对丰度较低,但是曲线比较平坦,表明物种分布较为均衡。图中php 与phps 样本间的曲线宽度、平滑程度都比较一致,表明其物种丰度及均匀度都无显著差异。
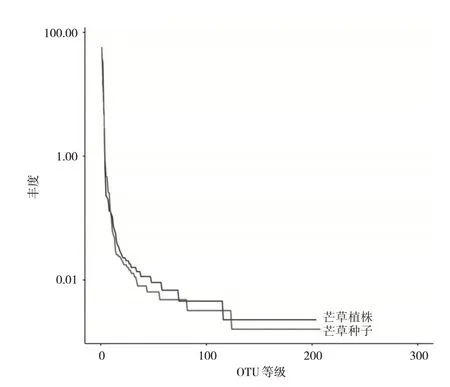
图2 基于OTUS水平Rank Abundance曲线分析
2.1.3 样本主成分
通过主成分(PCA)分析可知,主成分1(PC1)和主成分2(PC2)贡献率分别为58.23% 和40.5%,合计为98.73%。如图3 所示,两样本点的距离十分接近,且位于第一象限有明显的聚集,表明php 与phps 的细菌相似性较高。
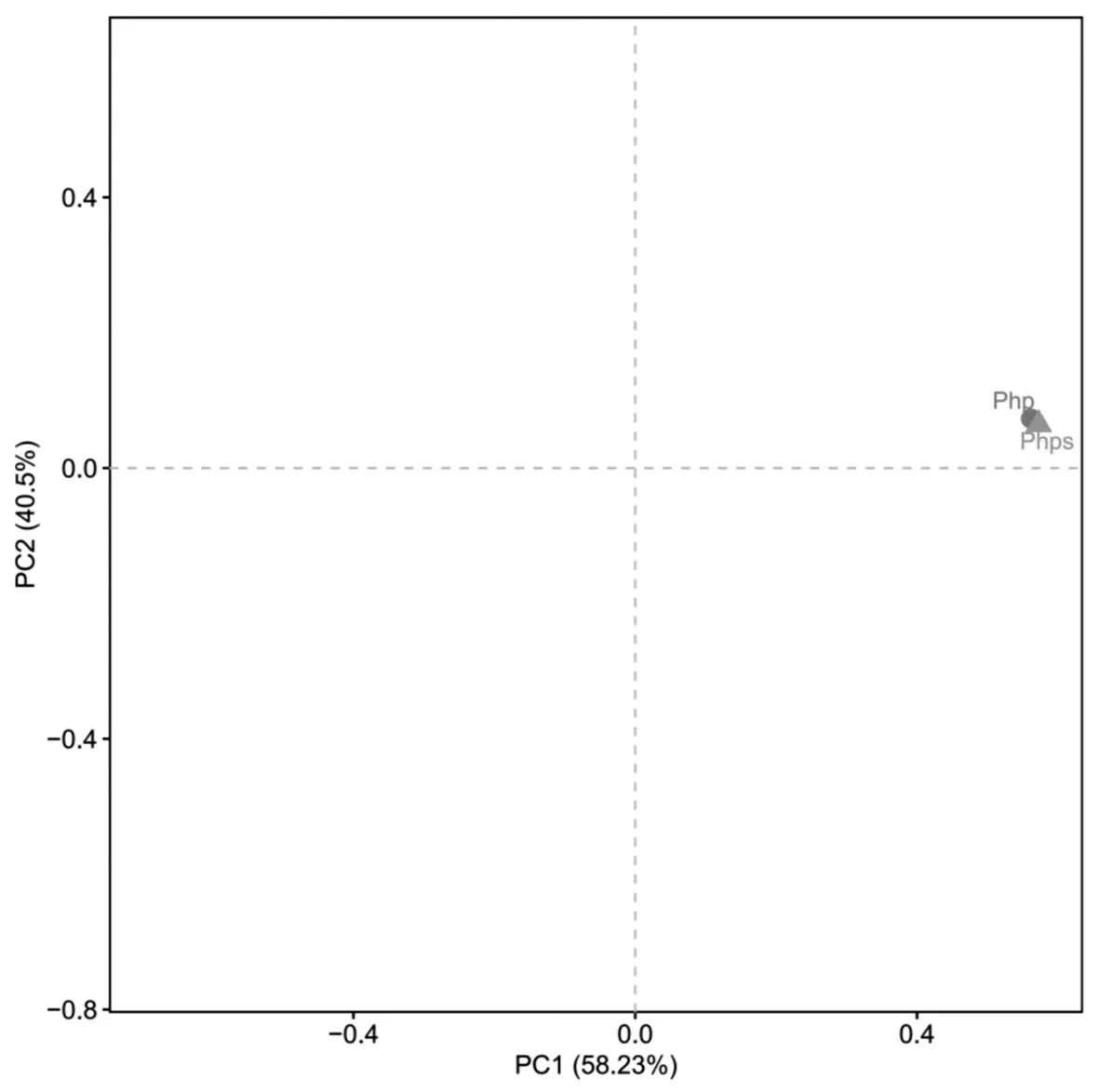
图3 芒草植株和种子OTU水平PCA图
2.2 细菌群落结构差异分析
2.2.1 门水平下陈化磷石膏上生长芒草植株及种子细菌群落结构
在门水平下,一共鉴定出17 个门类细菌,如表3所示,丰度低于1%的细菌门合并为Others,其中,芒草植株(php)及种子(phps)共有的优势细菌门为蓝菌门(Cyanobacteria_Chloroplast)。如图4 所示,蓝菌门细菌在芒草植株、种子内部的相对丰度分别为59%、79.3%,即蓝菌门的相对丰度phps大于php。原因可能是:1)种子相对于植株而言,营养物质积累较多,较多的营养物质有利于蓝菌门的生长,所以种子内部的蓝菌门丰度较大;2)在细菌功能方面,蓝菌门的菌类具有较强的抗紫外线辐射能力,在较强紫外线的辐射下能够形成一种代谢响应机制,使其适应紫外辐射的胁迫[8]。
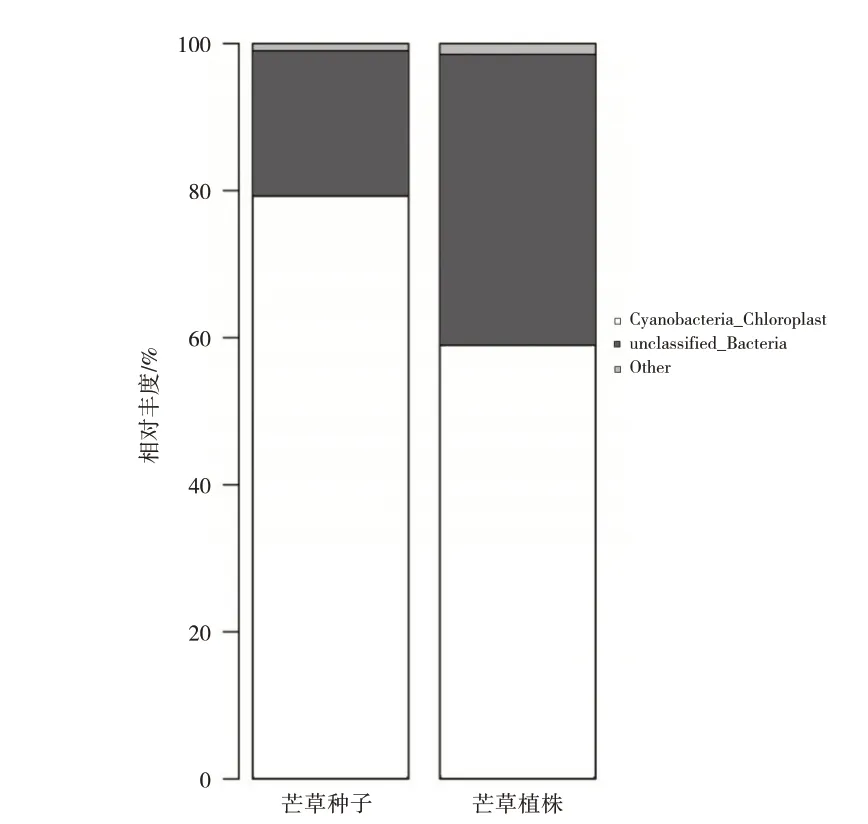
图4 门水平下芒草植株及种子细菌相对丰度图
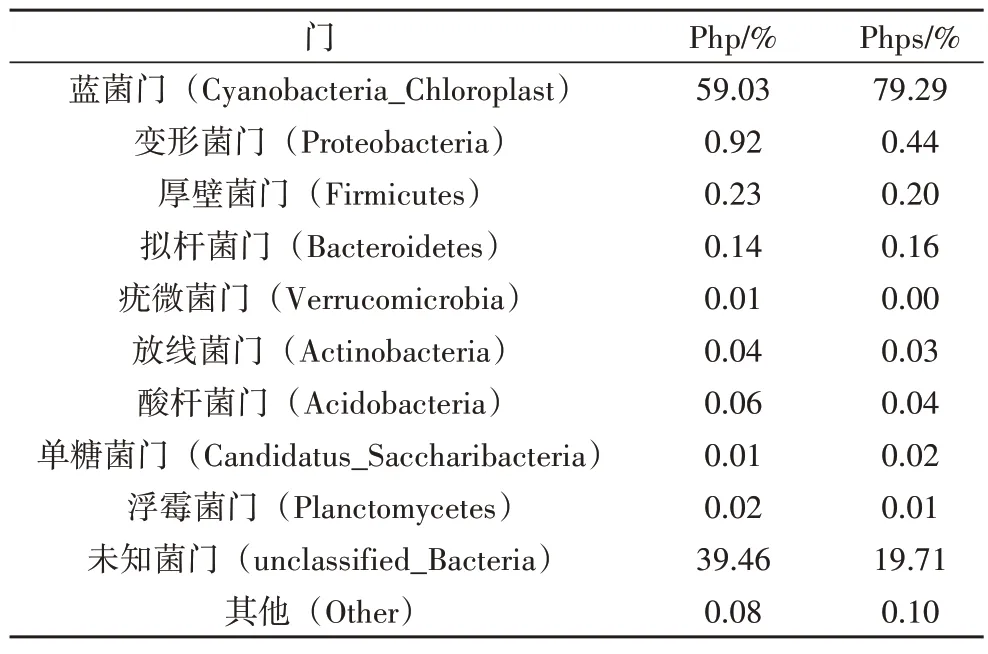
表3 门水平下芒草植株及种子细菌相对丰度表
2.2.2 属水平下陈化磷石膏上生长芒草植株及种子细菌相对丰度
在属水平下,共检测出148 个属的细菌,在芒草植株中链型植物(Streptophyta 59%)占比最大,其次是未知菌属细菌(unclassified_Bacteria 39.5%);鞘氨醇单胞菌属(Sphingomonas 0.07%)为植株菌群内部的重要细菌群落,在芒草种子(phps)中占比最大的同样为链型植物(Streptophyta 79.2%),其次为未知菌属(unclassified_Bacteria 19.8%)。如表4、图5 所示,在植株到种子过程中,其内部链型植物、未知菌丰度逐渐增大,但鞘氨醇单胞菌属、链霉菌属等细菌丰度相对减少。链型植物占比较高的原因可能为芒草植株及种子内部叶绿体信息没有被排除,导致测序结果中链型植物数据占了绝大部分。芒草植株之所以能够在磷石膏上生长,原因可能是鞘氨醇单胞菌属、链霉菌属细菌对植物的生长也起着一定的促进作用。鞘氨醇单胞菌属细菌常被研究者用于修复重金属污染土壤[9]。

图5 属水平下芒草植株及种子细菌相对丰度图
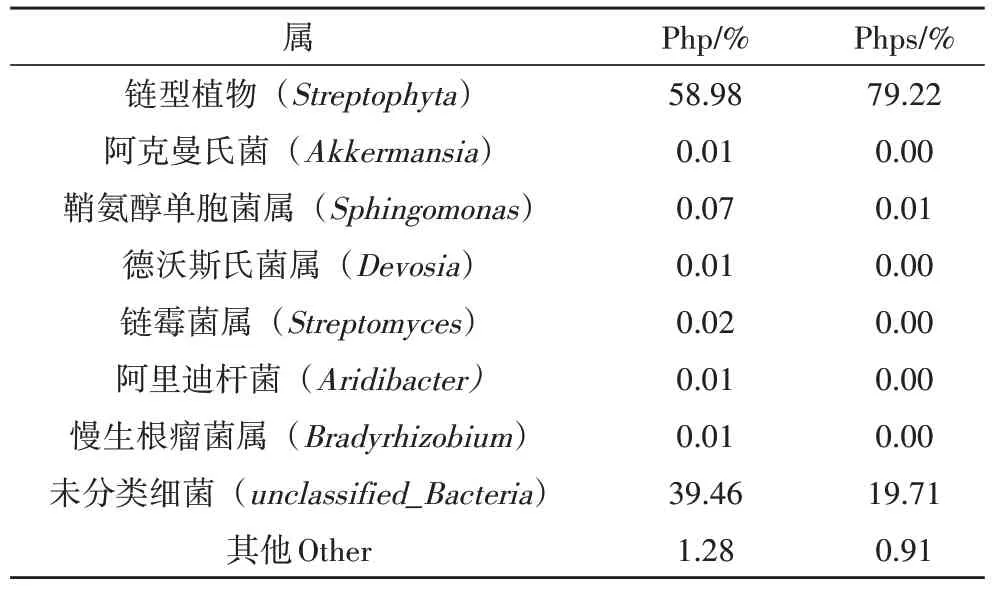
表4 属水平下芒草植株及种子细菌相对丰度表
2.3 16s功能预测分析
如图6 所示,在php 与phps 中,其功能性强的前五类均为:信号转导组氨酸激酶、糖基转移酶、由CheY 样受体域和翼螺旋DNA 结合结构域组成的响应调节剂、蓝藻中保守的未表征蛋白质、未表征的低复杂度蛋白质,且种子内部功能丰度值高于植株。其中植株与种子中功能性最强的均为信号转导组氨酸激酶。组氨酸激酶可以作为细菌细胞中的重要信号感知分子,细菌可以利用组氨酸激酶来感受胞外环境的变化,作为一种自身具有激酶、磷酸转移酶和磷酸酶活性的多功能酶,组氨酸激酶能够作为信号分子的细胞受体,且具有跨细胞膜信号转导的功能。这种转导信号在细菌、酵母菌和高等植物中都有发现[10-11]。

图6 COG功能预测热图
3 讨论与结论
本研究以磷石膏上芒草植株和种子为研究对象,利用高通量测序技术对微生物多样性进行细致研究,结果显示:在门水平上,其共同的优势菌门是蓝菌门。在属水平上,鞘氨醇单胞菌属细菌(Sphingomonas)、链霉菌属细菌(Streptomyces)为优势菌属,且php 中两种优势细菌相对丰度高于phps。这两种细菌在植物生长及抗逆性方面都起着较为重要的作用。黄媛林等对一株红树林链霉菌所产抑菌活性化合物的分离及其生物合成基因簇的研究表明,链霉菌的次生代谢产物具有多种抗性的功效,且多被用作生物防治剂[12]。何晓红等对鞘氨醇单胞菌的各项功能的综述研究表明,鞘氨醇单胞菌能够耐受恶劣环境及贫瘠营养环境,且能够促进植物生长与抵抗多种植物病原菌[13]。
目前,链霉菌属与鞘氨醇单胞菌属已广泛用于重金属污染的土壤植物与植物促生菌的联合修复研究[14],微生物环境修复仍然是目前研究的热点问题之一。然而现阶段对于磷石膏的处理利用及其内部元素对于环境污染的系统研究还比较缺乏,这些都将成为未来磷石膏堆渣污染研究的重要课题。芒草植株能够在磷石膏堆渣上面生存的原因可能是由于链霉菌与鞘氨醇单胞菌的存在,这两株细菌具备开发成为磷石膏堆渣治理与利用的植物促生菌的潜在价值,值得进一步开发与研究。
