咪达唑仑通过调节Nrf2/HO-1 信号通路对宫颈癌细胞铁死亡的作用及机制研究
2023-09-06张鹏葛亮孔令国韩旭东
张鹏 葛亮 孔令国 韩旭东
甘肃省妇幼保健院(甘肃省中心医院)麻醉科(兰州 730050)
宫颈癌是常见的妇科癌症之一,发病率和病死率极高。虽然手术、化疗、放疗等治疗方法已在临床得到应用,但预后并不令人满意,总生存率仍较低[1]。因此,迫切需要探索新的治疗靶点和疗法。研究表明,靶向铁死亡可能是治疗宫颈癌的一种可行策略[2]。铁死亡是一种铁依赖的脂质过氧化物积累达到致死水平的细胞死亡调控形式[3]。核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2)/血红素氧合酶-1(heme oxygenase-1,HO-1)是调控铁死亡的关键通路之一,该通路激活后可抑制脂质过氧化反应,保护细胞免受铁死亡[4]。咪达唑仑是一种吸收迅速、短效的苯二氮类衍生物,临床中被广泛用作镇静、催眠药[5]。近年来,有研究发现咪达唑仑可影响肝细胞癌[6]、肺癌[7]、乳腺癌[8]、神经胶质瘤[9]等多种肿瘤的发展,是一种潜在抗癌药物。然而,但咪达唑仑在宫颈癌中的作用以及是否影响铁死亡的发生仍鲜见报道。本研究旨在通过体外培养人宫颈癌HeLa 细胞,观察咪达唑仑对HeLa 细胞铁死亡的影响,并探究调节Nrf2/HO-1 信号通路作为其分子机制的可能性。
1 材料与方法
1.1 材料 HeLa细胞(货号4613210,上海奥陆生物科技公司);咪达唑仑(批号20210509,江苏恩华药业公司);Nrf2 激活剂Bardoxolone(货号HY-14909,Med Chem Express 公司);CCK-8 试剂、0.1%结晶紫染液(货号CA1210、G5500,北京Solarbio 公司);碘化丙啶(propidium iodide,PI)(货号P4170,上海玉博生物科技公司);醋酸铀(货号ZCA-JPH534,上海甄准生物科技公司);柠檬酸铅(货号0002,武汉普洛夫生物科技公司);铁检测试剂盒(货号ab83366,Abcam 公司);活性氧(reactive oxygen species,ROS)、谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)检测试剂盒(货号S0033S、S0052、S0131S,上海Beyotime 公司);RIPA 裂解液、BCA 试剂盒、兔源一抗anti-GAPDH、山羊抗兔二抗(货号WLA016a、WLA004a、WL01114、WLA023,沈阳Wanleibio 公司);兔源一抗anti-Nrf2、anti-HO-1、anti-GSH 过氧化物酶4(GSH peroxidase 4,GPX4)、Lamin B1(货号ab62352、ab68477、ab125066、ab133741,Abcam 公司)。
1.2 细胞培养 HeLa 细胞采用DMEM 培养基(含10%胎牛血清、1%青-链霉素双抗),培养于37 ℃、5% CO2培养箱中,待细胞密度达90%时收集。
1.3 CCK-8 实验、克隆形成实验检测各组HeLa细胞增殖情况
1.3.1 CCK-8实验 将HeLa细胞以5×103个/孔接种至96 孔板中,待贴壁后将其分为L-咪达唑仑组/M-咪达唑仑组/H-咪达唑仑组(5、10、20 μmol/L 咪达唑仑)[8]、H-咪达唑仑+Nrf2 激活剂组(20 μmol/L咪达唑仑+80 nmol/L Bardoxolone[10]),另设置正常培养的对照(Control)组,继续培养24 h。随后加入CCK-8 溶液,继续孵育2 h,通过SKSW-KC 酶标仪测定450 nm 波长处的吸光度(OD)。细胞活力与OD450值呈正比。
1.3.2 克隆形成实验 将HeLa 细胞以1 × 103个/孔接种至6 孔板中,待贴壁后分组处理同上。继续培养24 h 后置于4%多聚甲醛中固定20 min,而后置于0.1%结晶紫中染色10 min,于显微镜下计数≥50 个细胞的克隆数。
1.4 PI 染色检测各组HeLa 细胞死亡率 将HeLa细胞以1 × 106个/孔接种至6 孔板中,待贴壁后分组处理同1.3。继续培养24 h 后收集细胞,并转移至流式管中,加入5 μL PI,4 ℃孵育5 min,通过BD FACSCanto Ⅱ流式细胞仪测定细胞死亡率。
1.5 透射电镜观察各组HeLa 细胞线粒体形态变化 将HeLa细胞以1×106个/孔接种至6孔板中,待贴壁后分组处理同1.3。继续培养24 h 后收集细胞,加入2.5%戊二醛4 ℃固定过夜,次日PBS 清洗后加入1%锇酸固定2 h,乙醇梯度脱水后进行环氧树脂包埋、超薄切片(60~80 nm),最后醋酸铀、柠檬酸铅各染色15 min,通过H-7650 透射电镜捕获图像。
1.6 检测各组HeLa 细胞中铁、ROS、GSH、MDA水平 将HeLa 细胞以1 × 106个/孔接种至6 孔板中,待贴壁后分组处理同1.3。继续培养24 h 后收集细胞,利用铁、ROS、GSH、MDA 检测试剂盒分别检测细胞裂解液中的铁、ROS、GSH、MDA 水平。
1.7 Western blot检测各组HeLa细胞中Nrf2/HO-1信号通路相关蛋白及GPX4蛋白表达情况 将HeLa细胞以1 × 106个/孔接种至6 孔板中,待贴壁后分组处理同1.3。继续培养24 h 后收集细胞,利用RIPA 裂解液提取总蛋白,BCA 法测定浓度后进行定量、变性处理,随后进行凝胶电泳分离蛋白、转膜、封闭,孵育兔源一抗anti-Nrf2、anti-HO-1、anti-GPX4、Lamin B、anti-GAPDH(4 ℃过夜),次日室温孵育山羊抗兔二抗2 h,滴加ECL 发光液后置于Tan5200 凝胶成像分析系统中拍照,借助Image J软件进行灰度分析。
1.8 统计学方法 采用SPSS 25.0进行统计学分析。计量资料以(±s)表示,多组间比较行One-way ANOVA 分析,进一步两两比较行SNK-q检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 各组HeLa 细胞增殖情况 与Control 组比较,L-咪达唑仑组、M-咪达唑仑组、H-咪达唑仑组HeLa细胞活力下降,克隆数减少,且H-咪达唑仑组变化更明显(P<0.05);与H-咪达唑仑组比较,H-咪达唑仑+Nrf2 激活剂组HeLa 细胞活力升高,克隆数增加(P<0.05)。见图1、表1。
表1 各组HeLa 细胞增殖情况Tab.1 Proliferation of HeLa cells in each group ±s

表1 各组HeLa 细胞增殖情况Tab.1 Proliferation of HeLa cells in each group ±s
注:与Control 组比较,*P <0.05;与L-咪达唑仑组比较,#P <0.05;与M-咪达唑仑组比较,△P <0.05;与H-咪达唑仑组比较,▲P <0.05
组别Control组L-咪达唑仑组M-咪达唑仑组H-咪达唑仑组H-咪达唑仑+Nrf2激活剂组F值P值n4 4 4 4 4细胞活力(OD450值)1.54±0.15 1.27±0.12*0.94±0.11*#0.61±0.08*#△0.97±0.12▲35.768<0.001克隆数(个)132.45±10.93 107.28±9.41*81.45±6.52*#52.61±4.39*#△76.18±6.15▲61.159<0.001

图1 克隆形成实验检测HeLa 细胞克隆数Fig.1 Clonal formation experiment to detect the number of HeLa cell clones
2.2 各组HeLa 细胞死亡率 与Control 组比较,L-咪达唑仑组、M-咪达唑仑组、H-咪达唑仑组HeLa细胞死亡率增加,且H-咪达唑仑组变化更明显(P<0.05);与H-咪达唑仑组比较,H-咪达唑仑+Nrf2 激活剂组HeLa 细胞死亡率减少(P<0.05)。见图2、表2。
表2 各组HeLa 细胞死亡率Tab.2 HeLa cell mortality in each group ±s,%
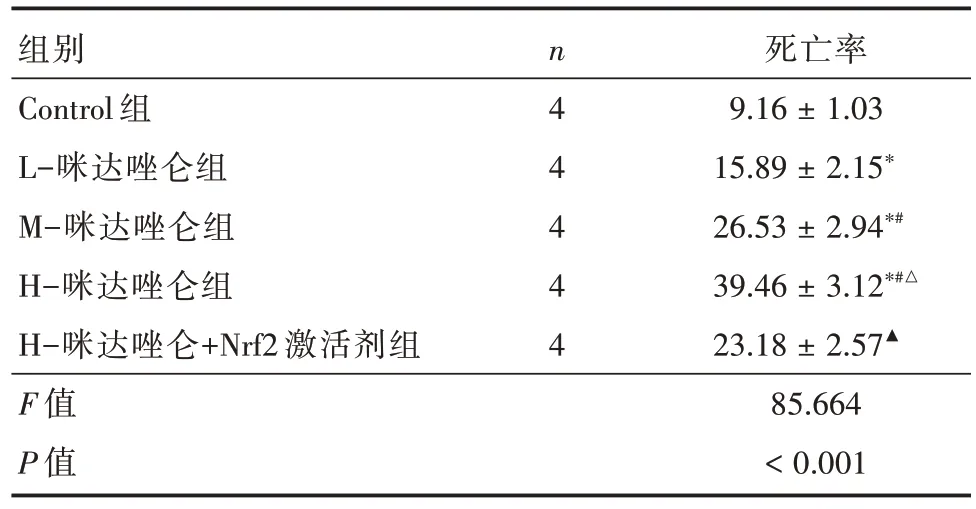
表2 各组HeLa 细胞死亡率Tab.2 HeLa cell mortality in each group ±s,%
注:与Control 组比较,*P <0.05;与L-咪达唑仑组比较,#P <0.05;与M-咪达唑仑组比较,△P <0.05;与H-咪达唑仑组比较,▲P <0.05
组别Control 组L-咪达唑仑组M-咪达唑仑组H-咪达唑仑组H-咪达唑仑+Nrf2 激活剂组F 值P 值n4 4 4 4 4死亡率9.16 ± 1.03 15.89 ± 2.15*26.53 ± 2.94*#39.46 ± 3.12*#△23.18 ± 2.57▲85.664<0.001
2.3 各组HeLa 细胞线粒体形态变化 Control 组HeLa 细胞线粒体形态正常,经L-咪达唑仑组、M-咪达唑仑、H-咪达唑仑处理后,线粒体呈现显著的铁死亡特征,体积缩小,膜密度增加,嵴减少,且H-咪达唑仑组变化更明显;而在H-咪达唑仑处理的同时增加Nrf2 激活剂处理,线粒体铁死亡损伤程度减轻。见图3。

图3 透射电镜观察HeLa 细胞线粒体形态变化(× 15 000)Fig.3 Morphological changes of mitochondria in HeLa cells observed by transmission electron microscopy(× 15 000)
2.4 各组HeLa 细胞中铁、ROS、GSH、MDA 水平及GPX4 蛋白表达情况 与Control 组比较,L-咪达唑仑组、M-咪达唑仑组、H-咪达唑仑组HeLa 细胞中铁、ROS、MDA 水平升高,GSH 水平及GPX4 蛋白表达下降,且H-咪达唑仑组变化更明显(P<0.05);与H-咪达唑仑组比较,H-咪达唑仑+Nrf2 激活剂组HeLa 细胞中铁、ROS、MDA 水平下降,GSH 水平及GPX4 蛋白表达升高(P<0.05)。见图4、表3。
表3 各组HeLa 细胞中铁、ROS、GSH、MDA 水平及GPX4 蛋白表达情况Tab.3 The levels of iron,ROS,GSH,MDA,and GPX4 protein expression in HeLa cells in each group ±s

表3 各组HeLa 细胞中铁、ROS、GSH、MDA 水平及GPX4 蛋白表达情况Tab.3 The levels of iron,ROS,GSH,MDA,and GPX4 protein expression in HeLa cells in each group ±s
注:与Control 组比较,*P <0.05;与L-咪达唑仑组比较,#P <0.05;与M-咪达唑仑组比较,△P <0.05;与H-咪达唑仑组比较,▲P <0.05
组别Control 组L-咪达唑仑组M-咪达唑仑组H-咪达唑仑组H-咪达唑仑+Nrf2 激活剂组F 值P 值n4 4 4 4 4铁(nmol/mg)0.46 ± 0.08 0.81 ± 0.10*1.52 ± 0.13*#2.14 ± 0.21*#△1.39 ± 0.15▲85.151<0.001 ROS(%Control)1.05 ± 0.12 1.53 ± 0.16*2.18 ± 0.21*#2.93 ± 0.27*#△1.86 ± 0.19▲51.782<0.001 GSH(nmol/mg)1.79 ± 0.16 1.45 ± 0.12*1.18 ± 0.10*#0.78 ± 0.09*#△1.06 ± 0.11▲42.271<0.001 MDA(nmol/mg)7.15 ± 1.02 10.86 ± 1.23*14.31 ± 1.62*#18.06 ± 2.08*#△13.29 ± 1.71▲26.493<0.001 GPX4/GAPDH 0.94 ± 0.09 0.78 ± 0.07*0.59 ± 0.07*#0.31 ± 0.04*#△0.53 ± 0.06▲50.346<0.001

图4 Western blot 检测HeLa 细胞中GPX4 蛋白表达情况Fig.4 Western blot detection of GPX4 protein expression in HeLa cells
2.5 各组HeLa 细胞中Nrf2/HO-1 信号通路相关蛋白表达情况 与Control 组比较,L-咪达唑仑组、M-咪达唑仑组、H-咪达唑仑组HeLa 细胞中核Nrf2、HO-1 蛋白表达下降,且H-咪达唑仑组变化更明显(P<0.05);与H-咪达唑仑组比较,H-咪达唑仑+Nrf2 激活剂组HeLa 细胞中核Nrf2、HO-1 蛋白表达升高(P<0.05)。见图5、表4。
表4 各组HeLa 细胞中Nrf2/HO-1 信号通路相关蛋白表达情况Tab.4 Expression of Nrf2/HO-1 signal pathway related proteins in HeLa cells of each group ±s
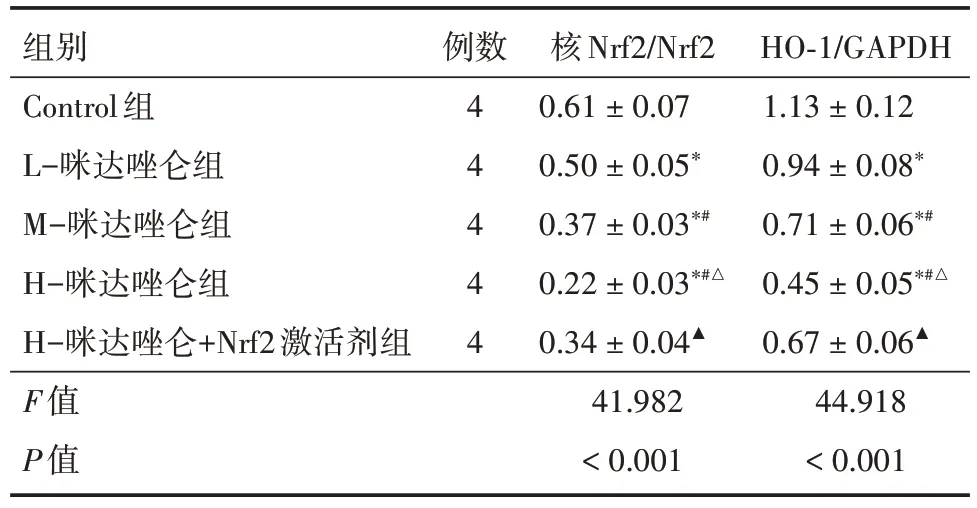
表4 各组HeLa 细胞中Nrf2/HO-1 信号通路相关蛋白表达情况Tab.4 Expression of Nrf2/HO-1 signal pathway related proteins in HeLa cells of each group ±s
注:与Control 组比较,*P <0.05;与L-咪达唑仑组比较,#P <0.05;与M-咪达唑仑组比较,△P <0.05;与H-咪达唑仑组比较,▲P <0.05
组别Control组L-咪达唑仑组M-咪达唑仑组H-咪达唑仑组H-咪达唑仑+Nrf2激活剂组F值P值例数4 4 4 4 4核Nrf2/Nrf2 0.61±0.07 0.50±0.05*0.37±0.03*#0.22±0.03*#△0.34±0.04▲41.982<0.001 HO-1/GAPDH 1.13±0.12 0.94±0.08*0.71±0.06*#0.45±0.05*#△0.67±0.06▲44.918<0.001

图5 Western blot 检测HeLa 细胞中Nrf2/HO-1 信号通路相关蛋白表达情况Fig.5 Western blot detection of Nrf2/HO-1 signal pathway related protein expression in HeLa cells
3 讨论
宫颈癌是全球发病率和病死率极高的恶性肿瘤类型[11-12]。宫颈癌的主要治疗策略是手术和化疗,但化疗易产生耐药性,转移和复发率仍较高,预后不理想[13]。因此,迫切需要寻找新的机制或治疗方案。
近年来,靶向铁死亡已成为癌症治疗的热门研究领域[14-15]。铁死亡为一种铁依赖的脂质过氧化物积累引发的细胞死亡形式,伴有特征性的形态学变化,包括线粒体皱缩,膜密度增加,嵴数量减少或消失,生化表现主要有ROS 堆积,毒性脂质过氧化产物MDA 大量产生[16-17]。GPX4 是一种抗铁死亡介质,GPX4 可催化还原型GSH 生成氧化型GSH,而在此过程中,毒性脂质过氧化物被还原为反应性较低的羟基化合物,也就是说,GPX4 可通过将GSH 作为底物终止铁死亡的发生,故铁死亡的生化表现亦伴随GPX4、GSH 的耗竭[18]。目前,咪达唑仑已被证实具有潜在的抗肿瘤作用,例如,QI 等[6]发现咪达唑仑可通过上调miR-124-3p 抑制肝细胞癌细胞增殖,促进细胞凋亡;LU 等[8]发现咪达唑仑可通过抑制细胞增殖和上皮间充质转化对肺癌和乳腺癌发挥抗癌作用。此外,有报道称咪达唑仑在妇科肿瘤(包括宫颈癌)患者的手术中具有较好的镇静作用[19-20]。但咪达唑仑在宫颈癌中的作用及铁死亡是否参与目前尚不清楚。本研究发现HeLa 细胞经L-咪达唑仑、M-咪达唑仑、H-咪达唑仑处理后,细胞活力下降,克隆数减少,死亡率升高,表明咪达唑仑可抑制宫颈癌细胞增殖,促进细胞死亡,具有抗宫颈癌作用。同时,本研究发现,咪达唑仑在抑制宫颈癌细胞增殖,促进细胞死亡时伴随着显著的铁死亡形态学特征和生化表现,即铁、ROS、MDA 水平升高,GSH、GPX4 水平下降,且存在剂量效应关系,表明咪达唑仑不仅能够抑制HeLa 细胞增殖,还可诱导其铁死亡,高剂量效果更佳。
Nrf2 是抗氧化系统的主要调节因子,正常条件下,Nrf2 锚定于胞质中,而在氧化条件下Nrf2 易位进入细胞核,启动HO-1 抗氧化基因转录,调节铁代谢、脂质代谢和谷胱肽合成等过程,保护细胞免受铁死亡[21-22]。研究显示,抑制Nrf2/HO-1 通路是诱导癌细胞铁死亡的重要靶点[23-24]。高薇等[25]发现,鸦胆子苦醇可通过抑制Nrf2/HO-1 通路,诱导胃癌HGC-27 细胞铁死亡,进而抑制细胞增殖。为了探究咪达唑仑诱导HeLa 细胞铁死亡是否与抑制Nrf2/HO-1 信号通路有关,我们首先检测了经L-咪达唑仑、M-咪达唑仑、H-咪达唑仑处理后HeLa 细胞中核Nrf2、HO-1 蛋白表达变化,结果发现,二者表达均下调,且经H-咪达唑仑处理后下调更明显。然后我们在H-咪达唑仑处理的基础上增加Nrf2 激活剂处理,结果发现,咪达唑仑诱导HeLa 细胞铁死亡的作用被减弱。这两部分结果共同表明咪达唑仑诱导HeLa 细胞铁死亡与抑制Nrf2/HO-1 信号通路有关。
综上所述,咪达唑仑能以剂量依赖性方式抑制HeLa 细胞增殖,诱导其铁死亡,可能通过抑制Nrf2/HO-1 信号通路而实现。本研究可望为咪达唑仑的抗癌应用提供一定的理论依据。
【Author contributions】ZHANG Peng performed the experiments and wrote the article.HAN Xudong performed the experiments.GE Liang revised the article.KONG Lingguo designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
