大黄素通过抑制IGF-1 介导的Akt/FoxO1 信号通路调控人角质形成细胞脂质分泌的机制
2023-09-06邓方祺刘思罗小华柳宇峰施歌
邓方祺 刘思 罗小华 柳宇峰 施歌
1中山大学附属第六医院医学美容整形中心(广州 510655);2广州市黄埔区中六生物医学创新研究院(广州 510799)
从大黄、芦荟、虎杖、何首乌和虎杖等药用植物根与皮中提取的大黄素,为1,3,8-三羟基-6-甲基蒽醌,在中医中广泛用于解滞、清湿热、泻火、凉血、散瘀解毒。有研究表明它能减轻肺损伤[1]、治疗结肠炎[2]、可以提高卵巢癌细胞对卡铂敏感性[3]、诱导白血病HL-60 细胞凋亡[4],可见其具有广泛的抗炎、抗癌作用。也有报道称其可通过抗炎活性、脂质代谢调节、抗氧化应激、抗细胞凋亡和血管保护等机制治疗动脉粥样硬化[5],YU 等[6]的研究则表明大黄素能够抑制高脂饮食喂养小鼠脂肪组织中的脂质积,这些研究提示脂质代谢密切相关。那么,大黄素是否能对与过量皮脂生成密切相关的寻常痤疮(acne vulgaris)[7-8]有作用?人们已经清楚表皮脂质的含量和成份随着角质形成细胞的分化而不断变化[9],也有研究提示角质形成细胞的皮脂合成增加与痤疮发生发展密切相关[10]。为此,我们以HaCaT 人永生化角质形成细胞为细胞模型,探究了大黄素对人永生化角质形成细胞增殖、凋亡和脂质合成等生理学特性的影响,现报告如下。
1 材料与方法
1.1 材料
1.1.1 细胞 HaCaT 人永生化角质形成细胞,购自南京凯基生物有限公司(产品编号:KG300)。
1.1.2 药物与试剂 大黄素、油红O 染色剂购自美国Sigma-Aldrich 公司;CCK-8、AnnexinV、FITC 凋亡检测试剂盒购自东仁化学科技(上海)有限公司;胎牛血清、DEME 高糖培养基、PBS、0.25%胰酶购自美国Gibco 公司;Bcl-2、Bax、PPARγ、Akt、p-Akt、FoxO1、p-foxO1 等之抗体购自美国CST 公司;PCNA、β-actin、SREBP-1、LXR、HRP 标记的山羊抗小鼠IgG、HRP 标记的山羊抗兔IgG 等之抗体购自美国SantaCruze 公司;ECL 检测试剂盒购自美国Invitrogen 公司。
1.2 仪器 Miltiskan FC 酶标仪、EvosFLAuto2 细胞成像系统、电泳仪、水平电泳槽为美国Thermo Fisher Scientific 公司产品,Qsonica Q700 超声波细胞破碎仪为美国Qsonica 公司产品,CytoFLEX 流式细胞仪为美国Beckman 公司产品。
1.3 方法
1.3.1 HaCaT 角质形成细胞培养 用含10% FBS和1%双抗的DMEM 高糖培养基培养HaCaT,于5% CO2孵箱37 ℃培养,每天洗涤细胞并更换培养液(下同);用0.25%胰蛋白酶进行消化、传代,当细胞融合程度达到50%时,分别加入含有浓度为0、25、50、100 μmol/L 的大黄素的培养基,继续孵育24 h。
1.3.2 结晶紫染色观察大黄素对细胞集落形成的影响 将细胞接种于60 mm 培养皿中培养,PBS 浸洗细胞2 次,每孔加入预冷4%多聚甲醛室温固定细胞20 min,弃甲醇,PBS 浸洗2 次,置于摇床轻柔洗涤,每次5 min;加入结晶紫染色液染色10 min,弃去染色液,PBS 浸洗2 遍,荧光显微镜观察拍照。
1.3.3 CCK-8 细胞活力检测 细胞经胰酶消化后,加入100 μL 细胞悬液于96 孔板中培养,每组设5 ~6 个复孔,后向培养板每孔加入10 μL CCK-8液,孵育1 h,酶标仪检测450 nm 处的吸光度。
1.3.4 TUNEL 荧光染色检测细胞集落 重复1.3.2细胞培养和固定步骤,然后在每孔加入稀释后的TUNEL 检测液50 μL,37 ℃箱孵60 min;弃去TUNEL 染液,PBS 浸洗2 遍,取出爬片,封片后荧光显微镜观察拍照。以上操作均收集3 次样本进行重复实验。
1.3.5 流式细胞术检测周期和凋亡 将HaCaT 接种于6 孔板中培养,吸除细胞培养液后用胰酶消化细胞,制备成单细胞悬液转移至离心管,离心沉淀细胞后弃上清,用预冷PBS 润洗一遍,再次离心弃去上清收集细胞;向离心管中加入1 × Binding Solution 重悬细胞,充分混匀后,转移至流式细胞术检测管,依次加入Annexin V-FITC 结合物和PI Solution各5 μL,轻晃混匀,室温下避光孵育15 min,再加入400 μL 1xAnnexinV Binding Solution,流式仪上机检测。
1.3.6 Western Blot 检测增殖、凋亡及成脂因子蛋白表达 将细胞接种于60 mm 培养皿中培养,加入蛋白质裂解液,用细胞刮刮取收集于EP 管中,使用超声波细胞破碎仪超声裂解蛋白,4 ℃12 000 r/min离心15 min;吸取上清液至新的EP 管,使用BCA测定法分析蛋白质浓度,配平各组体积和质量,制备蛋白样品;用聚丙烯酰胺凝胶电泳法分离蛋白,转膜,5%脱脂奶粉封闭90 min;加入浓度为1∶1 000 的鼠抗人PCNA、p-Akt、Akt、FOXO1、p-FOXO1、PPARγ、SREBP-1、LXR、β-actin、Bcl-2、Bax一抗,孵育床室温孵育1 h,4 ℃过夜;加入浓度为1∶5 000 的上述一抗的兔抗鼠二抗,孵育床室温孵育1 h,使用增强型化学发光液(ECL)显影定影,置于凝胶成像仪显影并拍照,使用Image J 软件,以β-actin 为内参,比较各蛋白表达水平。操作均收集3 次独立样本进行重复实验。
1.3.7 油红O 检测观察皮脂分泌水平 重复1.3.2细胞培养和固定步骤,以后每孔加入0.5%油红O染液,37 ℃恒温箱染色10 min;弃油红O 染液,PBS洗2 遍,风干后加入100%异丙醇37°C 温箱孵育10 min;分光光度计在500 nm 波长处检测吸光度,绘制浓度曲线。
1.4 统计学方法 用Graph Pad Prism8.0 软件进行数据统计和绘图分析。所有数据均以(±s)表示,采用单因素方差分析及事后检验来分析统计学差异,P<0.05 为差异有统计学意义。
2 结果
2.1 大黄素对HaCaT 细胞增殖的影响 经不同浓度大黄素溶液处理HaCaT 细胞24 h 后,光镜下结晶紫染色可见,细胞集落数量及融合度与大黄素浓度呈负相关,细胞形态未见明显变化(图1A);CCK-8 试验显示,大黄素明显抑制HaCaT 细胞增殖,与浓度呈正相关(P<0.001,图1B)。Western blot 结果则提示大黄素明显抑制PCNA 蛋白表达(图1C)。

图1 大黄素对HaCaT 细胞增殖的影响Fig.1 Effect of emodin on proliferation of HaCaT cells
2.2 大黄素对HaCaT细胞周期的调控作用 FACS检测发现,大黄素处理HaCaT 角质形成细胞中,G1期细胞比例增加且与其浓度呈正相关,S 期、G2/M期细胞比例减少但与其浓度呈负相关(图2)。

图2 大黄素对HaCaT 细胞周期的调控作用Fig.2 Regulation of emodin on HaCaT cell cycle
2.3 大黄素对HaCaT 细胞凋亡的影响 TUNEL 荧光染色结果提示,处理组绿光荧染凋亡细胞数量随大黄素浓度升高而逐渐增多(图3A)。FACS 检测和定量分析结果显示大黄素处理组较对照组细胞早、晚期凋亡率均有明显升高(P<0.05,图3B)。Western blot 结果提示,大黄素可以下调Bcl-2 表达和上调Bax 表达,作用强弱与浓度呈正相关(P<0.05,图3C)。

图3 大黄素对HaCaT 细胞凋亡的影响Fig.3 Effect of emodin on apoptosis of HaCaT cells
2.4 大黄素对HaCaT 细胞皮脂分泌的影响 图4(A)显示ORO 染色光镜下可见胞质内红色点状脂滴累积减少与大黄素浓度正相关,细胞体积也发生由大到小的渐进变化。Western blot 结果表明,低浓度大黄素仅下调PPARγ 蛋白表达(P<0.05),而高浓度则可使PPARγ、SREBP-1 和LXR 三种关键成脂因子表达均发生下调(P<0.05,图4B)。
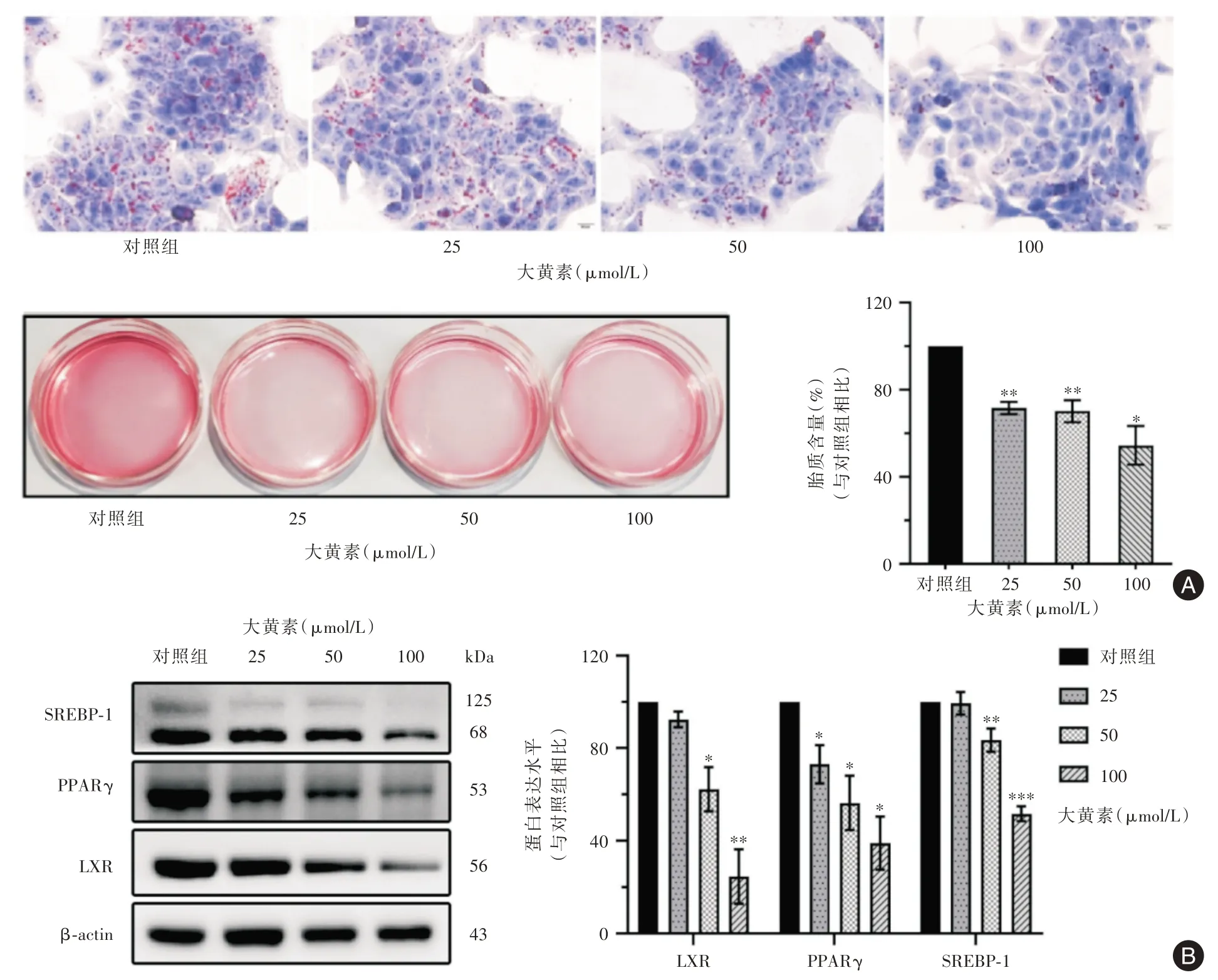
图4 大黄素对HaCaT 细胞皮脂合成与分泌的影响Fig.4 Effects of emodin on sebum synthesis and secretion in HaCaT cells
2.5 大黄素对HaCaT 细胞中皮脂合成通路IGF-1/Akt/FoxO1 的影响 ORO 染色光镜下可见:IGF-1处理HaCaT 细胞质内红色点滴状中性脂滴蓄积较空白对照组显著增加(P<0.001),而IGF-1+50 μmol/L 处理组细胞较IGF-1 处理组细胞明显减少(P<0.001,图5A)。Western blot 结果表明,IGF-1处理HaCaT 细胞Akt 和FoxO1 磷酸化水平较空白对照组增加(P<0.05),而IGF-1 + 50 μmol/L 处理组细胞较IGF-1 处理组细胞则显著降低(P<0.05,图5B)。

图5 大黄素对HaCaT 细胞中皮脂合成通路IGF-1/Akt/FoxO1 的影响Fig.5 Effects of emodin on sebum synthesis pathway IGF-1/Akt/FoxO1 in HaCaT cells
3 讨论
细胞的角化过度是痤疮产生的原因之一,涉及角质形成细胞的过度增殖和异常分化[11]。细胞凋亡是皮肤中调节角质形成细胞增殖和表皮生长的生理过程。Bcl-2、Bax 是在细胞凋亡调控起重要作用[11]。Bcl-2为抗凋亡蛋白,通过抑制线粒体释放细胞色素C下调Caspase激活水平而抑制细胞凋亡。Bax为促凋亡蛋白,在凋亡刺激下发生构象变化,迁移到线粒体外膜并寡聚化而形成孔隙,导致细胞色素C 从线粒体释放到细胞质中,随后激活半胱氨酸天冬氨酸蛋白酶级联,与Bcl-2 相拮抗而促进细胞凋亡[12]。本实验结果显示大黄素对角质形成细胞具有浓度依赖性的G1/S 期阻滞作用(图2),增殖标志物PCNA 表达下调也证实了这一点(图1)。同时实验结果还提示大黄素可增加细胞凋亡且与浓度呈正相关,其作用机制可能为下调Bcl-2 蛋白表达和上调Bax 蛋白表达所致(图3)。
目前的研究表明皮脂分泌过度会引发皮脂腺毛囊的炎症并诱导痤疮形成[13],如何减少皮脂的过量产生是痤疮治疗的关键,而IGF-1/Akt/FoxO1通路在包括角质形成细胞在内的多种细胞类型的脂质合成和代谢、细胞生长和存活中发挥重要作用[14]。IGF-1 与其受体结合后,激活PI3K/Akt 通路[15]。Akt 是一种丝氨酸/苏氨酸激酶,被磷脂酰肌醇3-激酶(PI3K)磷酸化后激活[16]。在脂质合成中,活化的Akt 通过抑制FoxO1 促进脂质生成[17]。IGF-1 激活皮脂腺细胞中PI3K/Akt 信号通路,抑制FoxO1 表达,增强下游成脂因子PPARγ、LXR、SREBP-表达,从而促进皮脂生成和分泌。本研究结果显示大黄素可通过促进角质形成细胞凋谢亡(图3)、抑制IGF-1/Akt/FoxO1 通路(图5)而限制细胞分泌皮脂。FoxO1 作为一种转录因子,正常情况下皮脂腺细胞胞质中FoxO1 不断进入胞核中,可抑制核受体PPARγ、LXR 及SREBP-1 转录[18-19],而减少皮脂腺细胞增殖及皮脂分泌、降低炎症因子释放,从而而阻止痤疮的发生。但IGF-1 则可通过PI3K/Akt 途径促进FoxO1 磷酸化[20]转移至胞质内而促进细胞的皮脂分泌,我们的实验研究结果则提示大黄素可以通过抑制Akt/FoxO1 通路的激活而拮抗IGF-1 活性(图5)。不过,我们未对胞核和胞质内Akt、FoxO1 及其磷酸化蛋白的表达进行定位研究,有待进一步探索。
至于大黄素在细胞脂质代谢中的作用,研究[21-23]发现大黄素可抑制细胞增殖与分化、减少脂质合成、减轻氧化应激和炎症反应等,并指出其机制与Pl3K/Akt 通路活性调节、抑制Akt 磷酸化、下调SREBP、C/EBP 等脂质合成相关蛋白的表达有关。SU 等[24]也发现大黄素可降低肥胖小鼠的血清和肝脏中的胆固醇含量与下调SREBP-2 表达水平。这些结果与我们的研究总体趋于一致,但大黄素是否通过影响成脂因子进而调控角质形成细胞的皮脂合成与分泌目前笔者尚未查见相关文献报道,我们的结果提示大黄素可以抑制角质细胞皮脂分泌而降低皮脂分泌水平,也由此可以想见大黄素这一天然化合物具有抗痤疮治疗功效,在痤疮预防和治疗中应占一席之地。
【Author contributions】DENG Fangqi and LIU Si performed the experiments and wrote the article.LUO Xiaohua and LIU Yufeng performed the experiments.SHI Ge designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
