基于卟啉⁃金属有机框架材料的光动力疗法研究进展
2023-09-04孔庆超孙文悦林金莹
孔庆超,孙文悦,林金莹,王 林*,董 彪
(1. 吉林大学 口腔医学院,吉林 长春 130021;2. 吉林大学 电子科学与工程学院,集成光电子学国家重点实验室,吉林 长春 130012)
1 引 言
光动力疗法(PDT)作为一种新兴的治疗策略,自上世纪70 年代后期开始逐步应用于临床,近几十年发展十分迅速,取得了许多显著的成果[1-3]。其原理是当光敏剂(PS)材料被光照射后,产生大量的活性氧(ROS),进而破坏DNA、RNA、蛋白质等成分,可以有效杀灭肿瘤以及细菌细胞从而起到治疗的效果[4-7]。PS 注射到体内后,在没有光照射时不发挥作用,仅在需要治疗的部位才会产生PDT 效应,这种按需激发的特点使得PDT有着良好的生物安全性。同时,使用的激发光能量密度低,仅起到激活PS 的作用,对正常组织结构不会产生破坏。面对一些让人束手无策的癌症和耐药菌引起的感染性疾病,PDT 相比于传统的放疗、化疗等治疗手段,不仅毒副作用小,而且其治疗效果明显且周期短[8-11]。
开发结构和功能可调的新型纳米材料是当今医学研究的热点方向。纳米材料的结构和形态与其生物学性能(细胞摄取、体内分布和细胞毒性)密切相关,独特的物理化学属性使其在生物医学领域有着广泛的应用。其中,金属有机框架(MOFs)材料是由金属离子或团簇与有机配体自组装而成的一类新型多孔材料,有机配体和金属位点的多样性导致MOFs 种类极其丰富[12-14]。MOFs 材料由于其结构的稳固性使有机配体之间不容易发生聚集,同时因为丰富的活性位点、较大的比表面积以及有序的多孔结构,这类材料在许多领域有着广泛的应用前景,如气体储存、化学吸附、药物输送、催化和生物传感等[15-18]。正因为MOFs 材料有上述优点,MOFs 介导的PDT 在近些年的研究中显示出巨大的治疗潜力。作为PDT产生的媒介,PS 可以封装到MOFs 的孔隙内或者与金属位点和有机配体相连接,也可以作为金属位点或者有机配体直接参与构成MOFs。这样的组合方式优点在于防止PS 的聚集,保护PS 并且实现PS 的高负载率,此外,MOFs 固有的多孔结构允许氧气分子和ROS 自由扩散。MOFs 除了尺寸和形态多样性,金属节点和有机配体的不同组合进一步赋予了其多功能性。由于MOFs 结构的可调整性以及可修饰性,研究者们通过不同手段和途径来调整MOFs 材料的微晶形态、组成和物理化学特性,从而拓展其在生物医学方面的应用范围[19-20]。因此,含有PS 的MOFs 材料不仅有PDT 的功能,在经过其他功能材料的修饰后,还可以获得分子识别、药物递送和成像等功能,拓展了其在临床应用的范围。
卟啉及其衍生物作为一类广泛存在于自然界的N-杂环化合物,具有良好的光物理和光化学性能,是一类优秀的PS 材料,其光吸收范围从紫外区域扩展到近红外区域[21-22]。卟啉类材料的典型特征是在光照下,卟啉将能量传递给周围环境中的氧气使其发生活化,从而产生ROS 并发挥治疗作用。然而,卟啉材料在生物体内应用时存在诸多缺陷,表现出低水溶性、易聚集,影响治疗效果,所以卟啉类材料的改性和性能提升成为PDT 领域的重要研究课题。1991 年,Robson 教授首次报道了基于Cd 的卟啉-MOFs 材料。1994 年,Robson教授报道了含有Cu(Ⅱ)离子和中性吡啶基或氰基苯基取代的卟啉结构的MOFs 材料。这几十年来,关于卟啉衍生物的研究报道数量一直稳步增加。卟啉大分子拥有不同的配位点,可以和元素周期表上某些过渡族的金属离子配位,共同构成卟啉-MOFs[23-25]。在卟啉-MOFs 的结构中,卟啉作为框架结构中的连接体,具有优秀的热稳定性和化学稳定性;而且这种MOFs 结构有效解决了卟啉大分子的聚集和荧光猝灭等问题,有利于提升卟啉的PDT 性能,增加其在生物体内应用时的稳定性。同时,较大的孔隙率和可修饰性使得卟啉-MOFs 成为当下的研究热点[26-28]。Goldberg 等首先合成了由金属-羧基盐配位组成的卟啉MOFs 材料,如Zn(Ⅱ)-四(4-羧基苯基)卟啉(TCPP)和Na(Ⅰ)-TCPP,由于其独特的结构和物理化学性能引起了众多研究者的注意,掀起了合成卟啉-MOFs的热潮[29-30]。
近年来,相关学者对卟啉-MOFs 材料进行了广泛的研究,合成了种类繁多的卟啉-MOFs 材料。尽管卟啉分子固有的方形平面几何形状限制了其在三维空间上的扩展,但是与金属离子配位后能够在不同方向上延伸从而产生了不同的形状。例如,Cu-TCPP 具有典型的二维纳米片样的结构,TCPP 与Cu 配位后沿着二维平面不断扩展,这样的二维结构赋予了其较大的比表面积和优异的集光网络;Zr-TCPP 有典型的方形纳米块样的结构,较高的孔隙率允许其他材料在其孔隙内负载。由于卟啉优异的PDT 性能和金属离子的独特作用,比如Cu、Fe 的纳米酶活性,卟啉-MOFs 材料在肿瘤及细菌感染性疾病的治疗中取得了许多重要的成果[31-35]。而且卟啉-MOFs 独特的分子骨架结构允许其他功能材料的负载,使得卟啉-MOFs 材料的功能得到更进一步的扩展。目前,基于这些卟啉-MOFs 的研究成果已经成为PDT 领域的重要代表性工作,对PDT 材料设计方面具有重要指导意义。而针对这方面工作的综述文章尚未见报道,我们希望通过综述近年来卟啉-MOFs 的研究成果,为MOF 类PDT 材料设计和应用提供参考依据。本篇综述首先介绍了卟啉-MOFs 材料产生PDT 的机制;随后评述近几年卟啉-MOFs 材料的应用和最新进展,根据具体应用过程中所面对的不同环境,采取不同手段来增强PDT 的效果,包括提高氧气浓度、改进能量传递过程、消耗功能分子、产生信号分子以及协同策略等;最后,针对卟啉-MOFs 材料的PDT 在生物医学领域未来的发展趋势进行了展望。
2 卟啉⁃MOFs 材料及PDT 的机制
2.1 卟啉⁃MOFs 材料
卟啉是18π芳香族大分子化合物,由4个吡咯单元以及桥接碳原子连接组成 (图1)。卟啉分子结构中4 个吡咯环的8 个β 位和4 个中位氢原子可以被其他基团取代,产生了数量众多的卟啉衍生物[36]。事实上,卟啉及其衍生物广泛存在于自然界,如叶绿素、血红素等。作为一类重要的有机发色团和PS 材料,卟啉类材料有着良好的光吸收能力,在两个不同区域有吸收峰。其中在390~425 nm 范围内有一个强烈的吸收带,称为Soret 带;在500~700 nm 范围内有一个较弱的吸收带,称为Q带[37]。卟啉分子作为PS 最主要的优势就是较高的ROS 产生效率,但卟啉材料本身的疏水性以及这种平面多环化合物之间存在强相互作用,导致其容易在生理条件下发生自聚集。这些缺点降低了卟啉的生物利用率,严重影响光吸收效率,限制了卟啉材料在光催化等方面的应用[38]。由于卟啉大分子的外围有孤对电子的存在,卟啉分子可以与某些过渡族金属离子(Zr4+,Cu2+等)配位共同组成MOFs 材料,这种复杂的结合模式使得卟啉能够形成理想的分子骨架结构。卟啉-MOFs 材料不仅有优秀的光物理和光化学特性,卟啉分子作为坚固的晶体框架结构中的连接体,可被封装到MOFs的孔隙中,这种特殊的网络结构有效解决了卟啉材料容易聚集的缺点,改善了卟啉的光吸收能力和PDT 性能[39-44]。虽然人体内存在的某些功能分子会削弱PDT 的疗效,但某些卟啉-MOFs 含有的金属离子本身具有的纳米酶活性,可以催化组织内过量表达的功能分子产生羟基自由基(·OH),增强PDT 效果,同时还能减少功能分子的浓度。
2.2 PDT 产生机制
作为一种新兴疗法,光动力疗法(PDT)涉及三个要素,分别是PS、激发光和氧源[45-47]。当PS 注射到人体内后,选择性地聚集在病变部位;在特定波长光的激发下,PS 吸收能量然后发生能级跃迁,PS 分子从基态转变为单重激发态,再通过系统间交叉转变为三重激发态,最终通过Ⅰ型、Ⅱ型和Ⅲ型三种不同类型的光催化反应生成不同类型的ROS(图2)。这些ROS 成分通过破坏肿瘤或细菌细胞的DNA/RNA、脂质和蛋白质成分,导致其结构形态和内部的成分发生变化,杀灭肿瘤或细菌细胞从而起到治疗的作用[48-49]。Ⅰ型PDT:PS分子被光激发后转入三重激发态,与氧分子发生反应产生超氧阴离子和·OH。Ⅱ型PDT:PS 分子进入三重激发态后,将能量传递给周围的氧分子,然后氧分子活化转变成具有高度反应性的单线态氧(1O2)。Ⅲ型PDT∶PS 分子被光激发后进入三重激发态,但在缺氧的条件下,处于三重激发态的PS 分子可以直接破坏肿瘤细胞或者其他病原微生物的DNA/RNA 从而起到治疗作用。Ⅱ型PDT是最常见的PDT 类型[36]。卟啉主要是通过Ⅱ型PDT 产 生1O2[50-51]。

图2 基于Perrin-Jablonski 能量示意图的PDT 机制图Fig.2 PDT mechanism diagram based on Perrin-Jablonski energy diagram
3 卟啉⁃MOFs 材料PDT 的应用
由于卟啉-MOFs 材料具有优异的PDT 效果且生物安全性良好,因此研究者们开发了许多不同类型的卟啉-MOFs 材料,在肿瘤和细菌感染性疾病的治疗方面有着显著的治疗效果。下面介绍卟啉-MOFs 在PDT 治疗中所取得的代表性成果。
3.1 提高氧气浓度
卟啉主要是通过Ⅱ型PDT 产生1O2来发挥治疗作用。1O2的产生主要是通过氧分子的活化来实现,当PS 被光照射后产生激子(光生电子空穴结合),单线态激子通过系统间交叉(ISC)转变成三重态激子,三重态激子将能量转移给氧分子使氧分子活化,改变其电子自旋状态产生1O2。因此,氧气的浓度对于卟啉PDT 的效果至关重要。在肿瘤组织内,由于肿瘤细胞代谢旺盛,消耗大量的氧气,同时由于肿瘤组织间质流动压力高导致血管受到压迫,血供不足,肿瘤组织内的微环境处于缺氧状态。在感染组织内,由于细菌大量繁殖导致氧气消耗量增加,因此也存在氧气不足的情况。氧气浓度的下降导致1O2产生不足,削弱了PDT 的治疗效果。因此,需要采取多种手段对卟啉-MOFs 进行改进,来提升治疗部位氧气浓度,从而增强PDT 的治疗效果。
植物的光合作用能够产生氧气,也是地球大气中氧气的重要来源。一些藻类细胞由于具有光合作用产生O2,可以被用来改善感染部位缺氧的状态。如图3(a)所示,王白良教授团队开发了一种具有可视化细菌感染且能够自产氧的双层水凝胶材料,内层水凝胶由氧化海藻酸钠(OSA)和羧甲基壳聚糖(CMCS)通过席夫碱反应合成[52]。然后,溴百里酚蓝(BTB,一种pH 指示剂)和PCN-224(Zr-TCPP)负载于内层水凝胶。外层水凝胶则是由琼脂糖/CMCS 组成,蓝藻细胞生长并黏附在外层水凝胶上,由于光合作用能够持续产生氧气。当伤口被感染时,感染部位的微环境呈酸性,pH值降低,导致BTB 颜色由淡蓝色变成灰黄色;此时使用660 nm 激光照射水凝胶,PCN-224 会产生大量的1O2,由于蓝藻细胞能够持续不断地补充氧气,从而增强PDT 效果。因此,缓解了感染组织内缺氧的状态,组织炎症状态得到缓解,缺氧诱导因子HIF-1α 以及炎症介质白细胞介素-6(IL-6)的表达下降,促进了巨噬细胞从M1 型(分泌促炎因子增强免疫反应)向M2 型(分泌抗炎因子减轻免疫反应)转化,感染部位组织快速修复,血管内皮生长因子CD31 的表达升高。
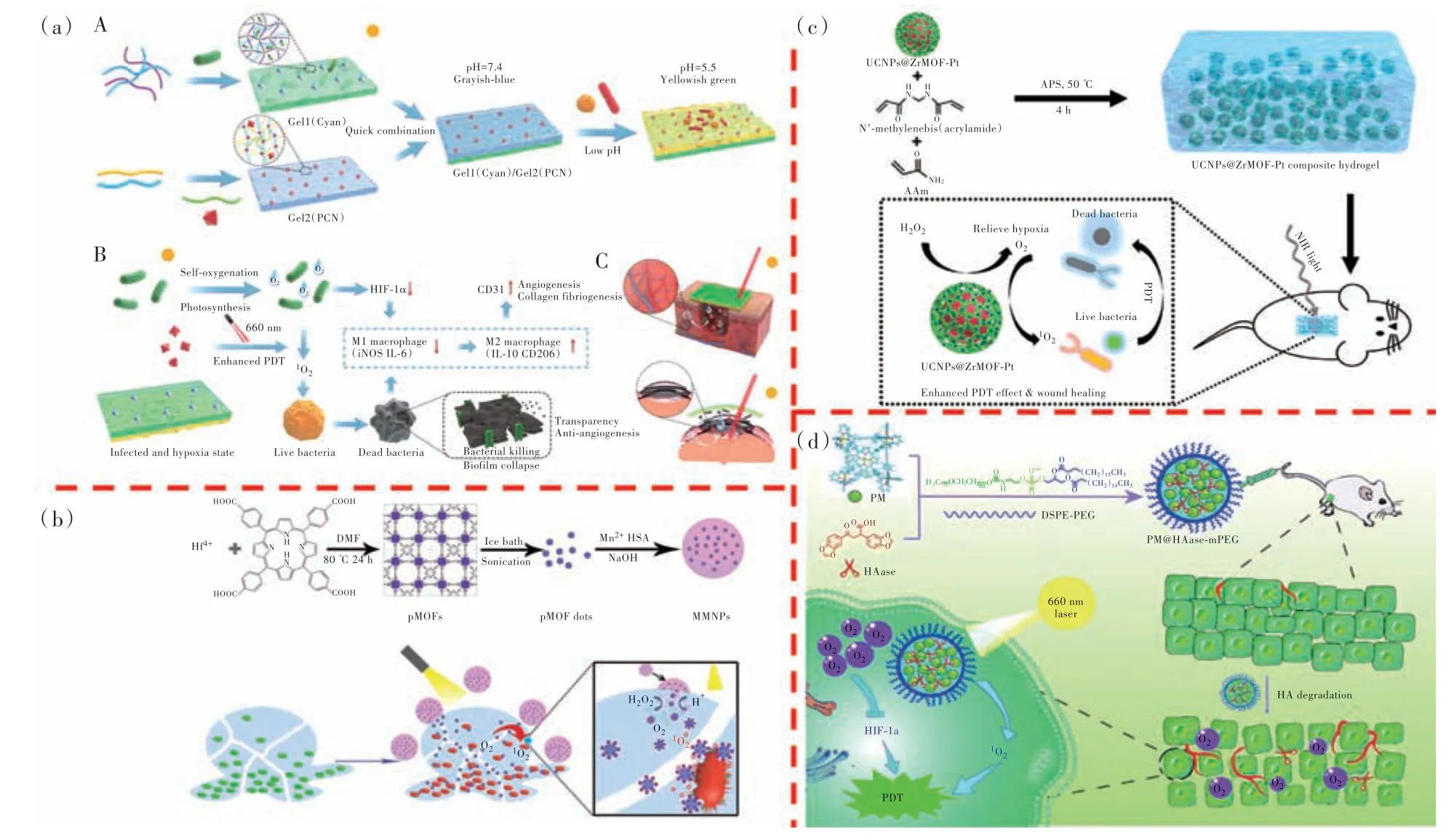
图3 (a)多功能双层水凝胶增强PDT 抗菌机制以及在糖尿病和角膜炎方面的应用[52];(b)MMNPs 的合成过程以及MMNPs 增 强 的PDT 抗 菌 效 果 机 制[53];(c)UCNPs@ZrMOF-Pt 纳 米 复 合 材 料 增 强PDT 抗 菌 效 果 机 制[54];(d)PM@HAse-mPEG 增强PDT 用于肿瘤治疗示意图[55]。Fig.3 (a)Multifunctional bilayer hydrogel enhances the antibacterial mechanism of PDT and its application in diabetes and ker⁃atitis[52]. (b)The synthesis process of MMNPs and the mechanism of MMNPs enhanced PDT antibacterial effect[53]. (c)The mechanism of UCNPs@ZrMOF-Pt nanocomposites to enhance the antibacterial effect of PDT[54]. (d)Schematic dia⁃gram of PM@HAse-mPEG enhanced PDT for tumor therapy[55].
PDT 对浮游菌有强大的杀伤作用,但在处理细菌生物膜方面收效甚微。由于生物膜主要由细菌和致密的细胞外聚合物组成,导致PS 在生物膜内的渗透和扩散距离有限,即使是十分有效的PS也需要更高浓度或者更高功率激光器才能够达到理想的效果,因此常导致PDT 效果不佳。如何增加生物膜的通透性从而提高材料的有效浓度成为一个让众多学者感兴趣的研究方向。区小刚教授团队开发了多组分纳米平台(MMNPs)来解决这个问题,不仅导致生物膜通透性增加,材料大量渗透到生物膜内部,而且其自产氧气有效提升了PDT 的效果[53]。如图3(b)所示,首先通过水热反应合成了超小尺寸的Hf-TCPP 纳米点,然后使用人血清白蛋白 (HSA)和二氧化锰(MnO2)包被Hf-TCPP纳米点形成MMNPs。在生物膜内,由于生物膜微环境的pH 呈酸性(pH~5.5),引起了MnO2的分解以及卟啉MOFs 的释放。在酸性条件下,MnO2与生物膜内的 H2O2反应产生O2,同时超小尺寸的Hf-TCPP 纳米点表明其带正电荷,可以与带负电荷的细菌特异性地结合;而且由于超小的尺寸能够更加容易渗透进入生物膜内部,增加材料在生物膜的积累。在缺氧条件下,MMNPs+H2O2表现出最高的ROS 生成效率,这意味着MMNPs 能 够 与H2O2反应补充O2从而增强PDT 效果,产生更多的ROS。在卤素灯(300 W,可见光)的照射下,MMNPs+ H2O2表现出更强的杀菌效果,对大肠杆菌和金黄色葡萄球菌的杀菌效率分别达到99%和90%。
由于感染伤口的微环境含有高浓度的 H2O2并且pH 为酸性,因此具有催化能力的过氧化氢酶和MnO2成为研究热点。然而,过氧化氢酶不稳定且容易失活,MnO2在酸性环境中容易降解,因此具有催化 H2O2能力且稳定的的Pt 成为研究的新方向。如图3(c)所示,王东教授团队开发了一种基于水凝胶的UCNPs@ZrMOF-Pt 的纳米复合材料[54]。水凝胶具有良好的生物安全性以及黏附性能,可以作为纳米材料理想的负载平台。在近红外光的照射下,上转换纳米粒子(UCNPs)发射可见光激活Zr-TCPP 产生1O2,表面负载的Pt 纳米粒子作为纳米酶催化H2O2产生O2,解决PDT 氧气不足的问题,提高了1O2的产量。在980 nm 激光照射下(10 min,1.5 W·cm-2),MMNPs+H2O2组对金黄色葡萄球菌和大肠杆菌的杀菌率近乎达到100%,并且在小鼠背部创口模型中,展现出了优秀的治疗效果。
在肿瘤微环境中的一个重要特点就是缺氧,这严重限制了卟啉-MOFs 材料的PDT 对肿瘤细胞的杀伤作用。与抗菌治疗过程类似,除了依靠不同纳米酶产氧来补充氧气、解决肿瘤组织中缺氧的难题以外,根据肿瘤组织自身间质流动压力高、压迫血管导致血管网异常、血流减少从而导致缺氧的发生这一观点出发,杨世平教授团队将Zn(Ⅱ)四(4-氨基苯基)卟啉(Zn-TAPP)和透明质酸 酶(HAase)构建卟啉金 属 笼(PM),然后 通 过DSPE-mPEG2000 对PM 进行修饰形成PM@HAasemPEG(图3(d))[55]。与 纯Zn-TAPP 相 比,在660 nm 激光照射下PM@HAase-mPEG 显示出更高的1O2生成效率,同时HAase 降解透明质酸使血管正常化,增加血流供应从而导致氧含量上升,解决了含氧量的问题,因而PDT 效果增强。因为肿瘤组织缺氧状态的缓解,抑制了缺氧诱导因子HIF-1α的表达,从而抑制肿瘤组织的生长。在小鼠模型中PM@HAase-mPEG 显示出明显的抗肿瘤效果。
3.2 改进能量传递过程
增强PDT 效果的方法除了增加氧气浓度以外,改善系统间交叉过程也是一个重要的研究方向,使得3O2更容易获取能量,从而活化为1O2。遵循这个思路,林文斌教授团队开发了DBP-UiO 的MOFs 材料,5,15-双(对苯甲酸)卟啉(H2DBP)为PS,插入重金属Hf4+形成卟啉-MOFs,卟啉化合物高度分散在MOFs 中,从而避免卟啉化合物自聚集引起的猝灭。此外,H2DBP 通过羧酸盐基团与重Hf 中心配位可以增强系统间交叉,促进3O2向1O2的转化,提高ROS 的产生效率(图4(a))[56]。如图4(b)所示,使用SOSG 作为1O2探针,可以看到DBP-UiO 的1O2产量要大于单纯的H2DBP 和H2DBP+HfCl4,表明H2DBP 与Hf4+形成的MOFs 结构增强了系统间交叉过程,促进了1O2产生。BPUiO 的1O2的产生效率是H2DBP 的两倍。如图4(c)所示,荧光寿命从H2DBP 的10.9 ns 减少 到DBP-UiO 的0.26 ns。同时,DBP-UiO 在头颈部肿瘤的治疗过程中表现出优秀的治疗效果。在接受单次光照和单次DBP-Uio 注射的小鼠中,将近一半的肿瘤完全消除。
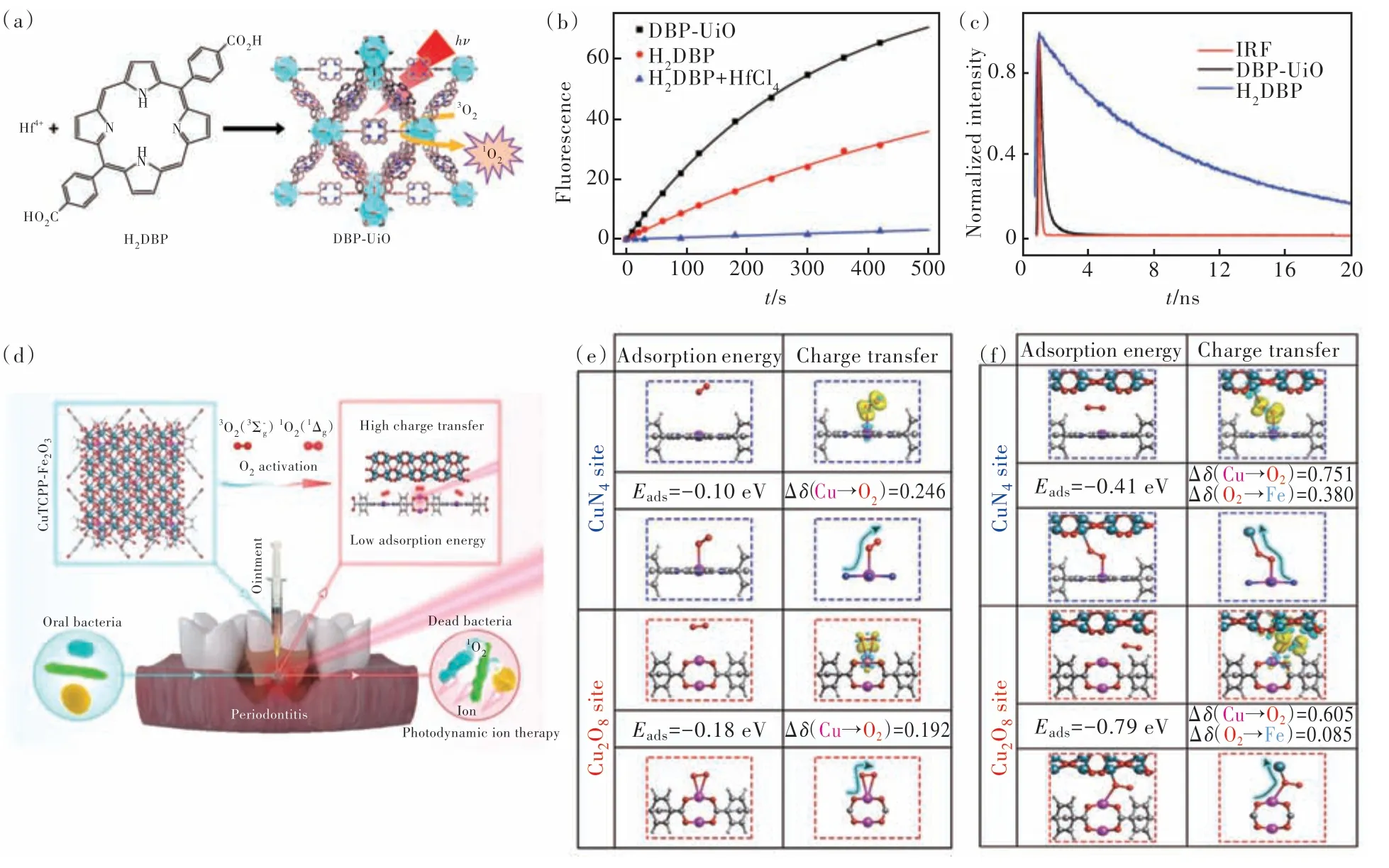
图4 (a)DBP-UiO 的合成过程以及产生1O2的原理图;(b)使用SOSG 检测1O2的产生;(c)H2DBP 和DBP-UiO 的时间分辨荧光衰减曲线以及仪器响应函数 (IRF)[56];(d)CuTCPP-Fe2O3产生1O2的机制以及在牙周炎治疗中的应用;CuTCPP 模型(e)和CuTCPP-Fe2O3模型(f)中不同位点(CuN4位点和Cu2O8位点)O2吸附能、吸附O2电荷密度差图和Bader 电荷计算[57]。Fig.4 (a)The synthesis process of DBP-UiO and the schematic diagram of producing1O2. (b)Detection of1O2production using SOSG. (c)Time-resolved fluorescence decay curves and instrument response function(IRF)of H2DBP and DBP-UiO[56].(d)Mechanism of1O2produced by CuTCPP-Fe2O3and its application in periodontitis treatment. O2adsorption energies,charge density difference plots of adsorbed O2,and Bader charge calculations of adsorbed O2on different sites(CuN4site and Cu2O8site)in the CuTCPP model(e)and CuTCPP-Fe2O3model(f)[57].
TCPP 是一种优秀的PS 材料,由于其优秀的生物相容性和光吸收能力,被广泛用作卟啉-MOFs的有机配体材料。Cu-TCPP 纳米片属于超薄的2D-MOFs 材料,由于其较大的比表面积和良好的分散性能,TCPP 分子能够接受更多的光照。Cu-TCPP 纳米片具有出色的光捕获网络以及较大的比表面积所带来的快速能量迁移的优势,同时铜离子本身具有的纳米酶功能扩展了材料的应用范围,在肿瘤治疗中发挥了巨大作用。但是,有限的电荷分离与转移效率限制了它的PDT 性能,因此通过修饰其他材料来改进Cu-TCPP 纳米片的PDT是一个重要的研究方向。吴水林教授团队采用原子层沉积(Atomic layer deposition,ALD)的方法,将Fe2O3修饰在Cu-TCPP 表面,Fe2O3有着优秀的光吸收和光生电荷分离能力,Fe2O3的负载优化了MOFs 的结构,加速了能量传递和氧分子活化过程,促进了1O2的产生。ROS 以及离子释放的协同作用赋予了CuTCPP-Fe2O3异质结构对牙周炎相关致病菌的广谱抗菌活性,同时铜离子的存在还可以减轻牙周组织的炎症,促进血管生成(图4(d))[57]。如图4(e)所示,在化学吸附过程中,根据3O2的电荷密度差和电荷计算制作了CuTCPP和CuTCPP- Fe2O3的模型图,解释了3O2的吸附位点和电荷转移的情况。如图4(e)所示,在CuTCPP模型中,由于Cu—O 键的形成,电子转移方向是从Cu 原子到吸附的O 原子。3O2分子在CuN4位点的电子转移量大于 Cu2O8位点的电子转移量。在CuTCPP-Fe2O3的 模 型 中(图4(f)),有Cu—O 和Fe—O 的形成,3O2分子在CuN4位点的净电荷转移量小于3O2在Cu2O8位点的净电荷转移量。总体而言,CuTCPP-Fe2O3中吸附位点与吸附3O2之间的电荷转移量多于CuTCPP,这解释了CuTCPP-Fe2O3的ROS 产量高于CuTCPP。体外实验证实了CuTCPP-Fe2O3的抗菌效率大于CuTCPP,并且大鼠牙周炎模型中CuTCPP-Fe2O3也有明显的治疗效果。
3.3 消耗功能分子
在肿瘤细胞内存在谷胱甘肽(GSH)等抗氧化物质,能够清除PDT 产生的ROS,保护肿瘤细胞免受氧化应激的损伤。细菌细胞内大量的GSH 同样参与维持氧化还原稳态,削弱了PDT 的抗菌效果。葡萄糖、乳酸等供能物质对维持细胞的新陈代谢十分重要,肿瘤细胞在氧气充足的情况下,优先通过糖酵解来获得ATP,抑制葡萄糖的有氧糖酵解可以降低氧气的消耗,从而提高PDT 的治疗效果。因此,开发能够消耗这些功能分子的材料是提高PDT 效果的一个重要研究方向。
如图5(a)所示,金映雪教授团队根据肿瘤微环境的上述特点,基于PDT 和GSH 消耗策略开发了Cu-TCPP@MnO2/FA/TPP@PAH 纳米复合材料[58]。FA(叶酸)的肿瘤靶向和TPP(三苯基膦)的线粒体靶向功能使得Cu-TCPP@MnO2/FA/TPP@PAH 精确锚定在肿瘤细胞的线粒体上,在660 nm 激光照射下,Cu-TCPP 发 挥PDT 的 作 用 产 生1O2。MnO2的存在能够发挥过氧化氢酶的作用,为PDT 持续供应氧气并且产生·OH。Cu-TCPP纳米片中的Cu2+在消耗GSH 的过程中被氧化成Cu+,然后与H2O2反应产生·OH,增强PDT 的效果。如图5(b)所示,使用亚甲蓝 (MB)检测·OH 的产生。MB 在650 nm处的吸光度与·OH 浓度呈负相关。Cu-TCPP+H2O2pH 6.8 的样品没有·OH 的产生,Cu-TCPP+GSH+H2O2pH 6.8 有·OH 的产生,表明Cu2+在消耗GSH 的过程中产生了·OH,Cu-TCPP@MnO2+GSH+H2O2pH 6.8的·OH 产生量更多,意味着MnO2也可以催化H2O2产生·OH,进一步提高了·OH 的产生量。使用5,5′-二硫代双(2-硝基苯甲酸)(DTNB)作为探针,检测GSH 的消耗情况。DTNB在325 nm 处有吸收,可被 GSH 还原形成 2-硝基-5-硫代苯甲酸 (NTB),NTB 在412 nm 处的吸光度与 GSH 消耗量成正比。如图5(c)所示,随着Cu-TCPP@MnO2浓度的升高,NTB 的吸光度逐渐下降,当材料浓度达100 µg·mL-1时,GSH 浓度最低,表明GSH 的消耗与Cu-TCPP@MnO2浓度相关,浓度越高消耗的GSH 也就越多。而姜秀娥教授团队 合 成 了 超 薄 二 维 Cu-TCPP 纳 米 片,TCPP 配 体在肿瘤的酸性环境中被H2O2过氧化,并且在具有过氧化物酶活性的Cu-TCPP 纳米片和微量Cu2+的参与下被进一步还原成过氧自由基(ROO·),在ROO·自发重组的反应中产生1O2。这种依靠Rus⁃sell机制产生ROS的方法既避免了缺氧导致的ROS产量不足等问题,同时消耗了大量的GSH[59]。
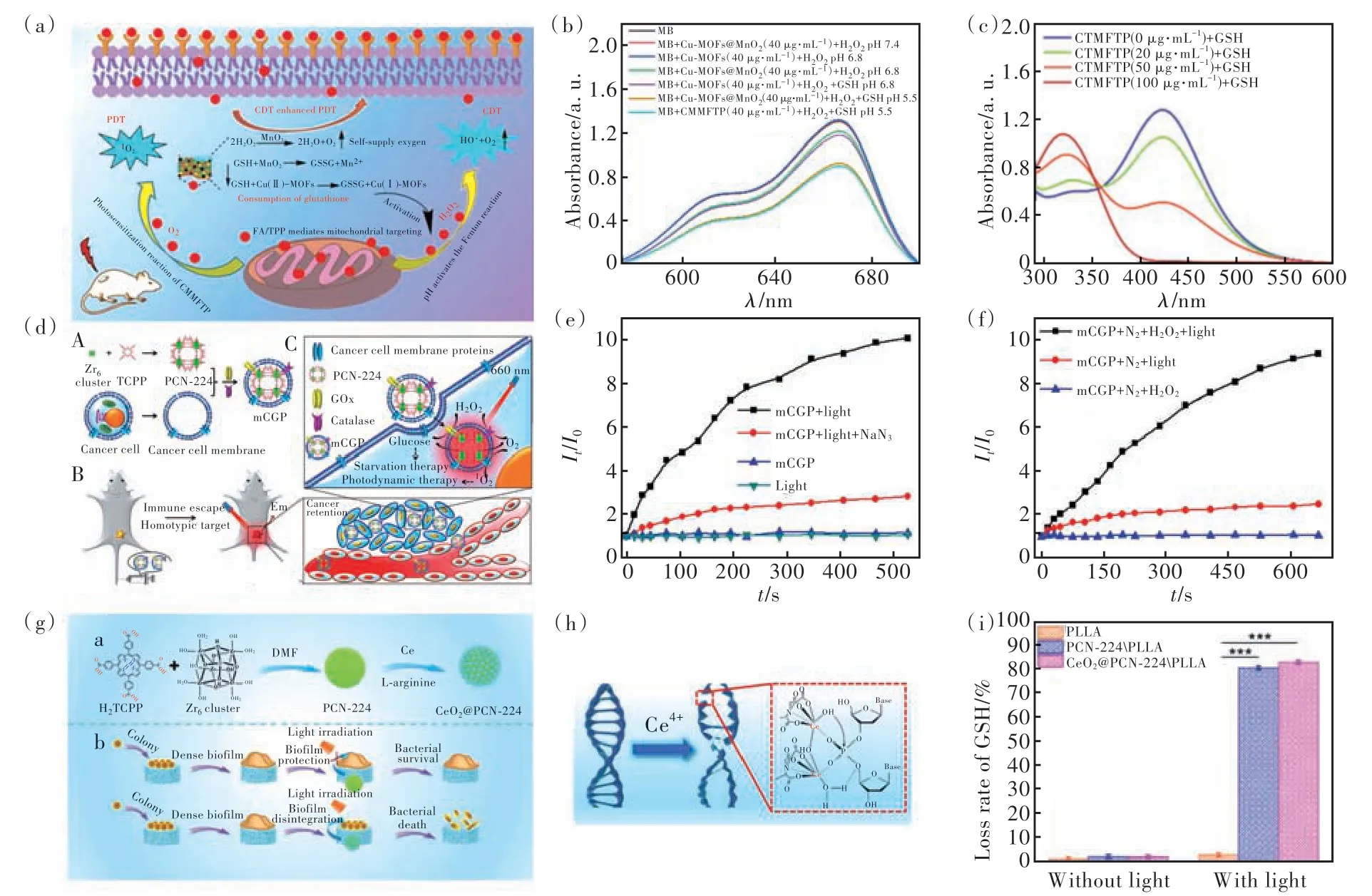
图5 (a)Cu-TCPP@MnO2/FA/TPP@PAH 杀灭肿瘤细胞机制图;(b)使用亚甲蓝 (MB)检测·OH 的产生;(c)5,5′-二硫代双(2-硝基苯甲酸)(DTNB)作为探针,检测GSH 的消耗[58];(d)mCGP 的合成过程以及抗肿瘤机制图;(e)O2浓度变化曲线;(f)ROS 产量变化曲线[60];(g)CeO2@PCN-224 的合成过程以及抗菌原理示意图;(h)Ce4+切割DNA 的机制;(i)PLLA、PCN-224/PLLA、CeO2@PCN-224/PLLA 对GSH 的消耗率[61]。Fig.5 (a)The mechanism of killing tumor cells of Cu-TCPP@MnO2/FA/TPP@PAH nanocomposites. (b)Use methylene blue(MB)to detect the generation of·OH. (c)5,5′-dithiobis-(2-nitrobenzoic acid)(DTNB)was used as a probe to detect the consumption of GSH[58]. (d)Schematic diagram of the synthesis process of mCGP and the mechanism of killing tumor cells. (e)O2concentration change curve. (f)ROS yield change curve[60]. (g)Schematic diagram of the synthesis process and antibacterial mechanism of CeO2@PCN-224. (h)Mechanism of DNA cleavage. (i)Consumption rate of GSH by PLLA,PCN-224/PLLA,CeO2@PCN-224/PLLA[61].
肿瘤细胞代谢旺盛,需要消耗大量能量。葡萄糖作为细胞主要的能量来源,在维持肿瘤细胞异常增殖的过程中起到了重要作用。通过抑制葡萄糖的有氧酵解过程来限制肿瘤细胞的代谢,使肿瘤细胞的耗氧量下降,导致氧气浓度保持相对稳定从而维持PDT 的效果。如图5(d)所示,张先政教授团队合成了Zr-卟啉MOFs(PCN-224),同时负载葡萄糖氧化酶(GOx)和过氧化氢酶(Cata⁃lase),然后用小鼠乳腺癌细胞膜伪装,构成了me@catalase@GOx@PCN-224 纳米粒子(mCGP),其中me 代表肿瘤细胞膜。得益于肿瘤细胞膜的免疫逃逸和靶向能力,mCGP 在肿瘤组织内积累并选择性内化到癌细胞中[60]。mCGP 的级联反应可以促进内源性H2O2产生1O2,同时加速葡萄糖的分解,增强光照下具有细胞毒性的1O2产生。如图5(e)所示,mCGP+light(660 nm 激光)在正常氧环境下产生了1O2。在图5(f)中,缺氧的状态下mCGP+N2+H2O2+light 也能产生大量的1O2。这种协同饥饿疗法降低了肿瘤细胞耗氧能力,同时通过过氧化氢酶的作用产生氧气缓解了组织内的缺氧状态,进一步增强了PDT 的效果。
在细菌细胞内同样存在大量的GSH 等抗氧化物质,参与细菌的抗氧化防御体系,清除ROS维持细菌的内部稳态。如图5(g)所示,杨胜教授团队合成了CeO2@PCN-224,PCN-224 在660 nm 激光照射下产生1O2,而细菌生物膜的存在导致PDT效果受到削弱,细菌生物膜主要是由eDNA、蛋白质和多糖组成[61]。如图5(h)所示,Ce4+可以攻击DNA 分子链中的磷酸酯导致P—O 键断裂,DNA被破坏后,细菌细胞外聚合物成分之间的有效连接被打断,导致生物膜破坏。当材料负载在聚乳酸(PLLA)制 成 的 支 架 上 后,如 图5(i)所 示,CeO2@PCN-224 和PCN-224 所导致的GSH 消耗率并没有差别,说明Ce4+不会导致GSH 的消耗;而消耗GSH 主要是因为1O2的存在降低了细菌细胞对外界环境的抗氧化能力,剩余的ROS 可以破坏细菌的DNA/RNA 和蛋白质等成分,从而增强材料的抗菌效果。
3.4 产生信号分子
许多内源性的信号分子,比如一氧化氮(NO),在体内参与细胞代谢和信号转导,调节细胞的增殖。当浓度高时,会导致细胞周期停滞和氧化应激,产生细胞毒性引起细胞死亡。因此,通过产生高浓度的内源性信号分子杀灭肿瘤细胞的方法成为研究的热点。因为NO 分子以气体形式存在,因此又称气体疗法。如图6(a)所示,悦园教授团队报道了一种基于Zr-TCPP 的纳米材料,Nic(尼可地尔)和HA(透明质酸)被负载在卟啉MOFs 上[62]。HA 可以主动靶向肿瘤部位过表达的CD-44,当HA 被透明质酸酶降解后导致Nic 释放,Nic 在治疗部位与过量的GSH 反应产生NO;如图6(b)所示,在不含GSH 的情况下没有NO 的产生。而由于MOFs 的缓释作用,Nic 的浓度始终低于游离的Nic,导致Nic/MOF 的NO 释放量低于游离Nic 所产生的NO。高浓度的NO 可以促进内源性亚硝胺的形成从而诱导肿瘤细胞DNA 损伤和细胞凋亡。同时,在655 nm 激光的照射下TCPP产生1O2。如图6(c)所示,使用DPBF 作为ROS 探针检测ROS 产生。纯MOF 组的DPBF 吸光度下降最多;而MOF+GSH 组要低于纯MOF 组,这是因为GSH 消 耗 了 大 部 分ROS;而Nic/MOF+GSH 组 的DPBF 吸光度下降程度要高于MOF+GSH 组,这是因为Nic 消耗了大量的GSH。同时PDT 诱导肿瘤细胞凋亡的过程会增加一氧化氮合酶的表达,使得内源性NO 产生增加。气体疗法的出现和使用为增强PDT 对肿瘤的治疗提供了一种新的策略。
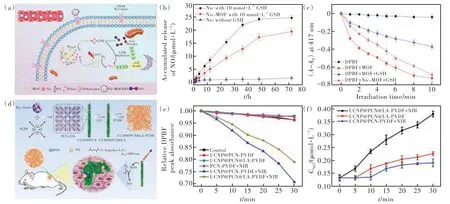
图6 (a)Nic-MOF@HA 基于PDT 和NO 疗法的抗肿瘤机制示意图;(b)NO 释放曲线;(c)ROS 的相对产量曲线[62];(d)UC⁃NPs@PCN@LA-PVDF 纳米复合膜的制备过程以及PDT/NO 气体疗法协同杀菌示意图;(e)ROS 的相对产量曲线;(f)NO 释放曲线[63]。Fig.6 (a)Schematic diagram of the anti-tumor mechanism of Nic-MOF@HA based on PDT and NO therapy. (b)NO release curve. (c)Relative yield curve of ROS[62]. (d)Schematic diagram of the preparation process of UCNPs@PCN@LA-PVDF nanocomposite membrane and the synergistic sterilization of PDT/NO gas therapy. (e)Relative yield curve of ROS. (f)NO release curve[63].
NO 作为参与体内各种生理和病理过程的内源性分子,高浓度的NO 不仅可以有效地杀伤肿瘤细胞,而且还具有广谱的抗菌效果。由于具有较长的半衰期(~5 s)和较大的扩散距离(40~200µm)等优势,NO 的杀伤范围较广,有效弥补了ROS 扩散距离短、杀菌面积不足等缺点。如图6(d)所示,卢全仁教授团队报道了一种纳米复合聚偏二氟乙烯(PVDF)膜,将PDT 和NO 疗法结合起来用于抗菌治疗[63]。首先合成了由UCNPs 和PCN-224 构成的纳米复合材料,然后将L-精氨酸(LA)修饰在上述材料上。最后,采用静电纺丝的方法将UCNPs@PCN@LA 与PVDF 结合,合成终产物UCNPs@PCN@LA-PVDF 纳米复合膜。如图6(e)所示,使用DPBF 作为ROS 探针,在980 nm 激光照射后UCNPs@PCN-PVDF 的DPBF 吸收值下降明显,表明有大量的ROS 产生,而UC⁃NPs@PCN@LA-PVDF 的DPBF 吸收值下降程度要弱于UCNPs@PCN-PVDF,这是因为一部分ROS 用来 氧 化LA 产 生NO。如 图6(f)所 示,UCNPs@PCN@LA-PVDF 光照后产生的NO 明显增多,但低于安全浓度(0.4 µmol·L-1)。这表明ROS 是产生NO 不可缺少的原料。体外实验证实,NO 气体疗法辅助PDT 有着显著的抗菌能力,对铜绿假单胞菌和金黄色葡萄球菌的杀菌率分别达到99.64%和99.63%。
3.5 协同策略
PDT 主要是通过产生具有高度反应性的ROS来破坏肿瘤或细菌细胞的蛋白质/DNA/RNA 等物质,从而杀灭肿瘤细胞或者病原微生物。为了提高治疗效果,可以将PDT 以及其他治疗手段联合应用,通过这种协同策略实现高效的肿瘤细胞以及细菌的杀伤作用。光热疗法(PTT)是一种依靠光激发导致光热剂产生高温从而杀灭肿瘤细胞或致病微生物的疗法。这是一种不依赖氧气的治疗策略,因此PDT/PTT 的联合应用不会引起冲突。而化学动力疗法(CDT)利用了芬顿或者类芬顿反应产生·OH,在众多的ROS 种类中,·OH 的细胞毒性最强。相较于PDT 和PTT,CDT 不需要外部激光照射输入能量,可以在GSH 或H2O2存在的情况下触发,CDT 的存在可以提升PDT 的效果。
如图7(a)所示,裴仁军教授团队开发了一种Au@MOF 的核壳纳米复合物,由Au 纳米棒作为核,在其表面修饰羧酸基团,然后通过金属-卟啉-金属自组装的过程在Au 纳米棒形成MOF 壳层[64]。MOF 壳层 的厚度主 要是通过 调 节Fe3O(OAc)6⁃(H2O)3和TCPP 之间配位反应的循环次数来实现。Au 纳米棒在650 nm 光的照射下发挥PTT 的作用,而PDT 功能主要是由Fe-TCPP 来实现。如图7(b)所示,在1 W·cm-2的功率下,Au 纳米棒的温度在10 min 内上升了15 ℃左右,Au@MOF 温度在10 min 内可以升高30 ℃,而且MOF 的厚度也将影响温度的变化。因此,合成了3 种不同的Au@MOF,测试它们的PTT效果。发现Au@MOF-2效果最好而Au@MOF-3 效果明显差于Au@MOF-2。这可能是因为卟啉材料本身在光的照射下产生振动弛豫导致温度上升,但是壳层太厚则会影响Au纳米棒的局部表面等离子体共振(LSPR)降低PTT 效果。使用SOSG 作为ROS 探针,检测1O2的产生。如图7(c)所 示,在650 nm 激 光 照 射 下,Au@MOF-2 的SOSG 吸收值随时间逐渐下降,到8 min 荧光强度几乎为零,表明Au@MOF-2 能够产生1O2。如 图7(d)所 示,体 内PTT 效 果 表 明,Au@MOF 在经过叶酸(FA)修饰后靶向能力得到增强,Au@MOF-FA 在肿瘤组织内聚集,导致有效浓 度 升 高。Au@MOF-FA(0.5 nmol·cm-3)在660 nm 光照射下,2 min 内温度上升到50.54 ℃。

图7 (a)Au@MOF 的合成过程以及PDT/PTT 协同破坏肿瘤细胞原理图;(b)不同Au@MOF 与AuNRs 的温度曲线;(c)经过Au@MOF 处理后,单线态氧探针(SOSG)的荧光强度随时间变化曲线;(d)PBS(-)、Au@MOF-FA(+)、Au@MOF(+)、PBS(+)的热成像图[64];(e)PB-PCN-224 纳米复合材料的PDT/PTT 协同抗菌原理图;(f)PB、PCN-224、PB-PCN-224 的ROS 相对产量曲线;(g)Control,PB、PCN-224、PB-PCN-224 的温度曲线;(h)~(i)Control,PB,PCN-224,PBPCN-224 在不同条件下分别对金黄色葡萄球菌及其生物膜的抗菌效率[65];(j)FeTCPP/Fe2O3的PDT/CDT 协同破坏肿瘤细胞原理图;(k)TMB、TMB +H2O2、FeTCPP/Fe2O3+H2O2+TMB 的紫外吸收曲线;(l)不同时间内·OH 的产量曲线[66]。Fig.7 (a)The synthesis process of Au@MOF and the principle diagram of PDT/PTT synergistic destruction of tumor cells. (b)Temperature curves of different Au@MOFs and AuNRs. (c)After Au@MOF treatment,the fluorescence intensity of sin⁃glet oxygen probe (SOSG)changes with time. (d)Thermal images of PBS(-),Au@MOF-FA(+),Au@MOF(+),PBS(+)[64]. (e)Schematic diagram of PDT/PTT synergistic antibacterial of PB-PCN-224 nanocomposite. (f)ROS relative pro⁃duction curves of PB,PCN-224,PB-PCN-224. (g)Temperature curves of Control,PB,PCN-224,PB-PCN-224. (h)-(i)Antibacterial rates of Control,PB,PCN-224,and PB-PCN-224 againstStaphylococcus aureusand the biofilm under different conditions[65]. (j)Schematic diagram of PDT/CDT of FeTCPP/Fe2O3synergistically destroying tumor cells. (k)UV-Vis absorption curves of TMB,TMB+H2O2,FeTCPP/Fe2O3+H2O2+TMB. (l)Production curves of·OH at different time[66].
PTT+PDT 协同治疗的策略在治疗细菌感染性疾病方面也有许多应用。吴水林教授团队合成了一种基于卟啉MOFs 的新型纳米材料,如图7(e)所示,首先合成PCN-224,然后通过持续搅拌将普鲁士蓝(PB)通过静电吸附与PCN-224 结合[65]。在660 nm 激光照射后,PB-PCN-224 的PDT效果与PCN-224 相比得到了明显的提升,如图7(f)所示。PB-PCN-224 的ROS 产量相比PCN-224更多,这是因为PB 和PCN-224 的能带匹配,它们的组合形成了异质结构,有效促进了光生电子空穴分离,导致ROS 的产量提升。同时,PB 的引入赋予了PB-PCN-224 良好的光热效果,如图7(g)所示,在660 nm 激光 照 射6 min 后,PB 和PB-PCN-224 的温度分别升至58.7 ℃和51.6 ℃。体外抗菌实验结果表明,PB-PCN-224 在光照下,对金黄色葡萄球菌的抗菌效率达到99.84%(图7(h)),对金黄色葡萄球菌生物膜的抗菌效率也可以达到99.30%(图7(i))。
如图7(j)所示,裴仁军教授团队通过液体扩散法合成了具有MOF 结构的FeTCPP/Fe2O3纳米复合材料,Fe3+催化H2O2产生·OH 同时产生氧气,有效改善了肿瘤部位缺氧的状态[66]。MOF 结构中卟啉PS 的良好的分散性和高孔隙率暴露了更多的活性位点,促进了卟啉分子与氧分子之间的能量交 换,增 强了PDT 效果。CDT 生成的·OH 和PDT产生的1O2可以协同杀灭肿瘤细胞,达到提高肿瘤治疗效果的目的。然后通过负载红细胞膜(RBCs membrane)以增强材料的血液循环和组织停留时间,最后修饰靶向分子AS1411 以实现MOFPS 在肿瘤域上的富集。如图7(k)所示,TMB 作为·OH的探针,探测到FeTCPP/Fe2O3+ H2O2有·OH 的产生。图7(l)反映的是FeTCPP/Fe2O3+ H2O2的·OH 产量与时间有关,时间越长,产生的·OH 越多。
4 总结与展望
本文总结了近几年关于卟啉-MOFs 材料的PDT 在治疗肿瘤以及细菌感染性疾病中的应用,主要集中在如何提升PDT 的性能和PDT 与其他治疗策略协同作用上。PDT 相较于传统的化疗和放疗,效果明显且治疗周期短。PDT 发挥作用主要是因为在治疗部位光的照射导致卟啉被激发并将能量传输给氧气产生1O2,这种按需治疗的特点以及卟啉本身具有良好的生物安全性,因此PDT被当作是一种高效、低毒、无创的治疗方法。尽管PDT 有上述优点,但是其依赖氧气以及某些卟啉MOFs 材料能量传输效率差等特点限制了其PDT效果,而且病变组织微环境本身含有大量的GSH等功能分子以及病变部位代谢旺盛导致的氧含量低等原因,导致ROS 产量低且被大量消耗。因此,如何有效提升PDT 的治疗效果是卟啉-MOFs材料在具体应用中亟待解决的重要问题。通过利用某些金属离子的纳米酶属性催化H2O2产生氧气,或者限制肿瘤细胞以及细菌的代谢,抑制氧气的消耗从而提高组织内氧气浓度可以有效解决缺氧的问题。氧气浓度的提高有利于ROS 的产生,从而增强PDT 效果。改进能量传递过程,加快电子分离和转移,使得分子氧能够快速活化为ROS,提高ROS 的产量。以GSH 为代表的功能分子能显著地消耗ROS,削弱PDT 的治疗效果。某些金属离子能够消耗GSH,削弱肿瘤和细菌的抗氧化防御体系,增强ROS 的治疗效果。以NO 为代表的气体疗法能够显著抑制肿瘤生长,杀灭细菌等病原微生物,协助PDT 增强治疗效果。PDT 与PTT/CDT 等组成的协同疗法,可以最大限度地提高疾病的治疗效果。
虽然卟啉-MOFs 的PDT 效果得到了广泛的研究与肯定,并且为了提升其治疗效果也采取了许多手段,但是卟啉-MOFs 在当前的研究中仍然存在许多缺点和不足,所以在未来的研究中需要更加关注如下问题:(1)卟啉-MOFs 材料的激发目前大都限制在660 nm 波长左右,在临床上应用时需要扩展到更长的波长,以实现更深的组织穿透性能。 (2)需要开发更多的基于肿瘤和细菌感染微环境设计的卟啉-MOFs 材料。在治疗的过程中材料与环境中的各种成分相互作用可放大PDT 的治疗效果,克服PDT 的固有局限性。 (3)目前关于卟啉-MOFs 材料在体内的安全性、体内代谢、作用机制和长期毒理学研究仍有许多重要问题需要解决,未来的研究方向需要关注的有:更加优秀的生物安全性、更低的毒副作用、优秀的靶向性以及体内递送效率的材料等,只有这样才能快速推动卟啉-MOFs 材料在临床上应用,更快地造福人类。
本文专家审稿意见及作者回复内容的下载地址:http://cjl. lightpublishing. cn/thesisDetails#10.37188/CJL.20230097.
