VEGFR-TKIs治疗晚期乳腺癌有效性及安全性的Meta分析
2023-09-04刘琳郑立平吴柚佼毕小慢郑少江
刘琳,郑立平,吴柚佼,毕小慢,2,郑少江
1.海南医学院第一附属医院肿瘤研究所,海南省热带心血管病研究重点实验室,海南 海口 570102;2.海南医学院生物医学信息与工程学院,海南 海口 571199
据世界卫生组织最新报告,2020 年全球乳腺癌新发病例达226 万,乳腺癌首次成为全球第一大癌症[1]。在新发乳腺癌病例中晚期乳腺癌的比率占4%~6%,5 年总生存率仅为20%[2]。晚期乳腺癌存在容易耐药复发和远处转移等特点,因此多线治疗失败后往往面临着少药甚至是无药的难题。抗血管生成药物在临床上常应用在三阴性乳腺癌及HER-2 阴性乳腺癌患者的后线治疗中[3],但临床上VEGFR-TKIs在晚期乳腺癌的线次使用及分子分型治疗仍存在一定的争议。本研究拟纳入VEGFR-TKIs治疗晚期乳腺癌的多项双臂试验文献,以期为临床研究提供循证医学证据。
1 资料与方法
1.1 文献检索 检索时间从2010 年1 月至2022年7 月,以中国生物医学文献数据库、中国知网、万方数据库、PubMed、Web of Science、Embase 等数据库为主。中文检索词包括晚期乳腺癌、小分子抗血管生成药物、酪氨酸激酶抑制剂、索拉菲尼、舒尼替尼、阿帕替尼、安罗替尼;英文检索词包括:advanced breast cancer、breast carcinoma、Anlotinib、Sunitinib、Apatinib、Sorafenib、tyrosine kinase inhibitors、vascular endothelial growth factor等。
1.2 纳入标准 (1)研究类型:双臂试验文献(包括Ⅱ期或Ⅲ期临床实验),且纳入每种药物文献数量至少两篇;(2)研究对象:通过病理活检及影像学等相关检查确诊为IV期乳腺癌患者;(3)干预措施:实验组使用VEGFR-TKIs 单药治疗或联合对照组药物治疗,对照组采用非VEGFR-TKIs (常规化疗药物或姑息)治疗;(4)结局指标:客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)、无进展生存期(progression-free survival,PFS)、总生存期(overall survival,OS);(5)安全性指标:高血压、手足综合征、疲劳乏力、骨髓抑制、胃肠道不良反应发生情况。
1.3 排除标准 (1)回顾性研究及队列实验;(2)会议摘要等;(3)无法通过作者获得全文信息及资料数据不完整的研究。
1.4 信息资料提取 根据PICO原则,2名研究人员根据预先设计的表格(主要包括文章的作者、年份、临床研究类型、实验组和对照组治疗措施及纳入偏倚风险评估相关要素、结局指标等)背对背相互交叉进行信息提取,若意见不一致交由导师进行解决。
1.5 文献质量评价 使用Cochran偏倚风险评估工具依次对随机序列的产生、分配隐藏、盲法的实施、退出与失访情况等5 个领域进行质量评价,其结果以低风险、不清楚、高风险3种表现形式展示。
1.6 统计学方法 采用RevMan5.4 软件和Stata17进行Meta分析。ORR、DCR二分类变量指标采用比值比(odds ratio,OR)或相对危险度(relative risk,RR)来进行分析;中位生存期、总生存期采用风险比(hazard ratio,HR)合并统计量。考虑到本文选择的研究对象VEGFR-TKIs类药物名称及靶点各不相同,因此在本研究中均采用随机效应模型进行Meta 分析。当I2>50%或P<0.1 异质性过于明显时,可通过亚组分析来探讨异质性的潜来源;另外当纳入的文献大于10 篇以上时,可通过漏斗图评估发表偏倚。Meta 分析的检验水准设为α=0.05,当P<0.05 时提示差异有统计学意义。
2 结果
2.1 文献检索结果 根据制定的检索策略对相应的数据库进行检索,通过主题词及关键词等初步检索,总共检索到3 092篇相关文献,按照排除与纳入标准最终纳入21篇文献,具体流程见图1。

图1 文献筛选流程及结果Figure 1 Flow chart of literature screening procedure and results
2.2 纳入研究偏倚风险评价结果 21 篇文献中只有3 项研究未具体描述随机方法类型,少数研究未采用分配隐藏、盲法,总体来说文献质量较高,见图2。

图2 RCTs偏倚风险评估Figure 2 Summary of risk of bias
2.3 纳入研究文献的基线特征 21 篇文献含英文文献14篇,中文文献7 篇,包括4 295 例晚期乳腺癌患者(实验组2 188 例使用VEGFR-TKIs 类药物治疗,对照组2 179 例使用非VEGFR-TKIs 治疗)。共包含12 项临床实验,其中5 项为Ⅱ期,2 项为Ⅱb 期,5 项为Ⅲ期,其余7篇均为随机对照实验。从分子分型方面来看,7篇研究中为HER-2阴性,9篇为三阴性,其余5篇未具体阐述。从治疗类型来看,5 篇研究是以一线治疗为主,11篇研究以后线治疗为主,2篇研究以一线或二线治疗为主。纳入研究的基本特征见表1。
2.4 Meta分析结果
2.4.1 客观缓解率 21 篇文献中17 篇报道了ORR。随机效应模型分析结果显示ORR (RR=0.48,95%CI=0.27~0.69),合并效应量检验(Z=2.845,P=0.004),且各个亚组间同质性较好(I2<50%,P>0.1)。结果表明,与非VEGFR-TKIs 组比较,VEGFR-TKIs 组ORR显著获益。但是不同药物间亚组Meta 分析结果示阿帕替尼和安罗替尼的客观缓解率差异有统计学意义(P<0.05),而索拉菲尼和舒尼替尼的客观缓解率差异无统计学意义(P>0.05);不同分子分型客观缓解率亚组Meta 分析结果示三阴性乳腺癌的客观缓解率(RR=0.95,95%CI=0.59~1.30)优于HER-2 阴性乳腺癌的客观缓解率(RR=0.19,95%CI=0.17~0.56),且差异均具有统计学意义(P<0.05);不同线次治疗类型客观缓解率亚组Meta分析结果示,后线治疗的客观缓解率(RR=0.89,95%CI=-0.43~0.41,P=0.000)治疗差异有统计学意义(P<0.05),一线(RR=0.16,95%CI=-0.12~0.44,P=0.264)和一线、二线(RR=-0.01,95%CI=0.56~1.21,P=0.938)治疗差异均无统计学意义(P>0.05),说明VEGFR-TKIs 的客观缓解率只能在乳腺癌后线治疗中获益,见图3~图5。

图3 不同药物客观缓解率的亚组Meta分析森林图Figure 3 Subgroup Meta-analysis forest plot of objective response rate of different drugs

图4 不同分子分型客观缓解率的亚组Meta分森林图Figure 4 Subgroup meta forest plot of objective response rate of different molecular subtypes

图5 不同线次治疗客观缓解率的亚组Meta分森林图Figure 5 Subgroup Meta forest map of objective response rate of different line treatment
2.4.2 疾病控制率 21 篇文献中16 篇研究报道了DCR,随机效应模型分析结果示RR=0.44,95%CI=0.18~0.70,合并效应量检验(Z=3.464,P=0.001),且各个亚组间同质性较好(I2<50%,P>0.1)。结果表明,与非VEGFR-TKIs 组比较,VEGFR-TKIs 组DCR 显著获益。不同药物间亚组Meta 分析示阿帕替尼和安罗替尼的疾病控制率差异具有统计学意义(P<0.05),而索拉菲尼和舒尼替尼的疾病控制率差异无统计学意义(P>0.05);不同分子分型疾病控制率亚组Meta分析中,三阴性乳腺癌的疾病控制率(RR=1.03,95%CI=0.66~1.39)优于HER-2阴性乳腺癌的疾病控制率(RR=0.19,95%CI=-0.17~0.56),且差异均有统计学意义(P<0.05);不同线次治疗类型疾病控制率亚组Meta分析显示,后线治疗的DCR (RR=0.85,95%CI=0.53~1.16,P=0.001)治疗差异具有统计学意义(P<0.05),一线(RR=-0.07,95%CI=-0.58~0.44),P=0.715)和一线、二线(RR=0.38,95%CI=-0.44~1.21,P=0.325)治疗差异均无统计学意义(P>0.05),说明VEGFR-TKIs 的疾病控制率只能在乳腺癌后线治疗中获益,见表2。
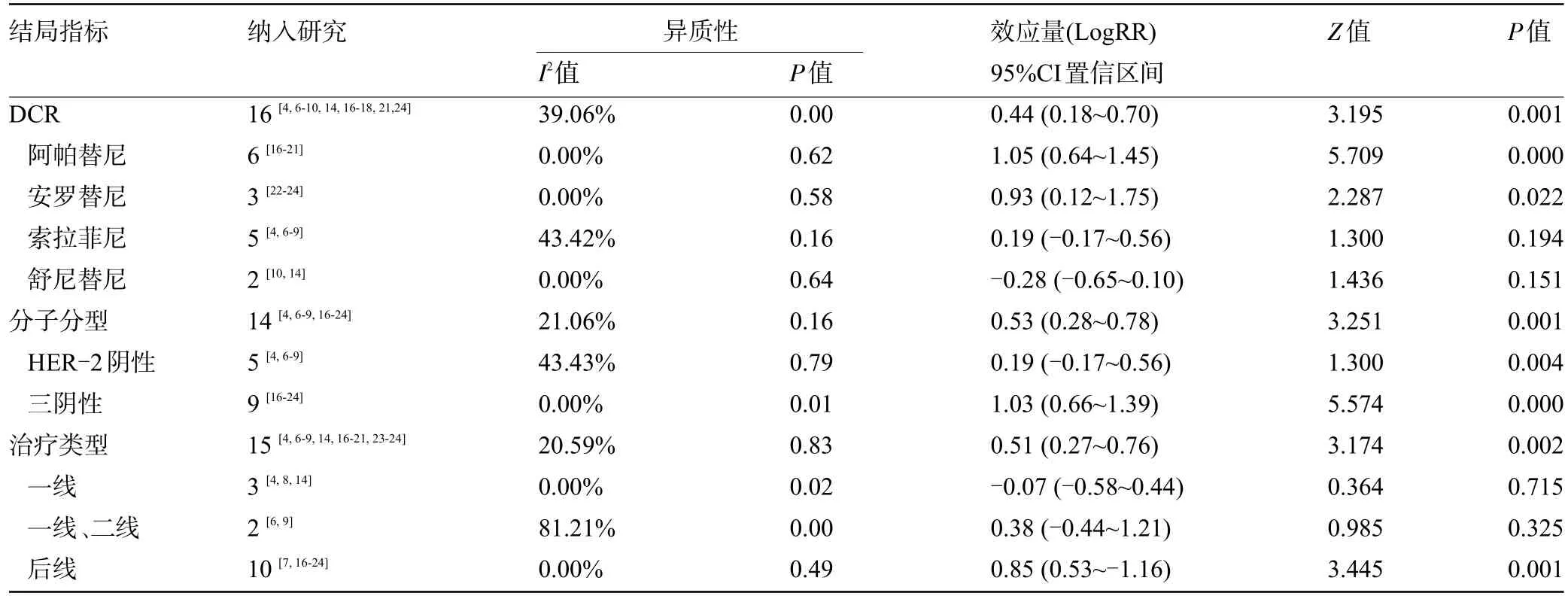
表2 DCR亚组Meta分析结果Table 2 Meta-analysis results of DCR subgroups
2.4.3 无进展生存期及总生存期 12 项研究报道了PFS,随机效应模型分析结果示VEGFR-TKIs 组PFS(HR=1.09,95%CI=0.99~1.19)短于非VEGFR-TKIs组,合并效应量检验(Z=1.767,P=0.077),但是差异无统计学意义(P>0.05);12项研究报道了OS,随机效应模型分析结果示VEGFR-TKIs 组OS (HR=1.26,95%CI=1.14~1.39)短于非VEGFR-TKIs 组,合并效应量检验(Z=4.532,P=0.001),Meta 分析发现非VEGFR-TKIs 组的OS明显长于VEGFR-TKIs组,且差异具有统计学意义(P<0.05),异质性检验结果示存在异质性(I2=68.3%,P<0.1),因此对目前现有的数据进行亚组分析,亚组分析结果提示索拉菲尼组具有一定的异质性(I2=81.3%,P<0.1),而舒尼替尼组间同质性较好(I2=23.5%,P=0.265),且进一步验证了索拉菲尼(Z=4.270,P=0.000)和舒尼替尼(Z=2.262,P=0.024)均未提高患者的OS,差异均有统计学意义(P<0.05),见表3。
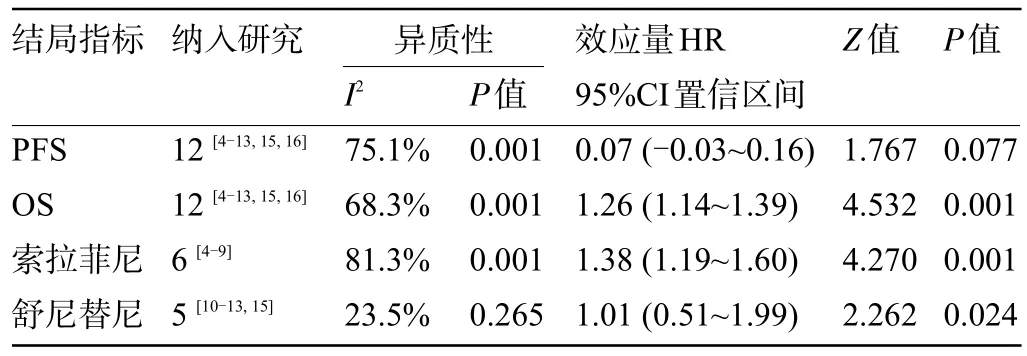
表3 PFS及OS亚组Meta分析结果Table 3 Meta-analysis results of PFS and OS subgroups
2.4.4 安全性评价 依次对纳入研究中≥3级不良反应事件进行评估,Meta 分析表明VEGFR-TKIs组发生≥3 级胃肠道、骨髓抑制、疲劳乏力不良反应率明显高于非VEGFR-TKIs 组,差异有统计学意义(P<0.05);而两组中≥3 级高血压、手足综合征不良反应发生率比较差异无统计学意义(P>0.05),见表4。

表4 安全性Meta分析结果Table 4 Meta-analysis outcome of safety
2.5 发表偏倚 对纳入文献中的客观缓解率和疾病控制率进行发表偏倚分析。由于疾病控制率、客观缓解率的漏斗图对称性欠佳,首先用Begg检验来进行发表偏倚分析,客观缓解率结果提示存在一定的发表偏倚(P<0.05),疾病控制率的稳健性较好(P>0.05),见图6~图7。为进一步明确发表偏倚来源,遂采用轮廓增强漏斗图[25]中的剪补法对客观缓解率进行发表偏倚分析,可以看出剪补出来的红色区域有少部分落在P>0.1区域范围之内,故发表偏倚较小,见图8。

图6 客观缓解率的Begg检验Figure 6 Begg test of objective remission rate

图8 客观缓解率增强漏斗图Figure 8 Objective response rate of contour-enhanced plot
3 讨论
在临床上,抗血管生成药物主要应用在三阴性乳腺癌及HER-2 阴性乳腺癌患者的后线治疗。在2022版晚期乳腺癌指南中[26],晚期三阴性乳腺癌的一线治疗方案可根据患者是否存在gBRCA 突变及PD-L1 表达情况,考虑在铂类单药或双药的基础上加用PARP抑制剂奥拉帕利及阿替利珠单抗,二线化疗方案推荐使用单药化疗或戈妥珠单抗。但是晚期三阴性和HER-2阴性乳腺癌由于存在复发率高、转移性强等特点,指南中曾提到在经过多线治疗失败后可根据患者ECOG体力状态评分尝试使用化疗联合小分子抗血管生成药物,其中VEGFR-TKI类药物由于具有靶点多、口服方便、易透过血脑屏障等优势[27],目前已经在临床上使用,但是具体有效性和安全性仍待进一步验证。
本研究纳入的研究类型多为HER-2阴性和三阴性及一线、二线多药耐药复发的后线治疗的晚期乳腺癌患者,总体数据结果分析表明VEGFR-TKI可提高晚期乳腺癌患者的ORR和DCR,但是亚组分析表明只有阿帕替尼和安罗替尼组间差异有统计学意义(P<0.05)。在对分子分型研究的亚组分析结果中,三阴性乳腺癌的ORR和DCR要优于HER-2阴性乳腺癌患者,这也从侧面说明三阴性乳腺癌患者可能会对VEGFR-TKI类药物更为敏感。线次治疗亚组分析发现,只有后线治疗差异有统计学意义,而一线或一线、二线治疗差异均无统计学意义。综上所述,VEGFR-TKIs类药物中阿帕替尼和安罗替尼后线治疗晚期乳腺癌临床获益率较高。
本研究发现,VEGFR-TKIs 组未能提高患者的总生存期(HR=1.26,95%CI=1.14~1.39),差异有统计学意义(P<0.05);而无进展生存期差异无统计学意义(P>0.05)。纳入本研究有4 篇是报道PFS 获益的[7-9,16],其余8篇[4-6,10-13,15]均未报道PFS获益,因数据差异较大导致组间比较差异无统计学意义,但索拉菲尼仍有提高无进展生存期的趋势。Shao 等[28]曾指出,无论NCCN指南还是中国临床肿瘤学会(CSCO)指南,转移性乳腺癌三线及以上治疗都没有标准的推荐方案,故没有公认的标准治疗方案作为安罗替尼在经过多线治疗失败后的对照组。检索文献后也发现阿帕替尼和安罗替尼缺乏有对照组作参考的临床实验较多,故本研究将此类文章中的临床数据和既往回顾性临床研究中转移性乳腺癌三线以上治疗中化疗和靶向治疗的数据进行对比,多项单臂研究结果发现阿帕替尼和安罗替尼PFS 的临床获益率均有提高[29-33],因样本量较少仍需进一步验证。在安全性上,晚期乳腺癌患者在经VEGFR-TKIs联合化疗后发生胃肠道不良反应、骨髓抑制、疲劳乏力反应等发生率虽高于对照组,但是经过对症处理后都在可耐受范围之内,与文献报道一致[7,9,17,21]。因此在临床上使用时还需评估患者的基本情况后方可使用。
晚期乳腺癌治疗方案主要依据HR 和HER-2 状态、既往化疗方案、用药不良反应情况、患者年龄性别营养情况等基本状态及对药物耐受性情况、无病间期、肿瘤负荷(转移部位和数量)等因素,在相关靶向药物耐受的情况下建议明确gBRCA、PD-L1 表达情况、微卫星不稳定性和肿瘤突变负荷等以指导治疗[26]。但是晚期三阴性和HER-2 阴性乳腺癌由于对内分泌治疗及抗HER-2治疗不敏感,在标准的一线或二线含铂类药物化疗失败后,可供选择的化疗药物较少。自肿瘤血管学说提出以来,越来越多研究表明[34]在乳腺癌发生发展过程中新生血管在起着重要作用,故抗血管生成靶向治疗联合化疗被认为是非常有希望的抗肿瘤策略。本研究也证实了VEGFR-TKIs联合化疗可提高晚期三阴性和HER-2 阴性后线治疗乳腺癌的ORR和DCR。
本研究尚存在一定局限性:(1)此次纳入21篇文献,其中只有12篇是临床实验,其余的未描述是否为临床实验,在文献质量上可能会存在一定的偏倚;(2)相关研究纳入样本量较少,可能或影响结果的可信度;(3)一些研究缺乏PFS 和OS 的数据,无法得出更加全面的结论;(4)本文仅纳入中英文文献,可能会遗漏其他语言的文献,可能造成纳入文献不全面、纳入人种较局限的弊端;(5)少部分纳入文献年限稍久远,但疾病处于不断发展变异的进程,对临床的指导意义可能存在一定的局限。因此,后续有效性及安全性Meta分析和评价尚需更多设计精良的前瞻性大样本、多中心随机对照试验纳入。
综上所述,虽然当前的指南并未指出VEGFR-TKIs可以作为三阴性或HER-2 阴性乳腺癌多线治疗失败后的解救方案。但是,结合本篇Meta分析纳入的研究类型及线次治疗方案,VEGFR-TKIs 类药物中的阿帕替尼和安罗替尼联合化疗可提高乳腺癌患者后线治疗的ORR 和DCR,并且有望转化为PFS 和OS 的临床获益率,因此有望成为晚期乳腺癌治疗的新策略。
