植物源次生代谢产物桧木醇的研究概况
2023-09-03梁宏杰李思雨
梁宏杰, 李思雨
(1.兰州大学 药学院,兰州 730000;2.甘肃省农业科学院 马铃薯研究所,兰州 730070;3.甘肃农业大学 植物保护学院,兰州 730070)
桧木醇 (hinokitiol) 是一种高活性广谱性天然抑菌物,又称为扁柏酚 (β-thujaplicin),具有托酚酮骨架,属于单萜类天然化合物,结构式见图式1[1-3]。高纯度桧木醇为无色或淡黄色结晶,熔点 50~52 ℃,性质与酚相似,能溶于碱性水溶液和常见的有机溶剂,稍溶于水,其水溶液遇铁、铜离子易起颜色反应,紫外吸收的特征波长为 247 nm[4]。桧木醇具有抗菌抑菌、杀虫、抗癌、抗炎及抗氧化等广泛的生物活性[2-3],具有重要的开发价值。有关桧木醇的综述论文较少,已有文章主要从生物活性及应用研究进行总结梳理[5-6],本文将从桧木醇的发现、合成、生物活性、作用机理、应用研究及结构衍生化等方面进行梳理总结,以期为桧木醇开发应用提供比较系统的参考。
图式1 桧木醇结构式[2]Scheme 1 Structural formula of hinokitiol[2]
1 桧木醇的来源及合成
1933 年,Anderson 和Sherrard 从美国西部雪松Thuja plicata的芯材中分离到一种低比重、耐腐烂的油,遗憾的是当时未进行分离纯化[7]。1936年,日本科学家Nozoe 从台湾扁柏Chamaecyparis obtusavar.formosana的芯材中分离出一种烯醛类化合物,并于1938 年确定其分子式为C10H12O2,在1947—1948 年间,Nozoe 推导出其化学结构如图式1 所示,并命名为桧木醇,该物质也被众多日本学者称之为Nozoe—hinokitiol[8-11]。天然源的桧木醇不仅存在于柏科植物中,在百里香、八角茴香等植物中也有发现,不过其在柏科植物中的含量较高,目前天然源桧木醇主要从柏木油中提取[4,11]。天然源桧木醇在植物组织中含量非常低,Hsu 等通过水蒸气蒸馏法从台湾翠柏Calocedrus formosana中分离出了具有抗食源性病原菌的油,检测发现桧木醇的含量仅约为4.5%[12]。桧木醇在植物体内的生物合成比较复杂,研究表明其核心结构来源于柠檬烯骨架,然后通过选择性氧化反应和C-C 键断裂重排可形成环庚三烯酮环[13-15]。
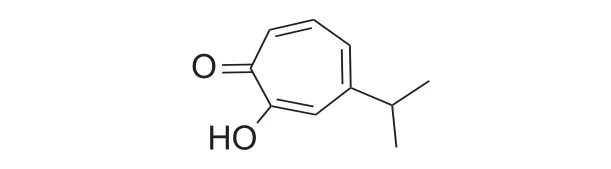
由于天然源桧木醇含量低,不适于进行规模化开发研究。因而,众多研究对桧木醇的人工合成进行了广泛研究,比较经典的有两条合成路线。第1 条合成路线从环戊二烯开始,通过烷基化反应得到中间体1-异丙基环戊二烯,其与二氯乙酰氯在三乙胺存在下发生加成反应,再通过扩环得到桧木醇 (图式2)[16-17]。
第2 条合成路线是从2-异丙基苯酚开始,通过催化加氢获得2-异丙基环己酮,然后用丙酮氰醇在碱性介质中处理,再通过Tiffeneau-Demjanov环膨胀得到3-异丙基环庚酮,最后用当量的二氧化硒在乙醇中处理3-异丙基环庚酮得到桧木醇(图式3)[18]。
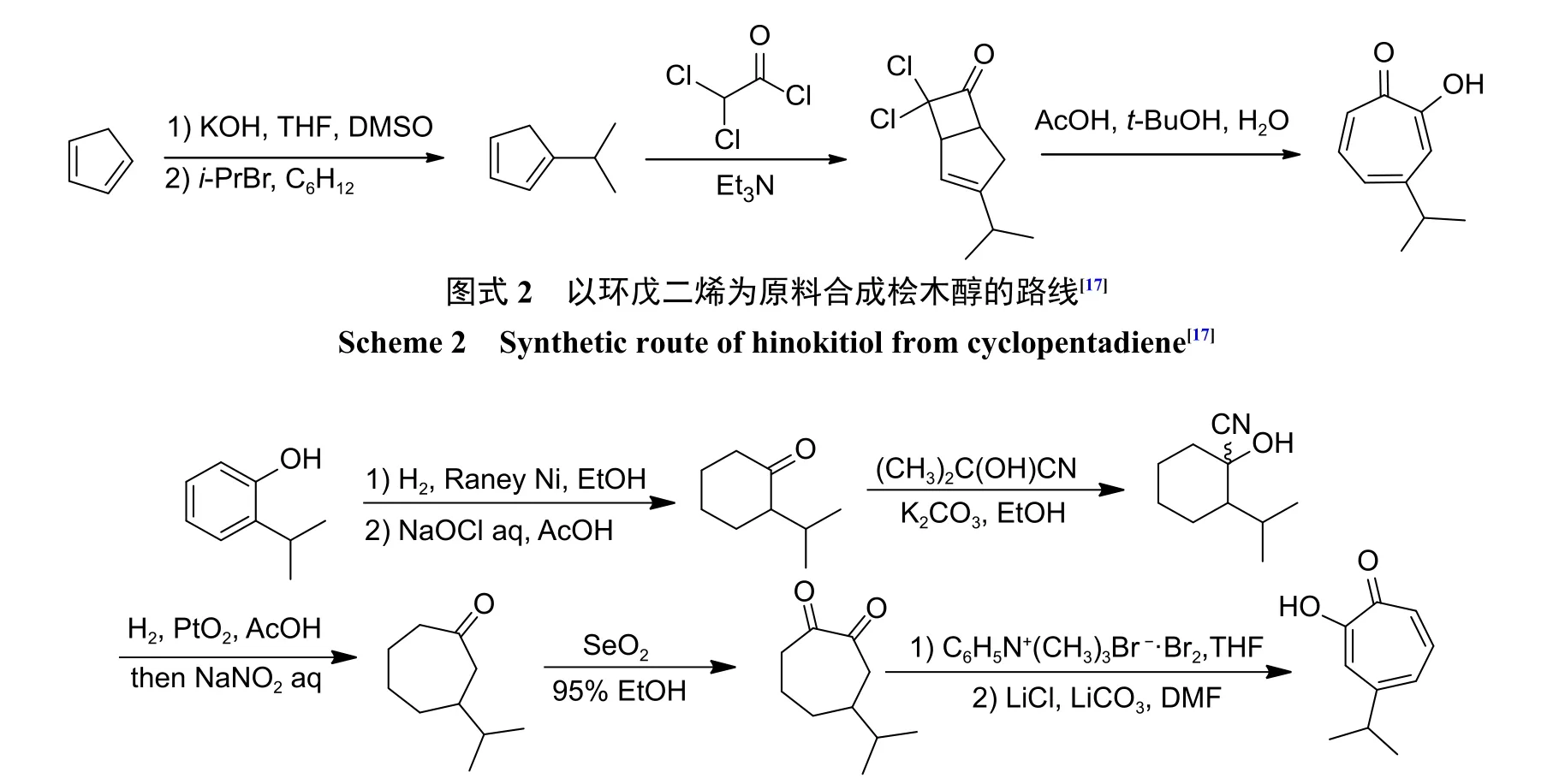
图式3 以2-异丙基苯酚为原料合成桧木醇的路线[18]Scheme 3 Synthetic route of hinokitiol from 2-isopropylphenol[18]
2 桧木醇的生物活性研究
2.1 桧木醇的抗菌、抑菌活性
2.1.1 桧木醇对人类致病菌的抗菌活性 文献报道显示,桧木醇对白色念珠菌Candida albicans、红色毛癣菌Trichophyton rubrum、须发癣菌Trichophyton mentagrophytes、烟曲霉Aspergillus fumigatus等真菌的最小抑制浓度(minimum inhibitory concentration, MIC)值分别为1.6~25、17~50、50 和25 μg/mL,其中抗白色念珠菌的活性比较显著[19-24]。白色念珠菌是导致人类多种疾病的致病菌,其耐药性已经严重影响到了相关治疗效果,发现新的抗白色念珠菌药物意义非凡[25]。研究人员用桧木醇对人的口腔、鼻腔、人造牙齿等进行处理,发现其能有效降低白色念珠菌数量[26]。Nakamura 等发现,0.25 mmol/L 的桧木醇处理口腔30 min 有助于控制口腔中的白色念珠菌数量,且对口腔上皮细胞安全[27]。研究还发现,桧木醇对耐氟康唑fluconazole 的白色念珠菌具有非常好的抑制活性,MIC 值为1.6 μg/mL,与敏感菌一致,对真菌的最低抑制浓度(minimal fungicidal concentration, MFC)为100 μg/mL,表明桧木醇与氟康唑无交互抗性[23]。日本的研究人员用1%的桧木醇水凝胶对志愿者口腔进行定期处理,每天处理3 次,累计处理28 d 后发现,桧木醇能够显著改善由口腔微生物引起的口腔异味,且接受治疗的志愿者均无不良反应[28]。
桧木醇对金黄色葡萄球菌Staphylococcus aureus、李斯特菌Listeria monocytogens、表兄链球菌Streptococcus sobrinus和变异链球菌Streptococcus mutans等革兰氏阳性菌,以及大肠杆菌Escherichia coli、肠炎沙门氏菌Salmonella enteritidis、鼠伤寒沙门菌Salmonella typhimurium、肺炎杆菌Klebsiella pneumoniae、绿脓杆菌Pseudomonas aeruginosa、伴放线放线杆菌Actinobacillus actinomycetemcomitans、牙龈卟啉单胞菌Porphyromonas gingivalis、中间普氏菌Prevotella intermedia、具核梭杆菌Fusobacterium nucleatum和军团菌属Legionella等革兰氏阴性菌也表现出了较强的抗菌活性[22,24,29-32],这可能是桧木醇被广泛用于食品添加剂、化妆品和牙膏中的重要原因[2]。这些研究结果都表明桧木醇在抗人源致病菌方面具有重要的开发意义。
2.1.2 桧木醇对植物致病菌的抑菌活性 在桧木醇对植物致病菌的抑制活性研究中,涉及到了植物从生育期到采后贮藏全过程中的多种病原菌。其中,桧木醇对细菌性植物病害青枯雷尔氏菌Ralstonia solanacearum具有较好的抑菌活性,其MIC 值为50 μg/mL[30]。青枯雷尔氏菌能够引起植物青枯病,被认为是世界十大重要植物病原物之一,其分布地域和寄主范围广,且具有丰富的种内遗传多样性[33],但可用的杀菌剂严重不足,在中国登记的防治药剂主要有中生菌素 (zhongshengmycin)、噻唑酮 (thiazolidinones)、噻唑锌 (thiazole-Zn) 和芽孢杆菌Bacillus等,与其危害性不相符[34]。此外,桧木醇对香蕉炭疽病菌Colletotrichum musae、核盘菌Sclerotinia sclerotiorum、立枯丝核菌Rhizoctonia solani、灰葡萄孢Botrytis cinerea、禾谷镰刀菌Fusarium graminearum和稻瘟病菌Magnaporthe oryzae等19 种致病真菌具有较好的抑菌活性,其EC50值在1.10~53.84 μg/mL 之间,MIC 值在12~50 μg/mL 之间[24,30,32,35-39]。
文献也报道了桧木醇在寄主植物上的应用效果。1992 年,Fallik 等研究发现,10 μg/mL 的桧木醇对灰葡萄孢和链格孢Alternaria alternata孢子萌发及菌丝生长的抑制率均超过50%,用750 μg/mL的桧木醇溶液处理收获后的茄子和辣椒后,其腐烂率减少50% 以上,且无明显药害[40]。将采后龙眼果实浸泡在 50 μg /mL 的桧木醇溶液中 10 min,晾干后于( 25 ± 1) ℃下贮藏,发现桧木醇处理可以维持采后龙眼果实的品质,延缓果皮褐变,具有防腐保鲜作用[41]。将桧木醇加入到包装材料中,能够延长番茄保存期,且对番茄安全[42]。用3000 μg/mL 的桧木醇处理采后葡萄和苹果,发现其对灰霉病的防治效果可达100%[43]。Qiao 等用采后的新鲜香蕉研究了桧木醇对香蕉炭疽病的防治效果,发现200 μg/mL 的桧木醇与100 μg/mL 的多菌灵(carbendazim)防治效果相当,能够完全阻止香蕉炭疽病侵染,且对香蕉品质无影响[38]。用600 μg/mL 的桧木醇处理采后的胡萝卜,发现其对菌核病的防效可达80%以上,且对胡萝卜品质无影响,同时发现桧木醇与多菌灵无交互抗性[35]。张旭欢等测定了桧木醇对西瓜枯萎病菌Fusarium oxysporumf.sp.niveum的抑菌活性和盆栽防效,发现其对西瓜枯萎病菌菌丝生长和孢子萌发的离体 EC50值分别为 31.017 μg/mL 和 45.174 μg/mL,还发现1000 μg/mL 的桧木醇盆栽防效达75.2%[39]。截止目前的研究结果表明,桧木醇在植物病害防治方面具有很好的应用价值,可作为绿色低毒的杀菌剂进行研发。
2.1.3 桧木醇对致病菌的作用机理研究 由于桧木醇的结构与酚类化合物类似,因此其抑菌机理被认为与影响细胞呼吸作用和细胞膜通透性有关。Wang 等研究发现,桧木醇破坏了灰葡萄孢膜的完整性,使细胞内容物渗漏,最终导致细胞死亡[43]。Yasumoto 等认为桧木醇的羟酮结构具有金属螯合活性,能够抑制病原菌的细胞呼吸和DNA 生物合成途径[44]。Morita 等研究了桧木醇对大肠杆菌和金黄色葡萄球菌的抗菌机理,认为桧木醇可抑制病菌的细胞呼吸和营养物质的运输,但不会导致细胞蛋白质或核酸泄漏或形态变化[45]。Komaki 等发现,在好氧条件下白色念珠菌对桧木醇的敏感性高于其在厌氧条件下的,并且在两种条件下桧木醇均未抑制白色念珠菌ATP 的合成,但是,控制生长的CYR1 和RAS1 蛋白的mRNAs 表达受到抑制,导致Ras-cAMP 信号通路受阻,最终造成细胞代谢紊乱,从而使桧木醇发挥抑菌效果[20]。
关于桧木醇的抑菌机理,研究人员还发现了一些现象。Ishimatsu 等采用圆盘法(disk)测定了桧木醇对嗜肺军团菌Legionella pneumophila的抗菌效果,发现25 μg/disk 桧木醇完全抑制了培养基上菌落的生长,而在含铁离子的培养基上菌落可以生长,在培养基中还可以看到红色的络合物,表明铁离子可能与桧木醇发生了作用,并弱化了桧木醇抗菌活性[46]。Nomiya 等研究了铁离子与桧木醇配合物的抑菌活性,配合物溶于水后对大肠杆菌的MIC 值大于1000 μg/mL,而溶于氯仿(CHCl3)后对大肠杆菌的MIC 值小于2 μg/mL。其原因在于配合物在水溶液中没有分解,而在氯仿中分解为金属离子和桧木醇的形式,该研究也暗示了铁离子可以减弱桧木醇的抗菌活性[47]。Grillo 等在研究利用桧木醇运输铁离子来治疗缺乏铁运输蛋白的疾病中发现,3 个桧木醇分子可以螯合1 个铁离子,而且能把铁离子带入细胞内,具有运输铁离子的功能[48]。Jin 等认为桧木醇对细胞内铁离子的螯合作用是直接的抑菌机理,也是主要抑菌机理,研究中其他测定指标的变化都是因为细胞内铁离子被螯合后引起的生理变化,而不是直接受到桧木醇的影响[19]。因此,桧木醇对细胞内铁离子的螯合作用被认为可能是其最重要的作用机理。
2.2 桧木醇杀虫活性
目前的研究报道主要是针对人畜致病性寄生虫和植物线虫。如桧木醇对白蚁Coptotermes formosanus和恶性疟原虫Plasmodium的LC50值约为0.07 g/m2和1.0 μg/mL[49-50]。在老鼠体内桧木醇具有很好的抗疟原虫活性,经桧木醇治疗后,寄生虫血症下降到5.6%,而阴性对照为28.7%[51]。研究发现,不同浓度的桧木醇与曼氏血吸虫Schistosoma mansoni尾蚴共同孵育,可以使曼氏血吸虫幼虫失去感染宿主的能力[52]。研究还发现,桧木醇对南方根结线虫Meloidogyne incognita的LC50值为0.3933 μg/mL,阳性对照甲氨基阿维菌素(emamectin benzoate) 的LC50值为0.1043 μg/mL[53]。
2.3 桧木醇其他生物活性
经测定,桧木醇对沙眼衣原体Chlamydia trachomatis的MIC 值为32 μg/mL,可作为治疗沙眼的局部药物进一步研发[54]。桧木醇在抗癌方面也具有比较突出的效果,其能够抑制老鼠畸胎癌细胞的生长,诱导癌细胞死亡,其机理可能是桧木醇诱导了癌细胞自噬作用[55-57]。桧木醇还具有抗炎作用,具有开发成为治疗牙周炎药物的潜力[58]。桧木醇能够可逆性地抑制黑色素的形成,适合用于增白型香皂的添加剂,还可用作生发剂、头发调理剂、去臭剂和减肥剂[59]。此外,桧木醇具有一定的抗病毒活性,主要表现为对人类免疫缺陷病毒HIV、乙型肝炎病毒HBV 及丙型肝炎病毒HCV 的抑制作用。HIV-1 逆转录酶核糖核酸酶H(RNaseH)具有4 种酶活性,对病毒复制至关重要,并且其催化活性需要金属离子的参与,而桧木醇具有螯合金属离子的能力,能够抑制RNase H的活性,是潜在的抗HIV 候选药物[60-61]。
3 桧木醇的非靶标毒性
在日本等国家,桧木醇作为食品添加剂和化妆品原料已使用20 多年,未有安全事故报道[2,59]。桧木醇对小鼠的经口急性毒性为760 mg/kg[62],按照中国有毒物毒性标准,可归类为低毒物质[63]。Jin 等比较了桧木醇对哺乳动物和白色念珠菌细胞内铁离子的螯合作用,结果表明,桧木醇对哺乳动物细胞内铁离子的螯合作用远低于对白色念珠菌[19]。有研究发现,用300 μg/mL 的桧木醇处理人类上皮细胞HGECs、HUVECs 3 h 后,细胞无明显受损[31]。在评价桧木醇对大鼠的慢性毒性和致癌性的研究中,以质量浓度分别为0.005%、0.015%和0.05%的桧木醇喂食大鼠52 周(364 d)后,考察大鼠存活率、体重、食物消耗、尿液和血液等变化,结果未发现与处理相关的不良反应;在致癌性研究中,通过组织病理学检查未发现与处理相关的任何肿瘤性病变[64]。在对农作物病害的防治研究中也发现,桧木醇对多种农作物未产生明显药害,具有很好的安全性[35,38,40-42,65]。但是,也有文献报道了50 μg/mL 的桧木醇可以显著抑制油菜和黄瓜种子的萌发,30 μg/mL 的桧木醇可以显著抑制油菜和黄瓜根系的生长[66]。桧木醇作为一种植物源化合物,具有非常优良的环境兼容性,对人类和哺乳动物等非靶标生物具有较高的安全性。但是,其对植物种子和根系可能具有一定毒性,需要进一步明确,这对桧木醇的用药方式具有重要参考价值。
4 桧木醇结构修饰及衍生物生物活性研究
桧木醇作为一个高活性的天然先导化合物,众多研究者对其结构进行了修饰,并评价了生物活性。Fotopoulou 等评价了桧木醇7 位被哌嗪基取代的5 种衍生物的生物活性 (图式4),发现衍生物mk60、mk61、mk148 和mk150 对蜡样芽孢杆菌Bacillus cereus、黄色微球菌Micrococcus flavus、金黄色葡萄球菌、单核增生李斯特菌Lysteria monocytogenes、铜绿假单胞菌Pseudomonas aeruginosa、大肠杆菌Escherichia coli、阴沟肠杆菌Enterobacter cloacae和鼠伤寒沙门氏菌Salmonella typhimurium的抑制活性高于链霉素 (streptomycin)和氨苄青霉素 (ampicillin);衍生物mk149 除对金黄色葡萄球菌的抑制活性低于链霉素和氨苄青霉素之外,对其余测定细菌的抑制活性均高于链霉素和氨苄青霉素;5 种衍生物对烟曲霉Aspergillus fumigatus、杂色曲霉Aspergillus versicolor、炭黑曲霉Aspergillus carbonarius、黑曲霉Aspergillus niger、绿色木霉菌Trichoderma viride、绳状青霉Penicillium funiculosum、赭绿青霉Penicillium ochrochloron和疣孢青霉Penicillium verrucosum的抑制活性高于联苯苄唑(bifonazole) 和酮康唑(ketoconazole)。该类化合物还具有制备方便、合成成本低和无肝脏毒性的优点,具有开发为抗菌药物的潜力[67]。
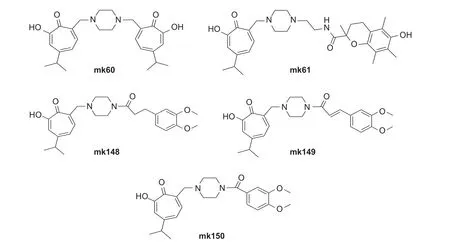
图式4 5 种桧木醇衍生化合物的结构式[67]Scheme 4 Structural formulas of 5 derivates from hinokitiol[67]
Elagawany 等对桧木醇进行了修饰,得到了4 种衍生物 (图式5)。抑菌活性测定结果显示,化合物e2 和e4 抗金黄色葡萄球菌的活性显著高于桧木醇,MIC80值分别为8.8 和16 μmol/L;化合物e1 和e3 的抗菌活性不如桧木醇,MIC80值大于100 μmol/L,而桧木醇的MIC80值为66.7 μmol/L。说明桧木醇羟基位置的取代可以显著增强对金黄色葡萄球菌的抗菌活性[68]。

图式5 4 种桧木醇衍生化合物的结构式[68]Scheme 5 Structural formulas of 4 derivates from hinokitiol[68]
Che 等对桧木醇的羟基进行了磺酰基类衍生化修饰,得到了16 个衍生物 (图式6)。生物活性测定结果显示,化合物3a 和3m 对辣椒疫霉Phytophthora capsici的抑制活性与苯酰菌胺(zoxamide)相当,且显著高于桧木醇,3a、3m、苯酰菌胺和桧木醇的EC50值分别为18.64、21.11、23.15 和88.78 μg/mL。初步构效关系分析表明,在桧木醇的羟基位置引入不同的磺酰取代基,对辣椒疫霉的抑菌活性有显著影响,但七元环和碳基的存在仍是该类衍生物具有高抑制活性的必要条件。此外,化合物3n~3p 对线虫LC50值在0.2079~0.3499 μg/mL 之间,活性显著高于桧木醇 (LC50值0.3933 μg/mL),表明桧木醇中引入杂环有利于提高其杀线虫活性[53]。总的来看,当R 为脂肪族时,其相应的衍生物具有更好的抗卵菌活性,未来可以考虑合成具有合适链长的衍生物;当R 为杂环时,其相应衍生物具有较好的杀线虫活性。今后可以考虑合成更多的这些衍生物。
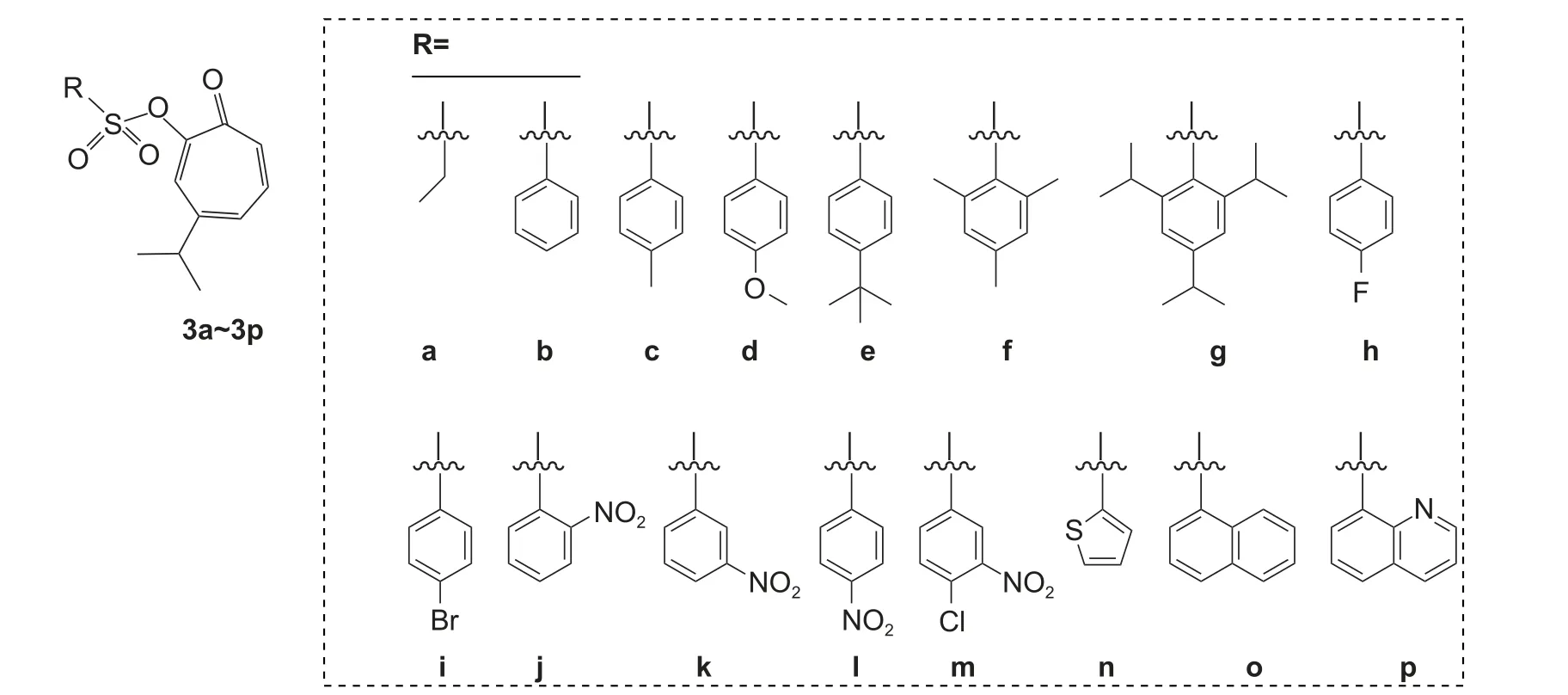
图式6 16 种桧木醇衍生化合物的结构式[53]Scheme 6 Structural formulas of 16 derivates from hinokitiol[53]
桂阔等以桧木醇为先导化合物,分子中引入酯键或醚键,设计并合成了17 个新型桧木醇衍生物 (图式7)。抑菌活性测定结果表明,目标化合物在50 μg/mL 下对水稻纹枯病菌Rhizoctonia solani、番茄灰霉病菌Botrytis cinerea、油菜菌核病菌Sclerotinia sclerotiorum、苹果树腐烂病菌Valsa mali和黄瓜炭疽病菌Colletotrichum orbiculare均表现出较好的活性,其中化合物3a 对水稻纹枯病菌、3j 对番茄灰霉病菌、3m 对油菜菌核病菌的EC50值分别为1.84、2.47、1.05 μg/mL,而桧木醇对水稻纹枯病菌、番茄灰霉病菌、油菜菌核病菌的EC50值分别为2.00、11.3、5.40 μg/mL,目标化合物表现出比桧木醇更优的活性。初步构效关系分析表明,酯类化合物的抑菌活性整体上要优于醚类化合物;对于醚类化合物,链越长对抑菌活性越有利(5b > 5a, 6b > 6a);对于酯类化合物,苯环上取代基为供电子基时对活性有利[69]。
5 展望

图式7 17 种桧木醇衍生化合物的结构式[69]Scheme 7 Structural formulas of 17 derivates from hinokitiol[69]
桧木醇具有非常优秀的抗菌、抑菌活性,在人源病菌、食品防腐、农业病害防治方面进行了广泛深入的研究。通过对相关文献的梳理,我们在桧木醇的有关研究中发现了一些特点[2,19-53,66-70]:一是天然源桧木醇主要存在于柏科植物中,其结构简单、特别,为托酚酮家族化合物;二是桧木醇能够抑制多种细菌和真菌,包括人源和植物源致病菌,其主要抑菌机理可能是螯合细胞内铁离子,造成细胞生理生化功能异常;三是桧木醇具有抗病毒和杀虫活性,其机理可能也与桧木醇对细胞内铁离子的螯合作用有关;四是桧木醇具有较高的非靶标生物安全性,但是对黄瓜、油菜等部分植物具有一定的毒性,可以抑制其种子萌发;五是桧木醇已经实现了较低成本的人工合成,其来源进一步丰富;六是对桧木醇的结构衍生化研究表明,桧木醇的七元环和羰基是其发挥生物活性的必要基团,羟基位置的结构修饰一般可以提高活性。目前,作为与桧木醇结构类似的天然产物,丁子香酚(eugenol)已经被登记用于防治多种经济作物的灰霉病等[34]。研究发现,丁子香酚对灰霉病菌离体EC50值为38.6 μg/mL,其抑菌活性远低于桧木醇 (EC50值小于10 μg/mL)[43,70]。综上研究进展,我们认为桧木醇在植物保护领域有很好的开发前景。
桧木醇结构简单,分子体量小,作用机理独特,展现出了巨大的可开发潜力[36]。不过,我们也注意到,自从桧木醇于1938 年被发现至今,相关应用产品却非常少[11]。目前,在中国桧木醇还没有作为医药或者农药登记应用,只有一种含桧木醇的“土传冲净”肥料应用。根据文献调研,认为影响其进一步开发应用的主要因素有3 个方面:一是桧木醇的作用特点尚不明确,如其作用位点是单一位点还是多位点等,特别是桧木醇的铁螯合作用是不是唯一的作用机理。例如,在类似结构的丁子香酚抑菌机理研究中发现,丁子香酚处理的立枯丝核菌菌丝收缩脱水,胞质壁分离,液泡和线粒体减少或溶解;C-4 甲基甾醇氧化酶的表达下调,麦角甾醇的合成受到抑制,细胞膜的通透性增加。此外,丁子香酚通过增加活性氧和丙二醛,降低线粒体膜电位,引发氧化应激反应,并与膜损伤共同促进了丁子香酚的抑菌活性。同时,丁子香酚还能通过影响氧化磷酸化和三羧酸循环来影响立枯丝核菌生长[71]。因此,有理由怀疑桧木醇的抑菌机理可能不是单一位点,而是多位点作用。二是对桧木醇的非靶标毒性研究还不够深入,特别是其对人类、动物、植物等毒理机理和特点尚待深入研究,这在一定程度上影响桧木醇的施药方式。有研究表明,桧木醇对油菜和黄瓜种子的萌发具有抑制作用[66]。三是桧木醇的结构稳定性有待研究,特别是在自然条件下的特点。Coombs 等研究发现,桧木醇溶液暴露在实验室正常光照 (日光灯和透过窗户的太阳光)下6 h 后,对嗜水气单胞菌Aeromonas hydrophila和溶壁微球菌Micrococcus lysodeikticus的抑菌效果降低了43.90%[72]。而用环糊精包埋后的桧木醇稳定性和抑菌活性显著提升[24]。另外,桧木醇与叔丁基对苯二酚的共晶体也表现出非常显著的稳定性和抑菌活性[59]。
在桧木醇开发应用方面以植物病害防治为例,桧木醇不仅本身可以作为一种绿色农药进行开发应用,还可以作为先导化合物进行高活性衍生物的创制,也可以与常规化学农药进行复配或者组合使用,其开发应用前景非常广阔。如,王勇等以丙烷脒与桧木醇进行复配,发现组合物增效显著[73],通过复配或者组合使用,可以达到减少化学农药用量,延缓抗药性发展的效果。
