β-氨基丁酸-大黄酸耦合物的合成、生物活性及韧皮部传导性
2023-09-03胡慈银王锦鹏肖永欣李俊凯
胡慈银, 王锦鹏, 肖永欣, 李俊凯*,,2
(1.长江大学 农学院,湖北 荆州 434025;2.长江大学 农药研究所,湖北 荆州 434025)
农作物病虫草害是制约粮食安全生产的重要因素。化学防治是预防植物病虫草害发生并对其进行管控的有效手段,但农药不合理使用难免对粮食生产及质量造成不利影响[1]。因此,创制具有高活性、高选择性、低风险、无残留及清洁生产的绿色农药是未来中国农药发展的主要趋势。近年研究表明,天然产物在绿色农药研究领域潜力巨大,一些植物、微生物或海洋生物的提取物展现出良好的杀虫、杀菌及除草效果。例如:利用植物苦皮藤Celastrus angulatusMaxim.制成的杀虫剂能够高效作用于鳞翅目昆虫靶标Na+/K+-adenosine triphosphatase (ATPase)[2];从假单胞菌和链霉菌等微生物中提取的申嗪霉素 (phenazine-1-carboxylic acid)已被登记为防治水稻纹枯病的高效杀菌剂[3]。此外,海洋天然产物芦竹碱 (gramines) 类似物和匹普利宁 (pimprinine) 生物碱等也具有良好的抗病毒活性[4-5]。
大黄酸 (Rhein,4,5-dihydroxyanthraquinone-2-carboxylic acid) 属于单核蒽醌类衍生物,主要从药用植物大黄、虎杖及何首乌等多种传统中药材中分离提取[6-7],具有抗炎、抑菌、抗肿瘤、抗病毒和抗氧化等活性[8-11]。以往对大黄酸的研究多集中在医药领域。大黄酸也是双醋瑞因 (diacerein) 的活性代谢物,Boileau 等[12]研究发现,双醋瑞因的作用机理是其代谢物大黄酸能够抑制胞外信号相关激酶ERK1/2 (extracellular signal-regulated kinase-1/2) 和p38 的活性,进而减少骨关节炎软骨组织中白细胞介素1β(interleukin-1-beta) 诱导的金属蛋白 (metalloprotease-13) 和组织蛋白酶K(cathepsin K) 的合成,从而影响非正常软骨组织的代谢及破骨组织的分化。Yang 等[13]对大黄酸3 号位上的羧基进行取代,分别合成了具有苯环结构和酰胺结构的两个系列衍生物。生物活性测定发现,这些衍生物对Hela 和Molt4 等肿瘤细胞具有较好疗效。王兴达等[14]在大黄酸羧基酰胺化的基础上继续对蒽醌母核C7 位进行结构修饰,通过微孔板法检测发现,在大黄酸蒽醌母核C7 位取代基上引入未取代杂环,可增强其对大肠杆菌的抑制作用。在农用活性研究方面,朱祥等[15]对大黄酸进行了结构改造,将其与氨基酸耦合,尝试从得到的系列衍生物中筛选到既具有良好的生物活性又具有韧皮部传导性的耦合物。生物活性测定发现,4,5-二甲氧基大黄酸氨基酸酯耦合物在离体条件下,对水稻纹枯病菌具有较好的杀菌活性,但其杀虫和除草效果不佳,且不具备韧皮部传导性。
β-氨基丁酸 (β-aminobutyric acid,BABA) 是一种植物体内次生非蛋白质氨基酸,可激活植物自身免疫系统,从而诱导植物对多种生物和非生物胁迫做出防御反应来提高自身免疫能力[16-18]。作为一种极具潜力的广谱性植物诱抗剂,BABA 不仅能够提高不同植物对霜霉病、白粉病和软腐病等病害的抗病性,而且能诱导植物对烟草花叶病毒、细菌、卵菌和线虫等产生局部和系统抗性[19]。已有研究表明,以植物内源物质如糖或氨基酸等为导向基团,通过其与农药活性成分耦合,得到的衍生物具有韧皮部传导性[20-21]。本研究拟将BABA作为导向基团,将其与先导化合物大黄酸耦合,设计、合成一系列衍生物,以期筛选到既保留大黄酸的生物活性和BABA 的诱导抗性,又具有韧皮部传导性等性质的内吸传导型诱抗杀菌剂。
目标化合物3a、3b、4a 和4b 的合成路线分别见图式1 和图式2。
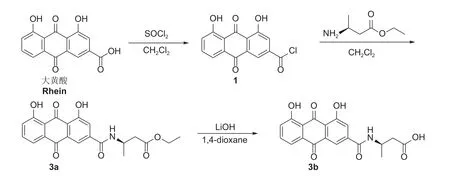
图式1 目标化合物3a 和3b 的合成线路Scheme 1 Synthesis routes of target compounds 3a and 3b
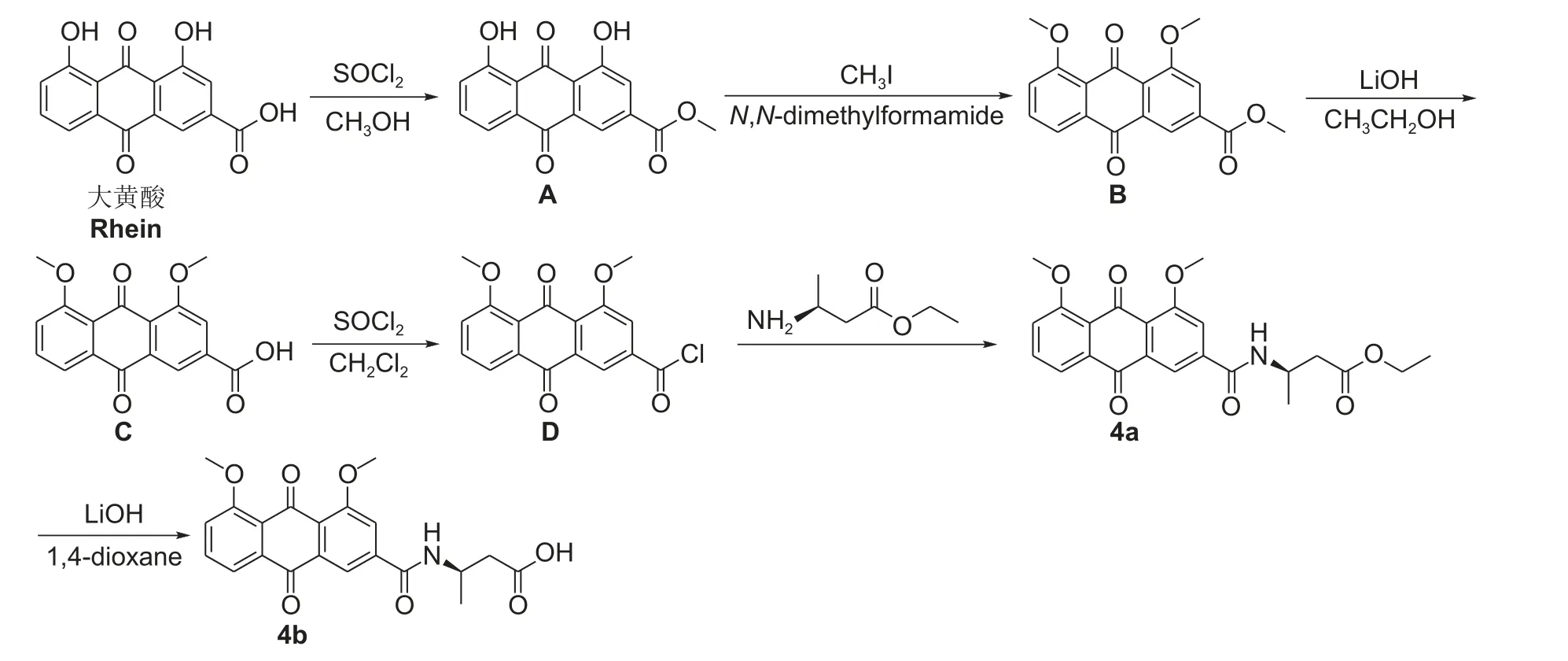
图式2 目标化合物4a 和4b 的合成线路Scheme 2 Synthesis routes of target compounds 4a and 4b
1 材料与方法
1.1 仪器与药剂
Bruker Avance DPX400 型核磁共振仪 (以TMS 作内标物,CDCl3或DMSO-d6作溶剂,德国-瑞士布鲁克光谱公司);Thermo Scientific QExactive 型高分辨率质谱仪 (ESI-MS,赛默飞世尔科技有限公司);WRR 熔点测定仪 (上海精密科学仪器有限公司);K2025 高效液相色谱仪 (山东悟空仪器有限公司);Sorvall Legend Micro 21R 型微量冷冻离心机 (赛默飞世尔科技有限公司);SENSE 425-301 型多功能酶标仪 (芬兰Hidex 公司)。
大黄酸原药、β-氨基丁酸乙酯盐酸盐和DL-β-氨基丁酸 (纯度均为98%),购自上海晶纯生化科技股份有限公司;过氧化物酶 (POD) 活性检测试剂盒和苯丙氨酸解氨酶 (PAL) 活性检测试剂盒,购自北京索莱宝科技有限公司。其他化学试剂均为市售国产分析纯。
1.2 供试材料
供试病原菌:水稻纹枯病菌Rhizoctonie solaniKühn、小麦赤霉病菌Fusarium graminearum、油菜菌核病菌Sclerotinia sclerotiorum、玉米小斑病菌Cochlibolus heterostrophus、小麦茎基腐病菌F u s a r i u m p s e d o g r a m i n e a r u m和辣椒疫霉Phytophthora capsici,均由长江大学农学院植物病理学实验室提供。
供试植物:小麦Triticum aestivum品种为“京双16”,由湖北省农业科学院植保土肥研究所提供。蓖麻Ricinus communisL.,由山东省淄博市农业科学院提供。
1.3 目标化合物的合成
中间体β-氨基丁酸乙酯溶液的制备:称取1.15 gβ-氨基丁酸乙酯盐酸盐于100 mL 圆底烧瓶中,加入30 mL 二氯甲烷超声溶解,再加入3.5 g三乙胺常温搅拌,反应3 h 后即可获得β-氨基丁酸乙酯溶液。
1.3.1 目标化合物3a 和3b 的合成 参考文献的方法[15]合成。称取1.31 g 大黄酸于150 mL 圆底烧瓶中,加入50 mL 二氯甲烷,充分搅拌溶解后加入1 mLN,N-二甲基甲酰胺 (DMF),缓慢滴加1.26 g 草酰氯,升温至50 ℃回流,反应12 h,用薄层色谱 (TLC,V(石油醚) :V(乙酸乙酯) = 4 : 1)监测至反应完毕,旋转蒸发后得到中间体1 用于下一步反应。向化合物1 中加入15 mL 二氯甲烷,使其完全溶解。在冰浴条件下,将β-氨基丁酸乙酯溶液转移至恒压滴液漏斗中,缓慢滴加到反应液中,室温反应2 h。减压浓缩,加入二氯甲烷100 mL 溶解并用饱和氯化钠水溶液洗涤3 次,有机相用无水硫酸钠干燥后,抽滤,旋转蒸发除去溶剂,通过柱层析 (V(石油醚) :V(乙酸乙酯) =8 : 1) 分离纯化,得到目标化合物3a (4-乙氧羰基-2-丁基氨基大黄酸酰胺,简称β-氨基丁酸-大黄酸乙酯)。
称取1.0 g 化合物3a 于150 mL 圆底烧瓶中,加入1,4-二氧六环 (1,4-dioxane) 50 mL,常温充分搅拌溶解,缓慢滴加0.38 g 氢氧化锂溶于5 mL 水的溶液,室温搅拌14 h (反应液由黄色变为红褐色),用TLC (V(石油醚) :V(乙酸乙酯) = 6 : 1) 监测至反应完毕。滴加稀盐酸调节pH 至5.0,析出固体后抽滤,加入二氯甲烷50 mL 溶解并用饱和氯化钠溶液洗涤3 次,有机相用无水硫酸钠干燥,抽滤,旋转蒸发除去溶剂,烘干得到目标化合物3b (4-羧基-2-丁基氨基大黄酸酰胺,简称β-氨基丁酸-大黄酸)。
1.3.2 目标化合物4a 和4b 的合成 参考文献的方法[15]制备,称取1.47 g 大黄酸于250 mL 圆底烧瓶中,加入80 mL 无水甲醇充分溶解后,室温下缓慢滴加5 mL 二氯亚砜,升温至回流,反应24 h。TLC (V(石油醚) :V(乙酸乙酯) = 4 : 1) 监测至反应完毕。将反应液倒入500 mL 冷水中充分搅拌,析出黄色固体,抽滤,烘干后得到中间体A。
称取1.43 g 中间体A 于250 mL 圆底烧瓶中,加入80 mL DMF 溶解。冰浴条件下,加入0.32 g氢氧化钠,搅拌10 min,缓慢滴加8.4 g 碘甲烷,升温至回流反应1 h,TLC (V(石油醚) :V(乙酸乙酯) = 4 : 1) 监测至反应完毕。向反应液中缓慢滴加稀盐酸,调节溶液pH 至7.0,加水搅拌10 min,抽滤,烘干,得到中间体B。
称取1.85 g 中间体B 于150 mL 圆底烧瓶中,加入30 mL 乙醇充分溶解后,称取0.32 g 氢氧化钠溶解于30 mL 水中,将其缓慢滴加入反应液中,室温搅拌反应1 h,TLC (V(石油醚) :V(乙酸乙酯) = 6:1) 监测至反应完毕。缓慢滴加稀盐酸于反应液中,调节pH 至3.0,加水逐渐有固体析出,抽滤,将固体用甲醇溶解,减压浓缩,烘干,得到中间体C (甲氧基大黄酸)。
称取1.47 g 中间体C 于150 mL 圆底烧瓶中,加入50 mL 二氯甲烷充分溶解后,加入1 mL DMF,缓慢滴加1.28 g 草酰氯,升温至50 ℃回流,反应10 h,TLC (V(石油醚) :V(乙酸乙酯) =4 : 1) 监测至反应完毕。旋转蒸发除去溶剂后加入30 mL 二氯甲烷,使其完全溶解。冰浴条件下,将β-氨基丁酸乙酯溶液缓慢滴加到圆底烧瓶反应液中,室温反应2 h。TLC (V(石油醚) :V(乙酸乙酯) = 4 : 1) 监测至反应完毕。减压浓缩,加入二氯甲烷100 mL 溶解并用饱和氯化钠水溶液洗涤3 次,有机相用无水硫酸钠干燥后,抽滤,旋转蒸发除去溶剂,用柱层析 (V(石油醚) :V(乙酸乙酯) =8 : 1) 分离纯化,得到目标化合物4a (4-乙氧羰基-2-丁基氨基-4,5-二甲氧基大黄酸酰胺,简称β-氨基丁酸-甲氧基大黄酸乙酯)。
称取1.1 g 化合物4a 于150 mL 圆底烧瓶中,加入50 mL 1,4-二氧六环常温充分搅拌溶解,再称取0.15 g 氢氧化锂溶解于5 mL 水中,将氢氧化锂水溶液缓慢加入反应体系中,室温搅拌7 h 后,反应液由黄色变为红褐色,TLC (V(石油醚) :V(乙酸乙酯) = 6 : 1) 监测至反应完毕。滴加稀盐酸调节pH 至5.0,析出固体后抽滤,加入二氯甲烷50 mL 溶解并用饱和氯化钠溶液洗涤3 次,有机相用无水硫酸钠干燥后,抽滤,旋转蒸发除去溶剂,烘干得到目标化合物4b (4-羧基-2-丁基氨基-4,5-二甲氧基大黄酸酰胺,简称β-氨基丁酸-甲氧基大黄酸)。
1.4 生物活性测定方法
1.4.1 离体抑菌活性测定方法 采用菌丝生长速率法[22]测定4 个目标化合物对6 种植物病原真菌的离体抑菌活性。称量对应质量的目标化合物,用1 mL 二甲基亚砜 (DMSO) 溶解,然后使用含有0.2% 吐温80 的双蒸水定容至50 mL,备用。向PDA 培养基中加入等体积的供试药液,充分混匀 (各组分终浓度:供试药剂为0.2 mmol/L 或0.5 mmol/L,DMSO 为1%,吐温80 约为0.1%)后制成含药平板 (Φ= 90 mm)。以大黄酸为对照药剂,以含1% DMSO 和0.1% 吐温80 的双蒸水处理为空白对照。使用直径为6 mm 的打孔器在活化菌培养基上制备菌饼,接种至含供试药剂的培养基中央,28 ℃黑暗培养72 h。每处理设置3 次生物学重复。采用十字交叉法测量菌落直径。按公式(1)计算各处理药剂对供试病原菌的菌丝增长抑制率(I)。
式中:DCK为空白对照PDA 培养基上菌丝平均直径,mm;DPT为处理后PDA 培养基上菌丝平均直径,mm。
1.4.2 诱导抗性相关酶活性测定方法 参考文献方法[23]进行。以大黄酸和DL-β-氨基丁酸为对照药剂,以含1% DMSO 及0.1%吐温80 的无菌水作为空白对照,供试药剂的浓度为10 mmol/L。称量对应质量的目标化合物,用5 mL DMSO 溶解后,使用含有0.5% 吐温80 的双蒸水稀释至500 mL,备用。采用叶面喷雾的方式对抽穗期小麦进行喷雾处理。每20 株为一组处理,每处理设置3 次重复。分别在施药1、3、5、7 和9 d 后采集小麦旗叶,用液氮速冻后放入 -80 ℃冰箱备用。分别使用PAL 活性检测试剂盒和POD 活性检测试剂盒按照说明书以96 孔板法测定PAL 和POD 活性。
1.4.3 目标化合物韧皮部传导性测定方法 参考文献[24-25]的方法,采用蓖麻幼苗体系测定目标化合物的韧皮部传导性。以L型缬氨酸-申嗪霉素耦合物 (L-Val-PCA) 为对照药剂,设置供试药剂浓度为0.2 mmol/L。首先将蓖麻种子置于自来水中在室温下浸泡过夜,27°C 催芽48 h。挑选发芽一致的种子播种于蛭石内培养72 h,培养条件:温度27°C、相对湿度80%。挑选16 株长势一致的幼苗 (下胚轴长约25 mm、胚乳直径约20 mm) 剥除胚乳洗净,将子叶浸泡于MES 缓冲液 (20 mmol/L MES、0.25 mmol/L MgCl2和0.5 mmol/L CaCl2,pH5.6)、胚根于0.5 mmol/L CaCl2溶液中同时预孵育2 h。用刀片在距离子叶同胚轴交际处约20 mm的弯钩处小心切断,然后向MES 缓冲液中补充供试药剂使其终浓度为0.2 mmol/L[26]。每隔1 h 于切口处收集韧皮部渗出液,连续收集5 h。使用双蒸水对收集的渗出液按照V(双蒸水) :V(渗出液) =2 : 1 的比例进行稀释,用0.22 μm 滤膜过滤,高效液相色谱 (HPLC) 检测。每处理设置3 次重复。
化合物3b 色谱检测条件:色谱柱为Venusil XBP C18反相色谱柱 (4.6 mm × 250 mm,5 μm),柱温为35℃,流动相为V[甲醇(A)] :V[0.1%甲酸水(B)] = 70 : 30,流速为0.9 mL/min,检测器检测波长为229 nm,进样量为10 μL。化合物4b 色谱检测条件与3b 基本一致,色谱柱为Venusil XBP C18反相色谱柱 (4.6 mm × 250 mm,5 μm),柱温为35℃,流动相为V[甲醇(A)] :V[0.1%甲酸水溶液(B)] = 65 : 35,流速为0.8 mL/min,检测器检测波长为226 nm,进样量为10 μL。
2 结果与分析
2.1 目标化合物的物理性质及结构表征
4-乙氧羰基-2-丁基氨基大黄酸酰胺 (3a):黄色固体,收率72.7%,m.p.201 ~ 203°C.1H NMR (400 MHz, CDCl3)δ12.04 (s, 1H), 12.00 (s, 1H), 8.12 (d,J= 1.6 Hz, 1H), 7.88(dd,J= 7.6, 1.2 Hz, 1H), 7.77 ~ 7.69 (m, 2H), 7.34 (dd,J=8.4, 1.2 Hz, 1H), 4.20 (qd,J= 7.2, 1.2 Hz, 2H), 2.66 (qd,J=16.0, 5.2 Hz, 2H), 1.38 (d,J= 6.8 Hz, 3H), 1.30 (t,J= 7.2 Hz,3H).13C NMR (101 MHz, DMSO-d6)δ192.02, 181.69,171.18, 163.77, 161.86, 161.57, 142.30, 138.03, 134.12,133.85, 125.02, 122.94, 119.92, 118.13, 118.04, 116.65, 60.38,43.35, 40.85, 20.58, 14.55.HRMS, 计算值 C21H19NO7[M +H]+: 398.1234, 实测值 398.1239.
4-羧基-2-丁基氨基大黄酸酰胺 (3b):黄色固体,收率81.5%,m.p.234 ~ 235℃.1H NMR (400 MHz, DMSO-d6)δ12.25 (s, 1H), 11.89 (d,J= 3.6 Hz, 2H), 8.78 (d,J= 8.0 Hz,1H), 8.11 (d,J= 1.6 Hz, 1H), 7.87 ~ 7.78 (m, 1H), 7.77 ~ 7.70(m, 2H), 7.43 ~ 7.37 (m, 1H), 4.41 ~ 4.31 (m, 1H), 2.61 (dd,J= 15.6, 7.2 Hz, 1H), 2.45 (dd,J= 15.6, 7.2 Hz, 1H), 1.21 (d,J= 6.4 Hz, 3H).13C NMR (101 MHz, DMSO-d6)δ191.98,181.61, 172.85, 163.63, 161.84, 161.57, 142.30, 138.03,134.04, 133.78, 125.00, 122.95, 119.91, 118.08, 118.02,116.56, 43.31, 40.85, 20.62.HRMS, 计算值 C19H15NO7[M +H]+: 370.0921, 实测值 370.0924.
4-乙氧羰基-2-丁基氨基-4,5-二甲氧基大黄酸酰胺(4a):黄色固体,收率83.7%,m.p.157 ~ 158℃.1H NMR(400 MHz, CDCl3)δ8.03 (d,J= 1.2 Hz, 1H), 7.88 (d,J= 1.2 Hz,1H), 7.83 (d,J= 7.6 Hz, 1H), 7.65 (t,J= 8.0 Hz, 1H), 7.31 (d,J= 8.4 Hz, 1H), 7.19 (d,J= 8.4 Hz, 1H), 4.65 ~ 4.52 (m, 1H),4.19 (q,J= 7.2 Hz, 2H), 4.06 (s, 3H), 4.00 (s, 3H), 2.73 ~ 2.60(m, 2H), 1.38 (d,J= 6.8 Hz, 3H), 1.29 (t,J= 7.2 Hz, 3H).13C NMR (101 MHz, CDCl3)δ183.52, 182.27, 171.66, 164.48,159.98, 159.59, 139.15, 134.83, 134.56, 134.19, 125.67,123.84, 119.03, 118.30, 117.30, 115.47, 60.89, 56.80, 56.55,42.89, 39.77, 20.03, 14.23.HRMS, 计算值 C23H23NO7[M +H]+: 426.1547, 实测值 426.1554.
4-羧基-2-丁基氨基-4,5-二甲氧基大黄酸酰胺 (4b):黄色固体,收率53.5 %,m.p.205 ~ 206℃.1H NMR (400 MHz,DMSO-d6)δ8.78 (d,J= 7.6 Hz, 1H), 8.15 (d,J= 1.2 Hz,1H), 7.85 (d,J= 1.2 Hz, 1H), 7.81 ~ 7.68 (m, 2H), 7.59 ~ 7.52(m, 1H), 4.38 (dt,J= 14.0, 7.0 Hz, 1H), 3.98 (s, 3H), 3.92 (s,3H), 2.62 (dd,J= 15.6, 7.0 Hz, 1H), 2.48 ~ 2.41 (m, 1H), 1.22(d,J= 6.4 Hz, 3H).13C NMR (101 MHz, DMSO-d6)δ183.47,181.44, 172.89, 164.17, 159.21 (2C), 139.75, 134.93, 134.65,134.56, 125.51, 123.89, 119.50, 118.66, 117.53, 117.18, 56.97,56.82, 43.31, 40.94, 20.69.HRMS, 计算值 C21H19NO7[M +H]+: 398.1234, 实测值 398.1236.
2.2 目标化合物的生物活性
2.2.1 离体抑菌活性 测定结果 (表1) 显示:在药剂浓度为0.2 mmol/L 时,目标化合物3b 对水稻纹枯病菌 (抑制率40.2%) 和油菜菌核病菌 (41.6%)的抑制作用优于对照药剂大黄酸 (28.5%和24.0%)。当药剂浓度调整为0.5 mmol/L 时,化合物3b 对水稻纹枯病菌 (62.6%)和小麦赤霉病菌 (41.3%) 的抑制作用优于对照药剂大黄酸。此外,化合物4b 对水稻纹枯病菌 (53.5%) 和小麦赤霉病菌 (40.2%) 的抑制作用也优于对照药剂大黄酸。表明在0.5 mmol/L时化合物3b 和4b 对水稻纹枯病菌和小麦赤霉病菌均具有较好的抑制作用。

表4 目标化合物对6 种植物病原菌菌丝生长的抑制作用Table 1 Inhibition of target compounds against six pathogens in vitro
2.2.2 诱导抗性 如图1A 所示,在药剂供试浓度为10 mmol/L 时,使用大黄酸处理小麦叶片1、3、5、7 和9 d 后,同CK 相比PAL 活性变化无显著性差异。使用BABA 处理后的1、5 和7 d 后,酶活性变化同CK 相比显著增高,其中,处理3 d后PAL 活性极显著增高。但在BABA 处理9 d后,PAL 活性同CK 相比无显著性差异。使用化合物3b 处理小麦叶片后,仅在第3 天检测到PAL活性呈显著上升,其他时间同CK 相比PAL 活性变化无显著性差异。化合物4b 处理小麦叶片1、5 和7 d 后,酶活性变化同CK 相比显著增高,其中,在处理3 d 后PAL 活性呈极显著增高。如图1B 所示,对于POD 活性来说,使用大黄酸处理小麦叶片1 和3 d 后,同CK 相比酶活性变化无显著性差异。处理5 d 后POD 活性极显著降低,处理7 d 后酶活性变化同CK 相比无显著性差异,处理9 d 后,同对照相比POD 活性变化又显著降低。使用BABA 处理小麦1、3、5、7 和9 d 后,POD 活性同CK 相比显著上升。然而,在化合物3b 处理小麦叶片后的任意时间段,POD 活性同CK 相比都无显著性差异。使用化合物4b 处理小麦1 d 后POD 活性无显著性变化,处理3 和5 d后活性显著上升,但在7 d 后活性无显著性变化,甚至在第9 天后POD 活性出现显著下降。使用化合物4b 处理小麦叶片后PAL 和POD 的活性变化趋势与激活剂BABA 基本一致表明4b 可能在诱导植物产生抗病性方面发挥重要作用。
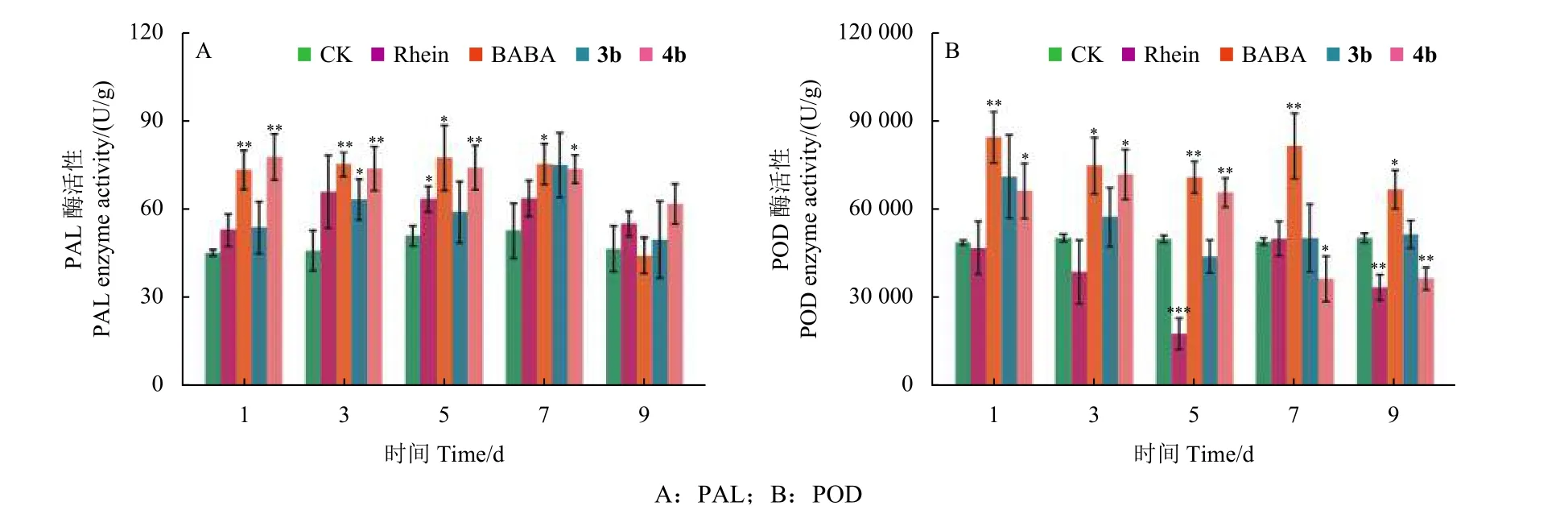
图1 不同化合物 (Rhein、BABA、3b 和4b) 处理小麦植株后的酶活性检测(*: P < 0.05, **: P < 0.01, ***: P < 0.001)Fig.1 Detection of the enzyme activity after the treatment of wheat leaves by the different compounds (Rhein, BABA, 3b 和4b) (*: P < 0.05, **: P < 0.01, ***: P < 0.001).
2.3 目标化合物的韧皮部传导性
蓖麻幼苗体系检测供试化合物的韧皮部传导性发现:在蓖麻韧皮部渗出液中未检测到大黄酸、化合物3a 和4a,说明三者不具备韧皮部传导性。对照药剂L-Val-PCA 在蓖麻幼苗韧皮部渗出液中的浓度为26.9 μmol/L。HPLC测试目标化合物3b 和4b 的韧皮部渗出液浓度分别为1.7 和15.1 μmol/L (图2),说明二者具有韧皮部传导性。化合物3b 标准溶液的峰面积与浓度之间的回归方程为y= 11.5041x+ 2.1869,相关系数为r=0.9998;化合物4b 的回归方程为y= 22.7776x+7.6147,相关系数为r= 0.9999;对照样品L-Val-PCA 的回归方程为y= 0.1181x+ 5.6624,相关系数为r= 0.9987。
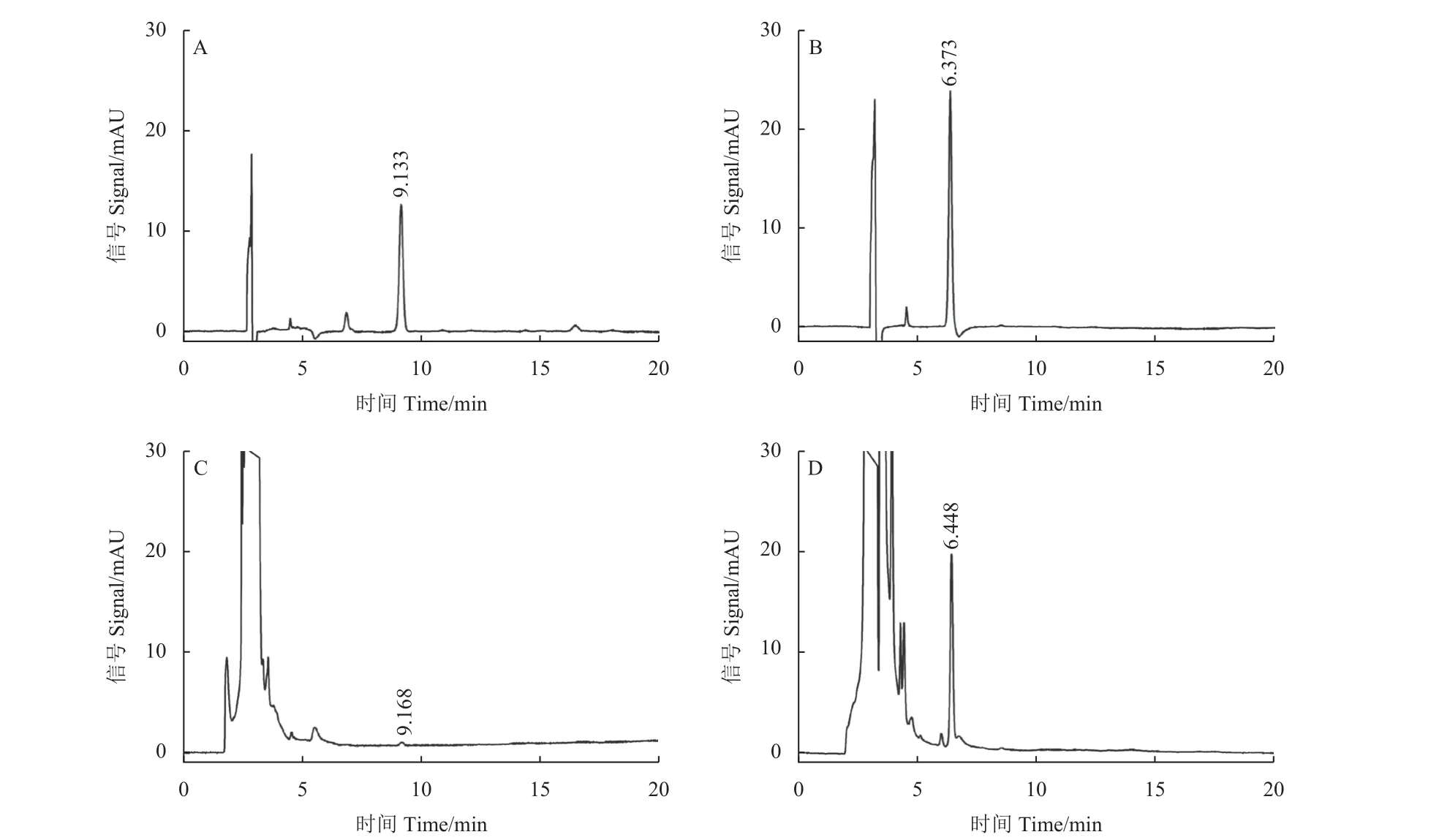
图2 HPLC 测试目标化合物3b 和4b 的韧皮部传导性Fig.2 HPLC test of the phloem translocation of target compounds 3b and 4b
3 讨论与结论
以天然产物为先导化合物进行结构改造,通过耦合植物内源物质如糖或氨基酸的方式来增加母体的韧皮部传导能力,是改善农药内吸性的有效手段之一。Yu 等[27]以PCA 为先导化合物合成了一系列氨基酸-申嗪霉素耦合物,其中,L-Val-PCA不仅保留了部分对水稻纹枯病菌的抑菌活性,而且具有良好的韧皮部传导性。本研究以大黄酸为先导化合物,以BABA 为导向基团,合成了4 个BABA-大黄酸耦合物,其中化合物3b 和4b 在0.5 mmol/L 时对水稻纹枯病菌和小麦赤霉病菌的抑制效果优于对照大黄酸。这说明以植物次生代谢物质为导向基团对天然产物进行结构改造具有可行性。虽然4b 对水稻纹枯病菌的生长抑制作用(53.5%) 低于3b (62.6%),但从诱导抗性检测结果来看,在使用化合物4b 处理小麦叶片后近一周的时间内,PAL 和POD 一直保持较高活性,诱导效果强于3b。从蓖麻幼苗韧皮部渗出液中检测到的浓度来看,4b 的韧皮部传导能力 (韧皮部渗出液中含量15.1 μmol/L) 远大于3b (1.7 μmol/L),说明将大黄酸的羟基基团改变为甲氧基基团能够提高其自身的诱导抗性及韧皮部传导能力。此外,蓖麻幼苗作为一种模式植物被广泛用于定性、定量地检测农药的韧皮部传导性[26]。开发具有韧皮部传导性的农药可实现药剂被叶片吸收之后向下输导,有利于对维管束病害的防治。本研究发现,在供试化合物浓度为0.5 mmol/L 时,除了3b 和4b 对水稻纹枯病菌和小麦赤霉病菌的抑制效果优于对照大黄酸外,其他化合物对6 种供试植物病原菌的抑菌效果并不明显,甚至低于大黄酸。Kleier等[28]曾指出,前体农药 (pro-pesticide) 往往不能兼具良好的“生物活性”和“韧皮部传导性”,这种现象在合成的糖基-氟虫腈耦合物[29]、拌种咯衍生物[30-31]和氨基酸-申嗪霉素耦合物[27,32]中也有报道。Yang 等[29]采用D-葡萄糖-氟虫腈耦合物处理4 叶期蓖麻幼苗子叶,待其吸收7 h 后,通过高效液相色谱-质谱 (HPLC-MS)联用仪检测发现,蓖麻幼苗韧皮部渗出液中该耦合物的浓度可达90 μmol/L,但同时发现,耦合物对3 龄小菜蛾Plutella xylostella幼虫的LC50值 (167.28 mg/L) 显著高于对照氟虫腈 (21.39 mg/L)。待D-葡萄糖-氟虫腈耦合物经蓖麻成株叶片吸收48~72 h 后,通过HPLC-MS 检测其在根部和下端茎中的含量发现,该耦合物可发生降解作用,从而将先导化合物氟虫腈释放出来,发挥杀虫作用,实现防控效果。β-氨基丁酸-大黄酸耦合物是否存在水解作用以及如何保持较高的生物活性,并能拥有良好的韧皮部传导性有待进一步研究。
本研究以天然产物大黄酸为先导化合物,以BABA 为导向基团,合成了4 个目标化合物,且4 个目标化合物均保留了先导化合物的部分抑菌活性。BABA 是一种植物次生代谢产物。作为非蛋白氨基酸,其自身具有诱导植物产生抗性且能在植物体内传导等性质,在农药分子中引入该基团,既能保留农药本身的活性,又能赋予耦合物传导性和诱导抗性,这对于内吸传导型诱抗杀菌剂的分子设计具有重要意义。
