玉米ZmGST基因的克隆及表达特性分析
2023-09-02王可欣郭昭阳殷宇航陈胜忠宋希云赵美爱
王可欣,郭昭阳,殷宇航,陈胜忠,宋希云,赵美爱,
(1.青岛市主要农作物种质创新与应用重点实验室,青岛农业大学 农学院,山东 青岛 266109;2.青岛农业大学 生命科学学院,山东 青岛 266109)
我国作为传统农业大国,人口基数大,粮食问题一直备受关注。玉米(ZeamaysL.)是我国第一大粮食作物,在农业生产和粮食安全中发挥重要作用,但在生长过程中经常遭遇干旱、盐碱、高温、低温等非生物胁迫,导致减产和品质的降低[1],其中盐碱地土壤所含的盐分严重影响作物的正常生长。我国盐碱地的面积约为9 913万hm2,开发利用价值巨大,已被开垦利用的盐碱地还未达到其总面积的五分之一[2]。合理利用盐碱地不仅可以缓解我国地少人多的局面,还可以在很大程度上缓解粮食供不应求的现状。盐碱地治理难度较大,进行耐盐基因的挖掘和耐盐碱新品种的培育是可行的治理措施之一。
谷胱甘肽-S-转移酶(Glutathione S-transferases,GSTs)是一个古老且具有多种作用的蛋白质超家族[3],可以调控植物的生长发育并在初生代谢、次生代谢、细胞信号转导以及对抗生物和非生物胁迫[3]等生物学过程中发挥重要作用[4]。GSTs分为4个主要的蛋白质家族,细胞质GSTs、线粒体GSTs、微粒体GSTs和细菌磷霉素抗性蛋白,其中细胞质GST家族是最丰富的[5]。在植物中,GST可分为6 类,包括Phi(F)、Tau(U)、Lambda(L)、Theta(T)、Zeta(Z)和脱氢抗坏血酸还原酶(Dehydroascorbate reductases,DHARs),其中Phi(F)和Tau(U)是最大植物特异性和高度应激诱导的谷胱甘肽转移酶基因种类[6]。根据 GST 蛋白序列构建的隐马尔可夫模型,鉴定出玉米基因组中一共含有37个ZmGST基因,可分为U、F、Z 3种[7]。U型 GST基因的表达与细胞分裂素、生长素等激素有关,对植物的生长发育起着调节作用[8]。
GST基因在逆境胁迫中扮演着重要角色,包括调控植物非生物胁迫过程[9]。如AtGSTU17通过作为胁迫介导的信号转导途径的负成分在干旱和盐胁迫的适应性响应中发挥作用[10],在烟草幼苗中过表达GST基因,增加了谷胱甘肽依赖性的过氧化物的清除和谷胱甘肽、抗坏血酸代谢的改变,从而减少了氧化损伤[11]。番茄相关GST基因LeGSTU2在根和花中表达,进行拟南芥异源验证获取的转基因植物对NaCl和甘露醇诱导的盐和渗透胁迫的抵抗力增强[12]。玉米ZmGST23基因的表达显著受干旱、盐、低温等非生物胁迫的诱导[4]。
GST的作用是通过与谷胱甘肽的结合来解除有毒物质,减轻氧化应激反应[13-14]。盐胁迫会导致植物失水使渗透压改变,体内活性氧代谢系统会出现紊乱现象,并产生大量活性氧,从而损伤植物质膜和其他细胞组分,进而影响植物的生长发育[15]。GST基因在植物的抗氧化过程中具有十分重要的作用[16],于是推测盐胁迫下过量表达玉米ZmGST基因能在一定程度上减缓对植物的损伤。GST基因除了抗逆相关功能,还有一些其他生物作用,主要包括清除体内的毒性代谢产物[17-18]并且参与到信号传递中[19]。功能多样化的GST在研究基因家族进化方面具有重要意义,并为研究其在植物发育和对环境信号的响应中的作用开辟了途径[20]。
本试验对ZmGST进行克隆和生物信息学分析。通过实时荧光定量PCR探究ZmGST组织特异性表达以及干旱和盐胁迫下的基因表达量。ZmGST转入原核载体pET28a并通过pET28a-ZmGST大肠杆菌研究该基因对盐胁迫、干旱非生物胁迫的作用,为该基因转入真核表达载体提供参考。
1 材料和方法
1.1 试验材料
本试验使用的玉米自交系CA66由玉米分子育种实验室提供。选取饱满的玉米种子种植于营养土中,三叶期时取样。
胁迫处理:使用0.2 mol/L的NaCl以及20% PEG6000处理CA66三叶期玉米,并对根进行分时段取样,分别是0,12,24,36 h,于-80 ℃保存。每个试验组3个重复。
1.2 试验方法
1.2.1ZmGST的克隆和原核表达载体构建 根据NCBI(National Center for Biotechnology Information (nih.gov))中参考序列的CDS全长进行特异性引物设计,见表1引物1。以根的cDNA作为模板进行PCR扩增后连接中间载体pMD19-T,将菌液PCR以及双酶切验证后检测得到的阳性克隆送青岛擎科生物公司测序,测序正确的菌液提取质粒pMD19-T-ZmGST后存于-80 ℃。pET28a菌株由本实验室保存,使用pMD19-T-ZmGST质粒作为模板进行PCR扩增,引物见表1引物2,使用T4连接酶配置pET28a-ZmGST连接体系。将菌液PCR验证后检测得到的阳性克隆送青岛擎科生物公司测序。具体步骤参照参考文献[21]。

表1 玉米ZmGST基因所用引物
1.2.2 ZmGST蛋白特性分析 通过NCBI网站的Blast功能,分析该基因的CD-Search保守区。ProtParam软件进行生物信息学分析,ProtScale在线软件对蛋白质序列进行亲水性、疏水性的预测分析,TMHMM 2.0对蛋白质序列跨膜结构预测分析,NetPhos 3.1软件分析ZmGST蛋白的磷酸化位点,SingalP 4.1预测信号肽,Psort Prediction进行亚细胞定位预测,SoPMA分析ZmGST蛋白二级结构,SWISS-MODEL分析三级结构,PlantCARE分析启动子区域元件。
1.2.3ZmGST基因的组织特异性表达分析 玉米自交系CA66正常生长至三叶期,取根、茎、叶样品至液氮中保存,根据TaKaRa试剂盒提取RNA,利用超微量分光光度计检测RNA浓度。反转录合成cDNA,通过实时荧光定量PCR(qRT-PCR)进行组织特异性表达分析。引物设计见表1引物3,以玉米Actin作为内参基因,基因号为LOC100282267。
1.2.4 实时荧光定量PCR 将0.2 mol/L的NaCl以及20% PEG6000处理后的玉米取样后进行实时荧光定量PCR。反应程序为:预变性95 ℃ 3 min;变性95 ℃ 10 s,退火55 ℃ 30 s,延伸72 ℃ 30 s,循环数35。釆用2-ΔΔCt相对定量的分析方法进行数据分析,使用SPSS软件进行数据差异性分析。
1.2.5 pET28a-ZmGST重组大肠杆菌的盐、干旱胁迫处理 盐胁迫:配置NaCl浓度为0.6,0.8,1.0 mol/L的LB液体培养基并在高温灭菌后,将pET28a空载和pET28a-ZmGST的大肠杆菌分别在超净工作台中接种至上述3种浓度的NaCl培养基中,37 ℃摇床中200 r/min振荡培养,每隔1 h取样测定吸光度并进行处理与分析。
干旱胁迫:本试验使用PEG6000模拟植物干旱条件,配置PEG6000浓度为5%,10%,15%的LB液体培养基,后续试验步骤同盐胁迫。
2 结果与分析
2.1 谷胱甘肽-S-转移酶ZmGST的克隆
以玉米CA66根、茎、叶cDNA为模板进行PCR扩增可知,ZmGST在根、茎、叶中均能扩增(图1-A),条带大小为384 bp。连接PMD19-T载体后进行菌液PCR鉴定(图1-B),菌液扩增片段大小为384 bp,双酶切验证在指定位置出现线性化DNA条带(图1-C)。测序结果与已公布B73序列碱基相似性为99.65%,氨基酸序列相似度为98.43%。pMD19-T-ZmGST连接pET28a原核表达载体进行菌液PCR验证得到正确条带(图1-D),测序与克隆序列比对相似度为100%。
2.2 ZmGST蛋白质特性分析
2.2.1 ZmGST蛋白质的理化特性ZmGST碱基序列以及蛋白质如图2-A所示,编码384 个核苷酸,127 个氨基酸。使用ProtParam软件进行生物信息学预测分析,表明ZmGST编码的蛋白质分子式为C654H1003N175O189S4,相对分子量为14.47 ku,理论等电点5.06,总负电荷残基数(Asp+Glu)为20,正电荷残基总数(Arg+Lys)为16,不稳定指数为46.75,属于不稳定蛋白质。通过NCBI网站的Blast功能,进行该基因的CD-Search保守区分析(图2-B),发现克隆的CDS蛋白内存在一个GST_C结构域,属于Tau(U)这一分支,是植物抗氧化系统的重要成员,可能在逆境响应等生物学过程中发挥重要作用[3],该基因包含2个外显子(图2-C)。
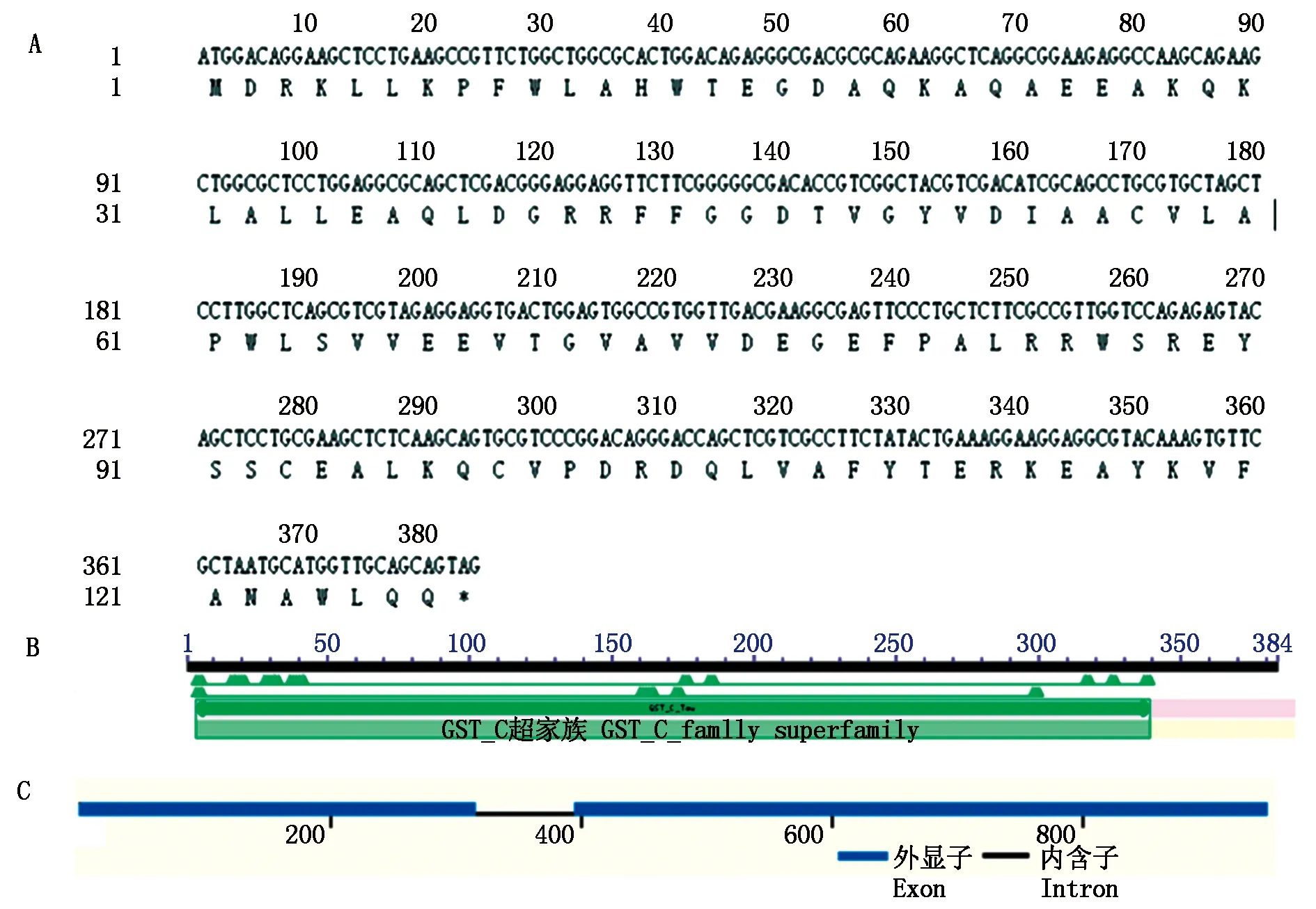
A.核苷酸及氨基酸序列;B.保守域分析;C.ZmGST基因结构分析。
利用 ProtScale在线软件对ZmGST蛋白质序列进行亲水性、疏水性预测分析,亲水性蛋白多于疏水性蛋白,该蛋白属于亲水性蛋白(图3-A)。TMHMM 2.0对蛋白质序列跨膜结构预测分析,其氨基酸序列中不存在跨膜结构(图3-B),可直接进行原核表达的验证。采用NetPhos 3.1修饰位点进行分析发现,ZmGST存在12 个磷酸化修饰位点(图3-C),其中Thr(苏氨酸)有4 个、Ser(丝氨酸)4 个、Tyr(酪氨酸)4 个,磷酸化修饰位点较为均等,可能与信号转导、生长发育等有关。使用SignalP 4.1对ZmGST蛋白进行信号肽预测分析(图3-D),未发现有信号肽,为非分泌型蛋白。Psort Prediction进行亚细胞定位预测,定位在细胞核里的可能性最大为34.8%,胞质为30.4%,线粒体为21.7%,最小的是细胞外(包括细胞壁)是4.3%。
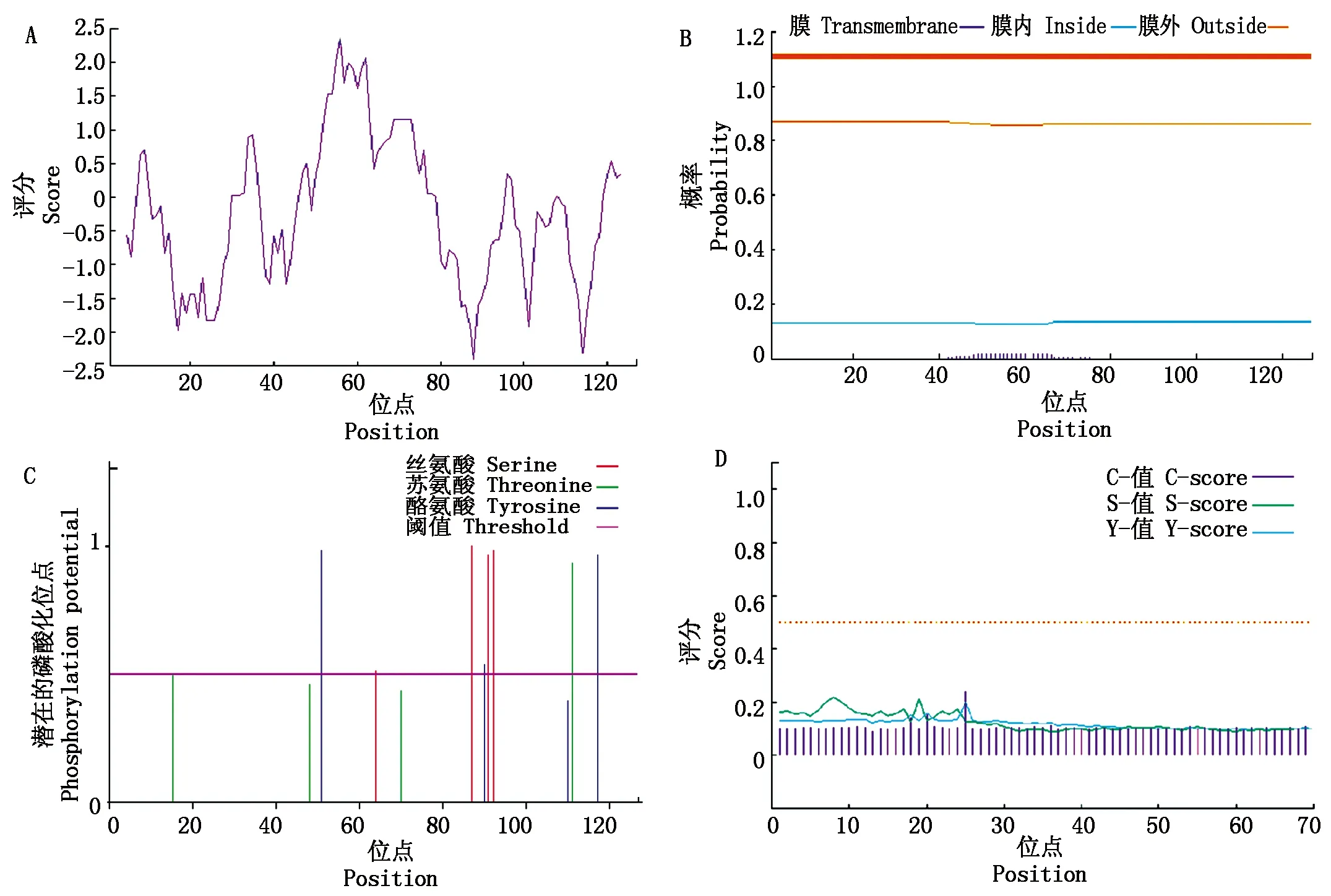
A.疏水亲水分析;B.跨膜结构分析;C.磷酸化预测;D.信号肽预测。
2.2.2 ZmGST蛋白结构预测 通过SoPMA分析ZmGST蛋白二级结构,如图4-A所示,二级结构依次为α螺旋(蓝色)占62.2%、β-折叠(绿色)占7.09%、无规则卷曲(紫色)占17.32%和延伸链(红色)占13.39%。再通过SWISS-MODEL进一步分析三级结构如图4-B所示,发现同样存在多个α螺旋与无规则卷曲,与二级结构分析一致,α螺旋为主要元件。

图4 ZmGST蛋白二级结构直观图与空间结构
2.2.3ZmGST以及玉米GST家族系统进化树 为了解ZmGST蛋白与不同物种的亲缘关系,将获得的氨基酸序列在NCBI上进行Protein Blast,得到的序列进行系统进化树分析(图5),该基因ZmGST与高粱(Sorghumbicolor)的亲缘关系最近。对玉米GST基因家族进行系统进化树分析,利用李晓玉等[7]对玉米GST家族的建立隐马尔可夫模型(Hidden markov model,HMM)的方法分析,将玉米GST基因根据序列相似性分为U型(蓝色区域)、F型(紫色区域)、Z型(橙色区域)三类(图6)。利用DNAMAN与这些序列对比发现ZmGSTU14与克隆的ZmGST基因的全长氨基酸相似度最高为82.46%(红色),属于U型。

图5 ZmGST的系统进化树
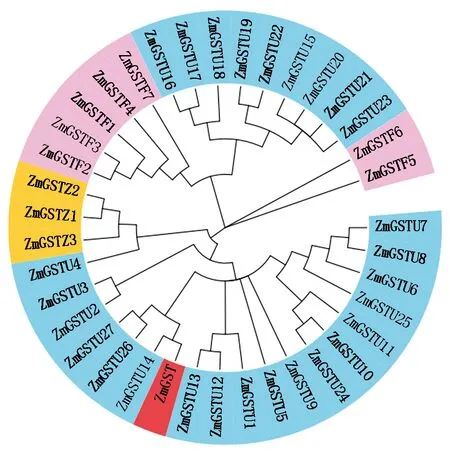
图6 玉米GST家族系统进化树
2.2.4ZmGST基因启动子分析 利用PlantCARE对启动子区域进行元件分析,ZmGST基因启动子区(图7)含有多个响应逆境及植物激素的作用元件,包括LTR参与低温反应原件、TC-rich repeats参与防御和应激反应元件、ABRE与脱落酸反应相关元件以及G-box光响应元件,推测基因被盐胁迫诱导可能与TC-rich repeats元件相关。

图7 ZmGST启动子元件分析
2.3 ZmGST的组织特异性表达分析
实时荧光定量PCR对玉米不同组织(根、茎、叶)中的基因表达特异性分析结果显示,ZmGST在不同组织中均有表达,相对表达量在根中最高,其次为叶和茎(图8-A)。根部表达量约为茎的5 倍,叶的2.5倍,说明ZmGST主要在根中发挥作用。胁迫处理后的相对表达量结果显示(图8-B),在模拟干旱条件下ZmGST基因下调表达,12~36 h表达量降低,在24 h最低。盐处理后该基因的表达量呈上升趋势,在24 h的基因表达量是0 h的3倍。因此,推测ZmGST在干旱胁迫时受到抑制,在盐胁迫处理时被诱导,表明该基因可能对这两个逆境胁迫存在不同作用。

A.ZmGST的组织特异性分析;B.ZmGST 受到胁迫后的表达量分析(0,12,24,36 h)。不同小写字母表示显著差异(P<0.05)。
2.4 ZmGST基因耐盐功能分析
成功构建重组大肠杆菌DH5α(pET28a-ZmGST)后,对pET28a-ZmGST以及pET28a进行不同浓度盐胁迫,测得平均OD600如图9所示,转入了重组质粒pET28a-ZmGST的菌体生长情况高于转入空载体pET28a的菌体,说明对照菌体pET28a在0.6,0.8,1.0 mol/L盐浓度培养基中菌体的生长明显受到了抑制,而转入重组质粒pET28a-ZmGST的大肠杆菌菌体在0.6,0.8,1.0 mol/L盐浓度的培养基中均能正常生长,ZmGST基因在原核水平内可能对盐胁迫有一定的抗性,与盐胁迫玉米后该基因上调表达结果一致。
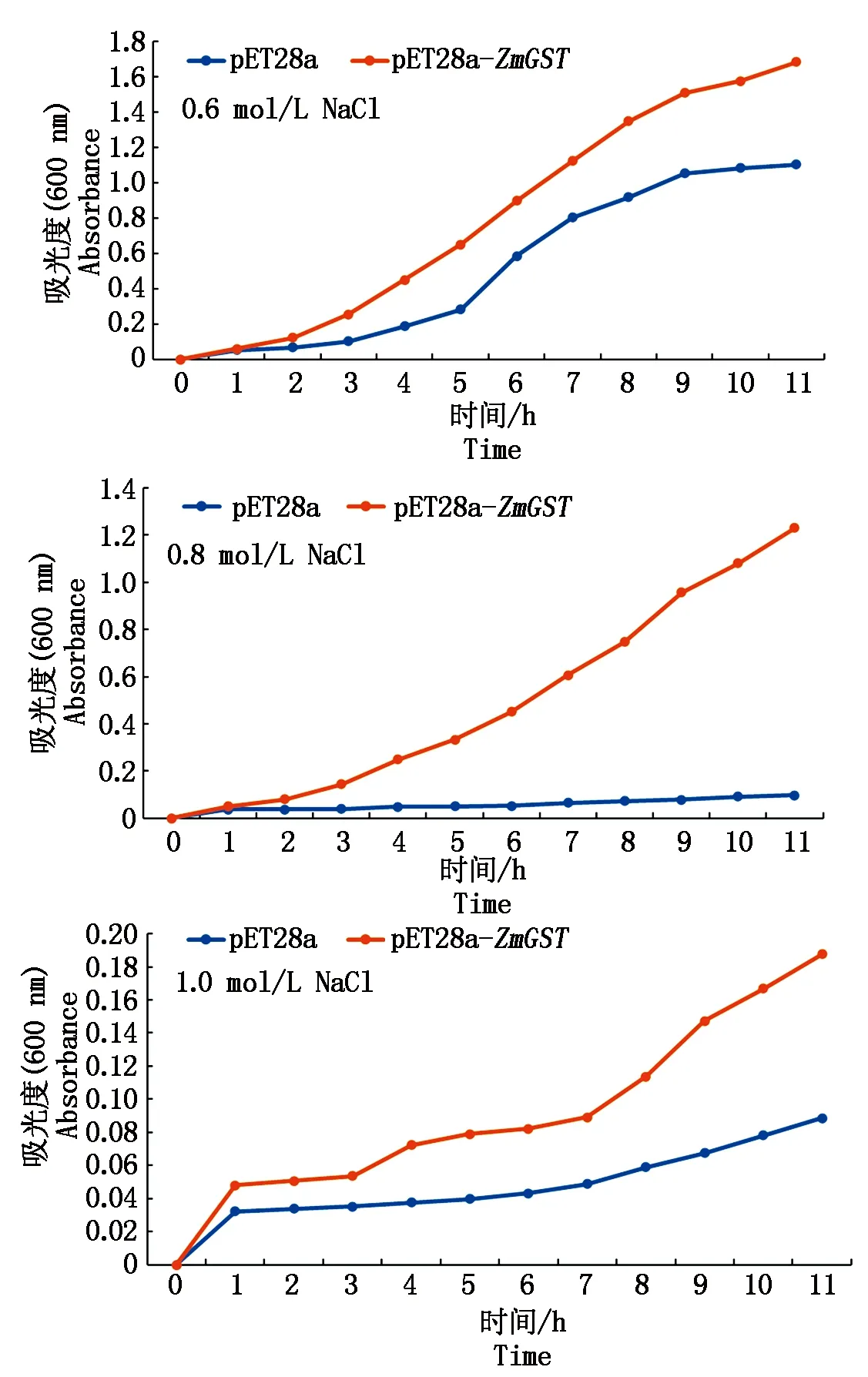
图9 盐处理后pET28a-ZmGST菌株、pET28a菌株生长曲线图
2.5 ZmGST基因耐旱功能分析
成功构建重组大肠杆菌DH5α(pET28a-ZmGST)后,对pET28a-ZmGST以及pET28a进行PEG6000的不同浓度干旱胁迫,测得平均OD600如图10所示,转入了重组质粒pET28a-ZmGST的菌体在5%,10%中与空载体pET28a的菌体生长情况一致,均明显受到抑制,在15%PEG6000中高于空载菌体生长状况,但趋势较为相似,推测该基因对干旱敏感。

图10 干旱处理后的pET28a-ZmGST菌株、pET28a菌株生长曲线图
3 结论与讨论
谷胱甘肽-S-转移酶家族成员众多,存在于各种植物中,在拟南芥[10]、水稻[22]、小麦[23]、玉米[24]等均有研究。在GST家族中,植物特有的是Phi、Tau、Lambda和DHAR类,其中U型是二聚体的,可以催化各种生物的结合,在除草剂中具有选择性解毒的作用[25]。U型是玉米谷胱甘肽转移酶成员最多的一类。同样地,本试验克隆了U型的玉米GST类基因中的一种,通过生物信息学分析发现,ZmGST蛋白相对分子量是14.47 ku,为不稳定的亲水蛋白,未发现信号肽,不存在跨膜结构域,同样符合该基因在细胞核的预测。通过分析其表达量,利用ePlant网站得到该基因在根中表达水平最大值约是在叶中表达水平最大值的100 倍且表达最大值在根毛附近,无根毛区域表达量较根毛区域表达量相差较大。表达差异结果与实时荧光定量结果相符,在根中表达量最大。系统进化树分析与高粱的亲缘关系最近,在玉米GST家族中与ZmGSTU14相似度最高。
U类GST基因在逆境胁迫中发挥作用。水稻GST基因OsGSTU3和OsGSTU4编码Tau类谷胱甘肽S-转移酶,响应水稻根系缺氧胁迫诱导以及盐胁迫[16]。GST还通过在各种生物或非生物胁迫下过量表达,来增强植物对逆境的抵抗力,是抗氧化防御系统中重要的酶系[26-28]。如大豆GmGSTU2是Tau类谷胱甘肽转移酶家族基因,通过增强谷胱甘肽转移酶的活性介导活性氧和谷胱甘肽的清除,从而增强植物对盐胁迫的耐受性[29]。柳树ThGSTZ1的过表达通过增强清除活性氧的能力来改善干旱和耐盐性[30]。这些与ZmGST响应盐胁迫的功能类似,但是其作用机理仍需探究,可见GST基因研究具有重要意义。
玉米在生长过程经常会遇到干旱、盐、低温等非生物胁迫,可引起玉米不同程度的脱水,从而引起渗透胁迫,使得ABA浓度急剧上升,从而诱发大量的活性氧(ROS)的生成。ROS还可以起到诱导植物抵抗逆境的作用,但过量的ROS会使生物大分子如膜脂、核酸、蛋白质等发生一定损伤,从而引起二次胁迫[31]。GST的主要功能是通过促进亲电性底物与GSH发生反应,从而实现对活性氧和外来物质的清除,谷胱甘肽硫转酶能使GSH的巯基与某些亲电子性化合物相结合,对DNA和某些蛋白的损害有一定的保护作用,GST能将疏水性较强的外源性与内源性的代谢物进行代谢并提高它们的极性,最后排出体外[27],从而保证植物正常的生长发育。因此推断GST作为一类与活性氧有关的酶,可能与ROS相关。
为了研究ZmGST基因是否对胁迫产生响应,荧光定量结果显示在盐胁迫条件下该基因表达上调。通过原核表达试验证明,重组质粒pET28a-ZmGST的大肠杆菌菌体在不同盐浓度的培养基中均能正常生长,因此,推测该基因可能与耐盐作用相关,也可能与ROS相关。进一步探究干旱敏感作用机理对于深入研究ZmGST基因功能和真核生物中的作用具有参考价值,同时也揭示了该基因在玉米逆境胁迫下反应机制至关重要。
