注射用益气复脉(冻干)对慢性心力衰竭大鼠的药效和作用机制研究
2023-09-02吴明明邓林华张积思刘思远梅雨航王振亮赵英强
翟 优,吴明明,邓林华,高 丹,张积思,张 元,刘思远,梅雨航,王振亮,赵英强*
注射用益气复脉(冻干)对慢性心力衰竭大鼠的药效和作用机制研究
翟 优1,吴明明1,邓林华2,高 丹3,张积思1,张 元1,刘思远4,梅雨航5,王振亮1,赵英强3*
1. 河南中医药大学,河南 郑州 450046 2. 北京中医药大学东直门医院,北京 100700 3. 天津中医药大学第二附属医院,天津 300150 4. 北京中医药大学针灸推拿学院,北京 100700 5. 辽宁中医药大学,辽宁 沈阳 110847
探究注射用益气复脉(冻干)在改善心梗后所致慢性心力衰竭(chronic heart failure,CHF)大鼠的作用及机制。将冠状动脉左前降支手术结扎造模成功后的75只SD大鼠随机分为模型组,益气复脉低、高剂量(464.3、928.6 mg/kg)组,卡托普利(3.35 mg/kg)组和益气复脉(464.3 mg/kg)+卡托普利(3.35 mg/kg)组,另取15只仅切口缝合但不结扎的SD大鼠作为假手术组。给予药物干预2周后,用小动物超声诊断仪检测大鼠心功能;采用ELISA试剂盒检测各组大鼠血清中心钠肽(atrial natriuretic peptide,ANP)、脑钠肽(brain natriuretic peptide,BNP)、内皮素-1(endothelin-1,ET-1)、心肌肌钙蛋白(cardiac troponin,cTn)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、三磷酸腺苷(adenosine triphosphate,ATP)含量和肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase isoenzyme-MB,CK-MB)、超氧化物歧化酶(superoxide dismutase,SOD)活力;采用苏木素-伊红(HE)染色法观察各组大鼠心脏组织病理变化;采用Western blotting检测各组大鼠心脏中能量代谢相关蛋白表达。与假手术组比较,模型组大鼠心功能指标左室射血分数(LVEF)、二尖瓣血流频谱E峰/A峰(E/A)和左室短轴缩短率(LVFS)均明显下降(<0.001),血清中ANP、BNP、cTn、ET-1、IL-6、TNF-α水平和CK、CK-MB活力均显著升高(<0.001),SOD活性和ATP水平显著下降(<0.001),左心室组织出现心肌纤维断裂及心肌细胞变性、坏死等病理改变,心脏中磷酸腺苷激活的蛋白激酶(AMP-activated protein kinase,AMPK)、p-AMPK、葡萄糖转运蛋白-4(glucose transporter-4,GLUT-4)和肉碱棕榈酰转移酶-1(carnitine palmitoyltransferase-1,CPT-1)蛋白表达水平均显著降低(<0.05、0.01、0.001)。与模型组比较,各给药组LVEF、E/A和LVFS均显著提高(<0.05、0.01、0.001),血清中ANP、BNP、cTn、ET-1、IL-6、TNF-α水平和CK-MB、CK活力均显著降低(<0.05、0.01、0.001),ATP水平和SOD活力显著升高(<0.01、0.001),大鼠心肌损伤得到明显改善,心脏中p-AMPK、AMPK、GLUT-4和CPT-1蛋白表达水平均显著升高(<0.05、0.01、0.001)。益气复脉可以通过提高CHF大鼠的射血分数和舒缩功能改善心功能,通过降低大鼠血清心肌损伤、氧化应激水平并改善能量代谢,从而改善CHF大鼠心衰症状,改善能量代谢可能是其重要的作用机制之一。
注射用益气复脉(冻干);慢性心力衰竭;心功能;氧化应激;炎症;能量代谢
心力衰竭简称心衰,是一种心脏结构或功能性疾病导致的心室充盈或射血能力受损的复杂临床综合征,也是大多数心血管疾病如高血压性心脏病、扩张性心肌病、急性心肌梗死、先天性心脏病和肺心病等的终末期阶段和导致死亡的主要原因[1]。常见的心衰动物模型有大鼠、豚鼠、家兔、犬、小型猪和斑马鱼等,而大小鼠是最常用的实验动物[2-3];在众多心衰动物模型中,大鼠因其易操作、价格实惠,且心脏结构更趋向于人类,也是更接近人类的研究对象。大鼠慢性心力衰竭(chronic heart failure,CHF)造模方式主要有压力负荷型(腹主动脉缩窄法、肺动脉高压法、盐负荷法),心肌缺血型(冠状动脉左前降支结扎法)和心脏抑制型(阿霉素法、异丙肾上腺素法)[3]。其中冠状动脉左前降支结扎法制作的模型由于更接近人类充血性心衰的病理生理演变过程而被较多的研究者采纳。前期通过结扎冠状动脉左前降支造成急性心梗,经过5~8周的心脏代偿性适应,急性心梗逐渐演变到心衰[4-5]。
生脉散出自张元素的《医学启源》,由人参、麦冬、五味子3味药组成,目前生脉散的现代制剂主要有口服药、注射剂和冻干粉针剂型,主要代表产品有生脉饮、生脉注射剂和注射用益气复脉(冻干)。其中益气复脉组方为红参、麦冬、五味子,益气复脉、养阴生津[6],用于冠心病劳累性心绞痛气阴两虚证,症见胸痹心痛、心悸气短和冠心病所致慢性左心功能不全II、III级气阴两虚证等[7]。中医认为气血津液是维持人体生命活动的基本物质,心气虚会导致多种生理机能下降,也是心衰的最基本病机[8]。现代医学认为心衰时,存在能量代谢障碍;同时炎症因子如C-反应蛋白(C-reactive protein,CRP)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6等均明显升高,诱导心肌细胞凋亡和发生,造成心肌重塑的恶性循环,加速心衰的发展进程[9]。CHF在疾病的不同阶段其中医证型分布也不同,阳虚水泛证、痰饮阻肺证主要出现在急性加重期,慢性稳定期以气虚血瘀证、心肺气虚证和气阴两虚血瘀证为主[10-11]。代谢组学研究表明,气阴两虚证患者苯丙氨酸、甘氨酸、高丝氨酸、葡萄糖、磷酸肌酸含量较低,因此CHF的治疗可能通过调节能量代谢、脂代谢、氨基酸代谢等多条途径发挥作用[12-13]。本研究通过构建经典的冠状动脉左前降支结扎所致的CHF大鼠探讨益气复脉对心功能的改善作用,并从能量代谢角度探讨其可能的作用机制。
1 材料
1.1 动物
SPF级雄性SD大鼠130只,体质量180~200 g,购自北京维通利华实验动物技术有限公司,生产许可证号SCXK(京)2021-0011。动物实验严格遵从天士力实验动物管理及福利伦理委员会)批准通过后执行(实验动物伦理号为TSL-IACUC-2023-19)。实验开始前,所有大鼠适应性饲养1周,实验环境为SPF级,实验期间自由进食饮水,隔日更换垫料1次。
1.2 药品与试剂
注射用益气复脉(冻干,批号20201205,有效期30个月,每瓶装0.65 g)由天津天士力之骄药业有限公司提供;卡托普利片(批号22101912)购自常州制药厂有限公司;0.9%氯化钠注射液(批号2001153204)购自石家庄四药有限公司;注射用青霉素钠(批号10122004073)购自山东鲁抗医药股份有限公司;异氟烷(批号045742)购自EZVET公司;甲醛(批号F809702)购自上海麦克林生化科技有限公司;无水乙醇(批号220221)购自天津市康科德科技有限公司;二甲苯(批号20200508)购自天津市风船化学试剂科技有限公司;苏木素-伊红(HE)染色液(批号210420)购自厦门迈威生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、心钠肽(atrial natriuretic peptide,ANP)、脑钠肽(brain natriuretic peptide,BNP)、心肌肌钙蛋白(cardiac troponin,cTn)、肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase isoenzyme-MB,CK-MB)、内皮素-1(endothelin-1,ET-1)、IL-6、TNF-α、三磷酸腺苷(adenosine triphosphate,ATP)ELISA检测试剂盒(批号均为20230310)购自上海酶联生物科技有限公司;裂解液、SDS-PAGE凝胶快速配制试剂盒、BCA蛋白定量试剂盒、SDS-PAGE上样缓冲液、Marker、ECL超敏发光试剂盒(批号分别为P0013B、P0012AC、P0010、P0015L、P0068、P0018AM)购自上海碧云天生物技术有限公司;PVDF膜(批号IPVH00010)购自美国Millipore公司;HRP标记的山羊抗兔IgG抗体(批号A0208)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自上海碧云天生物技术有限公司;磷酸腺苷激活的蛋白激酶(AMP-activated protein kinase,AMPK)、p-AMPK、肉碱棕榈酰转移酶-1(carnitine palmitoyltransferase-1,CPT-1)、葡萄糖转运蛋白-4(glucose transporter-4,GLUT-4)、过氧化物酶体增殖物激活受体γ辅助激活因子-1α(peroxisome proliferator activated receptor coactivator-1α,PGC-1α)抗体(批号ab32047、ab92701、ab189182、ab188317、ab188102)购自英国Abcam公司。
1.3 仪器
T1000型电子天平(常熟市双杰测试仪器厂);ST16R型高速冷冻离心机、902-ULTS型−80 ℃低温冰箱(美国Thermo Fisher Scientific公司);小动物超声诊断仪(百盛Saote公司);Tecan Infinite M200型多功能酶标仪(瑞士Tecan公司);VEM型小动物麻醉机(上海赞徳医疗器械有限公司);ASP300S型全自动脱水机、RM2235型切片机、EG1150型包埋机、HI1220型烘片机、HI1210型展片机(德国Leica公司);ECLIPSE Ni-U型生物显微镜(日本Nikon公司)。
2 方法
2.1 CHF大鼠模型的制备
将115只SD大鼠通过小动物麻醉机用异氟烷麻醉,仰卧位固定在手术板上,大鼠胸部左侧2~5肋处剃毛,碘伏消毒后,用手术剪在3~4肋处剪开皮层,逐层钝性分离肌肉层,暴露出肋骨后,在心脏跳动最明显的肋间隙间,快速挤出心脏,在左心耳根部下方进行结扎。结扎后将心脏送回胸腔内,挤出空气,用止血钳夹住剪开的两侧皮层,观察大鼠呼吸恢复,进行缝合(为避免气胸的形成,挤心脏和结扎心脏冠状动脉左前降支的时间应尽可能短)。缝合结束后,用碘伏擦拭缝合处,观察5~10 min。待大鼠恢复意识后,即可进食进水,放回饲养室正常饲养。所有大鼠于术后连续3 d腿部im青霉素钠。另取15只大鼠作为假手术组,只进行切口和缝合,不进行结扎。
2.2 分组及给药
术后6周将造模成功后存活的81只大鼠检测心功能,计算左室射血分数(left ventricular ejection fraction,LVEF),将LVEF≤40%作为CHF模型成功的标志。将符合标准的75只大鼠按照随机数字表法分为模型组,益气复脉低、高剂量(464.3、928.6 mg/kg,分别相当于临床剂量的1、2倍)组,卡托普利(3.35 mg/kg)组和益气复脉(464.3 mg/kg)+卡托普利(3.35 mg/kg)组,每组15只。益气复脉组尾iv益气复脉并ig 0.9%氯化钠注射液,卡托普利组ig卡托普利片(以0.9%氯化钠注射液配制成0.67 mg/mL的溶液)并iv 0.9%氯化钠注射液,假手术组和模型组尾iv并ig等体积0.9%氯化钠注射液(5 mL/kg),连续给药14 d。
2.3 指标观察
2.3.1 大鼠一般情况观察 给药期间认真观察动物的一般情况,包括大鼠的外观、毛发、行为活动、摄食情况、反应力及精神状态,每周记录大鼠体质量2次,末次给药前称定质量。
2.3.2 心功能检测 给药14 d后用超声诊断仪检测大鼠心功能变化,评估心脏功能。记录测量的心脏彩超重要参数,如左室舒张末期直径(LVIDd)、左室收缩末期直径(LVIDs)、左室收缩末容积(LVESV)、左室短轴缩短率(LVFS)、E峰(舒张早期心室充盈速度最大值)、A峰(舒张晚期心室充盈速度最大值)等心动参数。
LVEF=(舒张期心室容积-收缩期心室容积)/舒张期心室容积
LVFS=(舒张期心室内径-收缩期心室内径)/舒张期心室内径
2.3.3 血清生化指标 心功能检测结束后,每组取10只大鼠,采用小动物麻醉机以异氟烷麻醉,腹主动脉取血6~8 mL,3000 r/min离心10 min,取上清,于−80 ℃保存。按照ELISA试剂盒说明书分别检测ANP、BNP、CK、CK-MB、ET-1、cTn、IL-6、TNF-α、SOD和ATP的含量。
2.3.4 心脏指数的测定 取血后快速开胸取心脏,用滤纸擦拭多余的残血,称定全心湿质量,计算心脏指数,并用游标卡尺快速测量大鼠自然状态下心脏横向长度。每组快速取6只大鼠的心脏剪取心脏左心室,称定质量,以左心室质量与全心质量之比为左心室指数,快速用锡箔纸包好,用液氮快速冷冻固定后,置于−80 ℃冰箱中保存,用于后续实验。
2.3.5 大鼠心脏HE染色 每组取4只大鼠的完整心脏,用生理盐冲洗3次后放入10%的甲醛溶液进行固定,固定1周后切取心脏中段4~5 mm厚度,进行心脏组织脱水、包埋、切片和HE染色,封片并在显微镜下进行大鼠心脏病理观察。
2.3.6 Western blotting检测心肌组织相关蛋白表达 取假手术组、模型组和益气复脉低剂量组剩余5只大鼠心脏,去除左心室外的其余部分,加入裂解液裂解组织,高速离心后取上清液,采用BCA试剂盒定量蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,分别孵育一抗、二抗,显影,经凝胶成像仪曝光后分析条带灰度。
2.4 统计学分析
3 结果
3.1 益气复脉对CHF大鼠生存状况、心脏指数及左心室指数的影响
假手术组大鼠皮毛始终有光泽,摄食正常,心动敏捷,精神状态良好;造模后的大鼠渐渐有皮毛枯槁、活动量减少、行动迟缓等现象;给药后大鼠毛色逐渐有光泽,行动逐渐敏捷,说明益气复脉具有较好的改善CHF大鼠生存质量的作用。
如表1所示,与假手术组比较,造模后的大鼠体质量减轻,增长缓慢;与模型组比较,各给药组大鼠体质量增长稍加快,但无显著性差异。与假手术组比较,模型组大鼠心脏横向长度偏大,心脏指数和左心室指数明显增加(<0.01),说明CHF模型造模成功,大鼠心脏已发生心室重构;与模型组比较,各给药组心脏指数和左心室指数均明显减小(<0.05),心脏横向长度缩短,说明益气复脉具有较好的改善心室重构的作用。
3.2 益气复脉对CHF大鼠心功能的影响
LVFS和LVEF是评价心功能的重要黄金指标。如表2所示,与假手术组比较,模型组大鼠E/A值、LVEF和LVFS均显著降低(<0.001),而LVIDd、LVIDs和LVESV均显著升高(<0.001),说明模型组大鼠存在严重的心脏功能障碍;与模型组比较,给药后,各给药组E/A值、LVEF和LVFS均显著升高(<0.05、0.01、0.001),LVIDs和LVESV均显著降低(<0.05、0.01、0.001),说明益气复脉可以显著改善CHF大鼠的心功能,改善心脏的收缩和舒张功能。

表1 益气复脉对CHF大鼠体质量、心脏指数和左心室指数的影响(, n = 6~10)
与假手术组比较:*<0.05**<0.01***<0.001;与模型组比较:#<0.05##<0.01###<0.001,下表同
*< 0.05**< 0.01***< 0.001sham group;#< 0.05##< 0.01###< 0.001model group, same as below tables

表2 益气复脉对CHF大鼠心功能的影响(, n = 6)
3.3 益气复脉对CHF大鼠血清生化指标的影响
ANP、BNP是反映心脏心衰程度的经典标志物,其含量可直接反映心衰的严重程度;cTn和ET-1是反映机体心功能的指标。如表3所示,与假手术组比较,模型组大鼠血清中ANP、BNP、cTn和ET-1水平均显著升高(<0.001),ATP含量显著降低(<0.001);与模型组比较,给药组ANP、BNP、cTn和ET-1含量均显著降低(<0.05、0.01、0.001),益气复脉各剂量组和联合给药组ATP含量显著升高(<0.001),说明益气复脉可以在一定程度上改善CHF大鼠心功能,提高心脏供能。
TNF-α和IL-6是典型的炎症因子,如表4所示,与假手术组比较,模型组大鼠血清中TNF-α和IL-6水平均显著升高(<0.001);与模型组比较,各给药组大鼠血清中TNF-α和IL-6水平均显著降低(<0.001),说明益气复脉有助于改善CHF大鼠的炎症。
心肌细胞中CK和CK-MB的渗漏导致其在血清中浓度升高,可以反映心肌损伤的程度。与假手术组比较,模型组大鼠血清中CK-MB和CK活性均显著升高(<0.001),说明CHF大鼠心肌细胞大量坏死,导致心肌细胞内CK-MB和CK大量进入血液循坏系统。与模型组比较,各给药组血清中CK-MB和CK活性均显著降低(<0.05、0.01、0.001),说明益气复脉可以减少CHF大鼠心肌细胞的坏死(表4)。

表3 益气复脉对CHF大鼠血清中ANP、BNP、cTn、ET-1和ATP含量的影响(, n = 10)

表4 益气复脉对CHF大鼠血清中TNF-α、IL-6水平和CK、CK-MB、SOD活力的影响(, n = 10)
SOD活力的增加代表着机体抗氧化能力的恢复,与假手术组比较,模型组血清SOD活力显著降低(<0.001);与模型组比较,益气复脉各剂量组和联合给药组SOD活力显著升高(<0.01、0.001),说明益气复脉有助于促进机体的抗氧化能力(表4)。
3.4 益气复脉对CHF大鼠心脏病理变化的影响
如图1所示,假手术组大鼠心肌细胞排列整齐,无明显的病理变化;与假手术组比较,模型组的心肌细胞纤维排列紊乱,心肌细胞溶解并伴有出血现象;给予益气复脉和卡托普利后,心肌细胞溶解现象和出血现象较少,说明益气复脉对于心肌细胞损伤具有一定的改善作用。如表5所示,与假手术组比较,模型组大鼠病理评分明显增加(<0.05);与模型组比较,各给药组大鼠病理评分均显著降低(<0.05、0.01),说明益气复脉可以改善CHF大鼠心肌细胞病理变化。

图1 益气复脉对CHF大鼠心脏病理变化的影响(HE, ×100)

表5 各组大鼠心脏病理评分(, n = 4)
3.5 益气复脉对CHF大鼠心脏中能量代谢相关蛋白表达的影响
如图2所示,与假手术组比较,模型组大鼠心脏中p-AMPK、AMPK、GLUT-4和CPT-1蛋白表达水平均显著降低(<0.05、0.01、0.001),PGC-1α蛋白表达呈降低趋势;与模型组比较,益气复脉低剂量组p-AMPK、AMPK、GLUT-4和CPT-1蛋白表达水平均显著升高(<0.05、0.01、0.001),PGC-1α蛋白表达呈升高趋势。
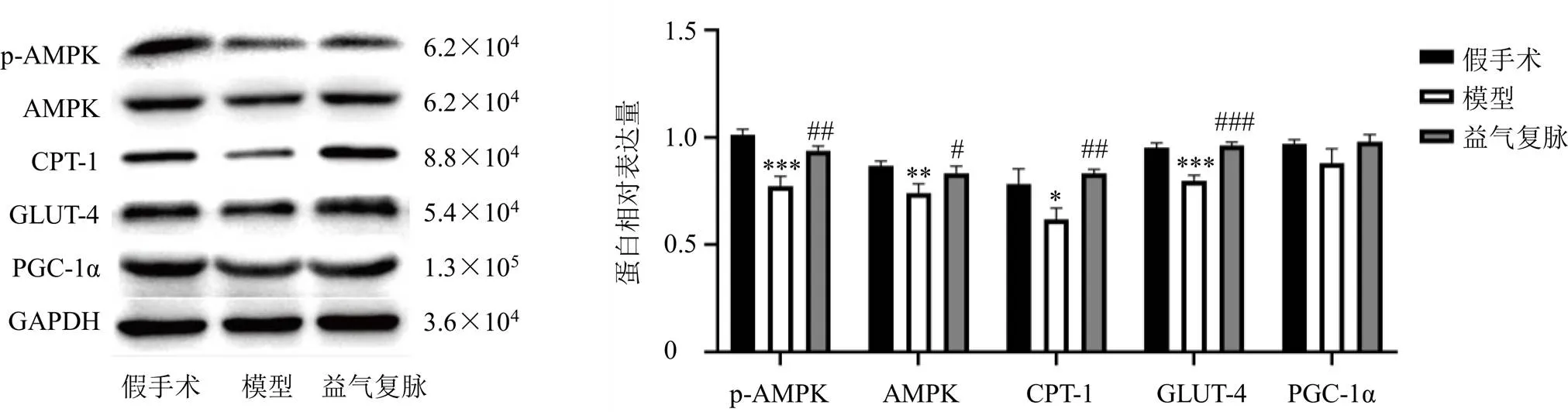
与假手术组比较:*P<0.05 **P<0.01 ***P<0.001;与模型组比较:#P<0.05 ##P<0.01 ###P<0.001
4 讨论
心衰的发生与能量代谢、心室重构引起血液动力学障碍、肾素-血管紧张素-醛固酮系统、细胞内钙离子循环障碍、氧化应激、内皮功能障碍、炎症、雌激素匮乏等有关,这些因素均是相互影响和交叉存在的[14]。ANP和BNP为心力衰竭的黄金指标。为了适应病理性变化,机体启动自我调节机制,增加ANP和BNP的释放,使血管扩张,缓解心脏负荷,从而改善心衰的症状,因此ANP和BNP水平的高低与心衰程度呈正相关[15]。早在1956年就有学者证实在心衰患者中炎症介质TNF-α、IL-6和IL-1β水平较正常人升高4倍,说明炎症在CHF中的病理生理过程具有重要作用[16]。SOD可反映机体的抗氧化能力。CHF时心肌细胞发生坏死,导致CK和CK-MB在血清中浓度升高,因此CK和CK-MB在一定程度上可以反映心肌细胞损伤的程度[17]。在本研究中,益气复脉低、高剂量组和与卡托普利联合使用均可降低心衰标志物ANP、BNP的含量,降低炎症因子TNF-α、IL-6、IL-1β水平,降低CK和CK-MB活性,提高心肌组织抗氧化能力,从而提高心功能,改善CHF。
为满足氧化代谢和ATP的需要,人体的心脏是摄氧量最高的器官,同时也是耗能最高的器官[18]。为维持心脏舒缩功能和心肌细胞内的离子稳定,需要丰富且充足的能量供应。正常心脏中,约80%的ATP来源于脂肪酸β氧化,其余的20%来自葡萄糖的氧化;而葡萄糖代谢涉及糖酵解与葡萄糖氧化,糖酵解过程发生在线粒体外的细胞质中,产能效率低,所产生的ATP占整个心脏不足10%[19-20]。虽然脂肪酸氧化能产生大量的ATP,但在产生等量的ATP时,脂肪酸耗氧量比碳水化合物多约10%。但在CHF时,心肌存在缺血缺氧和耗氧量增加的现象,能量代谢障碍产生,此时,因葡萄糖氧化磷酸化水平的不足,只能靠糖酵解来提供少量的能量,最终导致乳酸和氢离子的堆积,机体自动激活离子交换转运,导致钙离子超载,诱发细胞凋亡。钙超载的程度与心肌细胞的受损程度呈正相关,而钙超负荷又进一步导致线粒体损伤,内呼吸功能受损,氧化代谢减弱,糖酵解增加,能量产生不足,形成恶性循环,也加剧了CHF的恶化[21-23]。AMPKs是心脏能量代谢的调节器[24],细胞中ATP降低时,AMPK被激活并且能调节多种与能量平衡相关的生理过程,在心脏中AMPK激活能增加脂肪酸氧化,且在通过CPT-1的作用下,长链脂肪酸可以转化成脂肪酰辅酶A,增加脂肪酸进入线粒体进行脂肪酸β氧化[24-26]。AMPK的激活能促进肌小节上GLUT-4对葡萄糖的吸收;AMPK激活也能直接调节转录因子和共调节因子如PGC-1α[24]。益气复脉可以通过调控p-AMPK、AMPK、GLUT-4、CPT-1蛋白的表达,从而提高糖类能量代谢产能效率,改善能量代谢。
综上,益气复脉可以通过降低血清中炎症因子水平、提高心肌抗氧化能力、提升ATP含量、减缓CHF大鼠的病理损伤程度等途径,改善能量代谢,缓解心衰症状,从而改善心功能。
利益冲突 所有作者均声明不存在利益冲突
[1] 孙雪梅, 白文伟. 慢性心力衰竭诊治的研究进展 [J]. 检验医学与临床, 2016, 13(8): 1139-1142.
[2] 李云锋, 李琳. 心力衰竭中医证候动物模型研究进展 [J]. 湖南中医杂志, 2021, 37(8): 188-190.
[3] 黄明, 熊可, 李霄, 等. 心力衰竭动物模型的研究进展 [J]. 天津中医药大学学报, 2019, 38(6): 534-540.
[4] 陈明, 魏易洪, 侯玉鸣, 等. 心力衰竭动物模型研究进展 [J]. 医学理论与实践, 2021, 34(7): 1103-1105.
[5] 许静. 心梗致心衰潜在预警标志物发现及生脉注射液作用解析研究 [D]. 北京: 中国中医科学院, 2021.
[6] 张磊, 苏小琴, 李德坤, 等. 基于临床疗效的注射用益气复脉(冻干)质量标志物确证[J]. 中草药, 2021, 52(18): 5741-5750.
[7] 孟静, 鲁晓燕. 注射用益气复脉(冻干)治疗心力衰竭的药理作用及临床应用研究进展[J]. 药物评价研究, 2020, 43(8): 1506-1509.
[8] 吴昱杰, 刘建勋. 益气活血中药改善慢性心衰心气虚证作用机制研究进展 [J]. 中药药理与临床, 2021, 37(1): 234-239.
[9] 毛静远, 朱明军. 慢性心力衰竭中医诊疗专家共识 [J]. 中医杂志, 2014, 55(14): 1258-1260.
[10] 李越华, 肖沪生. 冠心病中医辨证分型与心功能及血液流变学之间关系的研究 [J]. 辽宁中医杂志, 2004, 31(12): 998-999.
[11] 方显明, 林荣荣, 张以昆, 等. 慢性心力衰竭中医证型的临床流行病学调查研究 [J]. 广西中医药, 2015, 38(1): 15-17.
[12] 朱明丹, 杜武勋, 魏聪聪, 等. 不同证型冠心病患者的血浆代谢组学研究 [J]. 中医杂志, 2013, 54(17): 1489-1493.
[13] 严蓓, 阿基业, 郝海平, 等. 气阴两虚证心肌缺血模型方证对应的代谢组学表征 [J]. 药学学报, 2011, 46(8): 976-982.
[14] Brahmbhatt D H, Cowie M R. Heart failure: Classification and pathophysiology [J]., 2018, 46(10): 587-593.
[15] 温玉, 胡琨建, 李欧, 等. 红参水煎液对心衰大鼠心功能及氧化应激的影响 [J]. 中国中医急症, 2022, 31(4): 584-587.
[16] 李媛媛, 冯娜, 付卫国, 等. 血浆IL-1β、IL-6水平与CHF患者临床病理参数关系 [J]. 河北北方学院学报: 医学版, 2010, 27(6): 45-48.
[17] 唐茜, 张浩, 程景林. NT-proBNP、cTnI、CK-MB在老年冠心病PCI术后预测心衰发生风险的探讨 [J]. 分子诊断与治疗杂志, 2022, 14(10): 1770-1774.
[18] 林金忠, 苗丽娜, 赵钟文, 等. 冠心病中辨证属实证者左心室结构和功能变化研究 [J]. 实用中医药杂志, 2001, 17(12): 3-5.
[19] Kantor P F, Lucien A, Kozak R,. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long-chain 3-ketoacyl coenzyme A thiolase [J]., 2000, 86(5): 580-588.
[20] Tuunanen H, Knuuti J. Metabolic remodelling in human heart failure [J]., 2011, 90(2): 251-257.
[21] Ruiz-Meana M, García-Dorado D. Pathophysiology of ischemia-reperfusion injury: New therapeutic options for acute myocardial infarction [J]., 2009, 62(2): 199-209.
[22] Sanada S, Komuro I, Kitakaze M. Pathophysiology of myocardial reperfusion injury: Preconditioning, postconditioning, and translational aspects of protective measures [J]., 2011, 301(5): H1723-H1741.
[23] Green D R, Wang R N. Calcium and energy: Making the cake and eating it too? [J]., 2010, 142(2): 200-202.
[24] Kim T T, Dyck J R B. Is AMPK the savior of the failing heart? [J]., 2015, 26(1): 40-48.
[25] Ballantyne C M, Davidson M H, MacDougall D E,. Efficacy and safety of a novel dual modulator of adenosine triphosphate-citrate lyase and adenosine monophosphate-activated protein kinase in patients with hypercholesterolemia: Results of a multicenter, randomized, double-blind, placebo-controlled, parallel-group trial [J]., 2013, 62(13): 1154-1162.
[26] Filippov S, Pinkosky S L, Lister R J,. ETC-1002 regulates immune response, leukocyte homing, and adipose tissue inflammation via LKB1-dependent activation of macrophage AMPK [J]., 2013, 54(8): 2095-2108.
Effect and mechanism of Yiqi Fumai Lyophilized Injection on rats with chronic heart failure
ZHAI You1, WU Ming-ming1, DENG Lin-hua2, GAO Dan3, ZHANG Ji-si1, ZHANG Yuan1, LIU Si-yuan4, MEI Yu-hang5, WANG Zhen-liang1, ZHAO Ying-qiang3
1. Henan University of Traditional Chinese Medicine, Zhengzhou 450046, China 2. Dongzhimen Hospital Beijing University of Chinese Medicine, Beijing 100700, China 3. Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300150, China 4. School of Acupuncture-Moxibustion and Tuina of Beijing University of Chinese Medicine, Beijing 100700, China 5. Liaoning University of Traditional Chinese Medicine, Shenyang 110847, China
To explore the pharmacodynamic effect and mechanism of Yiqi Fumai Lyophilized Injection (注射用益气复脉, YQFM) on improving rats with chronic heart failure (CHF) caused by myocardial infarction.Seventy-five SD rats were randomly divided into model group, YQFM low-and high-dose (464.3, 928.6 mg/kg) groups, captopril (3.35 mg/kg) and YQFM (464.3 mg/kg) + captopril (3.35 mg/kg) group, and 15 SD rats with incision suture but no ligation were selected as sham group. After two weeks of drug intervention, the cardiac function of rats was detected by small animal ultrasonic diagnostic instrument. Levels of central natriuretic peptide (ANP), brain natriuretic peptide (BNP), endothelin-1 (ET-1), cardiac troponin (cTn), interleukin-6 (IL-6), tumor necrosis factor-α (TNF-α), adenosine triphosphate (ATP) and creatine kinase (CK), creatine kinase isoenzyme-MB (CK-MB), superoxide dismutase (SOD) activities in serum were detected by ELISA; HE staining was used to observe the pathological changes of heart tissue in rats in each group. Western blotting was used to detect the expressions of energy metabolism-related proteins in hearts of rats in each group.Compared with sham group, the left ventricular ejection fraction (LVEF), E/A peak of mitral flow spectrum (E/A) and shortening rate of left ventricular short axis (LVFS) in model group were significantly decreased (< 0.001), levels of ANP, BNP, cTn, ET-1, IL-6, TNF-α and CK activity in serum were significantly increased (< 0.001), SOD activity and ATP level were significantly decreased (< 0.001), pathological changes such as myocardial fiber breakage, myocardial cell degeneration and necrosis occurred in the left ventricle, AMP-activated protein kinase (AMPK), p-AMPK, glucose transporter-4 (GLUT-4) and carnitine palmitoyl transferase-1 (CPT-1) protein expression levels were significantly decreased (< 0.05, 0.01, 0.001). Compared with model group, LVEF, E/A and LVFS in each administration group were significantly increased (< 0.05, 0.01, 0.001), levels of ANP, BNP, cTn, ET-1, IL-6, TNF-α and CK-MB and CK activities in serum were significantly decreased (< 0.05, 0.01, 0.001), SOD activity and ATP level were significantly increased (< 0.01, 0.001), myocardial injury in rats was obviously improved, p-AMPK, AMPK, GLUT-4 and CPT-1 protein expression levels in heart were significantly increased (< 0.05, 0.01, 0.001).YQFM can improve cardiac function by increasing ejection fraction and systolic and diastolic function in CHF rats, and improve heart failure symptoms and energy metabolism by reducing serum myocardial injury and oxidative stress levels in CHF rats, which may be one of its important mechanisms.
Yiqi Fumai Lyophilized Injection; chronic heart failure; cardiac function; oxidative stress; inflammation; energy metabolism
R285.5
A
0253 - 2670(2023)17 - 5649 - 08
10.7501/j.issn.0253-2670.2023.17.018
2023-06-07
国家重点研发计划项目(2019YFC1710005);国家自然科学基金资助项目(82205081);中国博士后科学基金第16批特别资助项目(2023T160069);2021年度科技协同创新专项(XTCX2021-09)
翟 优,男,讲师,博士,研究方向为中医药防治心血管疾病。E-mail: zhaiyou036@163.com
赵英强,博士生导师,主任医师,从事中医药防治心血管疾病的研究。E-mail: zhaoyingqiang1000@126.com
[责任编辑 李亚楠]
