基于分子生物学及代谢组学的柴胡注射液抗肝癌作用机制研究
2023-09-02陈一笑王威宇冯建有秦雪梅高晓霞
陈一笑,王威宇,冯建有,秦雪梅,高晓霞*
• 药理与临床 •
基于分子生物学及代谢组学的柴胡注射液抗肝癌作用机制研究
陈一笑1, 2, 3,王威宇1, 2, 3,冯建有1, 2, 3,秦雪梅1, 2, 3,高晓霞1, 2, 3*
1. 山西大学 中医药现代研究中心,山西 太原 030006 2. 山西大学 化学生物学与分子工程教育部重点实验室,山西 太原 030006 3. 地产中药功效物质研究与利用山西省重点实验室,山西 太原 030006
探究柴胡注射液抑制肝癌细胞增殖及诱导其凋亡的作用与机制。体外培养人肝癌SMMC-7721细胞与人正常肝细胞(LO-2),给予不同质量浓度的柴胡注射液干预,MTT法与划痕实验检测细胞增殖和迁移;采用流式细胞仪检测细胞周期及凋亡;采用qRT-PCR及Western blotting技术检测与周期阻滞、凋亡及迁移相关的基因与蛋白表达;代谢组学技术检测柴胡注射液干预前后肝癌细胞内源性差异物的变化,采用京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)分析柴胡注射液调节的代谢通路。柴胡注射液(100~450 mg/mL)显著抑制肝癌细胞增殖(<0.01、0.001),使细胞阻滞于S期与G2期(<0.05),促进肝癌细胞凋亡(<0.001),抑制肝癌细胞迁移(<0.05、0.001),表明柴胡注射液具有显著的抗肝癌作用。柴胡注射液显著降低肝癌细胞中神经元PAS结构域蛋白2(neuronal pas domain protein 2,)、细胞分裂周期蛋白25A(cell division cycle 25A,)、周期蛋白依赖激酶2(cyclin-dependent kinase 2,)、细胞周期蛋白A()、、、mRNA表达(<0.01、0.001),下调NPAS2、CDC25A、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白表达(<0.001),上调Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、细胞色素C(cytochrome-C,Cyt-C)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1,TIMP-1)蛋白表达(<0.01、0.001)。代谢组学结果显示,柴胡注射液干预核苷酸代谢、脂质代谢途径、糖酵解途径、氨基酸代谢途径、脂肪酸代谢途径等。柴胡注射液对SMMC-7721细胞有阻滞及促凋亡的作用,其可能的机制为下调NPAS2-CDC25A使细胞阻滞于S期,下调CDC25B、CDK1、cyclin B1使细胞处于G2期阻滞,下调MMP-9/TIMP-1值抑制肝癌细胞迁移,调节核苷酸、脂质与氨基酸代谢等通路,从而诱导肝癌细胞凋亡。
柴胡注射液;肝癌;凋亡;细胞周期;迁移;代谢组学
肝癌为临床上常见的恶性肿瘤,具有前期不易诊断、晚期致死率高等特点,严重威胁到患者的生命。由于肝肿瘤解剖部位特殊,因此外科通常以介入和手术治疗为主,中西医结合治疗也是其重要的治疗手段之一。柴胡是伞形科植物柴胡DC.或狭叶柴胡Willd.的干燥根,具有疏散退热、疏肝解郁的功效[1]。柴胡对于肝脏性疾病,如肝纤维化、肝癌等疗效显著,临床上将柴胡疏肝化瘀方与仑伐替尼联合治疗原发性肝癌取得较佳的治疗效果[2]。研究发现柴胡皂苷D可以通过促进细胞自噬及线粒体功能,促进有机阴离子转运多肽(organic aniontransporting polypeptide 1B1,Oatp1b1)表达,减少细胞外基质沉积,从而对阿霉素治疗小鼠肝癌具有靶向导引作用[3]。柴胡注射液是柴胡经水蒸气蒸馏制成的灭菌水溶液[4];临床上将肝动脉化疗栓塞(transarterial chemoembolization,TACE)与柴胡注射液配合治疗肝癌取得较好的疗效[5-7];相关药理实验也表明柴胡注射液具有体外抑制肝癌增殖的活性[8-9]。柴胡复方和柴胡制剂都表现出抑制肝癌增殖、促进肝癌细胞凋亡的效果,然而柴胡注射液的抗肝癌作用机制并未有明确的研究。
肿瘤是一种与节律相关的疾病,在许多肿瘤研究中均有报道[10-12]。神经元PAS结构域蛋白2(neuronal pas domain protein 2,NPAS2)是产生和维持周期节律的重要调控因子,恶性肿瘤的发生与其异常表达有关[13]。NPAS2作为昼夜节律生物系统中的重要核心组件,可以调控多种与周期相关基因的转录,进而影响肝癌细胞的增殖[14]。随着癌症恶性增殖机制的深入研究,发现细胞周期蛋白依赖激酶(cyclin dependent kinase,CDKs)与细胞周期蛋白(cyclins)组成的蛋白复合物(CDKs-cyclins)在调控癌症细胞进程中发挥着重大作用[15]。研究发现cyclin E调控细胞G1/S期进程,进入S期后略微下降[16]。
代谢组学是借助色谱、质谱及液质联用等技术对生物体内的代谢物进行定量分析,进而解释复杂性病理或生理变化的方法[17]。由于肝癌的发生发展与机体的代谢状态密切相关,因此检测差异代谢物的变化可以更好把握肝癌的发展阶段和恶化状态,这有利于临床早期肝癌的诊断。本研究以人肝癌SMMC-7721细胞及人正常肝细胞(LO-2)为对象,采用分子生物学与代谢组学的方法,来探讨柴胡注射液的抗肝癌作用与机制,从而在分子层面及代谢方面对柴胡注射液的抗肝癌机制有更深入的认识,为临床肝癌治疗提供理论基础。
1 材料
1.1 细胞
SMMC-7721细胞和LO-2细胞均购自武汉普诺赛生命科技有限公司。
1.2 药品与试剂
柴胡注射液(1 g/mL,批号Z20073102)购自辅仁药业;DMEM高糖培养基(批号E709FA0003)购自上海生物工程股份有限公司;0.25%胰酶(批号13F09A67)购自武汉博士德生物工程有限公司;胎牛血清(批号20170621)购自天杭生物科技股份有限公司;MTT、二甲基亚砜(dimethyl sulfoxide,DMSO)购自北京索莱宝科技有限公司;分析级石油醚、醋酸乙酯购自北京化工试剂;5-氟尿嘧啶(5-fluorouracil,5-FU)购自北京北大药业;BCA蛋白浓度测定试剂盒(批号PAB180007)购自Bioswamp公司;SYBR Green PCR试剂盒(批号KM4101)购自Kapa Biosystem公司;逆转录试剂盒(批号639505)购自日本Takara公司;NPAS2抗体(批号H00004862-D01)、细胞分裂周期蛋白25A(cell division cycle 25A,CDC25A)抗体(批号PAB0425)购自Abnova公司;基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)抗体(批号HPA001238)购自美国Sigma-Aldrich公司;基质金属蛋白酶抑制剂-1(TIMP-1)抗体批号orb1248799)、细胞色素C(cytochrome-C,Cyt-C)抗体(批号orb804756)购自Biorbyt公司、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号AB112)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号AG1208)购自Beyotime公司;半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)抗体(批号ab49822)购自英国Abcam公司;HRP标记的羊抗兔二抗(货号20536-1-AP)购自上海生工生物工程有限公司;抗体β-actin(货号20536-1-AP);无水乙醇(批号10009218)、氯仿(批号10006818)、异丙醇(批号80109218)购自国药集团有限公司;乙腈、甲酸(质谱级)购自美国Thermo Fisher Scientific公司。
1.3 仪器
Infinite M200 Pro型酶标仪(瑞士Tecan公司);Neofuge 1600R/1600型低温离心机(力康集团);D180型细胞培养箱(瑞沃德生命科技有限公司);NovoCyte型流式细胞分析仪(ACEA公司);EPS300r型电泳仪、5200型化学发光分析仪(上海天能科技有限公司);Q Exactive UPLC-MS型超高效液相色谱与质谱联用仪(美国Thermo Fisher Scientific公司)。
2 方法
2.1 细胞培养
SMMC-7721和LO-2细胞用含10%胎牛血清、100 U/L青霉素、100 μg/L链霉素的RPMI 1640培养基,在37 ℃、5% CO2培养箱内培养。
2.2 MTT法检测SMMC-7721和LO-2细胞增殖
SMMC-7721和LO-2细胞分别以1×105个/mL接种于96孔板中,100 μL/孔,培养24 h使细胞贴壁后,设置对照组、5-FU(25 μg/mL)组和柴胡注射液(以生药量计50、100、200、250、350、450 mg/mL)组,每组设3个复孔;对照组仅加入培养基,其余各组加入相应药物,培养24 h,弃去培养液,每孔加入100 μL含10% MTT的培养基,培养4 h后弃上清液,加入100 μL DMSO,振荡摇匀,用酶标仪在490 nm处测定吸光度()值。
2.3 流式细胞仪检测SMMC-7721细胞周期及凋亡
SMMC-7721细胞以1×105个/mL接种于6孔板中,设置对照组和柴胡注射液(200、250、350 mg/mL)组,检测细胞周期;设置对照组和柴胡注射液(200 mg/mL)组,检测细胞凋亡。对照组仅加入培养基,其余各组加入相应药物,培养24 h,收集细胞,按照文献方法处理[18-19],上机检测细胞周期与凋亡。
2.4 MTT法检测SMMC-7721细胞迁移
SMMC-7721细胞以1×105个/mL接种于6孔板中,培养12 h后,于孔中央用200 μL枪头垂直“一”字划痕,用预冷的PBS缓冲液洗涤以清除细胞碎片。设置对照组和柴胡注射液(200 mg/mL)组,对照组加入培养基,给药组加入药物,分别于0、12、24、36 h观察划痕伤口愈合情况并拍照,用Photoshop CS4软件“多边形套索工具”计算划痕面积。
2.5 qRT-PCR检测SMMC-7721细胞NPAS2、CDC25A、CDC25B、CDK1、CDK2、cyclin A和cyclin B1 mRNA表达
SMMC-7721细胞以1×105个/mL接种于6孔板中,设置对照组和柴胡注射液(250 mg/mL)组,对照组加入培养基,给药组加入药物,培养24 h,收集细胞,按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析。引物序列见表1。
2.6 Western blotting检测SMMC-7721细胞Bax、Bcl-2、Cyt-C、Caspase-3、NPAS2、CDC25A、MMP-9和TIMP-1蛋白表达
SMMC-7721细胞以1×105个/mL接种于6孔板中,设置对照组和柴胡注射液(250 mg/mL)组,对照组加入培养基,给药组加入药物,培养24 h,收集细胞,加入含蛋白酶和磷酸酶抑制剂的裂解液,4 ℃充分裂解细胞,95 ℃加热10 min,12 000 r/min离心5 min,收集上清。BCA法进行蛋白定量,蛋白样品经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,5%脱脂牛奶封闭1 h后,分别加入一抗(1∶1000),4 ℃孵育过夜;加入二抗室温孵育1 h,用ECL显影,扫描条带。
表1 引物序列
Table 1 Primer sequences
基因序列(5’-3’)扩增片段/bp NPAS2F: GCACTAAAGGACAAGGG93 R: TGGCGAATGACTGGTAT CDC25AF: CCTTGACAACCGATGC202 R: CAGGGATAAAGACTGATGAA CDC25BF: ACAGCGAAACCCCAAAGA243 R: TGATGGCAAACTGCTCGT CDK1F: GGAACTTCGTCATCCAAATA129 R: TACTGACCAGGAGGGATAGA CDK2F: GAAACAAGTTGACGGGAGA171 R: TGATGAGGGGAAGAGGAA cyclin AF: TGGAGTTGTGCTGGCTAC216 R: TCAGGGAGTGCTTTCTTT cyclin B1F: GCACTTTCCTCCTTCTCA100 R: CGATGTGGCATACTTGTT GAPDHF: CCACTCCTCCACCTTTG106 R: CACCACCCTGTTGCTGT
2.7 代谢组学研究
2.7.1 分组及给药处理 取8 mL SMMC-7721细胞培养液置于培养皿中培养24 h,弃去培养液,加入8 mL柴胡注射液(250 mg/mL)继续培养24 h,以不加入药物的SMMC-7721细胞作为模型组,不加入药物的LO-2细胞作为正常组,每组平行6个样本。刮取细胞,加入预冷PBS离心清洗2遍,超声破碎细胞[20],乙腈沉淀蛋白,低温13 000 r/min离心15 min,取上清液转移到干净EP管,于真空冷冻离心干燥机干燥。以200 μL初始流动相(0.1%甲酸水溶液-乙腈=9∶1)复溶,低温13 000 r/min离心15 min,上清液进UPLC-MS分析。另各取上述LO-2组、SMMC-7721组、柴胡注射液组细胞样本液20 μL混合,作为质控样本。
2.7.2 液相条件 Waters Acquity UPLC HSS T3色谱柱(100 mm×2.1 mm,1.7 µm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~4 min,2% B;4~5 min,2%~3% B;5~8 min,3%~15% B;8~13 min,15%~35% B;13~17 min,35%~55% B;17~23 min,55%~70% B;23~26 min,70%~80% B;26~28 min,80%~85% B;28~36 min,85%~95% B;36~38 min,95% B;38~40 min,95%~2% B;40~41 min,2% B。体积流量0.2 mL/min;进样量5 μL;柱温40 ℃。
2.7.3 质谱条件 采用ESI离子化方式,喷雾电压正极3.5 kV,负极−2.5 kV;毛细管温度320 ℃;加热器温度300 ℃;鞘气体积流量35 arb;辅助气体积流量10 arb;扫描模式为Full Scan/dd-MS2,采集范围/100~1500,正负离子切换采集模式。分辨率采用MS Full Scan 35 000 FWHM,MS/MS 17 500 FWHM,碰撞能量为12.5、25、37.5 eV[21]。
2.8 统计学分析

3 结果
3.1 柴胡注射液对SMMC-7721和LO-2细胞增殖的影响
如图1所示,柴胡注射液质量浓度为100~450 mg/mL时,显著抑制SMMC-7721和LO-2细胞存活率(<0.01、0.001),呈剂量相关性,且对SMMC-7721细胞的增殖抑制作用较强。柴胡注射液质量浓度为250 mg/mL时达到半数抑制率(49.54%),因此选择250 mg/mL进行后续研究。
3.2 柴胡注射液对SMMC-7721细胞周期和凋亡的影响
如图2所示,与对照组比较,柴胡注射液(200、250、350 mg/mL)组G1期细胞比例显著减少(<0.05、0.01),柴胡注射液(200、350 mg/mL)组S期细胞比例显著升高(<0.05),柴胡注射液(250、350 mg/mL)组G2期细胞比例显著升高(<0.05),表明柴胡注射液阻滞肝癌细胞于S期和G2期。如图3所示,柴胡注射液(250 mg/mL)作用于SMMC-7721细胞24 h后,肝癌细胞出现凋亡现象;与对照组比较,柴胡注射液组细胞凋亡率明显升高(<0.001)。
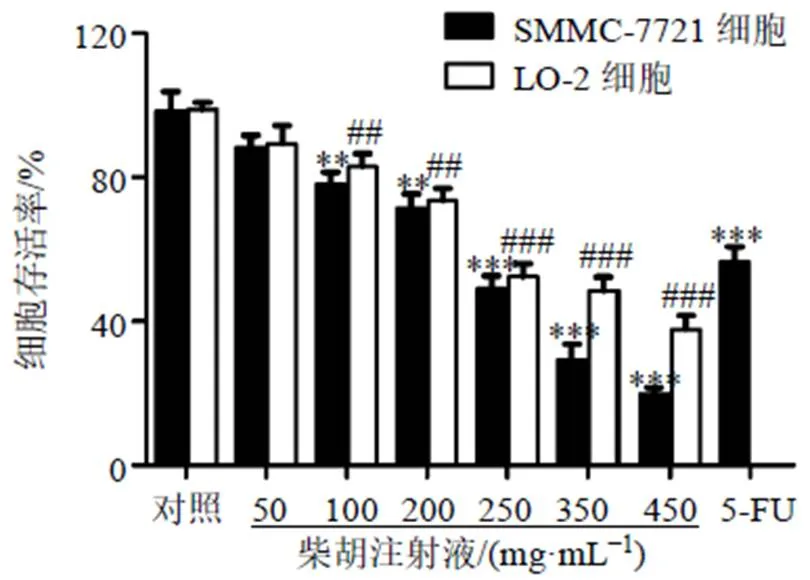
与SMMC-7721细胞对照组比较:*P<0.05 **P<0.01 ***P<0.001;与LO-2细胞对照组比较:##P<0.01 ###P<0.001,图2~5同

图2 柴胡注射液对SMMC-7721细胞周期的影响(, n = 3)
3.3 柴胡注射液对SMMC-7721细胞迁移的影响
如图4所示,与对照组比较,柴胡注射液显著抑制SMMC-7721细胞迁移(<0.05、0.001),表明柴胡注射液具有抑制肝癌细胞迁移的作用。
3.4 柴胡注射液对SMMC-7721细胞周期、凋亡和迁移相关蛋白及基因表达的影响
3.4.1 细胞周期相关基因与蛋白表达 如图5-A、B所示,与对照组比较,柴胡注射液组、、、、、、mRNA表达水平均显著降低(<0.01、0.001),NPAS2和CDC25A蛋白表达水平均显著降低(<0.001)。
3.4.2 凋亡相关蛋白表达 如图5-C所示,与对照组比较,柴胡注射液组Bax、Bax/Bcl-2、Cyt-C、Caspase-3蛋白表达水平显著升高(<0.01、0.001),Bcl-2蛋白表达水平显著降低(<0.001)。

图3 柴胡注射液对SMMC-7721细胞凋亡的影响(, n = 3)

图4 柴胡注射液对SMMC-7721细胞迁移的影响(, n = 3)
3.4.3 迁移相关蛋白表达 如图5-D所示,与对照组比较,柴胡注射液组MMP-9和TIMP-1蛋白表达水平显著升高(<0.001),MMP-9/TIMP-1值显著降低(<0.01)。
3.5 代谢组学分析
3.5.1 代谢轮廓数据采集 采用UHPLC-MS对正常肝细胞、肝癌细胞、柴胡注射液组样品进行数据采集,得到正、负离子模式下的代谢轮廓(图6)。
3.5.2 方法学考察 为了监测UHPLC-MS稳定性,每6针样品之后进一针质控样品。每针质控样品提取10个离子,计算6针质控样品中该10个提取离子的保留时间以及质荷比的RSD值。如表2所示,保留时间的RSD为0.136%~0.436%,质荷比的RSD为(3.28×10−5~6.15×10−5)%,提示所建立的UHPLC-MS方法符合批量肝细胞分析要求。
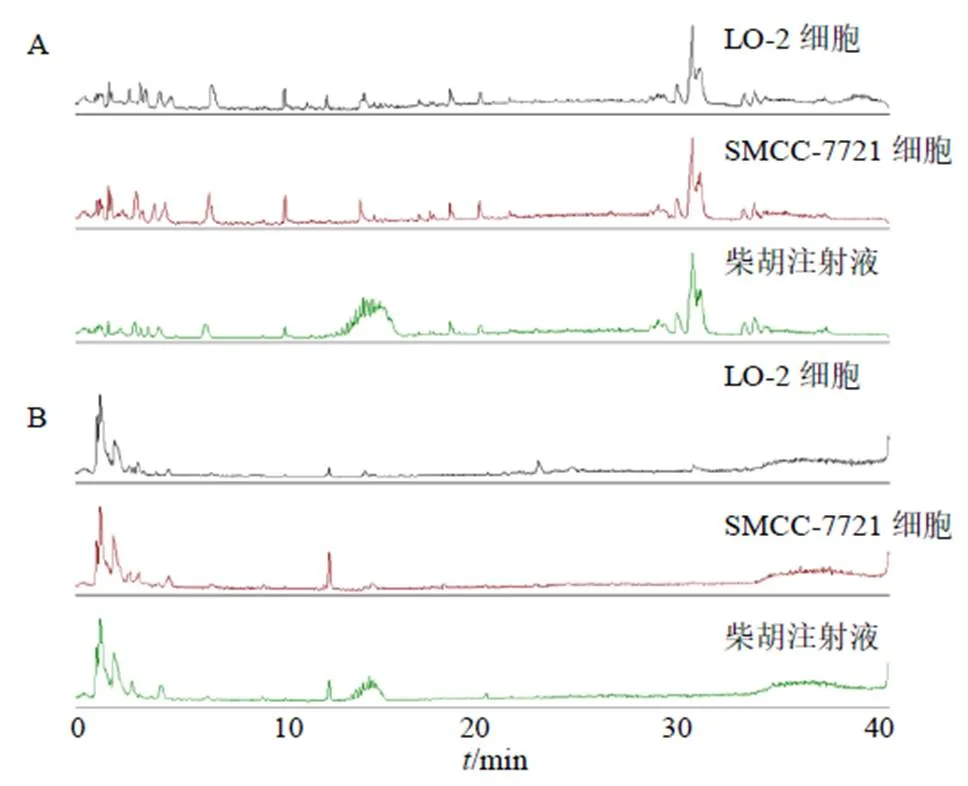
图6 正(A)、负(B)离子模式下各组样本总离子流图
表2 UHPLC-MS稳定性结果
Table2 UHPLC-MS stability results
编号tR/minRSD/%m/zRSD/%离子模式 11.550.236 7147.052 96.15×10−5[M+H]+ 22.100.315 8111.043 54.72×10−5[M+H]+ 33.100.436 8152.033 24.82×10−5[M-H]− 45.740.426 1151.049 53.37×10−5[M+H]+ 56.910.264 8148.052 55.17×10−5[M-H]− 613.030.375 8132.077 93.48×10−5[M-H]− 718.540.421 6465.309 03.28×10−5[M+H]+ 820.230.136 8449.314 44.75×10−5[M+H]+ 920.970.236 3299.282 44.17×10−5[M+H]+ 1021.460.169 2467.301 33.86×10−5[M+H]+
3.5.3 差异代谢物分析与鉴定 PLS-DA得分图可看出,正常肝细胞和肝癌细胞明显分离,表明肝癌细胞内源性代谢与正常肝细胞内源性代谢产生差异;药物干预组与肝癌细胞组明显分离(图7-A)。为了验证模型可靠性,对上述模型数据进行排列实验(=200),评判标准参考课题组已发表文献报道[21],相关验证结果表明模型可靠(图7-B)。
OPLS-DA得分图显示正常肝细胞组和肝癌组明显分离(图7-C),表明肝癌细胞代谢轮廓发生改变。借助HMDB数据库及NCBI数据库对正常肝细胞组、肝癌细胞组和药物干预组的显著性差异物进行鉴定指认,共鉴定指认出20个与肝癌相关的差异代谢物(表3)。
3.5.4 柴胡注射液对差异代谢物的影响 如图8所示,与模型组比较,柴胡注射液能够回调的差异代谢物有10种,如涉及脂质代谢的神经酰胺(d18∶1/16∶0),涉及糖酵解途径的3-磷酸甘油酸,涉及脂肪酸代谢的肉桂酸、2-羟基己酸,涉及氨基酸代谢的-正亮氨酸、谷氨酰胺,涉及核苷酸代谢的胞嘧啶核苷、尿苷、鸟嘌呤均显著下降(<0.05、0.01、0.001),涉及核苷酸代谢的次黄嘌呤显著上升(<0.01)。
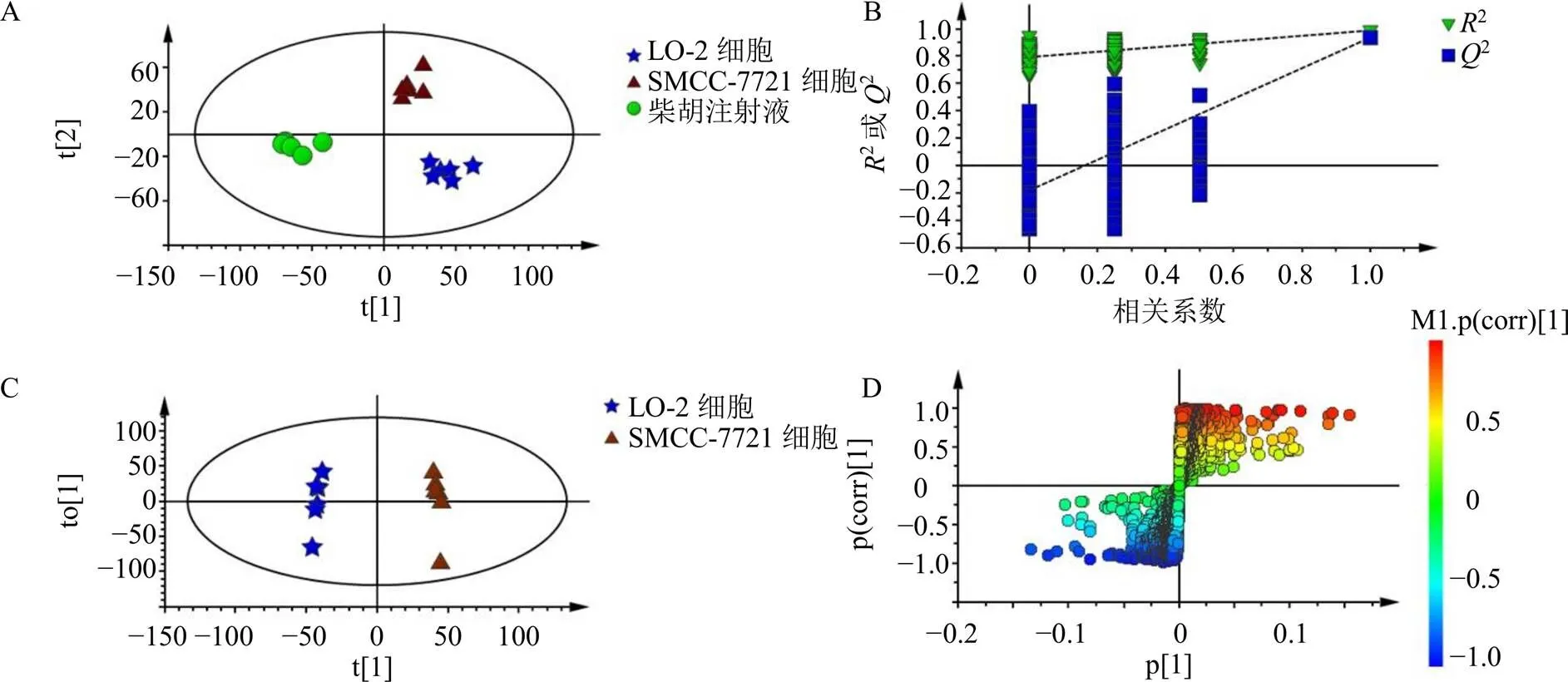
图7 各组样品PLS-DA得分图(A) 及其模型验证图(B)、正常肝细胞和肝癌细胞样本的OPLS-DA得分图(C) 及S-Plot图(D)
表3 各组样本差异代谢物
Table3 Differential metabolites of samples in each group
编号tR/minm/z离子模式代谢物SMCC-7721细胞vs LO-2细胞柴胡注射液vs SMMC-7721细胞通路 11.50149.105 2[M+H]+三乙醇胺↓↓脂质代谢 220.97299.282 4[M+H]+鞘氨醇↓↓脂质代谢 330.61538.519 7[M+H]+神经酰胺(d18∶1/16∶0)↑↓脂质代谢 421.46467.301 3[M+H]+溶血卵磷脂(14∶0/0∶0)↓—脂质代谢 51.92185.992 4[M-H]−3-磷酸甘油酸↑↓糖酵解途径 66.91148.052 5[M-H]−肉桂酸↑↓脂肪酸代谢 713.03132.077 9[M-H]−2-羟基己酸↑↓脂肪酸代谢 81.91203.115 9[M+H]+乙酰肉碱↓—脂肪酸代谢 918.54465.309 0[M+H]+甘氨胆酸↓↓胆汁酸代谢 1020.23449.314 4[M-H]−甘氨熊脱氧胆酸↓↓胆汁酸代谢 113.43131.094 8[M-H]−L-正亮氨酸↑↓氨基酸代谢 121.55147.052 9[M+H]+谷氨酸↓↓氨基酸代谢 131.40146.069 2[M-H]−谷氨酰胺↑↓氨基酸代谢 142.10111.043 5[M+H]+胞嘧啶↑↑核苷酸代谢 151.93243.085 6[M+H]+胞嘧啶核苷↑—核苷酸代谢 163.16244.069 4[M+H]+尿苷↑↓核苷酸代谢 172.73136.038 6[M+H]+次黄嘌呤↓↑核苷酸代谢 183.10152.033 2[M-H]−黄嘌呤↓↓核苷酸代谢 195.74151.049 5[M+H]+鸟嘌呤↑↓核苷酸代谢 202.00347.063 1[M+H]+5′-磷酸腺苷↓↓核苷酸代谢
“↑”表示升高;“↓”表示降低;“—”表示无变化
“↑” indicates increasing; “↓” indicates decreasing; “—” indicates no change

与正常组比较:#P<0.05 ##P<0.01 ###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001
3.5.5 差异代谢物的代谢通路分析 为更好分析各差异代谢物在正常肝细胞、肝癌细胞、药物干预组间的内在联系,借助在线京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库对上述差异代谢物做整合代谢通路分析(图9)。10种柴胡注射液回调的差异代谢物主要涉及核苷酸代谢、脂肪酸代谢途径、氨基酸代谢途径等。
4 讨论
肝癌即肝脏恶性肿瘤,外科通常以手术为主,由于其解剖部位特殊,治疗效果不佳,存在一定风险,现多以中西医结合治疗为主[6]。柴胡具有疏肝解郁、保肝柔肝的功效,临床上运用柴胡注射液配合TACE技术治疗肝癌取得较好疗效,但是柴胡注射液抑制肝癌细胞增殖以及诱导其凋亡的作用机制还需要探究。

代表肝癌细胞组与正常肝细胞组比较的变化;代表给药组与肝癌细胞组比较的变化
研究发现,节律基因的紊乱与肿瘤的发生、发展密切相关,且已在肝癌、乳腺癌和子宫内膜癌等肿瘤中得到证实[22]。基因是哺乳动物中最大的生物钟基因,在肝癌细胞中高表达,促进细胞周期G1/S期的转化,从而提高肝癌细胞的生存率[23]。研究报道CDC25A蛋白通过调控下游CDK2-cyclin A复合物参与S-G2的进程,CDC25A的转录表达受到基因的调控[24-25]。本研究发现,柴胡注射液可以显著抑制肝癌细胞增殖,使肝癌细胞阻滞于S期与G2期,为了探究其作用机制,借助qRT-PCR及Western blotting技术对相关基因与蛋白进行测定,结果表明细胞阻滞于S期可能是由于柴胡注射液下调NPAS2,进而下调CDC25A,导致CDK2-cyclin A复合物表达水平下调,进而导致肝癌细胞S期过渡到G2期受阻。CDC25B在多种肿瘤中高表达,能够阻滞细胞周期[26]。研究发现CDC25B作为G2/M期过渡的关键基因,通过调控下游底物CDK1-cyclin B1复合物去磷酸化参与G2/M进程[27]。qRT-PCR结果提示肝癌细胞在G2期受阻可能是因为柴胡注射液下调基因从而导致CDK1-cyclin B1复合物表达下降,G2/M肝癌周期进程受阻。为了探究肝癌细胞凋亡机制,采用Western blotting技术检测凋亡蛋白表达,结果提示柴胡注射液通过调控Bax/Bcl-2值,促使Cyt-C从线粒体释放,进而激活下游Caspase-3蛋白,从而引起肝癌细胞凋亡。但也有研究发现CDC25A蛋白可以调控Bcl-2蛋白去磷酸化参与肝癌细胞凋亡[24],因此推测柴胡注射液可能会通过下调NPAS2,进而下调CDC25A的表达,下调Bcl-2蛋白去磷酸化,从而促进肝癌细胞凋亡。
与正常细胞相比,肿瘤细胞因其基因或者表观遗传的改变,导致许多代谢通路发生紊乱[28]。为了探究柴胡注射液是通过何种代谢通路导致肝癌细胞发生阻滞与凋亡,采用代谢组学方法鉴定了20个与肝癌相关的差异代谢物;其中柴胡注射液能够回调的肝癌细胞差异代谢物有10种。研究报道神经酰胺(d18∶1/16∶0)通过调控参与内质网应激的转录激活因子6(activating transcription factor 6,ATF6)/C/EBP同源蛋白(C/EBP homologous protein,CHOP)复合物发挥抗细胞凋亡作用[29]。本研究结果发现柴胡注射液可能通过调控神经酰胺(d18∶1/16∶0)合成,进而激活内质网应激,从而发挥促进肝癌凋亡。病理情况下,细胞更倾向于糖酵解途径供能[30],3-磷酸甘油酸的生成是糖酵解途径中的重要环节,柴胡注射液组3-磷酸甘油酸显著下降,提示柴胡注射液可能通过阻滞糖酵解途径,干预3-磷酸甘油酸的生成,进而阻断肝癌细胞的能量供应。研究发现干扰脂肪酸的合成可以抑制肿瘤细胞的增殖[31];乙酰辅酶A是合成脂肪酸的原料,肉桂酸参与乙酰辅酶A的合成[32],2-羟基己酸参与脂肪酸代谢途径[33],结果发现柴胡注射液组肉桂酸及2-羟基己酸显著下调,因此推测柴胡注射液通过调控脂肪酸代谢途径,从而抑制肝癌细胞的增殖。肿瘤的发生发展离不开氨基酸代谢的参与[34],临床实验发现肝癌患者血浆中多种氨基酸水平发生明显改变[35],本研究结果表明柴胡注射液通过干预-正亮氨酸、谷氨酰胺的合成从而导致肝癌细胞的凋亡。相关肝癌研究发现肝癌患者体内存在核苷酸代谢异常[36],因此柴胡注射液组鸟嘌呤显著降低,可能与次黄嘌呤的增加相关;可能是由于柴胡注射液阻断了次黄嘌呤向鸟嘌呤的转化;另外柴胡注射液组胞嘧啶显著增加,而尿苷显著降低,表明柴胡注射液可能阻滞胞嘧啶向尿苷的转化,进而可能阻断肝癌中DNA的合成从而导致肝癌细胞凋亡。
综上,柴胡注射液不仅能够抑制肝癌细胞的增殖而且能够使其凋亡,肝癌细胞阻滞于S期主要与NPAS2-CDC25A-CDK2-cyclin A通路有关,阻滞于G2期主要与CDC25B、CDK1-cyclin B1复合物有关,凋亡主要与NPAS2-CDC25A、Bax/Bcl-2、Caspase-3有关,代谢组学结果提示还与核苷酸、脂质与氨基酸代谢等通路密切相关。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 293.
[2] 姜晓倩, 王丽宁. 柴胡疏肝化瘀方联合仑伐替尼治疗(气滞血阻证) 原发性肝癌的临床疗效 [J]. 中西医结合肝病杂志, 2022, 32(5): 462-464.
[3] 许严伟, 耿胜男, 王梦琪, 等. 柴胡皂苷D对阿霉素治疗小鼠肝癌的靶向导引作用[J]. 中草药, 2021, 52(3): 778-788.
[4] 邓晶晶, 唐嘉曦, 李婷婷, 等. 柴胡注射液有效成分的含量测定及指纹图谱模式识别的研究 [J]. 华西药学杂志, 2018, 33(1): 76-79.
[5] 张国顺, 李盛楠, 孟冬梅, 等. 肝动脉化疗栓塞术联合射频消融术治疗原发性肝癌 [J]. 中国老年学杂志, 2019, 39(8): 1855-1857.
[6] 刘芝雁, 段秀萍, 辛伟, 等. 柴胡注射液结合TACE技术治疗肝癌效果观察 [J]. 中医临床研究, 2017, 9(26): 11-12.
[7] 吴薏婷. 痰热清注射液治疗肝癌TACE术后发热60例 [J]. 福建中医药, 2005, 36(2): 23-24.
[8] 刘晓斌, 张正祥, 吉金山, 等. 柴胡注射液对人肝癌细胞株SMMC-7721增殖及凋亡的影响 [J]. 陕西医学杂志, 2016, 45(3): 279-281.
[9] 唐婷婷. 柴胡注射液对人肝癌细胞HepG2增殖及凋亡的影响 [D]. 武汉: 湖北中医学院, 2008.
[10] 董菲, 孙成铭. 节律基因在肿瘤中的研究进展 [J]. 国际检验医学杂志, 2016, 37(7): 941-944.
[11] 张霞, 李杰. 生物钟在肿瘤中的研究进展 [J]. 国际检验医学杂志, 2012, 33(24): 3030-3031.
[12] 杨柳青, 石汉平. 昼夜节律与肿瘤 [J]. 肿瘤代谢与营养电子杂志, 2017, 4(3): 338-342.
[13] 王爱武, 钟碧玲, 周扬帆, 等. 乳腺浸润性导管癌中生物钟基因NPAS2的表达及临床病理分析 [J]. 广东医学, 2021, 42(7): 751-755.
[14] 李波, 刘峰舟, 刘明莉, 等.基因敲除的HepG2细胞系构建及其对肝癌细胞凋亡的影响 [J]. 现代生物医学进展, 2017, 17(29): 5618-5622.
[15] Loyer P, Trembley J H, Katona R,. Role of CDK/cyclin complexes in transcription and RNA splicing [J]., 2005, 17(9): 1033-1051.
[16] 贾海全. RNAi Cyclin E对肝癌HepG2细胞生长及细胞周期的影响[D]. 郑州: 郑州大学, 2012.
[17] 李雨萌, 陈莹. 代谢组学在恶性肿瘤诊断中的应用研究进展 [J]. 医学研究与教育, 2016, 33(3): 42-46.
[18] 金艳书, 吴学敏, 娄金丽. 苦参碱对人肝癌细胞增殖、细胞周期及细胞凋亡的影响 [J]. 中国临床康复, 2006, 10(3): 107-109.
[19] 司维柯, 罗朝学, 陈庆海. 流式细胞术分析苦参碱诱导人肝癌细胞HepG2凋亡 [J]. 肿瘤, 2001, 21(3): 213-214.
[20] 王珂欣, 高丽, 周玉枝, 等. 苦参碱抗肝癌细胞增殖的1H-NMR代谢组学研究 [J]. 中草药, 2017, 48(20): 4275-4283.
[21] 梁梅丽, 赵芳, 方媛, 等. 基于LC-MS技术的柴胡石油醚部位对抑郁症模型大鼠海马组织的代谢组学研究 [J]. 中草药, 2018, 49(10): 2291-2301.
[22] 陈雅凡, 王刚, 田艺苑, 等. 节律基因NPAS2在肿瘤中的研究进展 [J]. 中国癌症防治杂志, 2022, 14(5): 569-574.
[23] 郭静. 周期节律蛋白NPAS2抑制乳腺癌细胞增殖的机制研究 [D]. 大连: 大连理工大学, 2018.
[24] Yuan P, Li J B, Zhou F,. NPAS2 promotes cell survival of hepatocellular carcinoma by transactivating CDC25A [J]., 2017, 8(3): e2704.
[25] Tu Y S, Kang X L, Zhou J G,. Involvement of Chk1-Cdc25A-cyclin A/CDK2 pathway in simvastatin induced S-phase cell cycle arrest and apoptosis in multiple myeloma cells [J]., 2011, 670(2/3): 356-364.
[26] 王志, 周晶晶, 张静. 细胞分裂周期因子CDC25B在肿瘤中作用的研究进展 [J]. 延安大学学报: 医学科学版, 2022, 20(1): 85-88.
[27] Lammer C, Wagerer S, Saffrich R,. The cdc25B phosphatase is essential for the G2/M phase transition in human cells [J]., 1998, 111(16): 2445-2453.
[28] 郭文正, 邓炯. 肿瘤代谢研究新进展 [J]. 国际肿瘤学杂志, 2015, 42(4): 277-280.
[29] Senkal C E, Ponnusamy S, Bielawski J,. Antiapoptotic roles of ceramide-synthase-6-generated C16-ceramide via selective regulation of the ATF6/CHOP arm of ER-stress-response pathways [J]., 2010, 24(1): 296-308.
[30] Xu S L, Herschman H R. A tumor agnostic therapeutic strategy for hexokinase 1-null/hexokinase 2-positive cancers [J]., 2019, 79(23): 5907-5914.
[31] 刘畅, 张一帆. 脂肪酸代谢在恶性肿瘤发生机制及分子影像中的应用 [J]. 分子影像学杂志, 2020, 43(1): 16-19.
[32] Zhao K J, Chen Y, Hong S J,. Characteristics of β-oxidative and reductive metabolism on the acyl side chain of cinnamic acid and its analogues in rats [J]., 2019, 40(8): 1106-1118.
[33] 赵超群. 基于代谢组学技术的慢性乙型肝炎及非酒精性脂肪性肝病“湿热证”的物质基础研究 [D]. 上海: 上海中医药大学, 2020.
[34] 高红梅, 杨仕仪. 肿瘤氨基酸代谢研究进展 [J]. 解放军医药杂志, 2021, 33(8): 112-116.
[35] Shariff M I, Gomaa A I, Cox I J,. Urinary metabolic biomarkers of hepatocellular carcinoma in an Egyptian population: A validation study [J]., 2011, 10(4): 1828-1836.
[36] 李君, 孙淑军, 王洋, 等. 29例肝细胞肝癌患者的肿瘤组织代谢组学研究 [J]. 世界科学技术—中医药现代化, 2017, 19(4): 578-586.
Mechanism of Bupleurum Injection against liver cancer based on molecular biology and metabolomics
CHEN Yi-xiao1, 2, 3, WANG Wei-yu1, 2, 3, FENG Jian-you1, 2, 3, QIN Xue-mei1, 2, 3, GAO Xiao-xia1, 2, 3
1. Modern Research Center of Traditional Chinese Medicine at Shanxi University, Taiyuan 030006, China 2. Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education, Shanxi University, Taiyuan 030006, China 3. Shanxi Provincial Key Laboratory of Research and Utilization of Functional Substances in Traditional Chinese Medicine, Taiyuan 030006, China
To explore the effect and mechanism of Bupleurum Injection (柴胡注射液, BI) on inhibiting proliferation and inducing apoptosis of hepatocellular carcinoma cells.Human hepatocellular carcinoma SMMC-7721 cells and normal human hepatocytes (LO-2) were cultured, and different concentrations of BI were given for intervention. MTT assay and scratch test were used to detect cell proliferation and migration. Cell cycle and apoptosis were detected by flow cytometry. qRT-PCR and Western blotting were used to detect the expressions of genes and proteins related to cycle arrest, apoptosis and migration. Metabolomics technology was used to detect the changes of endogenous differences in hepatocellular carcinoma cells before and after BI intervention, and the metabolic pathway regulated by BI was analyzed by Kyoto encyclopedia of genes and genomes (KEGG).BI (100—450 mg/mL) significantly inhibited the proliferation of hepatocellular carcinoma cells (< 0.01, 0.001), arrested the cells in S phase and G2phase (< 0.05), promoted the apoptosis of hepatocellular carcinoma cells (< 0.001), and inhibited the migration of hepatocellular carcinoma cells (< 0.05, 0.001), which indicated that BI had significant anti-hepatoma effect. BI significantly decreased neuronal pas domain protein 2 (), cell division cycle 25A (), cyclin-dependent kinase 2 (),,,andmRNA expression (< 0.01, 0.001), down-regulated NPAS2, CDC25A and B-cell lymphoma-2 (Bcl-2) protein expressions (< 0.001), up-regulated Bcl-2 associated X protein (Bax), cytochrome-C (Cyt-C), cystein-asparate protease-3 (Caspase-3), matrix metalloproteinase-9 (MMP-9) and tissue inhibitor of metalloproteinase-1 (TIMP-1) protein expressions (< 0.01, 0.001). The results of metabolomics showed that BI interfered with nucleotide metabolism, lipid metabolism, glycolytic pathway, amino acid metabolism and fatty acid metabolism.BI can block and promote apoptosis of SMMC-7721 cells. The possible mechanism is that down-regulation of NPAS2-CDC25A can block cells in S phase, down-regulation of CDC25B, CDK1 and cyclin B1 can block cells in G2phase, down-regulation of MMP-9/TIMP-1 can inhibit the migration of hepatocellular carcinoma cells, and regulate the metabolism of nucleotides, lipids and amino acids, thus inducing apoptosis of hepatocellular carcinoma cells.
Bupleurum Injection; liver cancer; apoptosis; cell cycle; migration; metabolomics
R285.5
A
0253 - 2670(2023)17 - 5590 - 11
10.7501/j.issn.0253-2670.2023.17.013
2023-04-04
国家自然科学基金面上项目(82174099);山西省基础应用项目面上项目(20210302123432);名优晋药再开发山西省重点实验室(202104010910001);地产中药功效物质研究与利用山西省重点实验室(201605D111004)
陈一笑(1997—),女,硕士研究生,研究方向为中药药动学。Tel: 15383417482 E-mail: yixiaochen2021@163.com
高晓霞,女,博士生导师,教授,从事中药药动学、中医药代谢组学等研究。Tel: (0351)7019297 E-mail: gaoxiaoxia@sxu.edu.cn
[责任编辑 李亚楠]
