基于等温滴定量热法对鱼腥草注射剂超分子结构特征的研究
2023-09-02王玉钗张雨恬张伟龙贺福元刘平安
刘 湘,王玉钗#,张雨恬,田 丽,谯 茹,张伟龙,贺福元, 3, 4*,刘平安
基于等温滴定量热法对鱼腥草注射剂超分子结构特征的研究
刘 湘1, 2,王玉钗1, 2#,张雨恬1, 2,田 丽1, 2,谯 茹1, 2,张伟龙1,2,贺福元1, 2, 3, 4*,刘平安5*
1. 湖南中医药大学药学院,湖南 长沙 410208 2. 中药成药性与制剂制备湖南省重点实验室,湖南 长沙 410208 3. 湖南中医药大学 中医药超分子机理与数理特征化实验室,湖南 长沙 410208 4. 中药药性与药效国家中医药管理局重点实验室,湖南 长沙 410208 5. 湖南省中医研究院,湖南 长沙 410006
基于超分子“印迹模板”的分布特征划分鱼腥草注射剂指纹图谱成分簇,进行谱热学研究探讨鱼腥草注射剂中形成超分子结构的可疑成分。采用气相色谱-质谱(GC-MS)法建立11批次鱼腥草注射剂的指纹图谱,采用匹配频数法和段带总量统计矩法划分“印迹模板”成分簇并构建新指纹图谱;采用等温微量热滴定仪测定11批次鱼腥草注射剂中挥发油成分相互滴定的放热量;根据超分子“印迹模板”作用放热的叠加性原理,进行总峰面积与鱼腥草注射剂自放热量的线性回归,建立谱热学方程并分析成分簇贡献率,根据关键成分簇信息筛选关键成分结构。11批次鱼腥草挥发油GC-MS指纹图谱可被划分为26个“印迹模板”成分簇,总峰面积与热量线性回归后保留10个相关性大的变量:V2、V10、V15、V17、V19、V20、V21、V22、V23、V26,其回归系数分别为−1.12×10−4、5.93×10−6、7.58×10−5、9.32×10−4、−1.14×10−5、4.97×10−4、5.26×10−5、−1.16×10−4、−5.66×10−5、−2.08×10−5,常数为24.199,=0.958。筛选得到17个形成超分子结构的可疑成分,分别为樟烯、β-月桂烯、4-甲基-3-(1-甲基乙叉基)-环己烯、3-(4-甲基-3-戊烯基)-呋喃等。以超分子“印迹模板”为理论指导,运用匹配频数法对鱼腥草注射剂挥发油进行成分簇划分;利用线性回归得到了各个成分簇对放热值的贡献度及排序,得到形成超分子结构的关键成分,为后续对鱼腥草注射剂(类)致敏研究提供方向。
微量热滴定;鱼腥草;印迹模板;谱热学;成分簇;超分子结构;樟烯;β-月桂烯;4-甲基-3-(1-甲基乙叉基)-环己烯;3-(4-甲基-3-戊烯基)-呋喃
中药注射剂已有70多年的发展和临床应用历史,是我国临床的独特治疗手段。中药注射剂由中医药理论指导,采用现代科学技术与方法,从中草药、天然药物中提取有效成分制成可供注入体内(包括肌内、穴位、皮内、皮下、静脉以及其他组织或器官)的无菌溶液以及供临床前配制溶液的无菌粉末或浓缩液[1]。随着临床应用的增多,频繁发生的中药注射剂安全问题,制约了中药注射剂的发展[2-3]。中药注射剂临床上引发的多数过敏样反应与I型变态反应的过敏在给药方式上有明显差异。最新研究表明77%的急性过敏反应为类过敏反应,而类过敏反应在中药注射剂引发的过敏性休克中又约占3/4,由此可见类过敏发生率远高于过敏反应[4]。2019年国家批准生产的141种中药注射剂中有44.7%的注射剂是由2种及以上的药材组成[5],所含物质成分十分复杂,难以明确致敏成分,故筛选中药注射剂中的潜在致类过敏反应物质,对提高临床应用的安全性至关重要。
临床上曾广泛应用的鱼腥草注射剂是一种清热解毒的传统中药,具有抗菌抗病毒、增加机体免疫力、抗炎镇痛、抗肿瘤等药理作用[6],主要用于治疗支气管炎、肺炎及严重急性呼吸系统综合征,具有药效迅速,能使药物发挥定位定向的局部作用等优势[7-8]。其有效成分是用水蒸气蒸馏法从鱼腥草中提取的挥发油类成分,加入增溶剂聚山梨酯-80及氯化钠制成注射剂[9]。鱼腥草注射剂疗效显著确切,但其不良反应报道也屡见不鲜。其不良反应主要累及呼吸系统、皮肤黏膜系统、消化系统、心血管系统及神经系统等多系统,且发生时间主要在给药后30 min内,临床表现复杂多样,严重时出现过敏性休克[10-11]。
超分子化学(supramolecular chemistry)根源于配位化学,有人称之为广义配位化学(generalized coordination chemistry),是30多年来迅猛发展起来的一门交叉学科,它与材料科学、信息科学、生命科学等学科紧密相关,是当代化学领域的前沿课题之一[12-15]。中药超分子化学理论认为,人体和中药可以看成是一个由单分子、超分子、聚合超分子及巨复超分子构成的复杂体系,其药效基础为生物超分子“印迹模板”的聚集体,进入人体后按超分子自主印迹行为发挥药效作用,致敏物质也同样适用[16]。“印迹模板”理论起源于Fischer的酶与底物作用的“锁钥模型”及Pauling的“抗体-抗原”学说,而免疫应答是人体超分子“印迹模板”识别、拷贝、贮存与复制过程中十分重要的一环[17-18]。基于超分子理论可知中药有效成分为具有“印迹模板”的中药小分子,一般为不具备免疫原性的半抗原,但能与体内的载体蛋白结合或自身聚合成超分子可直接作为抗原引起机体的免疫应答从而引起免疫毒性,这一作用机制可能就是由特殊超分子结构所引起的药物表观免疫现象[19]。
因此,本研究采用等温滴定量热技术,通过研究分子之间结合时所产生的热量变化来验证鱼腥草注射剂中总挥发油成分自身及与增溶剂聚山梨酯80(Tween 80,T80)之间可以形成超分子结构,据此可以初步推测超分子结构特征在中药注射剂致敏原性研究中起到特殊的作用。并基于团队前期提出的谱量学[20],对鱼腥草挥发油指纹图谱进行划分为“印迹模板”成分簇,通过关联不同批次鱼腥草挥发油指纹图谱“印迹模板”成分簇总峰面积的总量零阶矩和热量变化值建立谱热学方程,通过多元线性回归分析可得鱼腥草挥发油“印迹模板”成分簇中对放热量贡献较大的成分簇,得到各个成分簇的贡献度排序,即潜在的(类)致敏性排序,结合团队前期对鱼腥草具体成分的检测分析,筛选出可以形成超分子结构的可疑化合物,这对指导鱼腥草临床合理用药具有重要意义,为解决中药注射剂的免疫毒性这一问题提供新的研究思路。
1 基本原理
1.1 中药化学成分“印迹模板”成分簇作用规律和表征原理
中药和人体都为生物巨复超分子体,两者按超分子“印迹模板”自主进行作用,因此“印迹模板”的印迹性作用规律研究贯穿中医药理论始终[21]。中药成分在进行色谱分析时,表现为某个分子的某一个基团“印迹模板”随机与色谱固定相进行结合-迁移-解结合-再结合-再迁移等印迹作用,最终综合印迹特征以保留时间的形式体现出来。因此,成分的保留时间是衡量成分群间印迹性的综合指标,有效成分簇间的平均保留时间的变化就意味着构成比的变化,成分群整体印迹性的变化,其药(毒)效属性的变化,反之通过建立以平均保留时间的印迹评价指标就能控制成分群的构成比和药(毒)效属性[22]。中药指纹图谱上每个峰对应一个或一个以上化学成分,每个化学成分的“印迹模板”结构特征不同,而“印迹模板”结构特征相近的成分保留时间也相近;峰面积即表明其化学含量的高低,其受色谱条件、药材成分相互作用等的综合影响。因此,根据“印迹模板”特征与色谱印迹性相一致原则得知,不同化学成分并不是在色谱上在无序排列下出峰,而是“印迹模板”特征相近的化学成分在相近的保留时间下出峰,呈现为最接近“印迹模板”结构特征成分为中心的簇状分布和以指纹图谱色谱峰出现频数对保留时间的凸凹状分布,其分离度的大小表示“印迹模板”的相似程度,可通过各时间段的色谱峰匹配出现的频数进行按统计学划分,就能确定成分群“印迹模板”的数目。
1.2 中药指纹图谱“印迹模板”成分簇的划分
本团队前期创立的总量统计矩法可以表征中药成分簇印迹效果[23]。具体来说,它将每张完整的动态指纹图谱看作是一个由时间变量和对应的指纹峰响应值所构成的二维图谱。而根据中医药超分子“气析”理论,结合中药成分簇“印迹模板”在中药指纹图谱上的印迹性表征的凹凸状分布,利用匹配频数来划界确定成分簇“印迹模板”,并计算成分簇“印迹模板”的整合后色谱学参数,通过比较指纹图谱前后总量统计矩参数、信息熵与信息量的参数变化,发现基于匹配频数整合而成的新指纹图谱能保证原总量统计矩参数稳定,可极大地改变峰的数目、信息熵和信息量,然而又不改变其变异性,也就是指纹图谱的特征和样本间的变异不会因匹配频数统计法对成分整合成“印迹模板”成分簇而损失,可极大地降低中药研究的复杂性,因此该方法是进行中药指纹图谱整合,获得物质基础单元,以适宜中医药理论、生产与应用研究需要的理想工具[24]。具体步骤如下:对指纹图谱色谱峰匹配时共同出现的频数进行统计学分析,取频数的均数与一定置信度下的统计量乘以标准差的积之和为界值确定“印迹模板”成分簇数目。
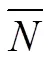
式中PC为划作“印迹模板”所需最低匹配频数的色谱峰,计算大于PC的色谱峰数即为“印迹模板”数,P是匹配频数的平均值,(α,ν)为置信系数,为1-,自由度(总匹配峰数目-1)对应的界值,SD为匹配频数的标准差。
对划好界的“印迹模板”成分簇按保留时间的匹配频数统计均值计算出新的保留时间,而峰面积相加得新的成分簇峰面积,由此构成体现不同批次鱼腥草挥发油“印迹模板”新指纹图谱的色谱峰表征体系,以此展开谱热学关联分析。
1.3 等温滴定量热技术及谱热学方程的建立
分子间的相互作用会产生吸热或放热效应。分子间相互作用的定量描述可通过化学反应过程中热力学参数的变化来确定。运用量热计可定量监测分子相互作用过程中产生的热量变化[25-26]。等温滴定量热技术(isothermal titration calorimetry,ITC)能准确地监测和记录一个变化过程的量热曲线,在线和无损伤的提供热力学信息,其原理是将反应物滴定到另一反应物的样品溶液中,该过程所释放或吸收热能被ITC所检测到,直接测量出反应过程相关的能量学参数,为热力学分析提供结合反应相关的能量过程的定量特征。ITC是一种监测由结合成分的添加而起始的任何化学反应的热力学技术,它已经成为鉴定生物分子间相互作用的首选方法[27-28]。本研究中使用的等温滴定微量热仪,能在线测量或控制重要的过程变量,如反应温度、夹套温度、压力、搅拌速度等,从而获得反应放热量等热学信息,并通过对实验结果的分析处理,获得反应动力学信息。
图1为等温量热技术的原理示意图,主要测量生物化学反应过程中某时刻的热量,并绘制为曲线。基本放热量为r=accum+flow+dos-c,每2 s记录并计算各数据点,且各热量数据按单位时间计,即为放热量,单位为W。式中,r为体系放热量,c为校准功率,accum为反应体系的热积累(accumulation),flow是自反应体系向夹套传递的热流束,dos为加入试样时所引起的热量流失速率。

图1 等温滴定量热技术原理示意图
由于热量的叠加效应,当试样为多成分()时,体系的放热量为每个成分放热量之和。
R=1+2+3+…+Q(2)
超分子“印迹模板”间的结合不是简单地堆砌在一起,而是存在着强烈的相互作用,为非共价键的结合,由于热量可以叠加,中药中多成分与多成分的结合,其热量之和即为等温量热滴定仪所测定的体系总热量的变化。当建立多组中药已知成分簇与成分簇的相互作用实验,可建立已知成分簇与成分簇间相互作用对叠加总热量的关系。采用线性回归计算后可得出对于最终放热量关联性最大的“印迹模板”成分簇,即可得出鱼腥草注射剂挥发油最有可能形成超分子结构的成分簇信息,而该成分簇所形成的超分子结构可能与鱼腥草挥发油注射剂的致敏性息息相关。
2 仪器与材料
2.1 仪器
GCMS-QP2010型气质联用仪,日本岛津公司;EKup-11-20T型超纯水系统,长沙市科临电子科技有限公司;MicroCal iTC200型等温滴定微量热仪,英国马尔文仪器有限公司;CP-114型电子天平,奥豪斯仪器上海有限公司。
2.2 试剂与试药
新鲜鱼腥草11批,采集于湖南中医药大学含浦校区周边村庄,按照采集时间批次编号依次为YXC01~YXC11,经湖南省中医药大学药学院中药鉴定教研室刘塔斯教授鉴定为三白草科蕺菜属植物蕺菜Thunb.的新鲜全草。
对照品甲基正壬酮(批号110834-200502,质量分数为99.0%)、正十五烷(批号11677-200401,质量分数为100.0%)、乙酸龙脑酯(批号110759-201105,质量分数为97.0%)、α-蒎烯(批号897-2000001,质量分数为99.6%)均购于中国食品药品检定研究院;T80,批号20170106-1,购自南京威尔化工有限公司;分析纯无水乙醇,批号0907360,安徽安特生物化学有限公司;水为超纯水。
3 方法与结果
3.1 溶液的配制
3.1.1 鱼腥草挥发油样品制备 取新鲜鱼腥草,除去泥沙、根及烂叶,称取2000 g,用刀切成1 cm小段,置于圆底烧瓶中加水浸没药材。按《中国药典》2020年版通则挥发油测定法进行提取,同时在挥发油提取器中加入适量醋酸乙酯,收集鱼腥草挥发油,−20 ℃保存,备用。
3.1.2 GC-MS样品的制备 取鱼腥草挥发油5 μL,用醋酸乙酯定容至2 mL,得鱼腥草挥发油样品,分别编号为S1~S11,经0.2 μm微孔滤膜滤过,进行GC-MS测定。
3.1.3 内标液的制备 精密称取正十五烷对照品135.8 mg至于10 mL量瓶中,加正己烷定容,取5 mL至于100 mL量瓶中,加正己烷定容,得0.679 g/L的正十五烷内标液,备用。
3.1.4 对照品溶液的制备 分别精密称取对照品甲基正壬酮72.6 mg、乙酸龙脑酯105.2 mg、α-蒎烯139.3 mg,加内标液溶解并定容,分别得质量浓度为7.26、10.52、13.93 g/L的混合对照品溶液。
3.1.5 主客体挥发油样品的配制 为了使拟合得到的热力学参数准确可靠,应用ITC进行分子热力学参数测定过程需要反应池样品充分消耗,最终得到S形等温线。取鱼腥草挥发油30 μL溶解于35 μL无水乙醇中,用超纯水定容至2 mL,−20 ℃保存,作为主体挥发油样品备用。另取鱼腥草挥发油5 μL溶解于35 μL无水乙醇中,用超纯水定容至2 mL,−20 ℃保存,作为客体挥发油样品备用。
3.1.6 0.17% T80的制备 取0.017 g T80,用水定容至10 mL,备用,即得0.17% T80溶液。
3.2 鱼腥草挥发油GC-MS指纹图谱的建立和“印迹模板”成分簇的划分
3.2.1 GC-MS条件 色谱条件SE-30石英毛细管柱(30 m×0.25 mm,0.25 μm),载气为氦气,体积流量为10 mL/min,升温程序:初始温度为60 ℃,保持1 min;以15 ℃/min升至103 ℃、再以0.2℃/min升至104 ℃、再以37 ℃/min升至140.7 ℃、再以0.02 ℃/min升至141 ℃、再以40 ℃/min升至168 ℃,保持1 min,再以7 ℃/min升至200 ℃,保持7 min;进样量为1 μL。
3.2.2 质谱条件 采用电子轰击离子源(EI),离子源温度为230 ℃,四极杆温度为150 ℃,接口温度为280 ℃,电子能量为70 eV,溶剂延迟时间为2.5 min,扫描质量范围为40~500。
3.2.3 精密度试验 取S1鱼腥草挥发油,按“3.1.2”项下方法制备供试品溶液,按“3.2.1”项下条件连续进样5次,共有指纹峰的相对保留时间和相对峰面积的RSD分别为2.56%和2.83%,说明仪器精密度符合要求。
3.2.4 稳定性试验 取S1鱼腥草注射剂挥发油的供试品溶液,分别在制备后1、2、4、6、12、24 h按“3.2.1”项下条件进行测定,共有指纹峰的相对保留时间和相对峰面积的RSD分别为2.45%和4.62%,说明样品在24 h内稳定性符合要求。
3.2.5 重复性试验 取S1批次鲜鱼腥草5份,按“3.1.1”和“3.1.2”项下方法制备供试品溶液,按“3.2.1”项下条件测定,计算共有指纹峰的相对保留时间和相对峰面积的RSD分别为0.44%和4.10%,说明该方法重复性符合要求,可以用于鱼腥草注射剂挥发油的检测。
3.2.6 鱼腥草挥发油GC-MS指纹图谱的建立 取11批鱼腥草挥发油样品,按“3.1.2”项下方法制备鱼腥草挥发油供试品溶液,进样得到GC-MS指纹图谱(S1~S11),并采用“国家药典委员会2012版中药指纹图谱相似度评价”软件进行图谱处理,详见图2。
3.2.7 鱼腥草挥发油指纹图谱“印迹模板”成分簇的划分 将11批次鱼腥草挥发油指纹图谱导入中药色谱指纹图谱相似度评价系统,经校正、匹配后导出数据,获得不同保留时间的匹配频数,详见图3,其中高匹配频数的成分主要集中在3.76~15.97 min,说明共有成分主要集中在这个保留时间段内;11批次鱼腥草挥发油指纹图谱共有峰有26个。按公式(1)计算出11批次鱼腥草挥发油成分簇划分成“印迹模板”中心成分的最少匹配频数为11.01个,所以取大于最大匹配频数11的匹配频数色谱峰为“印迹模板”每个“印迹模板”成分簇间的界限,再根据段带统计矩法计算出新保留时间和新峰面积,其划分后生成新的指纹图谱的保留时间和峰面积见表1。
使用匹配频数总量统计矩法可极大地降低中药研究的复杂性,使能从鱼腥草诸多成分中找出鱼腥草注射剂致(类)过敏关键成分变成可行[29]。
3.3 等温滴定量热法结果
3.3.1 检测条件及操作过程 在样品池加入的被滴定溶液(鱼腥草主体挥发油或空白溶剂)992 μL。进样针吸入滴定溶液(鱼腥草客体挥发油)100 μL,设置恒温搅拌,控制搅拌速率为150 r/min,系统用已设定好的恒定的加料速率匀速注入定量客体溶液,反应结束等待10 min,待温度信息显示稳定后,得到此时反应釜中混合体系的各项热值。
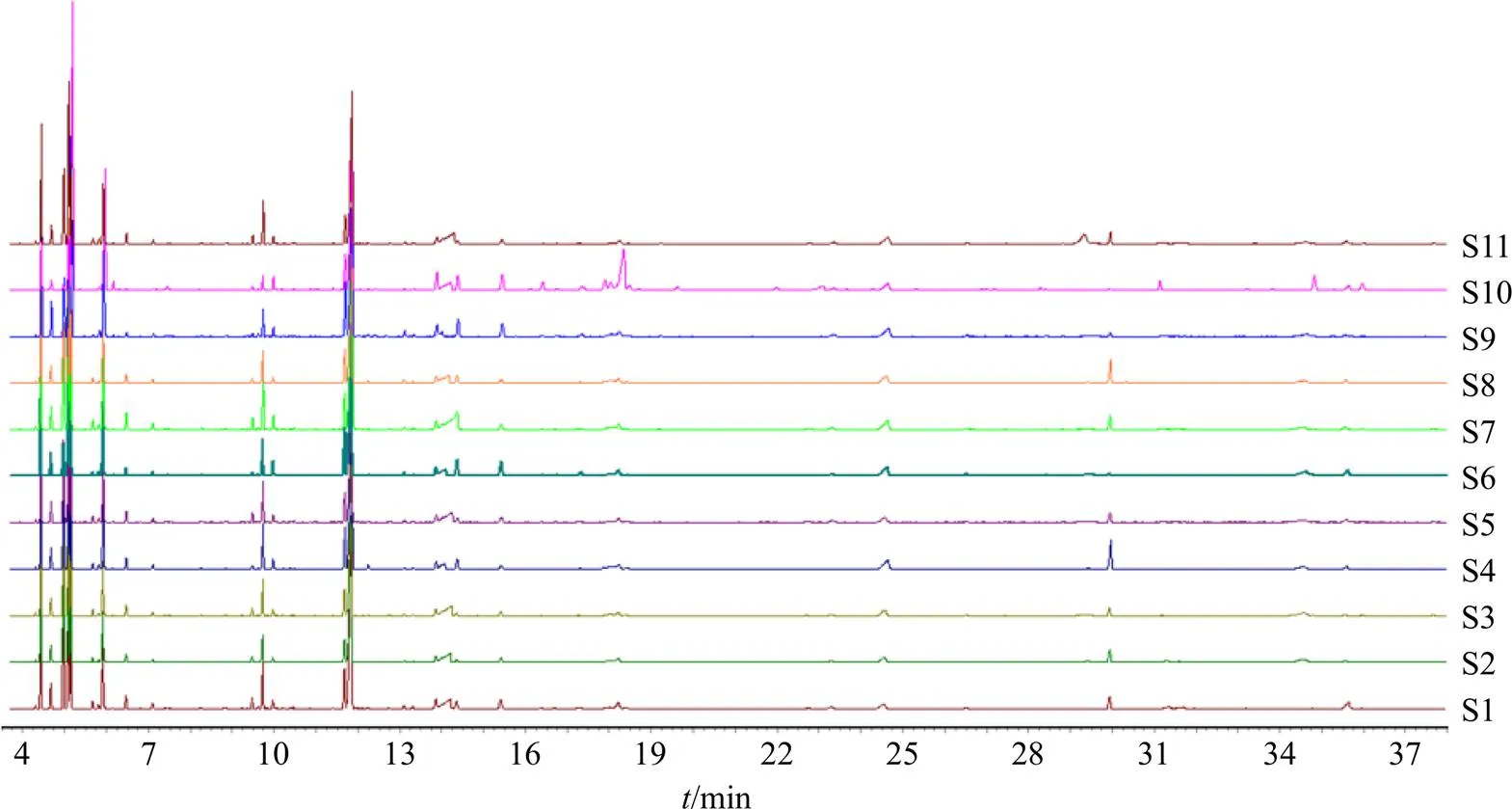
图2 11批鱼腥草挥发油(S1~S11)的GC-MS指纹图谱

图3 11批次鱼腥草挥发油不同保留时间的共有峰匹配频数图
3.3.2 方法学考察 平行制备6组主体溶液及客体溶液,按“3.3.1”项下步骤操作,测得的体系热量变化值的RSD<1.3%,表明方法的重现性良好。
3.3.3 11批次鱼腥草组互滴实验 取11批次鱼腥草挥发油进行互滴,由于分子间的相互作用,挥发油中的不同成分会产生吸热或放热效应。利用等温滴定量热技术,在扣除溶剂放热的前提下,收集释放或吸收的热能,根据超分子“印迹模板”作用放热的叠加性,采用主成分分析和线性回归计算出鱼腥草注射剂的挥发油可形成超分子的成分簇。每组滴定10次,记录每次产生的热量变化值,总热量变化值见表2。
3.3.4 11批鱼腥草挥发油互滴结果 11个批次的鱼腥草注射液挥发油相互滴定的结果如表2所示,为扣除滴定液与样品池中溶媒(混合溶剂)相互作用产生的热量,分别测定了11个批次的鱼腥草注射液挥发油与溶剂的滴定反应,扣除背景信息后,对滴定峰进行积分,得到互滴热值叠加变化值如表2所示。由表2可知,11个批次的鱼腥草注射液挥发油互滴的过程有10个批次为明显的放热过程,指示鱼腥草注射剂挥发油成分间发生了明确的放热反应,可以证实鱼腥草注射剂挥发油中分子之间发生了物理化学反应。各批次放热程度及大小均不相同,说明不同批次的鱼腥草注射剂挥发油中与放热相关性较大的成分簇含量可能不同,反应程度不同,对放热量的贡献度也不同,可以确定的是导致鱼腥草注射剂(类)过敏反应的超分子结构成分簇在每个批次中均存在。
这些成分簇很可能是发生自识别、自复制、自组装而形成超分子结构的成分簇,但如何筛选出反应放热的关键成分簇,即鱼腥草注射剂挥发油致敏性的关键成分簇是重中之重。
3.3.5 鱼腥草注射剂挥发油滴定0.17% T80组 取鱼腥草主体挥发油滴定0.17% T80样品溶液,根据滴定过程的能量变化值绘制出变化折线图,结果见图4。
3.3.6 鱼腥草注射剂挥发油滴定T80溶液实验结果 用鱼腥草挥发油滴定0.17%的T80溶液的热量变化曲线见图4。据图4可知,鱼腥草挥发油与T80可以产生相互作用,两者发生的反应是一个放热反应。客体(鱼腥草挥发油)每次滴加量中含有2 μL的鱼腥草挥发油溶液,反应在前6次滴定(挥发油加入量为0~12 μL时)放热量逐渐增大,根据分子结构推测放热量逐渐增大原因为稀释热、氢键及T80上羟基的未共用电子对与挥发油中含有电负性的不饱和键的成分之间产生电子能转移而产生的热量递增;在滴定第7~12次(挥发油加入量为14~24 μL),放热量逐渐从峰值减小至恒定值,因为此时T80未共用电子对和挥发油中的结合位点逐渐趋于饱和,贡献的热量值逐渐减少,产生的热量以稀释热及氢键生成热为主;滴定12次以后(挥发油加入量大于24 μL时),T80胶团(主体分子)的键合位点完全被挥发油(客体分子)所结合而达到饱和状态,热效应也逐渐减小,此时再滴加挥发油,放热量基本恒定,产生热量主要为稀释热。此时说明T80已形成临界超分子浓度胶团即达到增溶所需的浓度。当鱼腥草浓度达到或超过20 μL时,该体系的临界超分子浓度达到稳定,鱼腥草注射剂的挥发油成分被T80增溶后形成超分子结构(胶束),挥发油成分分散其内,镶嵌其中,吸附其外。这样的超分子结构增加了鱼腥草注射剂挥发油的表观相对分子质量和决定簇,增强了表观免疫原性而产生免疫毒性。由上述分析可推知,T80与鱼腥草挥发油所形成的超分子结构与鱼腥草注射剂的致敏性密切相关。
表1 11批鱼腥草挥发油“印迹模板”成分簇划分后新指纹图谱的保留时间和峰面积
Table 1 Retention time and peak area of new fingerprint of 11 batches of volatile oil of H. cordata after “imprinting template” component cluster division
峰号tR/min峰面积 S1S2S3S4S5S6S7S8S9S10S11 14.2661.51×1061.15×1061.18×1061.32×1061.24×1061.37×1061.50×1061.15×1061.97×1064.91×1051.23×106 24.6832.72×1051.92×1051.91×1052.26×1052.17×1052.38×1052.43×1051.94×1053.67×1051.31×1051.96×105 34.9561.21×1061.03×1069.49×1059.50×1051.04×1064.05×1051.20×1068.79×1058.01×1057.13×1048.86×105 45.0992.66×1061.94×1062.03×1062.51×1062.20×1062.41×1062.81×1062.21×1063.60×1067.96×1052.15×106 55.2201.15×1067.46×1057.76×1051.02×1068.67×1051.23×1061.18×1069.13×1051.76×1065.71×1068.11×105 65.5989.26×1047.21×1047.08×1049.58×1049.18×1044.74×1041.27×1057.34×1042.02×1042.39×1046.95×104 75.8791.08×1067.24×1057.72×1051.16×1069.01×1051.12×1061.23×1069.57×1051.51×1062.28×1068.60×105 86.1941.91×1041.11×1041.18×1041.05×1041.77×1042.61×1042.88×1041.22×1042.03×1041.45×1057.89×103 96.5722.05×1051.28×1051.46×1051.69×1051.71×1051.10×1052.51×1051.35×1055.56×1041.94×1041.58×105 107.3451.24×1055.26×1041.10×1059.44×1047.67×1041.17×1051.23×1057.80×1041.03×1051.72×1059.25×104 118.4997.54×1043.39×1042.63×1047.48×1044.22×1044.28×1041.07×1052.87×1047.85×1041.08×1055.58×104 129.2792.62×1047.28×1031.12×1041.32×1042.28×1041.84×1044.41×1041.76×1043.22×1042.46×1042.27×104 139.4811.28×1058.06×1041.02×1055.98×1041.13×1056.03×1041.49×1056.02×1045.14×1044.71×1041.14×105 149.6072.66×1049.92×1032.04×1042.10×1042.45×1043.72×1043.60×1041.50×1045.10×1042.73×1041.81×104 159.7916.08×1053.33×1054.29×1055.97×1055.27×1054.69×1058.35×1054.04×1053.57×1051.92×1055.67×105 1610.0191.11×1057.46×1049.69×1041.32×1051.16×1052.12×1052.25×1058.50×1041.33×1052.25×1051.10×105 1710.5786.75×1044.60×1045.21×1046.99×1047.66×1043.72×1041.03×1054.59×1044.24×1048.20×1045.14×104 1811.4906.64×1053.67×1054.10×1056.62×1055.19×1057.93×1056.14×1055.56×1051.07×1066.05×1054.61×105 1911.9365.23×1063.45×1063.48×1064.58×1064.05×1064.32×1066.21×1064.01×1064.70×1063.77×1063.96×106 2012.3176.12×1041.56×1041.90×1048.58×1044.53×1047.44×1046.80×1049.12×1041.24×1057.81×1045.60×104 2113.0231.15×1055.84×1049.75×1041.05×1055.74×1041.06×1051.13×1051.48×1051.94×1051.11×1051.17×105 2213.8352.07×1052.31×1052.67×1054.96×1053.44×1055.46×1053.82×1053.58×1054.18×1054.26×1053.62×105 2314.4208.79×1055.68×1057.04×1052.76×1057.81×1053.42×1051.34×1065.84×1053.60×1059.25×1059.03×105 2417.2396.96×1055.24×1053.61×1057.71×1054.29×1059.16×1056.80×1055.64×1051.08×1063.67×1064.36×105 2524.1083.92×1054.04×1054.73×1058.02×1054.28×1057.33×1056.50×1055.61×1056.87×1051.07×1065.88×105 2632.7076.98×1051.02×1065.18×1051.30×1067.26×1051.05×1068.58×1051.12×1068.14×1051.28×1061.49×106
表2 11批次鱼腥草注射液挥发油互滴热量变化值
Table 2 Heat change value of volatile oil in 11 batches of HCI
样品客体主体热量变化值/μJ溶剂热值/μJ最终变化值/μJ样品客体主体热量变化值/μJ溶剂热值/μJ最终变化值/μJ 1YXC01YXC02−114.36−34.99−79.377YXC07YXC08−155.21−40.45−114.76 2YXC02YXC03−445.46−69.43−376.038YXC08YXC09−189.56−48.87−140.69 3YXC03YXC04−278.65−57.75−220.909YXC09YXC10−240.78−66.34−174.44 4YXC04YXC05−56.38−112.5656.1810YXC10YXC11−254.18−3.61−250.57 5YXC05YXC06−118.60−37.33−81.2711YXC11YXC01−491.19−75.86−415.33 6YXC06YXC07−554.83−127.97−426.86

图4 鱼腥草注射剂挥发油滴入0.17% T80的放热值曲线
3.4 谱热学方程的建立
等温微量热滴定结果验证了鱼腥草注射剂自身成分形成超分子结构的可能性,同时也证明了增溶剂T80与鱼腥草挥发油超分子体系的形成,能够从实验结果论证“中药注射剂可自主产生超分子,单成分通过自组装、自组织、自识别作用形成超分子;各成分以一定的方式分散在其内,镶嵌在其中,吸附在其外”的假说。为了进一步筛选形成超分子结构的关键化学成分,根据11个批次的鱼腥草注射剂挥发油图谱信息和鱼腥草注射剂中各成分相互结合产生热量的不同,通过多元线性回归的方法建立谱热学方程。
由于中药化学成分受到遗传、产地、加工炮制、制剂等因素的影响,使得其化学成分种类和含量存在动态多样性[30]。然而中药材化学成分呈现“印迹模板”稳定性和随株随域随法变化的规律,可基于“印迹模板”成分簇构建的谱热学模型进行成分的印迹性分析[21]。回归系数反映一个变量对因变量的响应值,回归系数越大,代表这个变量内的值变化更容易被检测到,说明这个“印迹模板”成分簇的成分种类含量较大或反应强度较大,而回归系数标准差可表征出“印迹模板”成分簇中化学成分的变异程度。当回归系数与成分簇总峰面积联系起来时,体现出成分簇的药效属性大小[31],即该成分簇的作用量大小,因此回归系数与总峰面积(即AUCT)的乘积可表示该“印迹模板”成分簇对挥发油超分子体系印迹量的占比,可表征出成分簇的印迹作用大小。而回归系数的正负代表“印迹模板”成分簇对挥发油超分子体系中“印迹模板”成分变化的作用方向,可表征其对放热量的贡献,而作用量的标准差可以表征成分簇的热值变化的上下限。
所有数据采用Excel收集,将数据导入SPSS 26.0软件,为增加回归方程的准确度及相关性,因每批次鱼腥草所对应的放热量有10组,共计110组放热量数值,以放热量作为因变量,26个“印迹模板”成分簇总峰面积参数作为自变量,进行线性回归,通过回归分析可排除16个相关性小的变量:V1、V3、V4、V5、V6、V7、V8、V9、V11、V12、V13、V14、V16、V18、V24、V25,保留10个相关性大的变量:V2、V10、V15、V17、V19、V20、V21、V22、V23、V26,依此建立鱼腥草挥发油的谱热学方程:=24.199-1.12×10−4A2+5.93×10−6A10+7.58×10−5A15+9.32×10−4A17-1.14×10−5A19+4.97×10−4A20+5.26×10−5A21-1.16×10−4A22-5.66×10−5A23-2.08×10−5A26,=0.958,<0.001。
对回归方程中的10个“印迹模板”成分簇的回归系数、回归系数与总峰面积乘积和回归系数的正负进行排序,结果见表3。由表可知,“印迹模板”成分簇17的成分种类或含量变化最大,“印迹模板”成分簇10变化最小;“印迹模板”成分簇17在鱼腥草挥发油化学多成分体系的“印迹模板”作用最大,“印迹模板”成分簇10作用最小;在鱼腥草挥发油化学多成分体系中,“印迹模板”19、22、23、2、26可能是减少鱼腥草挥发油放热量的成分簇,而“印迹模板”成分簇17、15、20、21、10可能是促进鱼腥草挥发油放热量增加的“印迹模板”成分簇。
通过关键成分簇信息与GC-MS成分分析结果,筛选出鱼腥草注射剂中疑似超分子结构的成分,共17种成分,其名称、拓扑指数如表4所示。
分子连接性指数(molecular connectivity,MCI)可以将分子进行量化描述(如大小、分支、环、不饱和度、杂原子等)[32],有大量实验证明该指数与分子的理化性质[33](沸点、水溶性、油水分配系数、液体密度、溶解度等)及生物活性效应[34-35](麻醉活性、酶抑制活性、抗菌活性、毒性等)密切相关。MCI接近在一定程度上可以反映化合物结构存在一定的相似性(如相同的官能团、分子构象等),发生自身聚合的概率更高,这与形成超分子结构的自识别、自组装、自复制的特点吻合,结合这17种成分的化学结构来看,大多都含有碳碳不饱和键或杂原子即结构中均有未共用电子对,这为许多反应的发生建立了化学结构基础,如与T80产生氢键的结合、或因碳碳双键的存在而发生聚合,从物质结构方面说明这17种相关性大的挥发油成分可能发生聚合或分子之间的结合而形成超分子结构。但因MCI也存在一定的不足,如分子连接性和电子参数间有无内在关系并未予以解释,只能表达分子的二维平面拓扑结构信息,不能表征分子的立体结构和电子结构信息以及与免疫靶点的结合形成的超分子结构。
表3 10个“印迹模板”成分簇的贡献率、回归系数、作用量及标准差
Table 3 Contribution rate, regression coefficient, action amount and standard deviation of 10 “imprinting template” component clusters
成分簇序号作用量/%贡献率/%累积贡献率/%回归系数回归系数标准差作用量标准差 1757.09017.09517.0909.316×10−46.06×10−53.715 19−49.44014.80331.900−1.139×10−52.14×10−69.310 22−42.51012.73044.630−1.158×10−49.29×10−63.409 23−39.37011.78956.420−5.656×10−53.60×10−62.503 1536.65010.97367.3907.581×10−57.55×10−63.648 2032.4709.72377.1104.972×10−46.62×10−54.321 2−25.2307.55384.670−1.124×10−41.99×10−54.464 26−20.5506.15290.820−2.077×10−52.57×10−62.544 215.8521.75292.5705.264×10−54.16×10−54.623 100.6160.18492.7505.929×10−62.72×10−52.820 B (常数)24.2007.246100.00024.2006.7536.753
表4 17种形成超分子结构的可疑成分及其分子连接性指数
Table 4 Seventeen suspicious components, structures and MCI for supramolecular structures
编号英文名称中文名称零阶一阶二阶 1camphene樟烯6.9834.3144.454 2β-myrceneβ-月桂烯6.9833.6012.683 34-methyl-3-(1-methylethylidene)-cyclohexene4-甲基-3-(1-甲基乙叉基)-环己烯7.1464.0553.336 43-(4-methyl-3-pentenyl)-furan3-(4-甲基-3-戊烯基)-呋喃7.5934.1943.148 53,7-dimethyl-1,6-octadien-3-ol3,7-二甲基-2,6-辛二烯-3-醇7.7233.9713.381 64-methyl-1-(1-methylethyl)-3-cyclohexen-1-ol4-甲基-1-(1-甲基乙基基)-3-环己烯-1-醇7.7234.4254.013 71-cyclohexyl-2-propen-1-ol1-环己基-2-丙烯-1-醇6.4224.1503.124 8(1R-cis)-1-(1,2,2,3-tetramethylcyclopentyl)-ethanone1R-1-(1.2.2.3-四甲基环戊基)乙酮8.9004.8325.050 9cis-bicyclo[4.3.0]-3-nonen-8-one顺式双环[4.3.0]-3-壬烯-8-酮6.0464.0273.410 102-undecanone2-十一酮8.5655.2653.573 11tricyclo[5.2.1.0(1,5)]decane-8,9-diol三环[5.2.1.0(1,5)]癸烷-8,9-二醇7.2395.1014.958 124-(1-methylethyl)-benzenemethanol4-(1-甲基乙基)苯甲醇7.0413.9353.054 13α,α,4-trimethyl-3-cyclohexene-1-methanol acetateα,α,4-三甲基-3环己烯-1-甲醇乙酸酯9.5935.2684.719 14trans-2-pinanol反式-2-频哪醇7.7234.6685.202 15(E)-3,7-dimethyl-2,6-octadien-1-ol acetate香叶醇乙酸酯9.5934.9443.673 16n-decanoic acid癸酸8.0124.9883.265 17tetrahydro-4-hydroxy-6-pentyl-2H-pyran-2-one2H-吡喃-2-酮四氢-4-羟基-6-戊基8.1615.0963.701
4 讨论
传统方法来评价中药注射剂用药的安全性,会将中药的单成分个体独立看待而失去了对中药注射剂中超分子结构特征的整体把握,忽视隐藏在中药中独有的多成分致敏反应机制。中药注射剂和化学药物不同,成分构成较为复杂,不同批次之间成分种类和含量也存在差异,若按常见的化学药物模式将中药注射剂发生过敏反应看作单一成分的结果,将难以明确中药注射剂过敏反应发生的真正机制。鱼腥草注射剂中总挥发油、增溶剂T80以及体内代谢产物本身或相互形成稳定态的超分子物质产生的免疫毒性很可能就是引起类过敏反应的根本原因,其(类)致敏性的强度取决于超分子结构的强度,如超分子大小、表面积及鱼腥草挥发油成分基团在表面的分布情况都有影响。
超分子的结构单元在弱键(氢键作用力、静电引力、π-π堆积等)驱动下,自发聚集形成纳米尺度的超分子体,同时与单体的分布、吸收、代谢等特性都有所区别[36-38]。已有实验利用动态光散射法、扫描电子显微镜等多种技术联合,证实了超分子结构的形成影响药物在体内的溶解、释放、吸收的过程[39]。此外,也有实验研究表明中药成分形成的超分子颗粒可以提高药效活性[39]或降低毒性[40];还发现天然小分子构象的差异也影响超分子的结构进而影响生理活性。这些实验结论都证明了“化学结构-超分子形态-生物活性”三者存在着相关性[41]。
因此,本研究基于超分子“印迹模板”理论,从鱼腥草注射剂的超分子结构特征研究出发,根据超分子“印迹模板”作用放热的叠加性原理,联合等温微量热滴定和GC-MS技术,建立谱热学研究方法,由相关性高的超分子“印迹模板”成分簇中筛选出鱼腥草注射剂中最有可能形成超分子结构的可疑成分,推测出鱼腥草注射剂中的可能致敏性成分群,旨在从超分子作用层面来阐明鱼腥草注射剂的致敏性成分,为提高中药注射剂临床使用的安全性并为中药制剂的质量控制以及工艺优化提供参考。本研究从11批鱼腥草注射剂挥发油中筛选得出10个关键成分簇,从中初步筛选得到17个可能形成超分子结构的可疑成分,大多都含有碳碳不饱和键或杂原子即结构中均有未共用电子对,这就为超分子的形成提供了结构基础。但本实验是基于鱼腥草挥发油整体成分进行的筛选和推测,对于鱼腥草挥发油进行关键成分簇分离后是否会产生相应的(类)过敏反应,以及单成分与成分形成的超分子结构产生(类)过敏的差异还需进一步的药理毒理实验验证。
利益冲突 所有作者均声明不存在利益冲突
[1] 文雯, 梁慧慧, 余格, 等. 中药注射剂类过敏反应研究进展 [J]. 湖南中医药大学学报, 2020, 40(1): 117-122.
[2] 易艳, 李春英, 赵雍, 等. 中药注射剂不良反应及类过敏反应研究进展 [J]. 中国中药杂志, 2021, 46(7): 1711-1716.
[3] Zheng W W, Wu Y Y, Gao H L,. Traditional Chinese medicine injections: Where we are after 80-year development [J]., 2022, 17(1): 127.
[4] 张雨恬, 王韧, 李文姣, 等. 中药注射剂(类)致敏成分检测技术进展 [J]. 中南药学, 2017, 15(9): 1185-1190.
[5] 姜垦, 田其健, 包旭宏, 等. 中药注射剂不良反应分析与思考 [J]. 中国现代医药杂志, 2021, 23(4): 93-98.
[6] Wu Z, Deng X Y, Hu Q C,.Thunb.: An ethnopharmacological review [J]., 2021, 12: 714694.
[7] 黄南龙, 黄焕明, 张碧玉, 等. 中药鱼腥草的药理作用、临床应用及不良反应概述 [J]. 福建中医药, 2021, 52(3): 58-60.
[8] 王丹, 史宏硕, 王宗浩, 等. 6种清热解毒类中药注射液治疗儿童毛细支气管炎的贝叶斯网状Meta分析 [J]. 药物评价研究, 2023, 46(2): 430-444.
[9] 彭国平, 李存玉. 中药注射剂安全性的分析与思考 [J]. 南京中医药大学学报, 2019, 35(6): 744-751.
[10] 曹琳洁. 鱼腥草注射液临床应用及不良反应分析 [J]. 亚太传统医药, 2016, 12(8): 140-141.
[11] Wang L, Cui X H, Cheng L,. Adverse events toinjection: A systematic review [J]., 2010, 3(3): 168-176.
[12] Lehn J M. Supramolecular chemistry: Receptors, catalysts, and carriers [J]., 1985, 227(4689): 849-856.
[13] Geue N, Winpenny R E P, Barran P E. Structural characterisation methods for supramolecular chemistry that go beyond crystallography [J]., 2022, 51(1): 8-27.
[14] Mali K S, Pearce N, De Feyter S,. Frontiers of supramolecular chemistry at solid surfaces [J]., 2017, 46(9): 2520-2542.
[15] Mattia E, Otto S. Supramolecular systems chemistry [J]., 2015, 10(2): 111-119.
[16] 潘雪, 樊启猛, 余格, 等. 基于超分子“印迹模板”特性的中药质量标志物研究模式的思考 [J]. 中草药, 2019, 50(19): 4569-4575.
[17] Yu Z R, Xu Z G, Li H,. Recognition and neutralization of angiotensins I and II using an artificial nanogel receptor fabricated by ligand specificity determinant imprinting [J]., 2014, 50(21): 2728-2731.
[18] Lehn J M. Supramolecular chemistry: Where from? Where to? [J]., 2017, 46(9): 2378-2379.
[19] 贺福元, 贺红, 周逸群, 等. 中药注射剂超分子“印迹模板”特征对其(类)致敏性影响的探讨 [J]. 中国中药杂志, 2016, 41(2): 345-349.
[20] 陈定芳, 李文姣, 田丽, 等. 基于超分子“印迹模板”整合成成分簇的龙牙百合谱量学研究 [J]. 湖南中医药大学学报, 2022, 42(8): 1247-1254.
[21] 李文姣, 肖美凤, 李海英, 等. 中药超分子“印迹模板”作用对成分簇动态性与稳态性变化规律的理论研究 [J]. 中草药, 2023, 54(8): 2659-2667.
[22] 李海英, 潘雪, 王敏存, 等. 基于超分子“气析”理论定量整合与验证中药成分及靶点群 [J]. 中国实验方剂学杂志, 2021, 27(21): 207-213.
[23] 贺福元, 周宏灏, 邓凯文, 等. 指纹图谱的一种定性定量研究新方法: 总量统计矩分析法 [J]. 药学学报, 2008, 43(2): 195-201.
[24] 李世雄, 赵思宇, 李源, 等. 中药复方配伍理论下生血宝复方化学成分溶出规律研究 [J]. 中草药, 2022, 53(14): 4298-4306.
[25] Wang H, Li T, Xiang H J,. Origin and formation mechanism investigation of compound precipitation from the traditional Chinese prescription Huang-Lian-Jie-Du-Tang by isothermal titration calorimetry [J]., 2017, 22(9): 1456.
[26] Hoffmann C, Blume A, Miller I,. Insights into protein-polysorbate interactions analysed by means of isothermal titration and differential scanning calorimetry [J]., 2009, 38(5): 557-568.
[27] 余丹丹, 邬瑞光. 等温滴定量热技术在药物研究中的应用 [J]. 中草药, 2018, 49(22): 5463-5467.
[28] Rabbani G, Baig M H, Lee E J,. Biophysical study on the interaction between eperisone hydrochloride and human serum albumin using spectroscopic, calorimetric, and molecular docking analyses [J]., 2017, 14(5): 1656-1665.
[29] 肖美凤, 张雨恬, 杨岩涛, 等. 基于鱼腥草挥发性成分动态性的中药制剂“印迹模板”一致性分析 [J]. 中国实验方剂学杂志, 2019, 25(14): 150-155.
[30] 贺鹏, 李海英, 樊启猛, 等. 基于超分子理论探索古代经典名方的质量控制模式 [J]. 中国实验方剂学杂志, 2019, 25(16): 161-166.
[31] 毛超一. 基于成分-药效关联的中药菊花质量标准与评价研究 [D]. 北京: 中国中医科学院, 2020.
[32] Estrada E. Physicochemical interpretation of molecular connectivity indices [J]., 2002, 106(39): 9085-9091.
[33] Nowell I W. Molecular connectivity in structure activity analysis [M].1986: 2.
[34] Gupta S, Singh M, Madan A K. Application of graph theory: Relationship of eccentric connectivity index and Wiener’s index with anti-inflammatory activity [J]., 2002, 266(2): 259-268.
[35] Gozalbes R, Gálvez J, Moreno A,. Discovery of new antimalarial compounds by use of molecular connectivity techniques [J]., 1999, 51(2): 111-117.
[36] Hu J, Wu Z S, Yan J J,. A promising approach for understanding the mechanism of traditional Chinese medicine by the aggregation morphology [J]., 2009, 123(2): 267-274.
[37] 张小兵, 李敏. 基于横向分子间氢键的棒-线型分子自组装研究进展 [J]. 有机化学, 2009, 29(4): 528-535.
[38] Zhi K K, Wang J C, Zhao H T,. Self-assembled small molecule natural product gel for drug delivery: A breakthrough in new application of small molecule natural products [J]., 2020, 10(5): 913-927.
[39] 李文, 王志家, 林晓钰, 等. 基于弱键诱导的超分子体系探讨甘草和合黄连“性-味-效”物质基础 [J]. 药学学报, 2022, 57(6): 1901-1908.
[40] Wang P L, Guo W B, Huang G R,. Berberine-based heterogeneous linear supramolecules neutralized the acute nephrotoxicity of aristolochic acid by the self-assembly strategy [J]., 2021, 13(28): 32729-32742.
[41] 刘小靖, 李桐, 袁枝花, 等. 基于弱键诱导的小檗碱-黄酮苷类超分子“结构-构象-形态-活性”传导关系探讨中药配伍理论科学内涵 [J]. 中草药, 2022, 53(22): 7001-7009.
Supramolecular structure characteristics of allergens inInjection based on isothermal titration calorimetry
LIU Xiang1, 2, WANG Yu-chai1, 2, ZHANG Yu-tian1, 2, TIAN Li1, 2, QIAO Ru1, 2, ZHANG Wei-long1, 2, HE Fu-yuan1, 2, 3, 4, LIU Ping-an5
1. College of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China 2. Hunan Key Laboratory of Druggability and Preparation Modification of TCM, Changsha 410208, China 3. Laboratory of Supramolecular Mechanism and Mathematic-Physics Characterization for Traditional Chinese Medicine, Hunan University of Chinese Medicine, Changsha 410208, China 4. Key Laboratory of Property and Pharmacodynamics of Traditional Chinese Medicine, National Administration of Traditional Chinese Medicine, Changsha 410208, China 5. Hunan Academy of Traditional Chinese Medicine, Changsha 410006, China
Based on the distribution characteristics of supramolecular “imprinting template”, the fingerprint component clusters ofInjection (HCI, 鱼腥草注射剂) were divided, and the suspicious components forming supramolecular structure in HCI were discussed by spectral thermal study.The fingerprints of 11 batches of HCI were established by GC-MS method. The “imprinting template” component clusters were divided by matching frequency method and segment total statistical moment method, and a new fingerprint was constructed. The heat release of mutual titration of volatile oil components in 11 batches of HCI was determined by isothermal microcalorimetry. According to the principle of superposition of the exothermic effect of supramolecular “imprinted template”, the linear regression of the total peak area and the self-exothermic heat of HCI was carried out. The spectral thermal equation was established and the contribution rate of component clusters was analyzed. The key component structure was screened according to the key component cluster information.The GC-MS fingerprints of 11 batches ofvolatile oil could be divided into 26 “imprinting template” component clusters, and 10 variables with high correlation were retained after linear regression of total peak area and heat: V2, V10, V15, V17, V19, V20, V21, V22, V23, V26. The regression coefficients of the 1—12 “imprinting templates” clusters were −1.12 × 10−4, 5.93 × 10−6, 7.58 × 10−5, 9.32 × 10−4, −1.14 × 10−5, 4.97 × 10−4, 5.26 × 10−5, −1.16 × 10−4, −5.66 × 10−5, −2.08 × 10−5, respectively. A total of 17 suspicious components forming supramolecular structure were screened, which were camphene, β-myrcene, 4-methyl-3-(1-methylethylidene)-cyclohexene, 3-(4-methyl-3-pentenyl)-furan, etc.Based on the theory of supramolecular “imprinting template”, the matching frequency method was used to classify the volatile oil of HCI. The contribution and ranking of each component cluster to the exothermic value were obtained by linear regression, and the key components forming the supramolecular structure were obtained, which provided a direction for the subsequent research on the sensitization of HCI (class).
isothermal titration calorimetry;Thunb.; imprinting templates; spectral thermography; component clusters; supramolecular structure; camphene; β-myrcene; 4-methyl-3-(1-methylethylidene)-cyclohexene; 3-(4-methyl-3-pentenyl)-furan
R283.6
A
0253 - 2670(2023)17 - 5530 - 11
10.7501/j.issn.0253-2670.2023.17.007
2023-03-19
国家自然科学基金资助项目(81874507);湖南省科技创新重点研发项目(2022SK2014);湖南中医药大学研究生创新项目(2022CX83)
刘 湘,在读硕士,主要从事中药药理学、中药药剂学、中医药超分子与数理特征化研究。E-mail: 2519768007@ qq.com
贺福元,教授,博士生导师,主要从事中药药理学、中药药剂学、中医药超分子与数理特征的研究。E-mail: pharmsharking@163.com
刘平安,教授,硕士生导师,主要从事中药药剂学研究。E-mail: 723679086@qq.com
#共同第一作者:王玉钗,硕士研究生,研究方向为中医药超分子与数理化特征研究。Email:2680733940@qq.com
[责任编辑 郑礼胜]
