卵巢透明细胞癌和卵巢子宫内膜样癌患者的临床特症及预后分析*
2023-09-01奚晓雪曹天越钱永红王慧玲居颂文侯顺玉
奚晓雪,沈 晨,陈 婷,曹天越,钱永红,王慧玲,居颂文,侯顺玉△
(1.南京医科大学附属苏州医院/苏州市立医院妇产科,江苏苏州 215002;2.南京医科大学姑苏学院,南京 211166;3.苏州市中医医院妇产科,江苏苏州 215003;4.南京医科大学附属苏州医院中心实验室,江苏苏州 215128)
卵巢恶性肿瘤早期病变不易发现,且缺乏有效治疗手段,其病死率居妇科恶性肿瘤首位。卵巢肿瘤成分复杂,类型不同,组织学结构和生物学行为存在很大差异。卵巢上皮性癌(epithelial ovarian carcinoma,EOC)是最常见的组织学类型,占90%及以上[1]。EOC由5种主要的组织学亚型组成,包括高级别浆液性(70%~80%)、透明细胞样(10%)、子宫内膜样(10%)、黏液性(3%)和低级别浆液性肿瘤(<5%)[2-5]。其中卵巢透明细胞癌(ovarian clear cell carcinoma,OCCC)和卵巢子宫内膜样癌(ovarian endometrioid carcinoma,OEC)分别占EOC的10%~15%及10%[6],并且是子宫内膜异位症相关性卵巢癌(endometriosis-associated ovarian carcinoma,EAOC)的主要病理类型[7]。
根据临床行为和遗传分子特征,EOC又可以分为两种类型:Ⅰ型包括OCCC、OEC和黏液性癌,通常遗传稳定,临床病情进展相对缓慢;Ⅱ型主要为高级别浆液性癌(high-grade serous carcinoma,HGSC),具有更不可控的细胞周期紊乱,侵袭性更强[8]。HGSC发病率较高,是最常见的EOC(约占70%),其相关临床特征、分子及基因图谱研究较多[2]。而目前OCCC或OEC的相关研究较少,本研究通过回顾性分析OCCC和OEC患者的临床资料,探讨二者的临床及预后特征。
1 资料与方法
1.1 一般资料
收集2013年1月1日至2018年8月31日于南京医科大学附属苏州医院首次手术治疗并根据病理诊断为OCCC或OEC的患者临床资料,选取其中临床信息完整且全程随访的156例患者为研究对象,其中61例OCCC患者(OCCC组)和95例OEC患者(OEC组)。
1.2 方法
收集以下患者信息:(1)患者一般资料,如年龄、体重指数(BMI)、孕次、产次、是否伴有痛经、是否绝经、人工流产或清宫次数、剖宫产史、输卵管结扎史及疾病史(包括乳腺癌史、高血压史、糖尿病史)等;(2)患者术前辅助检查,如血清糖类抗原125(carbohydrate antigen 125,CA125)和人附睾蛋白4(human epididymis protein 4,HE4);(3)患者手术及术后随访信息,如肿瘤最大径、侧别、有无合并腹水、有无盆腔粘连、有无淋巴结转移、国际妇产科联盟(Intemational Federation of Gynecology and Obstetrics,FIGO)手术病理分期、肿瘤分化程度、有无合并子宫内膜异位症、有无合并子宫内膜病变、有无合并子宫肌瘤、有无化疗和有无化疗耐药,以及死亡和生存情况。随访时间至2022年8月31日。总生存期(overall survival,OS)为患者从接受初次手术治疗到死亡或最后一次随访的时间。化疗耐药指末次化疗结束后6个月以内出现肿瘤进展或复发。
1.3 统计学处理
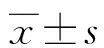
2 结 果
2.1 两组患者的一般信息及临床病理特征
OCCC组平均年龄(59.13±13.21)岁,高于OEC组的(51.08±14.60)岁,差异有统计学意义(P<0.05);OCCC组绝经患者占比较OEC组高,差异有统计学意义(P<0.05);两组BMI、痛经、孕(产)次、人工流产或清宫次数、剖宫产史、输卵管结扎史、乳腺癌史、高血压史及糖尿病史情况比较,差异均无统计学意义(P>0.05);两组血清CA125、HE4水平比较,差异均无统计学意义(P>0.05);OCCC组合并腹水及有淋巴结转移患者占比明显高于OEC组(P<0.05);两组FIGO分期、FIGO分期早期或晚期及分化程度分布比较,差异均有统计学意义(P<0.05);OEC组合并子宫肌瘤患者占比较OCCC组高,差异有统计学意义(P<0.05);两组肿瘤最大径、肿瘤侧别、盆腔粘连、合并子宫内膜异位症、合并子宫内膜病变、化疗及化疗耐药情况比较,差异均无统计学意义(P>0.05),见表1。
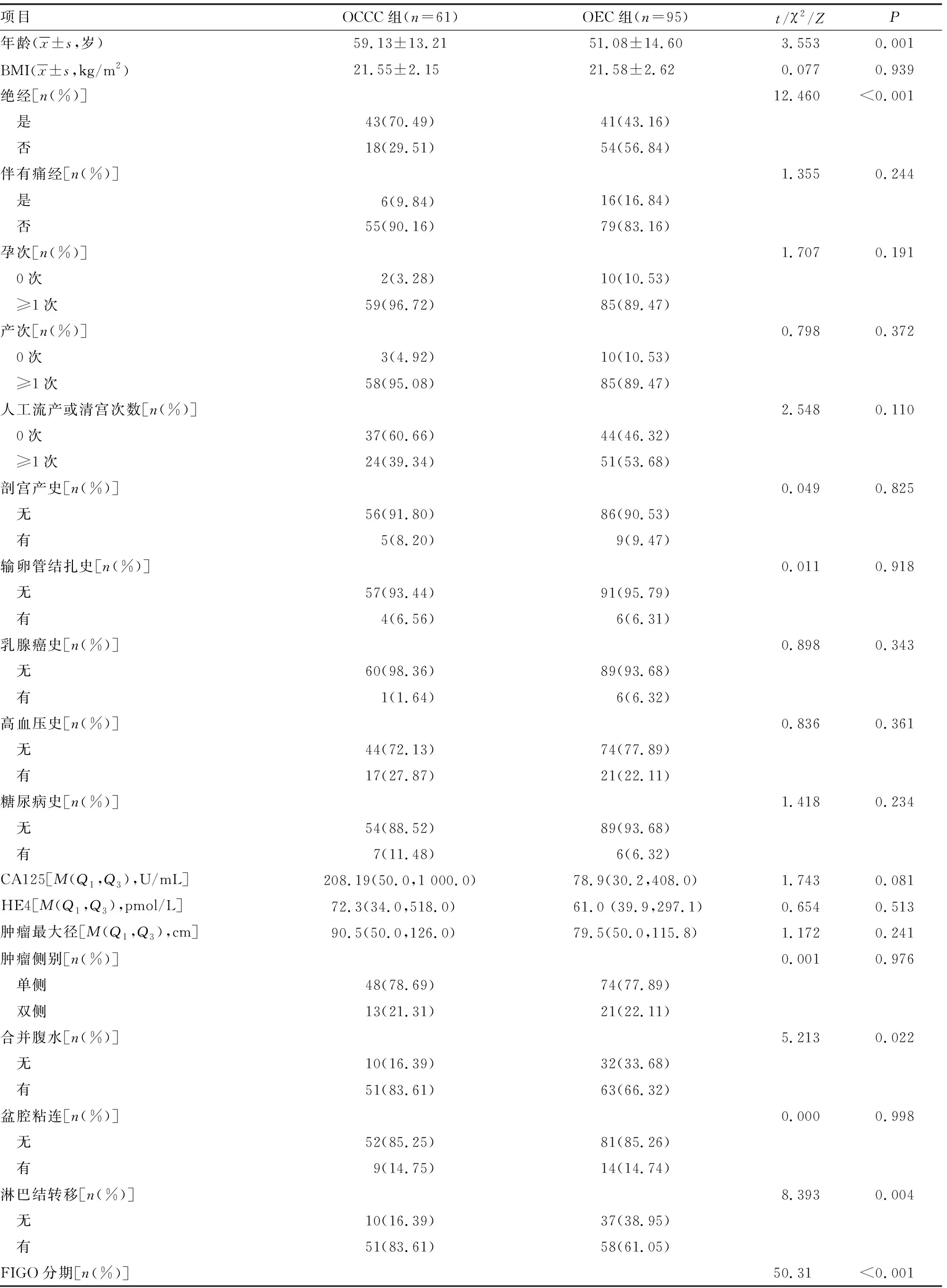
表1 两组患者的一般信息及临床特征比较
2.2 两组患者OS比较
156例患者术后中位随访时间为28.5个月,末次随访时确认为生存状态的患者98例(62.82%),肿瘤导致死亡者58例(37.18%)。OCCC组死亡患者占47.54%(29/61),OEC组占30.53%(29/95)。OCCC组与OEC组的中位OS分别为28.4、37.9个月,差异有统计学意义(χ2=4.443,P=0.035)。生存曲线见图1。
2.3 卵巢癌患者OS影响因素的单因素和多因素分析
由于患者年龄、BMI、血清CA125、HE4水平及肿瘤最大径为连续变量,根据患者OS绘制ROC曲线,得到最佳截断值:年龄为63岁(<63岁108例,≥63岁48例),BMI为21.8 kg/m2(<21.8 kg/m281例,>21.8 kg/m275例),血清CA125为107.4 U/mL(<107.4 U/mL 80例,>107.4 U/mL 76例),血清HE4为294.3 pmol/L(<294.3 pmol/L 114例,>294.3 pmol/L 42例),肿瘤最大径为10 cm(<10 cm 91例,>10 cm 65例),见图2。COX比例风险回归模型单因素分析结果显示,绝经状态、输卵管结扎史、高血压史、淋巴结转移、组织类型、FIGO分期、FIGO分期早期或晚期、分化程度、合并子宫内膜异位症、化疗及化疗耐药是OS的影响因素(P<0.05),见表2。将上述因素进一步纳入多因素分析,患者OS与合并子宫内膜异位症、FIGO分期及化疗耐药相关(P<0.05),而与绝经状态、输卵管结扎史、高血压史、淋巴结转移、肿瘤早期或晚期、分化程度及化疗均无明显相关性(P<0.05),见表3。
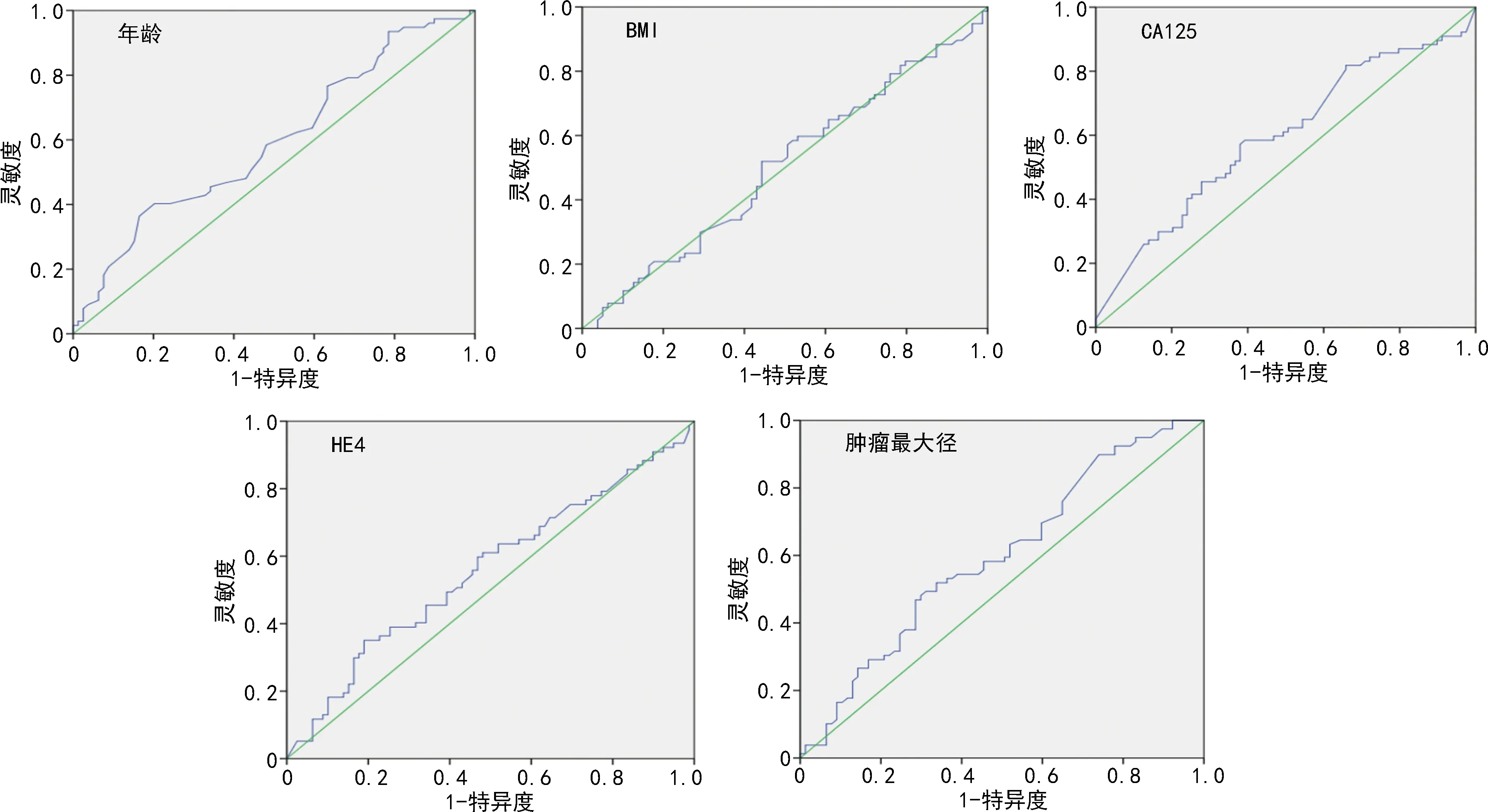
图2 年龄、BMI、CA125、HE4及肿瘤最大径的ROC曲线
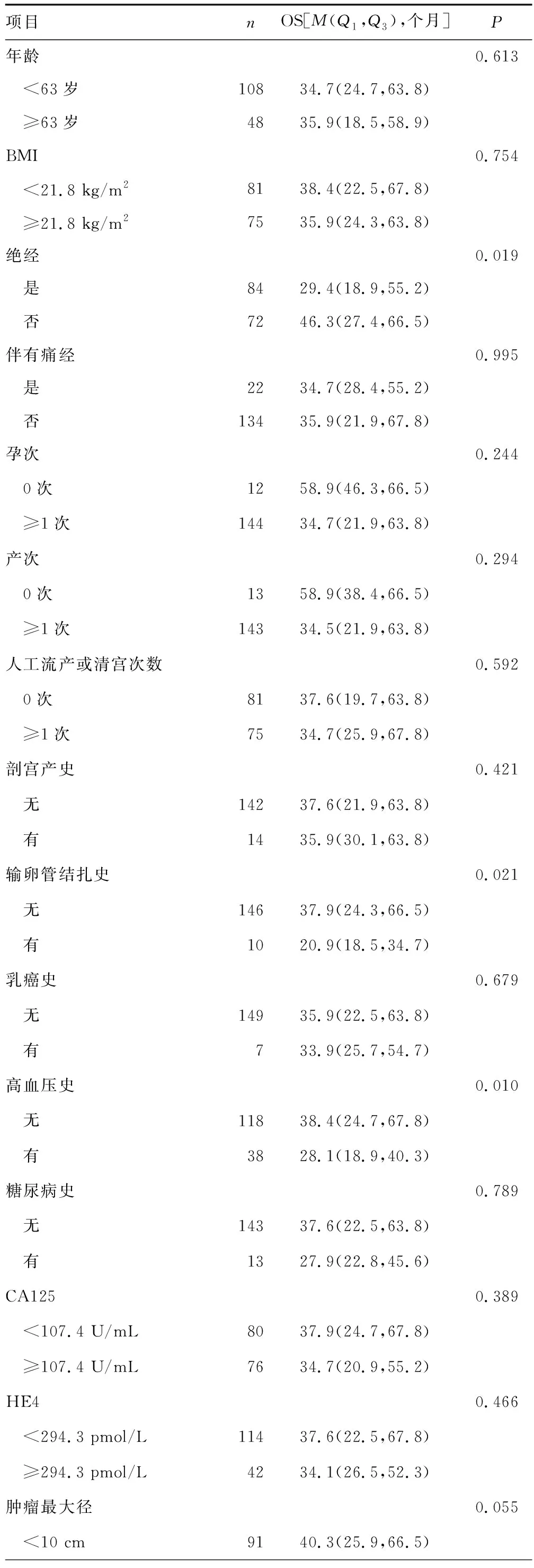
表2 卵巢癌患者OS影响因素的单因素分析
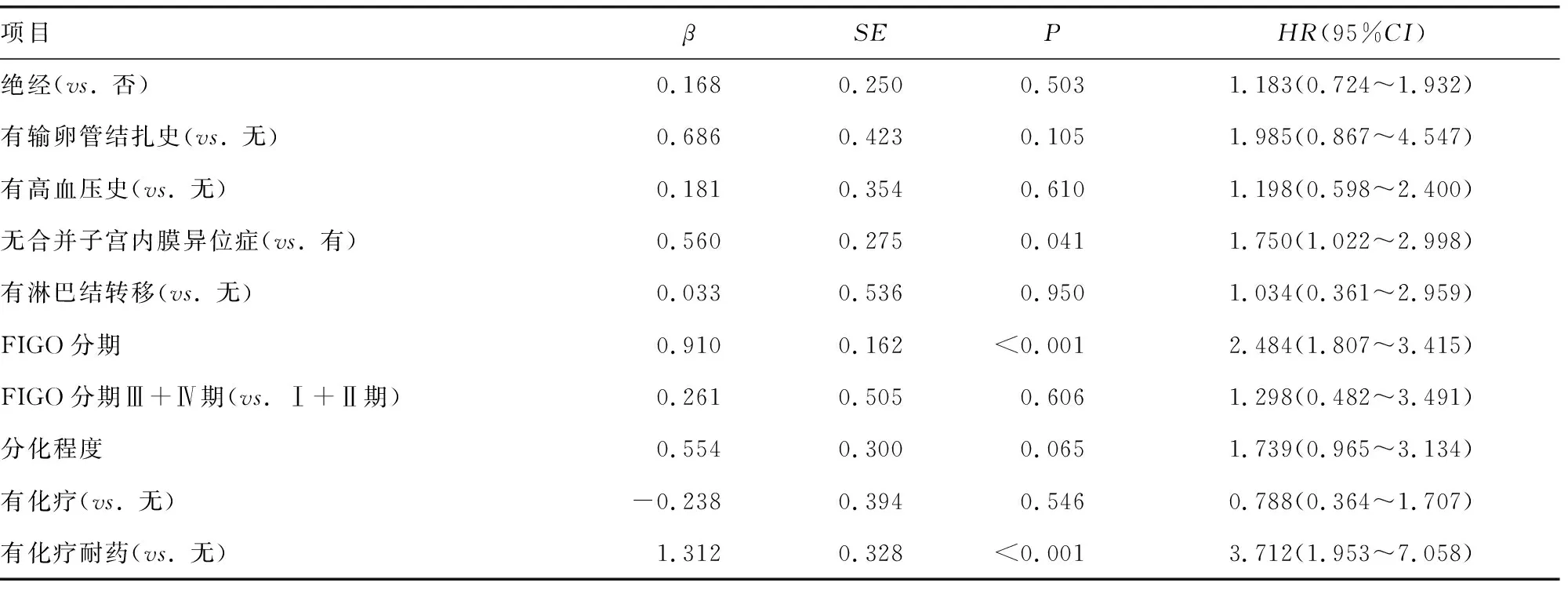
表3 卵巢癌患者OS影响因素的多因素COX回归分析
3 讨 论
3.1 OCCC和OEC的临床和预后特点
OCCC和OEC的发病年龄尚缺乏相对统一的数据,有报道称OCCC的发病年龄约在55岁,OEC的发病年龄约在54岁[9]。本研究中,OCCC患者平均年龄约为59岁,OEC患者平均年龄约为51岁,OEC患者发病年龄小于OCCC患者;OEC组绝经患者占比低于OCCC组;OEC组以FIGO分期早期(Ⅰ+Ⅱ)患者为主,OCCC组以晚期(Ⅲ+Ⅳ)患者为主,并且OCCC组合并腹水及有淋巴结转移患者占比较OEC组高。
OCCC患者OS较短,预后较OEC患者差。虽然根据临床行为和遗传分子特征将OCCC归类为Ⅰ型EOC,但多项研究表明OCCC的复发率高,易发生耐药,预后较其他EOC类型差[10]。本研究发现,卵巢癌患者预后与合并子宫内膜异位症、FIGO分期及化疗耐药有关。但合并子宫内膜异位症是否为卵巢癌预后的独立影响因素尚存在争议。有研究认为,合并子宫内膜异位症的卵巢癌(即EAOC)患者预后较好;相反,有报道称合并子宫内膜异位症与卵巢癌预后无关[6,11]。肿瘤FIGO分期及化疗耐药在大量文献中被认为是卵巢癌患者重要的预后因素[12],本研究与之相符。
3.2 OCCC和OEC的发病机制及分子生物学特征
OCCC和OEC的发病机制和分子生物学特征尚不清楚。OCCC分为原发性和继发性,部分继发性OCCC来自子宫内膜异位症恶变[13]。OCCC的发生过程可能由特定微环境诱导或受遗传/表观遗传改变和免疫因素的相互作用影响,与细胞骨架组织、染色质重塑、细胞增殖、DNA修复和细胞周期调控通路等相关。OCCC全外显子组测序显示复杂的突变图谱[14]。富含AT的交互式结构域1A( AT-rich interactive domain 1A,ARID1A)[15]、间质表皮转化因子(mesenchymal to epithelial trans factor,MET)[16],转录因子肝细胞核因子-1β(hepatocyte nuclear factor 1β,HNF-1β)[10]为子宫内膜异位症相关OCCC的突变基因。
OEC的组织起源有两种:(1)卵巢生发上皮向子宫内膜分化;(2)子宫内膜样腺癌转移而来或来自子宫内膜异位症病灶恶变[17]。OEC的特征是表观遗传变化,包括大量雌激素受体(ER)的表达,并且可能共享雌激素依赖的致癌途径[18]。OEC的发生可能与Wnt、PI3K和有丝分裂原活化蛋白激酶(MAPK)通路的突变、极外切酶区域突变、Switch/Sucrose不发酵(Switch/Sucrose nonfermentable,SWI/SNF)复合体和微卫星不稳定或DNA错配修复缺陷等有关[19]。最常见的基因突变包括钙粘着蛋白关联蛋白B1(cadherin-associated protein B1,CTNNB1)、磷脂酰肌醇3激酶催化多肽(phosphatidylinositol 3-kinase,catalytic-polypeptide,PIK3CA)、ARID1A的突变[20]。
3.3 OCCC和OEC的关系
OCCC和OEC的相关性研究有限,有报道称二者部分起源于子宫内膜上皮,含有不同程度的ARID1A突变,OCCC为40%~57%,OEC为30%[21]。尽管OCCC和OEC均是EAOC主要的病理类型[11],子宫内膜异位症相关OCCC(EAOCCC)和子宫内膜异位症相关OEC(EAOEC)存在不同的病理特征。EAOCCC多表现为局灶性、偏心性或息肉样结构,EAOEC则呈多灶性、同心性或广泛性生长模式。有研究表明,根据基因表达谱可以将子宫内膜异位症分成两个分子亚型:HNF-1β阳性(低甲基化)和阴性(高甲基化)细胞[22-23]。HNF-1β在EAOCCC中特异性上调,正向调节肿瘤细胞存活和侵袭,但在EAOEC中不表达[24]。HNF-1β阳性的EAOCCC细胞可形成局灶性、偏心性或息肉样壁结节结构。而EAOEC和雌激素依赖的致癌途径有关,ER表达上调在子宫内膜异位症、不典型子宫内膜异位症及EAOEC中普遍存在,内膜异位病变的整个区域都有致癌潜能,因此EAOEC呈现多灶性和广泛性的生长模式。
综上所述,OCCC和OEC是EOC中较为特殊的两种病理类型,与OEC患者相比,OCCC患者发现病变较晚,处于绝经状态和肿瘤晚期的患者比例较高,合并腹水和有淋巴结转移者多,OS短、预后差。合并子宫内膜异位症、FIGO分期及化疗耐药是卵巢癌预后相关影响因素。但由于本研究是回顾性研究且样本量较小,仍需要大样本、多中心研究进一步阐明OCCC和OEC的临床和预后特点。
