豆纹动脉和脑小血管病相关特征与豆纹动脉区域梗死亚型的关系研究*
2023-09-01任思勰姚海波张园园邓珍萍
任思勰,姚海波,张园园,邓珍萍,于 霞
(1.四川省成都市第二人民医院影像科 610000;2.四川省成都市妇女儿童中心医院医务部 611731;3.四川省成都市妇女儿童中心医院检验科 611731)
豆纹动脉(lenticulostriate artery,LSA)主要供应基底神经节区域的血供,对于维持大脑代谢最活跃的细胞核功能至关重要[1-3]。LSA是垂直起源于大脑中动脉(middle cerebral artery,MCA)的无侧支末梢动脉,故该供血区域更易发生血流改变,引起局部缺血导致梗死[4-5]。LSA区域梗死根据发病机制分为两类:(1)分支动脉粥样硬化疾病(branch atheromatous disease,BAD),MCA主干的斑块阻塞LSA开口,或LSA起始部微动脉粥样硬化闭塞;(2)近期腔隙性梗死(lacunar infarct,LI),由于脑小血管疾病(cerebral small vessel disease,CSVD)导致小血管远端纤维素样坏死或脂质透明样变[6-8]。由于穿支动脉解剖结构细微,基于活体研究相应区域卒中的发病机制具有挑战性。近年来,新的影像技术高分辨率血管壁成像(high resolution vessel wall magnetic resonance imaging,HRVW-MRI)有助于深入研究穿支动脉的解剖结构及梗死类型[1,3,9-10]。XIE等[1]通过评估LSA的形态学特征,认为LSA数量减少和MCA M1段斑块与基底节区LI有关。WANG等[9]研究发现,合并MCA狭窄的LSA区域梗死组的LSA平均长度减小。上述仅局限于LSA形态特征的探索研究,而以发病机制为基础的影像学特征未被纳入分析,LSA形态联合CSVD指标与LSA区域梗死亚型之间的关系也尚不明确。本文通过HRVW-MRI可视化LSA的形态并结合CSVD指标及临床资料,探讨LSA区域梗死亚型(BAD和LI)的特征及影响因素,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2020年9月至2022年6月成都市第二人民医院神经内科收治的44例LSA供血区首次单发近期梗死患者资料。纳入标准:(1)入院扩散加权成像(diffusion weighted imaging,DWI)提示LSA供血区域(半卵圆中心、侧脑室旁及基底节区层面)[11]存在首次单发近期梗死灶;(2)起病3 d内完成头部平扫、磁共振血管成像(magnetic resonance angiography,MRA)和HRVW-MRI检查;(3)MRA提示病灶侧MCA M1段未见明显狭窄或狭窄程度<50%;(4)有入院美国国立卫生研究院卒中量表(national institute of health stroke scale,NHISS)评分[12]和24 h内的生化指标。排除标准:(1)颈动脉超声或CT血管造影(CT angiography,CTA)结果提示病变侧颈内动脉狭窄≥50%;(2)病灶侧颅内外血管闭塞、夹层及血管炎等病变;(3)存在潜在的心源性栓塞因素。41例患者分为BAD组(25例)和LI组(19例),选取同期20例健康体检人群作为正常组。64例研究对象中男42例,女22例,年龄25~87岁,平均(62.30±13.79)岁。BAD组MCA M1段斑块多位于上壁。本研究通过成都市第二人民医院伦理委员会审查(批号:2021016)。
1.2 方法
1.2.1扫描协议
所有入组患者均采用3.0T(SIGNA Pioneer,美国GE Healthcare公司)设备扫描,标准头颅线圈。取仰卧位,行DWI、T2WI、T2 FLAIR 、3D-TOF MRA和HRVW-MRI CUBE T1扫描。扫描参数:(1)DWI。b值为0,1 000 s/mm2。TR/TE为3 845.0/76.8 ms,层厚5.0 mm,间距1.5 mm,层数21,FOV 240×240,总扫描时间31 s。(2)T2WI。TR/TE为5 098.0/106.2 ms,层厚5.0 mm,间距1.5 mm,层数22,FOV 240×240,总扫描时间56 s。T2 FLAIR:TR/TE为8 400/120 ms,层厚5.0 mm,间距1.5 mm,层数22,FOV 240×240,总扫描时间143 s。(3)3D-TOF MRA。TR/TE 为minimum/3.4 ms,FOV 220×220,翻转角15°,层厚1.2 mm,层数256,体素0.6 mm×0.6 mm×0.6 mm,总扫描时间173 s。(4)HRVW-MRI CUBE T1。3D CUBE T1扫描范围为全脑,冠状面覆盖,加脂肪抑制技术。TR/TE为1 200/21 ms,FOV 200×200,层厚0.6 mm,层数256,体素0.6 mm×0.6 mm×0.6 mm,扫描时间560 s。
1.2.2图像处理及指标评估
所有图像均由经验丰富的影像科医生利用GE ADW4.7工作站进行后处理及分析,15 d后再次评估,取两次测量的平均值。(1)梗死病灶特征分析。在DWI上评估病灶的最长径和累及层面,基于体积模块测量病灶的体积。在HRVW-MRI多平面重建图像(multi-planar reconstruction,MPR)上观察MCA M1段斑块的空间分布与多条LSA开口的关系,MCA M1段局限性偏心斑块位于LSA分支开口附近,归为BAD。MCA M1段未见明显斑块,且LSA开口可见,此类归为LI。 (2)LSA形态特征的评估。CUBE T1冠状位最小密度投影(coronal minimum intensity projection,Cor-Min IP)生成可视化LSA图,厚度10~20 mm。起源于MCA M1段的LSA均纳入分析,LSA形态特征包括:主干及分支的数量、总长度和平均长度。主干定义为直接起源于MCA的这部分LSA。分支定义为部分LSA主干发出的分支血管或无分支的主干(即单个血管);将LSA长度>5 mm纳入分析。当血管分支开口距离MCA起始部<5 mm时,每个主干需要单独测量计算(因为70%的分支起源共干);当血管分支开口较远时,主干的测量和计算以最长的分支为准。总长度被认为是所有LSA长度之和[11]。平均长度=总长度/分支数。 (3)CSVD相关指标的评估。血管来源的白质高信号(white matter hyperintensities,WMH)在T2WI/T2 FLAIR上表现为斑片状或大片融合状高信号[6],对深部白质和侧脑室周围的白质高信号进行Fazekas评分[13]。血管周围间隙扩大(enlarged perivascular space,EPVS)定义为T2WI/T2 FLAIR上平行于血管走向呈细线或圆形结构,与脑脊液信号类似,直径通常<3 mm[14]。腔隙灶(3~15 mm)表现为与脑脊液相似的信号,T2 FLIAR图像上环绕1圈高信号或全部高信号[15-16]。EPVS和腔隙灶的评估均在LSA供血区域评定。全脑皮层萎缩采用GCA量表进行评分[17],见图1~3。

A:TOF-MRA示右侧MCA M1段未见明显狭窄;B:血管壁CUBE T1冠状位最小密度投影示右侧MCA M1段LSA的走行,左上角显示该区域MCA的血管断面,上壁可见偏心性增厚;C:扩散加权成像示右侧侧脑室旁-基底节区急性脑梗死,病灶累及3个层面;D、E:深部白质和侧脑室周围的白质高信号,Fazekas评分均为1分。图1 1例分支动脉粥样硬化患者影像资料

A:冠状位最小密度投影示重建LSA形态;B:相应区域LSA走行图。图3 LSA示意图
1.3 统计学处理
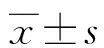
2 结 果
2.1 BAD组和LI组病灶特性比较
BAD组入院NHISS评分高于LI组,差异有统计学意义(P<0.05),见表1。

表1 BAD组和LI组的病灶特性比较
2.2 3组LSA形态特征和CSVD指标比较
3组高血压患病率、低密度脂蛋白(LDL)水平、LSA总长度和腔隙灶发生率比较,差异有统计学意义(P<0.05)。BAD组和LI组高血压患病率、LDL水平高于正常组(P<0.05);BAD组和LI组LSA总长度短于正常组,且BAD组短于LI组(P<0.05);LI组腔隙灶发生率高于BAD组和正常组(P<0.05),见表2。

表2 3组LSA形态特征及CSVD指标比较
2.3 LSA区域梗死的多因素logistic回归分析
以是否存在LSA区域梗死为因变量(0=正常组,1=BAD组,2=LI组),将单因素分析差异有统计学意义的因素纳入多因素logistic回归分析。结果显示,以正常组作为对照,LDL、LSA总长度是LSA区域梗死(BAD或LI发生)的影响因素(P<0.05);以BAD组作为对照,LSA总长度、腔隙灶是LI发生的影响因素(P<0.05),见表3。

表3 LSA区域梗死的多因素logistic回归分析
3 讨 论
本研究通过联合HRMR-VWI、DWI及T2 FLAIR技术对BAD、LI和正常组的LSA特征、CSVD相关指标进行比较,并分析其与LSA区域梗死亚型的关系,结果发现,BAD组的LSA总长度最短,LI组次之,正常组的LSA总长度最长;LI组的腔隙灶所占比例较大(52.6%)。LSA总长度越短,LDL水平越高,更容易发生LSA区域梗死(BAD或LI);LSA总长度越长,同时存在腔隙灶,更容易发生LI。联合LSA特征和CSVD指标能更全面地反映LSA区域梗死的发病机制,为该区域梗死患者的危险分层及个体化治疗提供影像学依据。
研究表明,高血压及高血脂是急性缺血性卒中的病因[18],且LDL水平与缺血性卒中发病率呈正相关[19]。在LSA区域单发梗死(BAD和LI)的患者中,作者发现高血压的比例明显高于正常组,较高的LDL水平与BAD和LI有关,与上述文献结果一致。
本研究收集了MCA无中重度狭窄的LSA区域梗死患者,发现BAD组和LI组的病灶最长径≥1.5 cm、累及层面≥3个均无统计学意义(P>0.05),表明以往研究[2,10,20]对LSA区域梗死亚型的定义并不准确。通过观察MCA M1段有无斑块及斑块的位置,发现BAD组MCA斑块多位于上壁,此位置多是LSA分支的开口部位,这就为BAD的发病机制提供了证据。XIE等[1]研究比较了LI与正常侧的LSA特征,发现LI组的LSA分支及长度均减少。JIANG等[11]研究表明LSA分支数量、腔隙灶的存在和深部白质高信号可能与不同类型的近期皮质下梗死有关。本研究与上述结果一致,原因可能为:BAD的发病机制是动脉粥样硬化和炎症的作用[21],当MCA主干的斑块阻塞LSA开口,或LSA起始部微动脉粥样硬化,导致LSA近段闭塞,LSA主干甚至整个血管管腔不可视。与BAD不同的是,LI的病理机制被认为是血管末端的脂质玻璃样变性,是介于长期高血压引起的微动脉粥样硬化和重度高血压引起的纤维蛋白样坏死之间的中间病理病变[7],该过程的改变引起LSA远侧血管部分不通畅。
CSVD是由于动脉粥样硬化累及脑内小血管的一组疾病[15]。根据CSVD的磁共振特征,主要表现为近期皮质下梗死、脑白质高信号、腔隙灶、脑微出血、血管周围间隙扩大和脑萎缩等[14-15]。常规的磁共振手段——DWI/T2 FLAIR仅可识别除脑微出血外的其他病变。脑内粥样硬化小血管的自动调节能力受损导致脑血流量减少和慢性脑灌注不足[22]。动脉腔的阻塞引起急性缺血事件(LI)的发生,重度狭窄和低灌注累及深部白质的多个小动脉,导致不完全局部缺血性血管损伤,在影像学上表现为白质高信号[6]。腔隙灶在某种程度上,被认为是LI病灶的一种转归,当脑深部小动脉病变致脑组织梗死或出血时,在巨噬细胞的作用下形成小腔隙[6,16]。因此,LI与WMH和腔隙灶具有相似的病理改变,这印证了腔隙灶是LI发生的影响因素。此外,本研究发现BAD组重度白质病变比例(56.0%)高于LI组(36.8%),可能是BAD组大血管/分支动脉开口处粥样硬化斑块的易损特性与WMH病变负荷程度存在正相关,因为其与颈动脉斑块具有相同的病理过程[23]。
本研究运用HRVW-MRI明确穿支动脉梗死机制的意义在于:LI患者的二级预防主要是抗血小板和控制高血压等危险因素[24],而载体血管斑块所致穿支动脉梗死患者的二级预防,除上述措施外,理论上的另一重点是抗动脉粥样硬化治疗(他汀类药物)以稳定和逆转斑块[25]。
综上所述,通过HRVW-MRI可视化LSA并结合CSVD指标,有助于鉴别LSA区域梗死亚型。LSA总长度和腔隙灶可作为区别BAD和LI的影像学指标,并指导临床最佳治疗决策。但本研究亦存在局限性:(1)为避免两组受混杂因素影响,仅纳入典型病例,故样本量较少;(2)由于部分患者缺乏磁敏感加权成像,故未对CSVD相关微出血指标进行分析,需在后续研究中进行补充验证。
