贝伐珠单抗联合吉西他滨治疗肺癌的疗效及对免疫功能的影响
2023-09-01彭甘霖龙静查军
彭甘霖,龙静,查军
作者单位: 410004 长沙市,南华大学附属长沙中心医院
肺癌是我国临床比较常见的癌症类型之一,肿瘤发病于肺部支气管黏膜或腺体,早期无明显症状,随着肿瘤生长逐渐出现咳嗽、咯血、胸痛、喘鸣等呼吸系统症状[1]。目前,临床主要采用药物、手术方案治疗肺癌,选择治疗方案前需明确患者的病理类型、临床分期,并全面评估患者的身体状态,以选择合适的治疗方案,增强临床疗效[2]。临床治疗肺癌以减轻症状、延长生存期、改善生存质量为根本目的。吉西他滨是肺癌患者化疗的常用药物,尤其是鳞癌患者化疗的首选药物。吉西他滨属于细胞毒素类药物,可通过抑制肿瘤细胞DNA的合成过程而发挥抗肿瘤作用[3]。有研究表明,在肺癌化疗过程中使用吉西他滨与顺铂可获得一定疗效,但总体疗效与预期疗效存在显著差异[4-5]。贝伐珠单抗是重组人源化单克隆抗体,可抑制肿瘤血管生成,进而发挥抗肿瘤作用。在肺癌临床治疗中,吉西他滨加用贝伐珠单抗可通过两种不同的抗肿瘤机制抑制肿瘤细胞的生长及DNA的复制、转录等过程,发挥药物协同作用。现探究贝伐珠单抗联合吉西他滨治疗肺癌的疗效及对患者免疫功能的影响,报道如下。
1 资料与方法
1.1 临床资料 将2021年1—10月南华大学附属长沙中心医院收治60例肺癌患者按照随机数字表法分为吉西他滨组和贝伐珠单抗组,各30例。吉西他滨组中男21例,女9例;年龄44~76(65.45±2.35)岁;病理类型:非小细胞肺癌22例,鳞癌8例;癌症分期:Ⅲa期20例,Ⅲb期10例。贝伐珠单抗组中男20例,女10例;年龄44~77(65.50±2.40)岁;病理类型:非小细胞肺癌23例,鳞癌7例;癌症分期:Ⅲa期18例,Ⅲb期12例。2组临床资料比较,差异无统计学意义(P>0.05),具有可比性。患者对本研究内容、开展时间、方式等知情并自愿参加,本研究经医院医学伦理委员会审批。
1.2 病例选择标准 纳入标准:(1)经病理学检查确诊为肺癌;(2)首次入院接受治疗;(3)预期生存期>6个月;(4)精神状况良好,治疗依从性高。排除标准:(1)入组前进行过化疗或其他方案治疗者;(2)存在化疗禁忌证者;(3)对贝伐珠单抗、吉西他滨等药物过敏者;(4)精神疾病者。
1.3 治疗方法
1.3.1 吉西他滨组:患者入院后予以注射用盐酸吉西他滨(江苏豪森药业集团有限公司生产)75 mg/m2,于化疗第1、8天用药,每次在30 min内静脉滴注完成。以21 d为1个化疗周期,持续治疗4个周期。
1.3.2 贝伐珠单抗组:患者在吉西他滨组治疗基础上使用贝伐珠单抗注射液[Roche Pharma(Switzerland)Ltd.生产]7.5 mg/kg,静脉滴注,每2周用药1次。以21 d为1个治疗周期,持续治疗4个周期。
1.4 观察指标与方法 (1)T淋巴细胞亚群:采集患者治疗前及治疗4个周期后的空腹静脉血5 ml,3 000 r/min离心操作10 min,测定CD4+、CD8+,计算CD4+/CD8+。(2)血清细胞因子水平:采集患者治疗前及治疗4个周期后的静脉血5 ml,常规离心操作分离血清,采用酶联免疫吸附法检测血清白介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)、γ-干扰素(IFN-γ)水平。(3)肿瘤标志物:抽血化验方法同上,应用电化学发光法测定血清癌胚抗原(CEA)、糖类抗原125(CA125)、细胞角质蛋白19片段抗原21-1(CYFRA21-1)水平。(4)药物不良反应:包括便秘、腹泻、皮疹。
1.5 疗效判定标准 患者经治疗后病灶完全消失,且维持1个月以上,为完全缓解;患者肿瘤体积缩小50%以上,且维持1个月以上,为部分缓解;患者肿瘤体积缩小50%以下,或增大20%以下,为稳定;患者肿瘤体积增大20%及以上,或出现新病灶,为进展。疾病缓解率=(完全缓解+部分缓解)/总例数×100%;疾病控制率=(完全缓解+部分缓解+稳定)/总例数×100%。
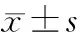
2 结 果
2.1 疾病缓解率、疾病控制率比较 贝伐珠单抗组疾病缓解率为43.33%,与吉西他滨组的30.00%比较,差异无统计学意义(χ2=1.148,P=0.284)。贝伐珠单抗组疾病控制率为76.67%,高于吉西他滨组的50.00%,差异有统计学意义(χ2=4.593,P=0.032),见表1。

表1 吉西他滨组与贝伐珠单抗组疾病缓解率、疾病控制率比较 [例(%)]
2.2 T淋巴细胞亚群比较 治疗前,贝伐珠单抗组CD4+、CD8+、CD4+/CD8+与吉西他滨组比较,差异无统计学意义(P>0.05);治疗4个周期后,2组CD4+、CD4+/CD8+较治疗前升高,CD8+较治疗前降低,且贝伐珠单抗组升高/降低幅度大于吉西他滨组,差异有统计学意义(P<0.01),见表2。

表2 吉西他滨组与贝伐珠单抗组治疗前后T淋巴细胞亚群比较
2.3 血清细胞因子水平比较 治疗前,贝伐珠单抗组血清IL-10、TNF-α、IFN-γ水平与吉西他滨组比较,差异无统计学意义(P>0.05);治疗4个周期后,2组血清IL-10、TNF-α水平较治疗前降低,血清IFN-γ水平较治疗前升高,且贝伐珠单抗组降低/升高幅度大于吉西他滨组,差异有统计学意义(P<0.01),见表3。
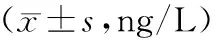
表3 吉西他滨组与贝伐珠单抗组治疗前后血清细胞因子水平比较
2.4 血清肿瘤标志物水平比较 治疗前,贝伐珠单抗组血清CEA、CA125、CYFRA21-1水平与吉西他滨组比较,差异无统计学意义(P>0.05);治疗4个周期后,2组血清CEA、CA125、CYFRA21-1水平较治疗前降低,且贝伐珠单抗组低于吉西他滨组,差异有统计学意义(P<0.01),见表4。

表4 吉西他滨组与贝伐珠单抗组治疗前后血清肿瘤标志物水平比较
2.5 不良反应比较 贝伐珠单抗组不良反应总发生率为16.67%,与吉西他滨组的13.33%比较,差异无统计学意义(P=1.000),见表5。
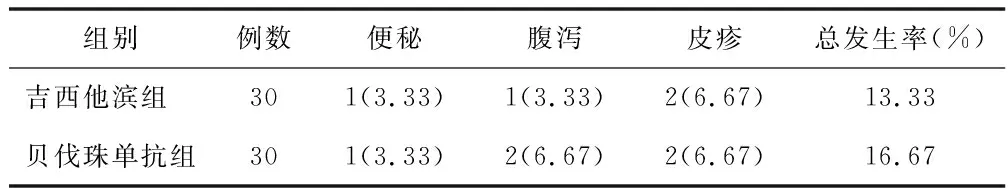
表5 吉西他滨组与贝伐珠单抗组不良反应比较 [例(%)]
3 讨 论
肺癌是临床上发病率较高的一种恶性肿瘤,多发于中老年人,在癌因死亡中占比较高,恶性程度高,患者预后差。早期肺癌一般无明显症状,部分患者存在呼吸系统症状,症状缺乏特异性,诊断有一定难度,导致很多患者在确诊时病情已发展至晚期,错失最佳手术时机或无法手术。化疗是目前临床治疗中晚期肺癌的常用手段,化疗药物种类较多,一线药物主要是铂类,其中顺铂较常用[6]。通过对患者进行化疗,杀灭肿瘤细胞,同时增强患者放疗敏感性,提升放化疗整体疗效。但是,化疗药物会对机体造成一定损伤,主要体现在过敏反应,如皮疹,或出现胃肠道症状,常见症状有恶心、呕吐、腹泻等[7]。因此,对患者进行化疗时,除需要考虑肿瘤控制率、肿瘤缓解率外,还需考虑药物对患者造成的不良反应。
本研究吉西他滨组患者化疗使用吉西他滨,该药物是一种新的胞嘧啶核苷衍生物,通过静脉滴注的给药方式可使药物有效成分进入患者血液中,由脱氧胞嘧啶激酶活化,并通过胞嘧啶核苷脱氨酶代谢[8]。药物代谢物可以掺入肿瘤细胞的DNA,对细胞G1/S期起作用[9]。此外,该药物也可以抑制核苷酸还原酶活性,减少肿瘤细胞内脱氧核苷三磷酸酯,并且可通过抑制细胞内代谢物的降解而起到增效效果。本研究结果显示,贝伐珠单抗组疾病控制率、疾病缓解率均较吉西他滨组高,特别是2组疾病控制率存在显著差异,且贝伐珠单抗组治疗后血清CEA、CA125、CYFRA21-1水平低于吉西他滨组,表明贝伐珠单抗联合吉西他滨治疗肺癌的效果确切,可有效延缓病情进展,分析原因为:贝伐珠单抗组患者在吉西他滨的基础上加用贝伐珠单抗,从另一个抗肿瘤作用机制入手,提升抗肿瘤效果。贝伐珠单抗静脉滴注给药,使药物进入人体内与血管内皮生长因子受体进行竞争性结合,切断其路径,并对内皮细胞的增殖与分化进行抑制,阻止肿瘤新血管生成,促使肿瘤细胞凋亡[10]。此外,联合用药可发挥药物协同作用,提高抗肿瘤效果。
本研究结果还显示,贝伐珠单抗组治疗后CD4+、CD4+/CD8+较吉西他滨组高,CD8+较吉西他滨组低,可见贝伐珠单抗联合吉西他滨治疗肺癌可增强机体免疫功能。T淋巴细胞亚群可反映机体免疫功能,其中CD4+可以被肿瘤细胞活化,CD8+可以起到负向免疫调节作用,CD8+升高则可促进肿瘤细胞增殖[11]。肺癌患者的肿瘤细胞会对机体免疫功能造成影响,导致机体T淋巴细胞亚群异常,而联合用药的抗肿瘤效果好,可较好地杀灭肿瘤细胞,改善病情,可降低对免疫功能的影响,从而表现为T淋巴细胞亚群明显改善。此外,贝伐珠单抗组治疗后血清IL-10、TNF-α水平较吉西他滨组低,血清IFN-γ水平较吉西他滨组高,主要因联合治疗方案可从不同抗肿瘤作用机制杀灭肿瘤细胞,减轻肿瘤细胞引起的机体炎性反应,表现为IL-10水平降低,TNF-α水平也随之降低。IL-10是一种炎性因子,IFN-γ是免疫调节因子,IL-10水平下降,则提示机体免疫功能增强,IFN-γ水平则随之升高。此外,2组药物不良反应总发生率均较低,可见贝伐珠单抗对患者造成的不良反应小。
综上所述,贝伐珠单抗联合吉西他滨治疗肺癌的临床效果较好,可有效改善机体免疫功能,减轻炎性反应,延缓病情进展,且安全性较高。
利益冲突:所有作者声明无利益冲突。
