二次界面聚合法制备聚酰胺-银纳米粒子复合纳滤膜
2023-08-31李姝雨何书恒曹志海秘一芳
李姝雨 何书恒 曹志海 秘一芳


摘 要: 为提高聚酰胺纳滤膜的抗菌性能,采用间苯二胺还原银前驱体,制备带有氨基的银纳米粒子(MPD-Ag NPs),通过简单易操作的二次界面聚合法制备抗菌聚酰胺-Ag NPs纳滤膜,分析MPD-Ag NPs的形成,表征聚酰胺-Ag NPs纳滤膜的化学组成、表面形貌,测试亲水性、荷电性、分离性能和抗菌性能进行表征。结果表明:MPD-Ag NPs中银是以金属态形式存在;当MPD-Ag NPs的质量分数为0.02%时,制备的纳滤膜水通量为21.11 L/(m2·h),对Na2SO4的截留率为97.95%;与未负载MPD-Ag NPs的纳滤膜相比,通过二次界面聚合法制备的纳滤膜耐氯性能更佳,且具有更优异的抗菌能力,对大肠杆菌和金黄色葡萄球菌的杀菌率分别为92.46%和84.35%。
关键词: 银纳米粒子;纳滤膜;界面聚合;聚酰胺;抗菌
中图分类号: TQ028.8
文献标志码: A
文章编号: 1673-3851 (2023) 07-0500-08
引文格式:李姝雨,何书恒,曹志海,等. 二次界面聚合法制备聚酰胺-银纳米粒子复合纳滤膜[J]. 浙江理工大学学报(自然科学),2023,49(4):500-507.
Reference Format: LI Shuyu, HE Shuheng, CAO Zhihai, et al. Preparation of polyamide-Ag nanoparticle composite nanofiltration membranes via secondary interfacial polymerization[J]. Journal of Zhejiang Sci-Tech University,2023,49(4):500-507.
Preparation of polyamide-Ag nanoparticle composite nanofiltration membranes via secondary interfacial polymerization
LI Shuyu, HE Shuheng, CAO Zhihai, MI Yifang
(Key Laboratory of Advanced Textile Materials and Manufacturing Technology, Ministry of Education, Zhejiang Sci-Tech University, Hangzhou 310018, China )
Abstract: To improve the antibacterial performance of polyamide nanofiltration membranes (NFMs), m-phenylenediamine was used as a reducing agent to form amino-functionalized silver nanoparticles (MPD-Ag NPs). Antibacterial polyamide-Ag NPs nanofiltration membranes were prepared by simple and easy-to-operate secondary interfacial polymerization, and the formation of MPD-Ag NPs was analyzed. Furthermore, the chemical compositions and surface morphology were tested, and the hydrophilicity, charge performance, separation properties, and antibacterial abilities of the prepared polyamide-Ag NPs nanofiltration membranes were systematically investigated. The results show that silver is present in MPD-Ag NPs in the metallic state. When the concentration of MPD-Ag NPs is 0.02%, the water flux of the prepared NFMs is 21.11 L/(m2·h), and the rejection of Na2SO4 is maintained at 97.95%. Compared with polyamide NFMs without MPD-Ag NPs, the NFMs prepared by the secondary interfacial polymerization method have better chlorine resistance and antibacterial ability. The bactericidal rates against Escherichia coli and Staphylococcus aureus are 92.46% and 84.35%, respectively.
Key words: Ag nanoparticles; nanofiltration membrane; interfacial polymerization; polyamide; antibacterial property
0 引 言
納滤是一种压力驱动的膜分离技术,主要通过孔径筛分和道南效应实现物质分离,对小分子有机物和高价离子具有较高的截留能力[1]。纳滤膜具有分离效率高、能耗小和环保等优点,因此在废水处理、化工和食品等领域都有着广泛应用[2-3]。然而,膜的生物污染一直是纳滤膜应用中需要解决的关键问题之一。细菌等微生物在膜表面附着和繁殖,最终形成生物膜,发生生物污染,并且形成的生物膜难以去除,导致膜分离性能严重下降,从而缩短纳滤膜的使用寿命,增加运行成本[4-5]。因此,提高纳滤膜的抗菌能力对其实际应用具有重要意义。
膜生物污染主要是由细菌与膜表面的相互作用引起的,因此对纳滤膜进行表面修饰是一种提高纳滤膜抗生物污染的有效方法[6]。银纳米粒子(Silver nanoparticles, Ag NPs)对细菌、真菌和病毒具有较强的广谱抗菌活性,且对人体细胞的毒性低,被广泛用于提高纳滤膜的抗菌性能[7]。由于Ag NPs与聚合物基体的相容性差,物理引入的Ag NPs存在团聚和分布不均匀问题,因此将Ag NPs通过化学键固定在纳滤膜表面,可有效提高Ag NPs的均匀性和操作稳定性[8-9]。Guo等[10]用乙二胺对聚酰胺(Polyamide, PA)膜进行表面修饰,通过与Ag NPs表面的活化后羧基发生化学反应,制备了抗菌PA膜;Huo等[11]则通过在成膜过程中引入聚多巴胺(Poly dopamine,PDA),通过PDA生成Ag NPs,得到PA-Ag NPs抗菌聚酰胺膜。但是上述方法步骤繁多,而且需要使用一些昂贵的试剂。因此,通过一种简单的方法来制备负载Ag NPs的抗菌PA纳滤膜十分必要。
界面聚合是目前制备商品化纳滤膜的主流方法,具有操作简单、反应时间短、可控性强的特点[12]。多元胺和多元酰氯在水-油界面处发生缩聚形成PA分离层,在新生成的PA纳滤膜表面残留有反应性的酰氯基团,能够与氨基发生二次界面聚合,实现PA纳滤膜表面化学改性[13]。间苯二胺(M-phenylenediamine,MPD)是一种常见的界面聚合二胺单体,将MPD水溶液与硝酸银(AgNO3)水溶液在室温下直接混合,MPD可还原Ag离子,得到外壳为聚间苯二胺的银纳米粒子(MPD-Ag NPs)[14-15],并且MPD-Ag NPs已被证明具有良好的抗菌性能[16]。通过MPD制备Ag NPs不仅易操作,而且生成的MPD-Ag NPs含有可反应性氨基。
本文以哌嗪(Piperazine, PIP)为水相单体,与均苯三甲酰氯(Trimesoyl chloride, TMC)进行界面聚合,制备PA纳滤膜,利用膜表面残留的酰氯基团与MPD-Ag NPs发生二次界面聚合反应,制备抗菌的PA-Ag NPs复合纳滤膜;探究MPD-Ag NPs的形成;通过红外、X射线光电子能谱仪(XPS)、扫描电镜(SEM)、接触角、Zeta电位和纳滤性能测试等手段对纳滤膜的化学组成、表面形貌、亲水性、荷电性和分离性能进行了表征,并以大肠杆菌和金黄色葡萄球菌为测试菌种,评估所制备纳滤膜的抗菌性能。
1 实验部分
1.1 实验试剂与仪器
材料:TMC购于百灵威有限公司,PIP、MPD、AgNO3、硫酸钠(Na2SO4)、硫酸镁(MgSO4)、氯化钠(NaCl)、氯化镁(MgCl2)、十二烷基硫酸钠(SDS)、戊二醛和PBS缓冲溶液均购于阿拉丁试剂中国(上海)有限公司,正己烷购自国药集团化学试剂有限公司,次氯酸钠(NaClO)购自上海麦克林生化科技有限公司,大肠杆菌、金黄色葡萄球菌和LB琼脂培养基均购于鲁威生物科技有限公司,去离子水实验室自制和聚砜超滤膜(Psf)购于中科瑞阳膜技术有限公司。以上试剂均为分析纯。
Nicolet 5700傅里叶红外光谱仪(美国热电公司)、UV-2600紫外-可见光吸收光谱仪(日本岛津)、GeminiSEM 500扫描电子显微镜(德国蔡司仪器公司)、固体表面Zeta电位仪(奥地利安东帕公司)和视频接触角张力仪(德国Kruss公司)、XPS(英国赛默飞公司)、FE30型数显电导率仪(上海雷磁仪器有限公司)及纳滤膜评价装置(杭州晓科生物技术有限公司)。
1.2 MPD-Ag NPs的制备
根据文献[16]制备MPD-Ag NPs,流程如图1所示。具体方法如下:配置20 mL 质量分数为 1% 的MPD 溶液。为稳定生成的MPD-Ag NPs,在MPD水溶液中加入质量分数为0.05% SDS。待溶液搅拌10 min后,加入10 mmol/L AgNO3 继续搅拌 10 min,可观察到溶液由无色变成红棕色,且无沉淀产生,说明MPD还原Ag离子生成Ag NPs,得到均匀分散的MPD-Ag NPs。
1.3 PA-Ag NPs复合纳滤膜的制备
采用二次界面聚合法制备PA-Ag NPs复合纳滤膜,流程如图1所示。方法如下:将Psf超滤膜表面浸入质量分数为0.3% PIP水溶液2 min后,移除多余溶液,再将Psf超滤膜表面浸入含有质量分数为0.15% TMC的正己烷溶液中,聚合1 min,吸附在Psf膜表面的PIP与正己烷中的TMC发生缩聚,形成PA纳滤膜;将PA纳滤膜表面浸泡在质量分数分别为0.01%、0.02%和0.04 %的MPD-Ag NPs水溶液中,30 s后移除MPD-Ag NPs水溶液,将纳滤膜在50 ℃下热处理10 min,得到PA-Ag NPs纳滤膜。根据MPD-Ag NPs质量分数,將所得到的纳滤膜分别命名为NFM-0、NFM-1、NFM-2和NFM-3。
1.4 PA-Ag NPs复合纳滤膜性能测试
在0.7 MPa下预压纳滤膜30 min,待性能稳定后,在25 ℃、0.6 MPa条件下,以1 g/L的Na2SO4、MgSO4、MgCl2和NaCl为进料液,测试纳滤膜的分离性能。膜水通量J和溶质截留率R分别通过式(1)—(2)计算:
I=VA×t(1)
R/%=1-CpCf×100(2)
其中:V为透过液体积,L;A为有效测试膜面积,m2;t为时间,h;Cf 、Cp分别为进料液和透过液中的无机盐质量浓度,g/L,通过FE30型数显电导率仪测定得到。
1.5 PA-Ag NPs复合纳滤膜耐氯性能的评价
将纳滤膜浸泡在pH值4的NaClO溶液(1 g/L),浸泡不同时间(0、2、4、6 h和10 h)后取出纳滤膜,用去离子水冲洗,对浸泡后的纳滤膜进行纳滤性能测试,通过比较纳滤膜通量和截留率的变化来评估纳滤膜的耐氯性能。
1.6 PA-Ag NPs复合纳滤膜抗菌性能的评价
通过平板计数法评估纳滤膜的抗菌性能。将100 μL、OD600=0.1的菌种均匀滴加在经紫外光照射、直径约为1.5 cm的纳滤膜表面,置于37 ℃培养3 h。将100 μL稀释后的菌液涂布在LB琼脂培养基上,在37 ℃下培养12 h后观察菌落数量,每种膜样品至少重复3次。由式(3)计算出抑菌率(Eb):
Eb/%=1-NtNc×100(3)
其中:Nt与Nc分别为测试膜片与空白对照膜片的菌落数。
采用抑菌圈法评估纳滤膜的抗菌性能。将OD600为0.1的大肠杆菌菌液稀释10倍后,取100 μL大肠杆菌菌液,以涂布法接种于LB琼脂培养基上。然后将经紫外光照消毒过后的纳滤膜(直径1.5 cm)放入固体培养基,并将培养基置于37 ℃培养箱中培养12 h,最后监测抑菌区是否存在。
观察纳滤膜表面细菌黏附情况。将1 cm2消毒灭菌后的纳滤膜置于大肠杆菌分散液中,在37 ℃下培养24 h。取出膜片,用0.01 mol/L PBS缓冲液漂洗3次后,浸入含体积分数为3%的戊二醛的PBS缓冲液中,4 ℃下保持4 h,使得大肠杆菌固定在纳滤膜表面。然后用去离子水冲洗纳滤膜3次,以除去多余的戊二醛。将纳滤膜在25 ℃干燥24 h,然后通过SEM观察表面细菌黏附情况。
2 结果与讨论
2.1 MPD- Ag NPs的形成及化学组成的分析
采用紫外-可见光吸收光谱对形成的MPD-Ag NPs进行表征,结果如图2所示。MPD溶液在350~700 nm范围内均无紫外-可见光吸收峰,而含有AgNO3的MPD溶液在476 nm处有一个明显的吸收峰(见图2(a)),该峰为Ag NPs的特征吸收峰,证明MPD诱导还原Ag离子形成Ag NPs[16]。通过XPS对MPD-Ag NPs进行表征,在Ag 3d的高分辨分谱图中(图2(b))可观察到结合能为367 eV 和373 eV 的2个特征衍射峰,分别属于Ag 3d5/2 和 Ag 3d3/2。2个特征衍射峰的差值为6.0 eV[17], 说明MPD-Ag NPs中Ag是以金属态形式存在,MPD还原Ag离子生成Ag NPs。
2.2 PA-Ag NPs复合纳滤膜化学组成的分析
通过红外表征纳滤膜的化学组成,结果如图3所示。由图3可知:在NFM-(0-3)的红外谱图中,均在1630 cm-1处观察到酰胺的特征吸收峰,说明PIP和TMC通过界面聚合形成了PA分离层[18];NFM-1、NFM-2和NFM-3的红外谱图中,在1542 cm-1处均发现属于伯胺的N—H特征吸收峰,PIP分子中无伯胺基团,而MPD-Ag NPs中含有伯胺基团,显示MPD-Ag NPs与PA膜表面的酰氯基团化学反应接枝在膜表面,以上结果表明本文成功制备了PA-Ag NPs复合纳滤膜。
2.3 PA-Ag NPs复合纳滤膜表面形貌和表面元素的分析
图4为NFM-0和NFM-2的SEM表面形貌,从图中可以看出:与NFM-0相比,NFM-2的表面形貌未发生明显变化,均可观察到结节状突起结构,这是PIP与TMC形成PA纳滤膜的典型形貌。
NFM-2的EDS能谱图及Ag 元素分布图结果如图5所示。NFM-2表面检测出Ag元素,再次证明MPD-Ag NPs的成功接枝,同时可以观察到NFM-2膜表面较NFM-0粗糙(见图5(a)),一方面可能是由于MPD-Ag NPs的引入,另一方面可能是由于少量的MPD参与界面聚合,形成较为较大的突起结构。在图5(b)中可观察到Ag元素的均匀分布,说明制备的MPD-Ag NP分散性好,可较为均匀的负载在纳滤膜表面。
2.4 PA-Ag NPs复合纳滤膜化表面亲水性和荷电性的分析
本文进一步通过接触角测试对NFM-(0-3)的表面亲水性进行表征,结果显示:NFM-(1-3)的接触角较NFM-0略有增大(见图6),可能是由于MPD-Ag NPs的引入提高了纳滤膜表面粗糙度所引起[11],表明NFM-(1-3)具有与NFM-0相近的亲水性。
对NFM-(1-3)的表面Zeta电位进行表征,结果如图7所示。图7显示:NFM-(0-3)均为荷负电纳滤膜,且NFM-(1-3)的表面电位较NFM-0低,PA纳滤膜表面的负电荷主要来自表面酰氯水解后形成的羧酸基团,MPD-Ag NPs的氨基与膜表面残留的酰氯基团发生反应,降低膜表面羧酸基团的数量,因此NFM-(1-3)的表面电位低于NFM-0。
2.5 MPD-Ag NPs质量分数对纳滤膜性能的影响
通过式(1)—(2)计算纳滤膜的水通量和Na2SO4截留率,分析MPD-Ag NPs质量分数对纳滤膜性能的影响,结果如图8所示。NFM-0的水通量为18.71 L/(m2·h),对Na2SO4的截留率为97.65%。当表面接枝MPD-Ag NPs时,随着MPD-Ag NPs质量分数的提高,水通量呈先上升后下降的变化规律。尤其当MPD-Ag NPs质量分数为0.02%时,纳滤膜的水通量略提升至21.11 L/(m2·h),对Na2SO4的截留率为97.95%。进一步提高MPD-Ag NPs质量分数至0.05%时,纳滤膜的水通量降低至13.68 L/(m2·h)。这一现象与文献报道的结果相一致[19-20],可能的原因是随着MPD-Ag NPs质量分数的提高,纳滤膜表面负载更多的MPD-Ag NPs,增加水的传质阻力,从而导致通量的降低。综合考虑纳滤膜的水通量和对Na2SO4的截留率,认为0.02%为MPD-Ag NPs最佳质量分数。
NFM-0和NFM-2对4种无机盐的分离性能影响的结果如图9所示。测试4种盐时,NFM-2的水通量均略高于NFM-0,NFM-0和NFM-2对4种无机盐截留率从大到小的顺序为:Na2SO4、MgSO4、MgCl2、NaCl(见图9(a)),为典型荷负电纳滤膜的截留规律[21],与图7表面Zeta电位测试结果(即NFM-0和NFM-2均为荷负电纳滤膜)相一致。荷负电纳滤膜表面与二价阴离子SO42-存在强静电排斥,因此NFM-2对Na2SO4 和MgSO4截留率较高(见图9(b)),Mg2+能够屏蔽一部分膜表面负电荷,Na2SO4的截留率大于MgSO4;Mg2+的离子半径大于Cl-的离子半径[22],NFM-2对MgCl2和NaCl截留率相近,说明道南效应在NFM-2的分离中起到主导作用[21]。相比于NFM-0,NFM-2的水通量和無机盐截留率均未有明显的降低,是MPD-Ag NPs未对PA分离层的结构产生明显影响,且在膜表面具有良好的分散性,对水的传质阻力较小。
將NFM-0和NFM-2浸泡在pH值4的NaClO水溶液中,浸泡不同时间后取出测试纳滤性能,结果如图10所示。NFM-0对Na2SO4的截留率由97.65%降低至61.26%。这主要是由于酸性条件下,具有强氧化能力的次氯酸为主要的活性氯物种,次氯酸能够使PA发生N-氯化反应,从而使得纳滤膜对Na2SO4的截留率降低[23]。随着浸泡时间的延长,NFM-2对Na2SO4的截留率略有下降。当浸泡时间为10 h时,NFM-2对Na2SO4的截留率仍为91.2%。此外,由图10可观察到NFM-2的通量较NFM-0的通量变化较小。耐氯性能的提高可能是因为表面化学键合的MPD-Ag NPs作为阻隔层保护了内部的PA分离层。上述结果表明,MPD-Ag NPs的引入有利于纳滤膜耐氯性能的提高。
2.6 PA-Ag NPs复合纳滤膜抗菌性能的表征
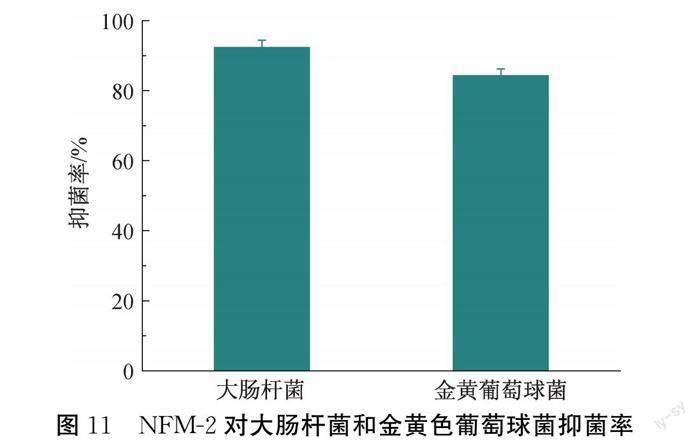
通过平板计数法评估NFM-2膜对大肠杆菌和金黄色葡萄球菌的抑制作用,结果如图11所示。以未添加MPD-Ag NPs的纳滤膜(NFM-0)作为对照组,通过式(3)计算杀菌率,NFM-2对大肠杆菌和金黄色葡萄球菌的杀菌率分别为92.46%和84.35%,杀菌性能较NFM-0有所提高(见图11)。NFM-2膜的抗菌性能主要来自于分离层中嵌入的MPD-Ag NPs,NFM-2表面上的MPD-Ag NPs能够释放Ag离子,通过与细菌细胞蛋白结合,引起蛋白质变性,从而终止细菌的代谢和繁殖,实现有效杀菌[24]。
大肠杆菌在NFM-0周围生长良好,而NFM-2周围出现抑菌圈(见图12(a)),通过SEM观察浸泡在大肠杆菌溶液中纳滤膜的表面形貌(见图12(b)),NFM-0表面可观察到完整的大肠杆菌,NFM-2表面无完整的大肠杆菌且表面黏附的大肠杆菌残余物明显减少(见图12(b)),说明NFM-2较NFM-0具有更优异的抗菌抗黏附性能。
3 结 论
本文以常见的界面聚合单体MPD为原料,还原Ag离子,获得具有可反应性的MPD-Ag NPs。利用MPD-Ag NPs表面氨基与PA纳滤膜表面酰氯基团发生反应,通过简单易操作的二次界面聚合法,制备了负载Ag NPs的抗菌PA-Ag NPs复合纳滤膜。主要结论如下:
a)通过紫外-可见光吸收光谱和XPS表征证明MPD可还原Ag离子形成Ag NPs。通过红外表征证明生成的MPD-Ag NPs中氨基基团能与PA纳滤膜表面的酰氯基团发生反应,MPD-Ag NPs通过化学键负载在PA纳滤膜表面,从而提高MPD-Ag NPs的分布均匀性和稳定性。
b)MPD-Ag NPs的引入对纳滤膜分离性能的提升作用并不明显。当MPD-Ag NPs质量分数为0.02%时,所制备纳滤膜水通量由18.71 L/(m2·h)略提升至21.11 L/(m2·h),对Na2SO4的截留率为97.95%。
c)NFM-2对大肠杆菌和金黄色葡萄球菌的杀菌率分别为92.46%和84.35%。浸泡在大肠杆菌溶液后,NFM-2表面黏附的大肠杆菌残余物明显减少。说明该方法制备的纳滤膜具有比原始PA纳滤膜NFM-0更高的抗菌性能和更优异的抗黏附性能。
参考文献:
[1]彭华文,赵强. 离子单体界面聚合制备纳滤膜的研究进展[J]. 膜科学与技术, 2021, 41(6):213-225.
[2]李清泉,谭惠芬, 韩子龙,等. 一种天然聚电解质制备荷正电纳滤膜的研究[J]. 水处理技术, 2023, 49(2): 30-34.
[3]张思齐,马忠宝, 任龙飞,等. 聚酰胺纳滤膜对不同电性抗生素的去除及其机理研究[J]. 水处理技术, 2023, 49(2):35-39.
[4]王希,江志彬,洪鑫军, 等. 一种耐细菌黏附纳滤膜的制备及其性能研究[J].膜科学与技术, 2021, 41(1):64-72.
[5]汪文华,雷彩虹,余媛, 等. 基于Zn2+与Mo6+共掺杂TiO2复合粒子的抗菌PVDF平板膜制备及其性能分析[J].浙江理工大学学报, 2022, 47(4):524-532.
[6]Peng S G, Chen Y M, Jin X P, et al. Polyimide with half encapsulated silver nanoparticles grafted ceramic composite membrane: Enhanced silver stability and lasting anti-biofouling performance [J]. Journal of Membrane Science, 2020, 611(1):118340.
[7]Yang Z, Takagi R, Zhang X Y, et al. Engineering a dual-functional sulfonated polyelectrolyte-silver nanoparticle complex on a polyamide reverse osmosis membrane for robust biofouling mitigation [J]. Journal of Membrane Science, 2021, 618(15):118757.
[8]Park S H, Ko Y S, Park S J, et al. Immobilization of silver nanoparticle-decorated silica particles on polyamide thin film composite membranes for antibacterial properties[J]. Journal of Membrane Science, 2016, 499(1):80-91.
[9]Yi M, Liu Y F, Zhu T Y, et al. In-situ silver recovery for biofouling mitigation with catechol-assisted nanofiltration membrane [J]. Desalination, 2023, 547(1):116233.
[10]Guo Q Q, Li J G, Chen T K, et al. Antimicrobial thin-film composite membranes with chemically decorated ultrasmall silver nanoclusters [J], ACS Sustainable Chemistry& Engineering, 2019, 7(17):14848-14855.
[11]Huo H Q, Mi Y F, Yang X, et al. Polyamide thin film nanocomposite membranes with in-situ integration of multiple functional nanoparticles for high performance reverse osmosis [J]. Journal of Membrane Science, 2023, 669(5):121311.
[12]秘一芳,安全福.界面聚合聚酰胺纳滤膜渗透选择性能优化的研究进展[J].化工进展, 2020, 39(6):2093-2104.
[13]Xiao H F, Chu C H, Xu W T, et al. Amphibian-inspired amino acid ionic liquid functionalized nanofiltration membranes with high water permeability and ion selectivity for pigment wastewater treatment [J]. Journal of Membrane Science, 2019, 586(15):44-52.
[14]Tian J, Luo Y, Li H, et al. Ag@poly(mphenylenediamine)-Ag core-shell nanoparticles: One-step preparation, characterization, and their application for H2O2 detection[J]. Catalysis Science & Technology, 2011, 1(8):1393-1398.
[15]Zhang Y, Wang L, Tian J, et al. Ag@poly(m-phenylenediamine) core-shell nanoparticles for highly selective, multiplex nucleic acid detection[J]. Langmuir, 2011, 27(6):2170-2175.
[16]Jeon S K, Lee J H. Rationally designed in-situ fabrication of thin film nanocomposite membranes with enhanced desalination and anti-biofouling performance [J]. Journal of Membrane Science, 2020, 615(1):118542.
[17]Ray P G, Biswas S, Roy T, et al. Sonication assisted hierarchical decoration of Ag-NP on zinc oxide nanoflower impregnated eggshell membrane: evaluation of antibacterial activity and in-vitro cytocompatibility[J]. ACS Sustainable Chemistry & Engineering, 2019, 7(16): 13717-13733.
[18]Fang W X, Shi L, Wang R. Mixed polyamide-based composite nanofiltration hollow fiber membranes with improved low-pressure water softening capability [J]. Journal of Membrane Science, 2014, 468(15):52-61.
[19]Zhang W T, Guo D X, Li Z W, et al. A new strategy to accelerate co-deposition of plant polyphenol and amine for fabrication of antibacterial nanofiltration membranes by in-situ grown Ag nanoparticles [J]. Separation and Purification Technology, 2022, 280(1):119866.
[20]Yi M, Tian L, Liu Y F, et al. Thin-film composite polyamide membranes with in situ attached Ag nanoparticles for fouling-mitigated wastewater treatment[J]. ACS EST Water, 2021, 1(18):1901-1910.
[21]謝艳新,杨倩,王辉,等. 荷负电分离膜的研究进展[J]. 印染助剂, 2019, 36(11): 6-11.
[22]Trivedi J S, Bhalani D V, Bhadu G R, et al. Multifunctional amines enable the formation of polyamide nanofilm composite ultrafiltration and nanofiltration membranes with modulated charge and performance [J]. Journal of Material Chemistry A, 2018, 6: 20242-20253.
[23]李梦菲, 杨少霞, 杨宏伟, 等. 哌嗪聚酰胺纳滤膜的氯氧化特性及机理[J]. 膜科学与技术, 2023, 43(1): 27-36.
[24]包诗玉, 孙昊宇, 龙茜, 等. 银系抗菌剂与有机抗菌剂对大肠杆菌的联合毒性效应[J]. 环境化学, 2022, 41(3): 871-882.
(责任编辑:廖乾生)
收稿日期: 2023-03-20 网络出版日期:2023-05-05网络出版日期
基金项目: 浙江省大学生科技创新计划(新苗)(2022R406A005)
作者简介: 李姝雨(2000- ),女,山西临汾人,本科生,主要从事纳滤膜方面的研究。
通信作者: 秘一芳,E-mail:myf@zstu.edu.cn
