mRNA水平探究人脂肪干细胞对SD大鼠放射性皮肤损伤的炎症修复作用
2023-08-31蔡卫超曹卫红胡大利叶超杨霖璟李晶晶林威钢仇灵江
蔡卫超,曹卫红,胡大利,叶超,杨霖璟,李晶晶,林威钢,仇灵江
·论 著·
mRNA水平探究人脂肪干细胞对SD大鼠放射性皮肤损伤的炎症修复作用
蔡卫超,曹卫红,胡大利,叶超,杨霖璟,李晶晶,林威钢,仇灵江
浙江省台州医院整形美容科,浙江台州 317000
从mRNA水平探究人脂肪干细胞(human adipose-derived stem cells,H-ADSCs)在SD大鼠放射性皮肤损伤中的作用及炎症机制。选取15只SD大鼠,采用随机数字表法分成5组,每组3只。给予各组大鼠背部皮肤45Gy电子线照射,分别于照射后0周、1周、2周、3周、4周后处死并取组织标本,检测皮肤组织内炎症因子mRNA水平。选取35只SD大鼠,采用随机数字表法分成空白对照组(=7)、PBS组(=14)和ADSCs组(=14)。空白对照组不做任何处理,PBS组和ADSCs组大鼠背部皮肤给予45Gy电子线照射,辐射后48h起,每72h完成1次注射,共5次,PBS组的大鼠注射1ml PBS,ADSCs组大鼠注射1ml含ADSCs的PBS,共注射5次。观察大鼠皮肤大体形态及病理组织学损伤,进行皮肤损伤评分,同时检测大鼠皮肤组织内炎症因子mRNA表达水平变化。辐射后2d,两组大鼠的Douglas and Fowler评分比较,差异无统计学意义(0.05);辐射后4~10d,ADSCs组大鼠的Douglas and Fowler评分均显著低于PBS组(0.05);至辐射后12d,两组大鼠的Douglas and Fowler评分达到一致。辐射后2周,PBS组和ADSCs组大鼠均出现相同面积及相同程度的皮肤损伤;辐射后3周至处死前,ADSCs组大鼠皮肤损伤面积比值均显著低于PBS组(0.05)。辐射后3周时,PBS组和ADSC组大鼠皮肤内的肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、白细胞介素(interleukin,IL)-6、IL-10、IL-1β,TNF-α等炎症因子的mRNA水平均显著高于其他时间点(<0.05),且显著高于空白对照组(<0.05)。与PBS组相比,ADSC组TNF-α,IL-1β,IL-6水平均显著降低(0.05),IL-10显著升高(<0.05)。PBS组与ADSC组的NOS及Arg水平比较,差异均无统计学意义(>0.05)。H-ADSCs能有效促进大鼠放射性皮肤损伤创面修复,其机制可能是H-ADSCs促进抑炎因子表达、降低促炎因子表达,从而抑制炎症反应发挥生物学效应。
人脂肪干细胞;放射性皮肤损伤;炎症
随着现代医学的发展,放射治疗逐渐成为重要的医学治疗手段,但常会导致不同程度的皮肤放射性损伤。目前在临床对于轻中度放射性皮肤损伤的治疗仍以药物治疗为主,但缺乏有效治疗药物;对于局部重度放射性皮肤损伤以外科手术为主,除此之外尚无其他有效的治疗方法[1]。在皮肤放射性损伤后的愈合过程中,炎症反应是首要环节,转化生长因子β1(transforming growth factor β1,TGF-β1)是主要启动因子,成纤维细胞的活化是中心环节,而脂肪组织参与创伤组织修复的全过程[2]。人源性脂肪干细胞(human adipose-derived stem cells,H-ADSCs)属于间充质干细胞(mesenchymal stem cells,MSCs),具有多向分化潜能。但其来源广泛、提取便捷、免疫源性更低。有研究表明,H-ADSC可以通过旁分泌、免疫调节、抗氧化等调节并干预炎症反应,可能有助于创面的愈合过程[3]。基于此,本研究对H-ADSCs在SD大鼠放射性皮肤损伤中的作用进行观察,从mRNA水平探讨其干预创面局部炎症反应的机制,以期为临床治疗提供一定的理论依据。
1 材料与方法
1.1 动物与仪器
健康雄性SD大鼠50只,体质量(300±20)g,购自上海斯莱克实验动物有限公司[动物实验许可证号:SYXK(浙)2019-0030]。所有大鼠分笼饲养,每笼1只,室温为18~24℃,湿度约为40%~60%。放置于固定的12h光照、12h黑暗环境中,自由摄取食物和水,饲料及饮用水符合实验标准(动物实验伦理审批号:tzy-2020053)。
电子线加速器:美国瓦里安公司;光学显微镜:日本Olympus公司;一抗:英国Abcam公司;HE染色试剂盒及4%甲醛:武汉谷歌生物科技有限公司;流式细胞仪:美国Beckman公司;细胞培养箱:美国Thermo公司。
1.2 方法
1.2.1 H-ADSCs的分离及培养 由水动力吸脂患者提供正常健康的颗粒状脂肪组织,经伦理委员会同意及供者知情同意(伦理审批号:K20230723);采用胶原酶Ⅰ充分消化脂肪组织后PBS悬浮离心,尼龙纱布过滤;PBS重悬离心,接种培养得到细胞外基质血管组分(stromal vascular franctiongel,SVF);使用CD90和CD105作为表面标志物对SVF进行标记,通过流式细胞仪检测H-ADSCs比例,经过细胞筛选得到原代H-ADSCs后继续培养。
1.2.2 H-ADSCs的鉴定 光学显微镜下观察脂肪干细胞的生长特点及形态;分别以CD90、CD105、CD73、CD29作为阳性标志,以CD11b、CD45、CD31、HLA作为阴性标志,通过流式细胞仪鉴定H-ADSCs。
1.2.3 成脂/成骨分化诱导 选取第3代H-ADSCs,诱导H-ADSCs成脂分化,进行油红O染色,通过光学显微镜(×100)观察,红色为脂滴;成骨分化采用茜素红S染色,通过光学显微镜(×100)观察,红色为钙沉积。
1.2.4 动物模型建立与H-ADSCs干预 选取5只雄性SD大鼠,采用随机数字表法分成5组,每组3只,给予水合氯醛腹腔麻醉后接受辐射刺激(6MEV电子线,23EX型直线加速器),非照射部位以铅板屏蔽,照射面积40mm×50mm,源皮距100cm,吸收剂量率为750cGy/min,总剂量45Gy。各组大鼠分别于辐射后0周、1周、2周、3周、4周后处死并取组织标本,通过荧光定量PCR检测皮肤组织内炎症因子mRNA水平。选取35只雄性SD大鼠,采用随机数字表法分为空白对照组(=7)、ADSCs组(=14)和PBSs组(=14)。空白对照组不做任何处理,其余所有两组大鼠同上述方法进行辐射干预,辐射后48h起,对各组大鼠每72h进行1次注射,共5次,其中ADSCs组注射1ml含600万个ADSCs的PBS悬液,PBS组注射1ml PBS溶液。随机选取ADSCs组及PBS组各7只大鼠,于辐射后3周处死并取组织标本,检测皮肤组织内炎症因子mRNA水平并观察苏木精–伊红(hematoxylin-eosin staining,HE)染色情况,ADSCs组和PBS组余下大鼠用于观察皮肤照射损伤创面愈合情况。根据《急性放射性皮肤损伤分度诊断标准》[4]将皮肤损伤分为Ⅰ、Ⅱ、Ⅲ、Ⅳ度,采用Douglas and Fowler评分评估皮肤损伤严重程度,通过计算每只大鼠未愈合皮肤面积占原始皮肤辐照面积的比例,分析创面愈合速度。Douglas and Fowler评分方法如下:0分为正常皮肤;0.75分为轻微红肿;1分为严重红肿;1.75分为开始脱毛;2分为脱毛面积为25%;2.25分为脱毛面积为33%;2.5分为脱毛面积为50%;2.75分为脱毛面积为66%;3分为脱毛面积>66%;3.25分为大部分区域脱毛且有渗出物;3.5分为大部分区域脱毛,有渗出物且表面有坏死。
1.2.5 HE染色和免疫组织化学染色 取大鼠皮肤组织于10%中性甲醛溶液固定,脱水包埋切片,灭活内源性酶,展片后进行HE染色;白片封闭山羊血清,在室温作用20min后检测抗体,4℃过夜,二抗37℃孵育,DAB显色,苏木精复染,二甲苯透明,封片,光镜(×40)下观察。
1.2.6 皮肤组织内炎症因子mRNA水平检测 辐射后3周处死3组大鼠并取皮肤标本,通过荧光定量PCR检测皮肤组织内炎症因子mRNA水平。Trizol试剂抽提SD大鼠皮肤组织RNA,测定提取的RNA浓度及纯度并定量,取等量RNA 5μl,在20μl逆转录体系中合成cDNA,以5μl cDNA为模板加入靶基因上下游引物,在25μl体系中进行PCR扩增。检测组织中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、白细胞介素(interleukin,IL)-10、IL-6、IL-1β以及精氨酸酶1(arginase1,Arg1)的变化情况。引物序列见表1。
1.3 统计学方法
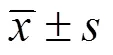

表1 引物序列
2 结果
2.1 H-ADSCs的培养与鉴定情况
使用CD90和CD105作为表面标志物对SVF进行标记,可见SVF中含有约五分之一的H-ADSCs。培养24h后贴壁细胞大多为干细胞,含部分其他细胞。培养至第3代ADSCs,镜下可见细胞形态全为梭形,见图1。所提细胞表面分子检测结果显示CD90、CD105、CD73、CD29阳性表达,CD11b、CD45、CD31、HLA无表达,鉴定其为H-ADSCs,见图2。取第3代细胞进行成脂诱导,H-ADSCs变为圆形,细胞间质中出现脂滴,油红O染色后脂质变红;进行成骨诱导,H-ADSCs变为不规则形状,见基质中钙盐沉积,重叠生长,见图3。
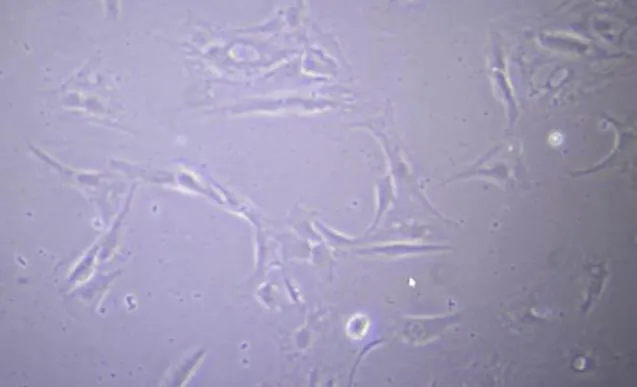
图1 H-ADSCs细胞形态(×200)
2.2 PBS组和ADSCs组大鼠Douglas and Fowler评分及皮肤损伤面积比较
辐射后2d,两组大鼠的Douglas and Fowler评分比较,差异无统计学意义(0.05);辐射后4~10d,ADSCs组大鼠的Douglas and Fowler评分均显著低于PBS组(0.05);至辐射后12d,两组大鼠的Douglas and Fowler评分达到一致,见图4。
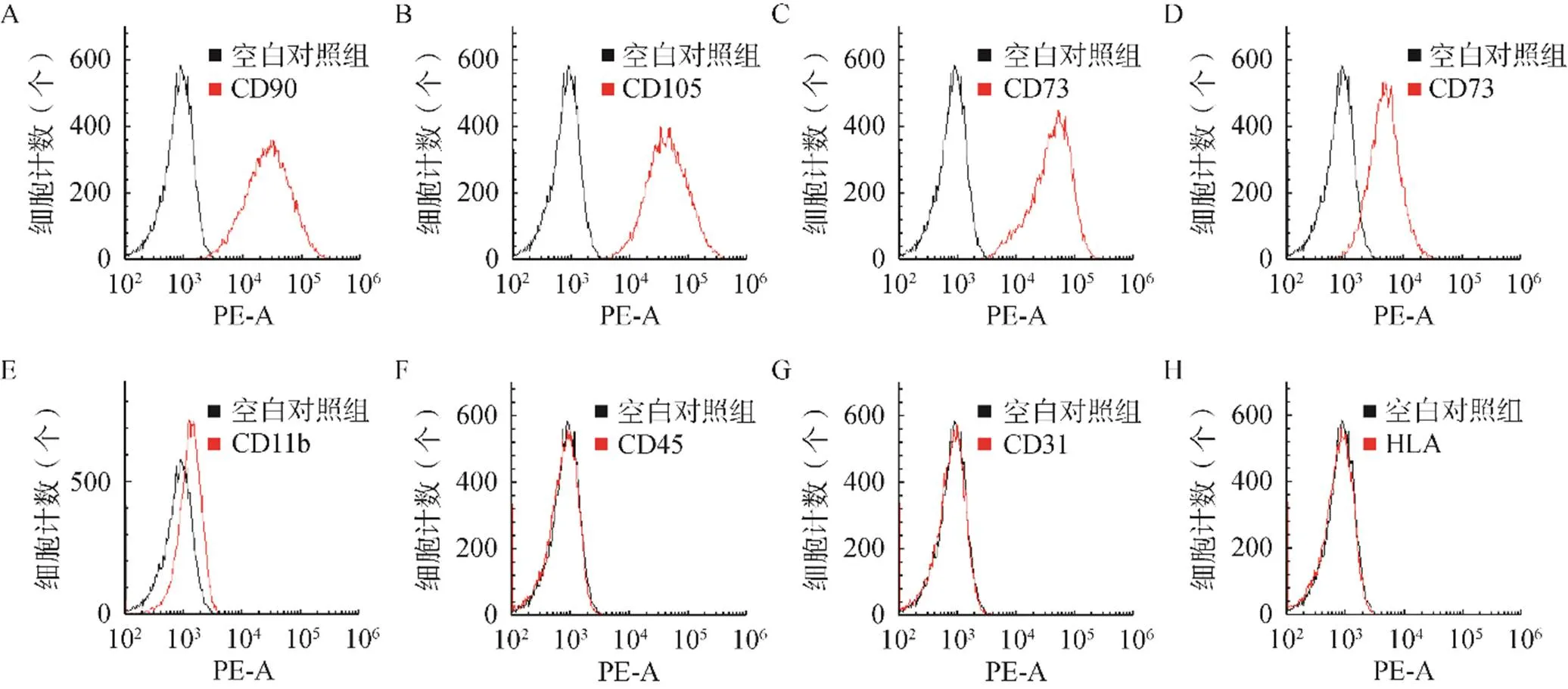
图2 H-ADSCs表面分子表达
A~D.分别为CD90、CD105、CD73、CD29阳性表达;E~H.分别为CD11b、CD45、CD31、HLA阴性表达
图3 H-ADSCs的成脂/成骨诱导分化(×100)
A.成脂诱导;B.成骨诱导
辐射后2周,PBS组和ADSCs组大鼠均出现相同面积及相同程度的皮肤损伤,照射区域皮肤表面潮湿,毛发呈棕黄色,部分毛发脱落,轻轻触碰有明显痛觉反应,表皮极易撕脱,符合Ⅳ度放射性皮肤损伤表征。其中ADSCs组大鼠辐射刺激的边缘区域最先出现瘢痕化,瘢痕化面积及瘢痕化速度超出PBS组大鼠。辐射后3周至处死前,ADSCs组大鼠皮肤损伤面积比值均显著低于PBS组(0.05),见图5。
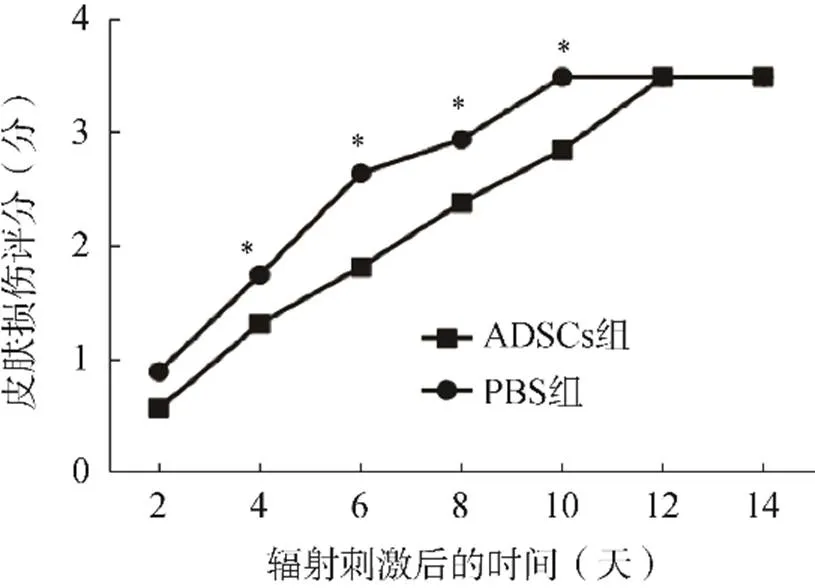
图4 ADSCs组与PBS组大鼠Douglas and Fowler评分比较
注:*<0.05
2.3 三组炎症相关免疫因子水平比较
辐射后3周时,PBS组和ADSC组大鼠皮肤内的TNF-α、IL-1β,IL-6、IL-10、iNOS等炎症因子的mRNA水平均显著高于其他时间点(<0.05),且显著高于空白对照组(<0.05),见图6。
辐射后3周,与PBS组相比,ADSC组TNF-α,IL-1β,IL-6水平均显著降低(0.05),IL-10显著升高(<0.05)。PBS组与ADSC组的NOS及Arg水平比较,差异均无统计学意义(>0.05)。PBS组和ADSC组各指标均显著高于空白对照组(<0.05),见图7。

图5 ADSCs组与PBS组大鼠皮肤损伤面积比较
注:*<0.05
2.4 HE染色
镜下观察发现ADSCs组大鼠背部皮肤染色后仍可见清晰的层次及相关附属器,而PBS组表皮破碎撕脱,组织结构不清,真皮层结构排列紊乱,见图8。
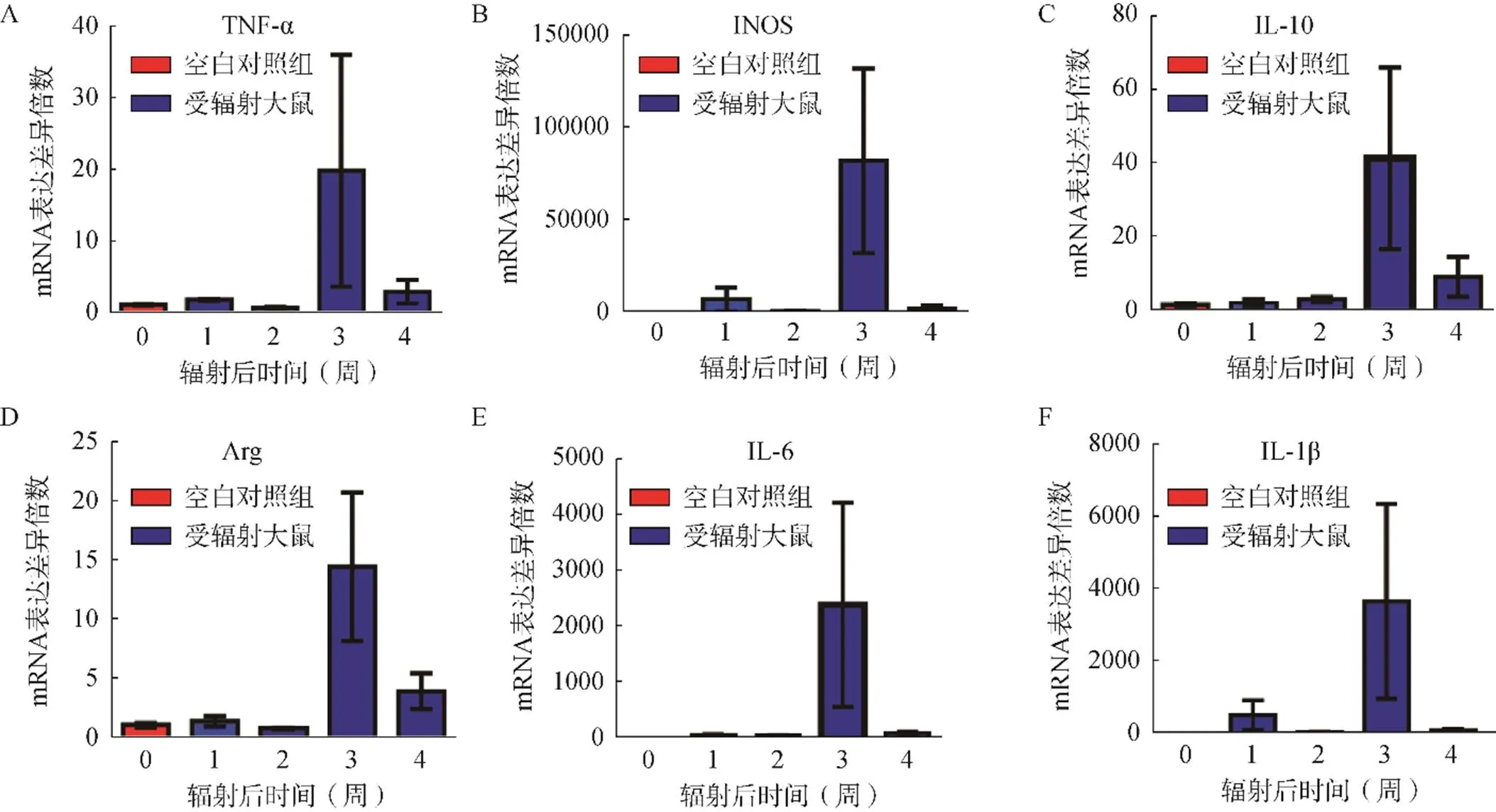
图6 辐射刺激后1~4周SD大鼠皮肤组织内炎症因子表达水平
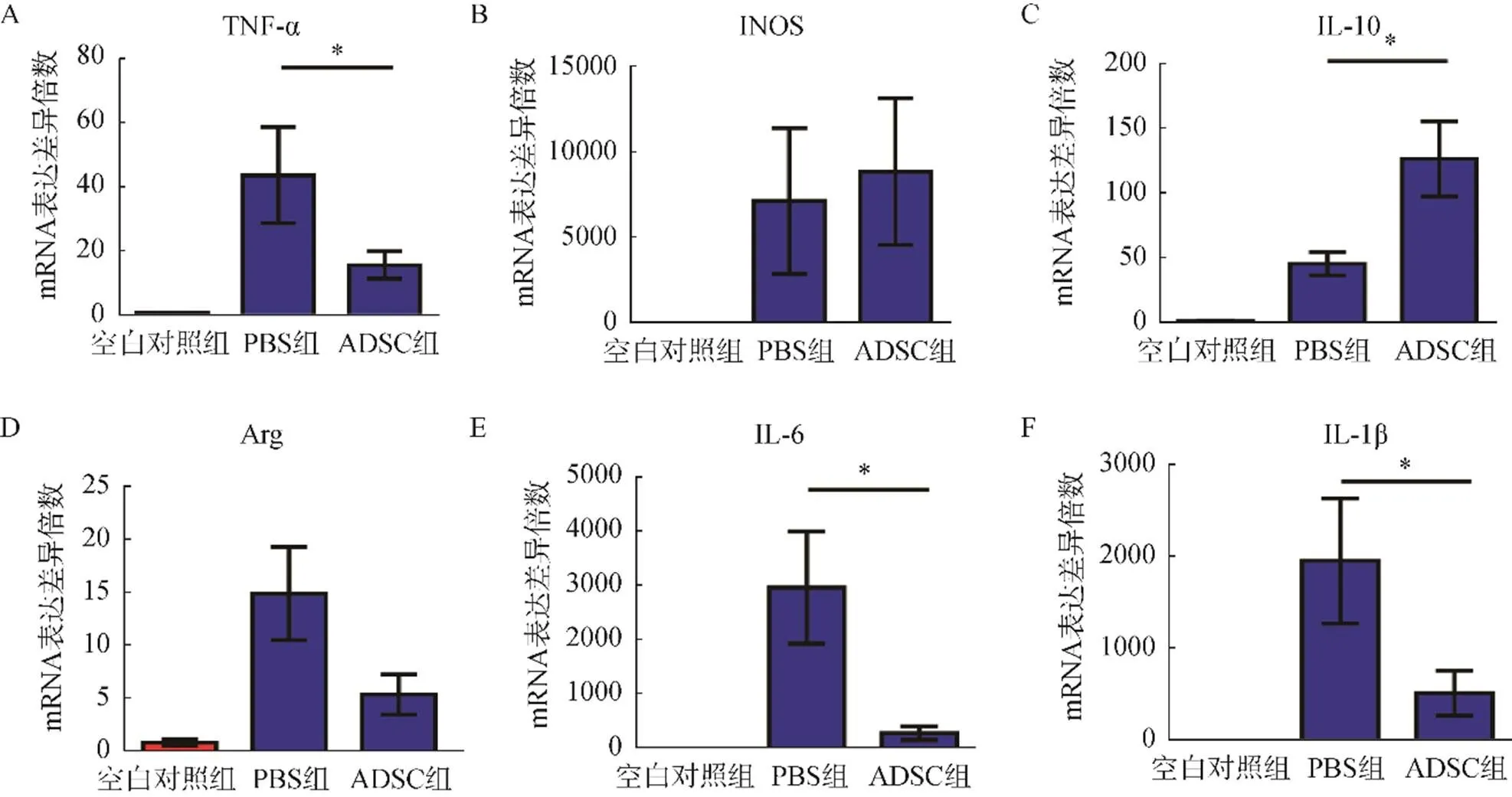
图7 辐射刺激后3周SD大鼠皮肤组织内炎症因子表达水平
注:*<0.05

图8 SD大鼠皮肤组织HE染色(×40)
A.PBS组;B.ADSC组
3 讨论
近年来对于H-ADSCs促进各类创伤修复的临床及实验研究日益增多。H-ADSCs来源广泛、提取便捷且免疫源性更低,具有更为广泛的使用前景和推广价值。近期研究表明,脂肪、骨及脐带来源干细胞均可通过降低促炎因子表达发挥其生物学功能,而ADSCs对细胞的损伤保护作用优于骨、脐带来源干细胞,能减轻和修复放射性损伤引起的正常肠、唾液腺、肝脏、皮肤、肺和心肌等组织损伤[5]。
本研究结果显示,接受45Gy辐射后的大鼠均出现Ⅳ度放射性皮肤损伤,进行H-ADSCs干预后发现,H-ADSCs不仅可延缓放射性皮肤损伤出现的进程,还可以加速创面的愈合。有研究认为辐射刺激皮肤后可介导相关炎症介质的表达,并通过经典的S-mad途径参与组织纤维化进程,进而干预皮肤的修复过程[6]。研究也证实,ADSCs可通过降低血清中IL-4,IL-6水平非特异性下调Th2型免疫反应[7],还可通过在mRNA水平上/下调干扰素表达及上调IL-10,转录因子P3表达从而减轻移植反应[8]。在创伤环境下,ADSCs可以分泌TNF-α,IL-6,IL-8等调节细胞的增殖、黏附、迁移、分化,影响创伤的愈合进程,为局部创面的愈合提供良好的微环境[9-10]。巨噬细胞在炎症反应微环境中起到了功能性作用,M1型与M2型巨噬细胞的分化诱导以及环境变化中的相互转换是免疫系统中的重要组成成分,通过对TNF-α、IL-1β,IL-6、IL-10、iNOS等炎症因子mRNA水平表达的检测,有助于更好的了解H-ADSCs对炎症微环境的干预作用。
本研究结果显示,受辐射大鼠出现了红肿、脱屑、褪毛、溃疡形成等一系列炎症反应,且照射区域表皮增厚,胶原结构紊乱,附属器破坏消失,TNF-α,IL-1β,IL-6等炎症因子表达显著增加。通过给予外源性的H-ADSCs能够有效减轻大鼠放射性皮肤损伤局部的炎症反应,减少照射区域炎性细胞浸润及炎症诱导的组织损伤。辐射后3周,皮肤组织内TNF-α,IL-1β,IL-6,IL-10,iNOS及Arg-1出现显著升高,给予外源性的H-ADSCs可从mRNA水平上降低促炎因子TNF-α,IL-1β,IL-6表达,并促进抑炎因子IL-10表达增加。
综上所述,H-ADSCs可通过抑炎反应减轻SD大鼠皮肤放射性损伤。但目前临床上缺少明确的对于放射性损伤的治疗方法,亦缺少早期评估诊疗手段,期望本研究可为临床提供一定的理论依据。
[1] 杨飞,谢卫国,张伟, 等. 放射性溃疡严重程度分型及临床治疗分析[J]. 组织工程与重建外科杂志,2022,18(1): 62–65.
[2] BRETT A, RENEE R,OMER M,et al. Dermal adipocyte lipolysis and myofibroblast conversion are required for efficient skin repair[J]. Cell Stem Cell. 2020, 26(6): 880–895.
[3] DARÉ R G, OLIVEIRA M M, TRUITI M C T, et al. Abilities of protocatechuic acid and its alkyl esters, ethyl and heptyl protocatechuates, to counteract UVB-induced oxidative injuries and photoaging in fibroblasts L929 cell line[J].Photochem Photobiol B, 2020, 203(1): 111771.
[4] 中华人民共和国卫生部. 急性放射性皮肤损伤分度诊断标准: GBZ106—2016[S]. 北京: 中国标准出版社, 2002.
[5] SHOLOGU N, SCULLY M, LAFFEY J,et alHuman mesenchymal stem cell secretome from bone marrow or adipose-derived tissue sources for treatment of hypoxia- induced pulmonary epithelial injury[J]. Int J Mol Sci, 2018, 19(10): 2996–3017.
[6] SALVOLINI E, LUCARINI G, ZIZZI A, et al. Human skin-derived mesenchymal stem cells as a source of VEGF and nitric oxide[J]. Arch Dermatol Res, 2010, 302(5): 367–374.
[7] BAO M, LIU Y, WANG Y, et al. Application of human umbilical cord mesenchymal stem cells in the regeneration of skin injury in a case who was exposed to Iodine-192 source accident in Nanjing[J]. Chin J Radiol Med Prot, 2016, 36(5): 22.
[8] SALVO N, BARNES E, DRAANEN J, et al. Prophylaxis and management of acute radiation-induced skin reactions: a systematic review of the literature[J]. Curr Oncol, 2010, 17(4): 94–112.
[9] LIU T, ZHANG Y, SHEN Z, et alImmunomodulatory effects of OX40Ig gene-modified adipose tissue-derived mesenchymal stem cells on rat kidney transplantation [J]. Int J Mol Med, 2017, 39: 144–152.
[10] WANG P, ZHANG S, MENG Q, et alTreatment and application of stem cells from different sources for cartilage injury: a literature review[J]. Ann Transl Med, 2022, 10(10): 610.
Inflammatory repair effects of human adipose-derived stem cells promotion on radiodermal skin injury in SD rats probed at the mRNA level
Department of Plastic Surgery, Taizhou Hospital of Zhejiang Province, Taizhou 317000, Zhejiang, China
To investigate the role and inflammatory mechanism of human adipose-derived stem cells (H-ADSCs) in radiological skin injury in SD rats at the mRNA level.Selected 15 SD rats were divided into 5 groups of 3 rats each according to the random number table method. The rats in each group were irradiated with 45Gy electron beams on the back skin, and were executed and tissue specimens were taken at 0, 1, 2, 3 and 4 weeks after irradiation, respectively, to detect the mRNA levels of inflammatory factors in the skin tissues. A total of 35 SD rats were selected and divided into blank control group (=7), PBS group (=14) and ADSCs group (=14) according to the random number table method. Blank control without any treatment, the remaining rats were subjected to electron beam irradiation. After the back skin of SD rats in the PBS and ADSCs groups were irradiated with 45Gy electron ray, the rats in PBS group were injected with 1ml PBS, and the rats in ADSCs group were injected with 1ml PBS containing ADSCs for five times. Observed the gross morphology and pathological histological damage of rat skin, scored the skin damage, and also detected the changes of mRNA expression levels of inflammatory factors in rat skin tissues.At 2 days post-irradiation, the Douglas and Fowler scores of rats in the two groups were compared, and the difference was not statistically significant (>0.05). From 4-10 days post-irradiation, the Douglas and Fowler scores of rats in the ADSCs group were significantly lower than those in the PBS group (<0.05). By 12 days post-irradiation, the Douglas and Fowler scores of the two groups reached the same level. At 2 weeks post-irradiation, rats in the PBS and ADSCs groups showed the same area and degree of skin damage. At 3 weeks post-irradiation and before execution, the ratio of the area of skin damage in the ADSCs group was significantly lower than that in the PBS group (<0.05). Tumor necrosis factor-α (TNF-α), inducible nitric oxide synthase (iNOS), interleukin (IL)-6, IL-10, IL-1β, and TNF-α were found in the skin of rats in the PBS and ADSC groups at 3 weeks after radiation, the mRNA levels of which were significantly higher than those of other time points (<0.05) and significantly higher than those of the blank control group (<0.05). Compared with the PBS group, the levels of TNF-α, IL-1β, and IL-6 were significantly lower in the ADSC group (<0.05), and IL-10 was significantly higher (<0.05). Comparing the levels of NOS and Arg in the PBS group and the ADSC group, the differences were not statistically significant (>0.05).H-ADSCs can effectively promote the repair of radioactive skin injury wounds in SD rats, and the mechanism may be that H-ADSCs exert biological effects by promoting the expression of anti-inflammatory factors and decreasing the expression of pro-inflammatory factors, thus inhibiting the inflammatory response.
Human adipose-derived stem cells; Radiation-induced skin injury; Inflammation
R818
A
10.3969/j.issn.1673-9701.2023.23.007
台州市社会发展科技计划项目(21ywa10)
曹卫红,电子信箱:caoweihong@hotmail.com
(2022–09–16)
(2023–07–25)
