玉米ZmSOD基因克隆及其在干旱胁迫下的表达
2023-08-31李玉华赵振华白佳田王烁莹王同朝
李玉华,赵振华,吴 征,白佳田,王烁莹,王同朝
(1 郑州师范学院 生命科学学院,郑州 450044;2 河南农业大学 农学院,河南粮食作物协同创新中心,郑州 450002)
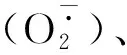
SOD基因是一个多基因家族,在同一植物中存在多个不同家族的SOD基因,且不同植物SOD家族基因的数量存在较大差异[5-7]。对不同植物SOD基因的研究表明,这些基因可以作为抵御包括冷、热、盐和干旱等非生物胁迫的第一道防线[8-9]。个体SOD基因家族成员在不同物种和不同环境胁迫下的表达模式不同。如:对拟南芥植株进行多种处理发现,臭氧熏蒸降低了叶绿体中Fe-SOD1和Cu/Zn-SOD2的转录水平,而叶绿体Fe-SOD2的mRNA相对保持不变。Fe-SOD2mRNA对UV-B的响应显著增加,Fe-SOD1和Cu/Zn-SOD2的mRNA却保持稳定,Cu/Zn-SOD1mRNA在UV-B和臭氧处理下都明显升高[10]。同样,在干旱胁迫下,白三叶草中FeSOD、Mn-SOD和Cu/Zn-SOD基因产生了更多的转录本[11];陆地棉中3种SOD基因的表达均显著上调,而在低温胁迫下,只有Cu/Zn-SOD基因的表达升高[12]。在小麦中,这个家族的成员在不同组织中表达不同,在高温、干旱和盐胁迫下,小麦Cu/Zn-SOD和Mn-SOD高度表达[13]。相反,在干旱胁迫下,香蕉中的Cu/Zn-SOD、Fe-SOD和Mn-SOD基因表达量却降低[14];在玉米中鉴定出的6个Cu/Zn-SOD基因,其中Cu/Zn-SOD2在干旱胁迫下表达水平显著上升,而Cu/Zn-SOD4在干旱胁迫下表达水平显著下降[15]。
近年来研究报道,许多胁迫诱导的Cu/Zn-SOD异构体已在多种单子叶和双子叶植物中被鉴定[15-16],且其在植物中的防御功能已被转基因方法所证实。如在水稻中过表达OsCu/Zn-SOD基因增强了植株对盐胁迫的耐受性[17],在烟草中过表达花生Cu/Zn-SOD可以缓解高盐和干旱对植株的伤害[18],在拟南芥中过表达Cu/Zn-SOD可使拟南芥耐受多种非生物胁迫[19-21]。过表达Cu/Zn-SOD的大量研究表明,将其表达水平与植物的氧化应激耐受程度联系起来,发现了它们在植物适应非生物和生物胁迫中的重要性。
玉米在世界范围内被广泛用作粮食作物和饲料作物,也是遗传研究的主要模式植物。玉米是研究C4光合作用和非生物胁迫耐受性功能基因组学的理想材料。已知干旱、高温、寒冷和高盐等环境胁迫会降低农作物产量,鉴于玉米在中国农业生产和国民经济发展中的重要性,在不利环境下提高玉米产量一直是学者研究的热点。尽管玉米基因组的研究进展迅速,辅助基因表达模式来深入理解基因功能的要求日益增长,仍需要对SOD基因在玉米中的特性及功能进行研究。
1 材料和方法
1.1 试验材料和设计
依据项目组前期研究工作基础[22],选用抗旱性有明显差异的玉米杂交品种‘蠡玉35’(LY35,抗旱性强)和‘登海605’(DH605,干旱敏感)为试验材料。种子在塑料钵中播种(每钵1粒种子),填充2种不同相对含水量的土壤。田间最大持水量(field capacity,FC)为每100 g土壤干重最大含水量22.67 g。播种后,土壤水分保持在75%的为对照植株,土壤水分保持在40%的为干旱胁迫植株,2个品种的土壤含水量控制相同。
供试材料于光照培养箱内培养1周(日照时间为15 h,温度28 ℃,光照度6 000 lx;黑暗9 h,温度25 ℃),第8天开始取样。
采集植株幼苗上第二片叶(自下往上)立即液氮速冻后保存在-80 ℃冰箱用于后续试验。每个处理3个生物学重复。
1.2 方 法
1.2.1ZmSOD基因克隆利用Plant RNeasy试剂盒(凯杰,德国)从2个品种玉米叶片中提取总RNA,RNA浓度和纯度用微量分光光度计Nanodrop2000(热电,美国)测定。根据primeScriptTMRT试剂盒(TaKaRa,No.RR047A)说明书合成第一链 cDNA,以cDNA为模板进行PCR扩增,扩增程序为:95 ℃预变性4 min;95 ℃变性30 s,58 ℃复性30 s,72 ℃延伸50 s,35个循环;72 ℃终延伸10 min。PCR产物电泳检测后,使用胶回收试剂盒(TaKaRa,No.9762)纯化回收,连接pMDTM18-T载体(TaKaRa,No.6011),转化大肠杆菌DH5α感受态细胞,挑取阳性克隆菌液,送华大基因公司测序。用于克隆ZmSOD基因全长和qRT-PCR引物序列如表1所示。

表1 试验所用引物
1.2.2 基因序列及预测蛋白分析利用Blast软件从GenBank中挑选甘蓝型油菜(登录号为AAY40317.1)、大白菜(登录号为Aac25568.1)、萝卜(登录号为AAD05576.1)、拟南芥(登录号为ABN50366.1)、琴叶拟南芥(登录号为XP002889716.1)和芥菜(登录号为AAN60796.1)6个十字花科植物的Cu/Zn-SOD基因编码的氨基酸序列,利用DNAMAN软件将其与甘蓝型油菜Cu/Zn-SOD的氨基酸序列进行多序列比对,并通过MEGA 6.0软件构建系统进化树。
利用ProtParam在线软件进行理化性质分析(http://web.expasy.org/protparam/);TMHMM软件进行蛋白质跨膜区段分析(TMHMM:http://www.cbs.dtu.dk/services/TMHMM/);SignalP软件进行N-末端信号肽序列预测分析(http://www.cbs.dtu.dk/services/SignalP/);NCBI在线CDS进行结构域预测分析(http://www.ncbi.nlm.nih.gov/Structure/cdd/);利用ExPASy工具SOPMA软件进行蛋白质二级结构预测。
1.2.3 qRT-PCR分析qRT-PCR用TB GreenTMPremix Ex TaqTMⅡ(TaKaRa,No. RR820A)在32孔实时荧光定量PCR仪Lightcycler®Nano(罗氏,瑞士)上进行。qRT-PCR程序条件是:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环,18S作为内参基因。20 μL反应体系包括:正/反向引物(10 μmol/L)各0.8 μL,模板2 μL,ddH2O 6.4 μL和TB GreenTMPremix Ex TaqTMⅡ为10 μL。每个样品进行2个技术重复和3个生物学重复,采用2-ΔΔCT方法计算ZmSOD的相对表达量。
1.2.4 2-DE和质谱鉴定分析ZmSOD 蛋白参照Li等[23]的方法提取玉米叶片中总的蛋白质进行双向电泳,分离鉴定ZmSOD蛋白,每个样品3个生物学重复。将叶片组织(1 g)在液氮中磨成细粉,加入适量含有10%(m/V)三氯乙酸的冷丙酮进行提取。晾干的蛋白沉淀溶于水化缓冲液中[9.5 mol/L尿素,4%(m/V)CHAPS,60 mmol/L DTT,2%(V/V)两性电解质]进行2-DE电泳,每500 μL缓冲液中加入10 μL蛋白抑制剂Cocktail Set I(Merck)。
用超声波(80 W,超声10 s,间歇15 s,10次)粉碎蛋白样品,14 000g离心20 min。以牛血清白蛋白为标准,采用Bio-Rad蛋白试剂盒测定总蛋白含量。
第一向等电聚焦用13 cm IPG胶条(pH 3~10,非线性)在Ettan IPG phor IEF System(GE Amersham,美国)上进行,聚焦程序设置为:30 V 12 h,500 V 1 h,1 000 V 1 h,8 000 V 8 h。第一向聚焦完成后,胶条放在平衡液Ⅰ[50 mmol/L Tris-HCl,pH 8.8,2% SDS,6 mol/L尿素,30%甘油,1%(m/V) DTT]中平衡15 min,然后再将胶条在缓冲液Ⅱ中平衡15 min[其成分与I液相同,但用4%(m/V)碘乙酰胺替代DTT]。第二项 SDS-PAGE用12.5%聚丙烯酰胺凝胶在Hofer SE 600(GE Amersham,美国)垂直板上以每胶条15 mA运行30 min,然后以每胶条30 mA运行30 min,直至溴酚蓝达到凝胶末端取出凝胶。用Image Master 2D Platinum分析软件对2-DE凝胶图片进行分析处理,选取3次重复中丰度差异大于1.2倍的蛋白质点做进一步分析。
1.2.5 SOD活性测定参照Çelik[24]的方法测定玉米幼苗叶片中的SOD活性。通过检测在560 nm处氮蓝四唑的光化学还原抑制率来测定总的SOD活性,1个单位的酶活性被定义为引起氮蓝四唑还原50%抑制所需的酶量。
1.3 统计分析
数据以平均值±标准差表示,至少3个生物学重复。所有统计分析均用SPSS 20.0进行,采用 Duncan进行多重差异显著性分析。
2 结果与分析
2.1 ZmSOD 基因的克隆和序列分析
分别提取2个玉米品种DH605和LY35幼苗叶片的总RNA,经分光光度计检测,D260/280均为1.8~2.1,并用1%琼脂糖凝胶电泳检测RNA的质量和完整性,都表明提取的RNA质量很好。以cDNA为模板PCR扩增产物均在近500 bp处有一特异性条带,凝胶电泳检测结果如图1所示。测序结果分析显示:DH605中ZmSOD1的ORF全长456 bp,编码151个氨基酸;LY35中ZmSOD2的ORF全长459 bp,编码152个氨基酸。

M. DL2000; 1-2.ZmSOD图1 ZmSOD 基因扩增Fig.1 Amplification of ZmSOD
用DNAMAN对ZmSOD1和ZmSOD2与GenBank中的SOD核苷酸序列进行比对发现:ZmSOD1与谷子(XM_012842967)、水稻(NM_001402155)和拟南芥(NM_100757)等植物SOD的cDNA 序列一致性高于72.77%(图2),ZmSOD2和以上几种植物SOD的cDNA序列一致性高于74.07%,表明克隆得到的ZmSOD1和ZmSOD2属于SOD基因家族成员。

图2 玉米ZmSOD和其他植物的SOD核苷酸序列多重比对Fig.2 Multiple sequence alignment of ZmSOD nucleotide sequences with SODs from other plants
2.2 ZmSOD编码的蛋白质理化性质和系统进化分析
用ProtParam软件对ZmSOD1和ZmSOD2编码的蛋白质进行推算,ZmSOD1编码151个氨基酸,蛋白等电点5.76,分子量15.05 kD;ZmSOD2编码152个氨基酸,蛋白等电点5.65,分子量15.11 kD。预测ZmSOD1和ZmSOD2蛋白不稳定系数分别为18.51和22.27,脂肪系数分别为73.58和76.32,总平均亲水指数分别为-0.245和-0.198,均属稳定亲水性蛋白。
用TMHMM和SignalP 3.0分析显示ZmSOD1和ZmSOD2序列N端无信号肽及无跨膜结构域,包含1个保守的Cu/Zn-SOD功能结构域,属于Cu/Zn-SOD家族成员。亚细胞定位分析ZmSOD1和ZmSOD2是位于细胞基质中的非分泌蛋白,为细胞质型定位。
二级结构分析显示,ZmSOD1和ZmSOD2蛋白分别包含53.64%和53.29%无规则卷曲,32.45%和36.18%延伸链,7.28%和6.58% β-转角,以及6.62%和3.95% α-螺旋。
同源性和系统进化分析发现,玉米ZmSOD1和ZmSOD2蛋白和单子叶植物谷子Cu/Zn-SOD蛋白(登录号XP_012698421)的亲缘关系最近,相似性分别高达93.42%和96.05%,并且ZmSOD在氨基酸水平与其他植物的SODs也有很高的相似性,与水稻OsSOD(XP_001389084)的相似性分别为90.13%和92.76%;与高粱SbSOD (XP_021309598)的相似性分别为87.50%和90.13%,与拟南芥(NP_172360)的相似性也较高,分别是81.58%和84.21%(图3)。
使用MEGA 5.0软件系统发育分析发现,ZmSOD首先与禾本科谷子FmSOD和水稻OsSOD聚合在一起,再与禾本科高粱SbSOD聚合在一起,最后与其他科植物的SOD 聚合(图4)。表明已知的Cu/Zn-SOD氨基酸序列中,玉米和禾本科植物的亲缘关系最近,这与blastp结果基本一致。
分支点上的数字为自展值百分比。图4 玉米ZmSOD蛋白与其他植物SODs的系统发育树分析The numbers shown at the branches are bootstrap values.Fig.4 The phylogenetic analysis of ZmSOD and other SODs from various plants
2.3 ZmSOD响应干旱胁迫分析
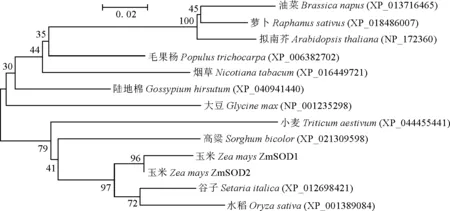
从图5可以看出,和对照相比,干旱处理导致ZmSOD转录水平在DH605和LY35叶片中都发生显著变化。但干旱胁迫条件下DH605幼苗叶片中ZmSOD1的表达量为对照的62.5%,显著下降;而LY35幼苗叶片中ZmSOD2的表达量为对照的2.68倍。这些结果表明ZmSOD基因响应了干旱处理,且其在不同的玉米品种幼苗叶片中的响应模式存在差异。
*和**表示该处理与对照组表达量比较差异显著(P<0.05)和极显著(P<0.01)。下同。图5 干旱处理下2个玉米品种ZmSOD的表达* and ** represent significant difference at 0.05 and 0.01, respectively, as compared to the control. The same as below.Fig.5 The expression patterns of ZmSOD in DH605 and LY35 under drought stress condition
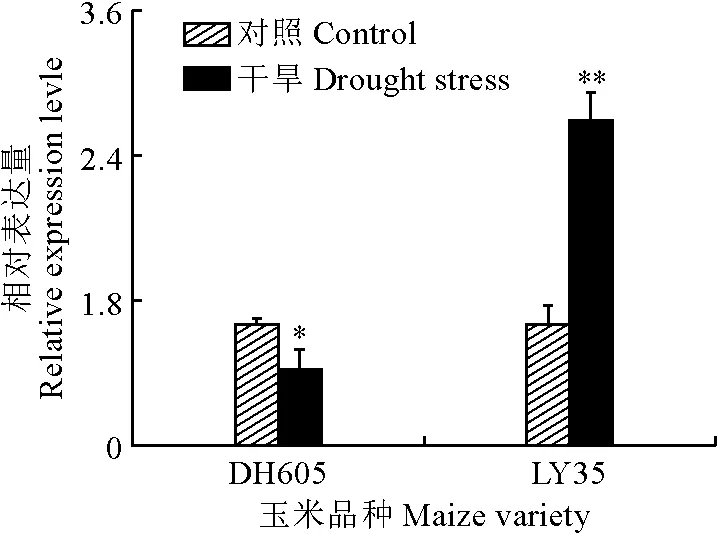
进一步结合2-DE耦联的MALDI-TOF法分析2个玉米品种响应干旱胁迫时的蛋白表达模式,质谱分析与NCBI数据库中的玉米蛋白序列库进行比对,只有高得分、较多肽段数和蛋白可信度不低于95%的蛋白才被认定为ZmSODs。图6显示,2个玉米品种幼苗在干旱胁迫条件下,DH605中的点1(图6,A、B)和LY35中的点2(图6,C、D)蛋白表达量和对照比均有显著变化。其中,DH605幼苗叶片中的ZmSOD1在干旱条件下表达量下调,且对照植株叶片中的表达量为干旱条件下的1.25倍;在LY35幼苗叶片中鉴定到的SOD蛋白属于Mn-SOD,在干旱条件下表达量上调,为对照的1.79倍。从DH605和LY35中鉴定出的ZmSOD,其蛋白名称、登录号、可信度及匹配的肽序列等详细信息都列在表2中。
A-B.在对照(A)和干旱胁迫(B)下‘登海605’的2-DE图像;C-D.在对照(C)和干旱胁迫(D)下‘蠡玉35’的2-DE图像。图6 2个玉米品种干旱胁迫下ZmSOD蛋白的表达A and B represent the control and the drought stressed plants of DH605, respectively; C and D represent the control and the drought stressed plants of LY35, respectively.Fig.6 2-DE maps of ZmSOD in DH605 and LY35 under control and drought stress conditions
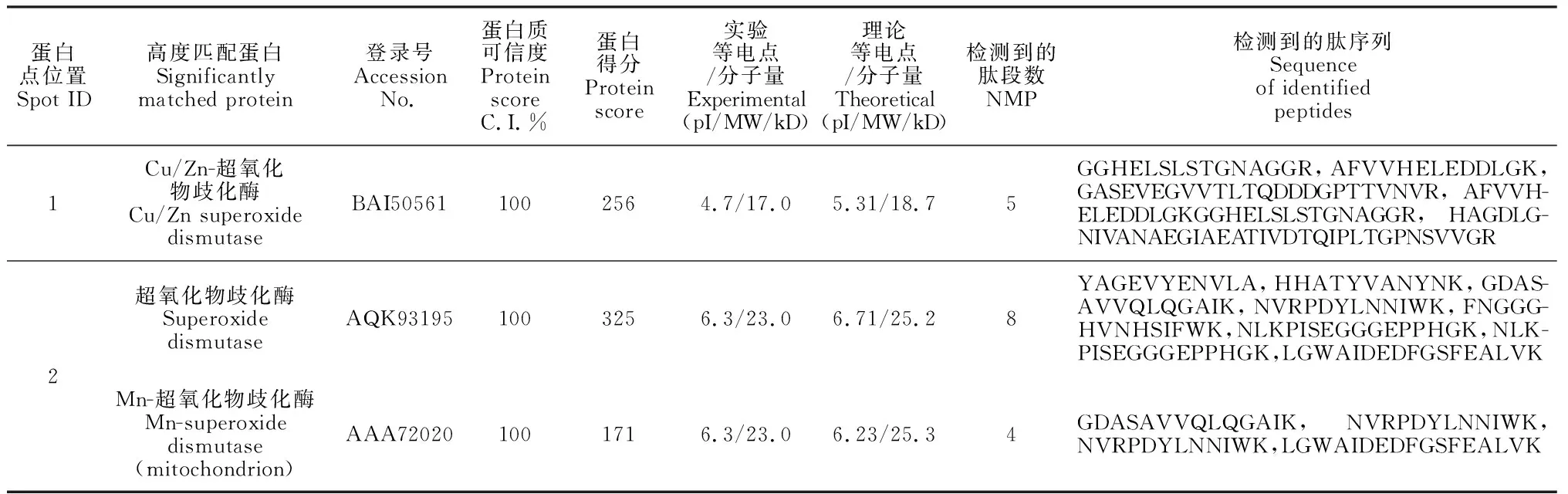
表2 对照和干旱条件下2个玉米品种中鉴定出的SODs
2.4 干旱胁迫下SOD活性
由图7可知,干旱处理后DH605幼苗叶片中的SOD活性显著下降,比对照下降了29.45%;而LY35幼苗叶片中的SOD活性显著上升,比对照升高了25.59%。

图7 干旱处理条件下‘登海605’和‘蠡玉35’叶片中的SOD活性Fig.7 The activity of SOD in leaves of DH605 and LY35 under drought stress condition
相关性分析表明,2个品种叶片中SOD活性总体变化趋势和ZmSOD的基因表达水平和蛋白丰度较为一致,ZmSOD1和ZmSOD2基因表达量、ZmSOD1和ZmSOD2蛋白丰度与SOD活性分别呈极显著正相关和显著正相关(表3)。

表3 干旱胁迫下玉米幼苗ZmSOD基因相对表达量、蛋白丰度和SOD活性的Pearson相关性分析
3 讨 论
SODs是一种广泛存在的蛋白质,在植物生长发育和代谢过程中起着重要作用,也参与胁迫反应。然而,SODs响应植物抗逆性的机制仍不清楚。从DH605和LY35玉米品种叶片中各克隆到1个Cu/Zn-SOD基因,该基因与其他植物的SOD成员有很高的同源性,进一步证实了这些基因在植物物种中是高度保守的。
环境胁迫会诱发植物细胞中ROS的产生,抗氧化酶活性的增加是细胞对抗氧化胁迫的防御机制,通常,抗氧化酶的活性被用来衡量ROS介导的氧化胁迫程度[25]。有研究报道从30个小黑麦基因型中选择遗传距离最大的2个基因型,对地上部和根部中Mn-SOD、Cu/Zn-SOD和Fe-SOD这3种同工酶的差异表达谱分析发现,耐旱性强基因型小黑麦的根和茎中Cu/Zn-SOD的表达水平高于干旱敏感基因型[26]。在限制土壤水分条件下,耐旱的甘蔗品种叶片中鉴定到1个Cu/Zn-SOD,而商业品种叶片中却没有,表明Cu/Zn-SOD在耐旱性中起着关键作用[27]。有研究称,在玉米中共鉴定出13个SOD基因(6个ZmCu/Zn-SOD,5个ZmFeSOD,2个ZmMnSOD),这些基因在干旱和盐胁迫下的表达水平存在显著差异,部分成员在不同的胁迫条件下表现出相似的表达模式[15]。本研究发现ZmSOD是玉米中积极响应干旱胁迫的参与者,在缺水条件下,ZmSOD1在DH605幼苗叶片中显著下降,而LY35幼苗叶片中ZmSOD2却明显上升,这与Li等对镉胁迫下耐镉玉米品种叶和根中Cu/Zn-SOD转录水平高于敏感品种的研究结果[28]一致。以上研究结果都表明不同植物中,不同SOD成员响应非生物胁迫的调节机制不同。
有研究发现在小麦抗旱基因型中的SOD活性随着渗透势能的降低而增加。此外,Mn-SOD转录本显著上调,与SOD活性变化趋势一致,说明Mn-SOD可能在植物的抗旱性中起重要作用[29]。在干旱胁迫下,2个普通大豆叶片中的Cu/Zn-SOD基因表达量上调,且耐旱基因型中Cu/Zn-SOD的上调幅度高于干旱敏感品种[30]。类似的报道称,萝卜叶片中SOD活性在高温胁迫条件下和对照比均有不同程度增加,但耐热材料比热敏感材料中增幅更大[31]。对23个基因型棉花幼苗叶片测定SOD活性发现,有些基因型在干旱胁迫下SOD活性增加不显著,有些基因型在干旱胁迫下SOD活性降低显著。有趣的是,耐旱性基因型在对照条件下SOD活性最高,但其在干旱胁迫下SOD活性却最低[32]。
总的来说,抗氧化酶水平随着环境胁迫而发生差异性变化,这取决于胁迫的程度、种类和植物对胁迫的种属特异性及敏感性。由此可以推测,植物在受到生物或非生物等逆境胁迫时,植株受到损害,ROS增多,ROS可作为一种信号诱导Cu/Zn-SOD的表达,而由于各个信号传导途径的调控机制不同或多种途径间的相互作用,导致Cu/Zn-SOD对胁迫的响应又各不相同。本研究虽取得一定成果,但较多研究表明,转不同SOD基因的植株在不同逆境胁迫下其SOD活性和抗氧化能力存在较大区别。后续研究将在耐旱玉米品种LY35中继续挖掘Cu/Zn-SOD成员,并探究不同基因成员在各种逆境胁迫下的表达模式和功能,为进一步揭示耐旱基因型玉米抗氧化能力与其抗逆性的关系提供新的线索,并为将来通过基因工程手段调控玉米Cu/Zn-SOD基因的表达进而提高玉米的抗逆能力提供目的基因资源。
