重组人神经生长因子通过抑制小胶质细胞炎症反应发挥神经保护作用
2023-08-31李瑶陈旖朱丹妮宋小红张金龙张哲赵拯浩侯利华吴诗坡陈薇
李瑶,陈旖,朱丹妮,宋小红,张金龙,张哲,赵拯浩,侯利华,吴诗坡,陈薇
(军事科学院军事医学研究院生物工程研究所,北京 100071)
神经炎症是神经系统疾病如神经退行性疾病和缺血性脑损伤的病理特征[1-2]。清除炎症对于中枢神经系统(central nervous system,CNS)的损伤和重建至关重要,但继发性神经炎症具有神经毒性,可进一步导致神经细胞坏死或凋亡[3]。因此,即使炎症是免疫防御系统的一部分,也有必要适当控制,以治疗与细胞炎症相关的疾病[4]。
神经炎症是一个复杂而精细的过程,由各种胶质细胞和外周免疫细胞完成,活化的小胶质细胞被认为是这一过程的关键角色[5]。小胶质细胞是CNS 中固有的免疫细胞,在生理状态下呈高度分枝状,持续监测周围微环境[5-6],可通过感染、损伤或内源性神经毒性因子激活,极化为经典激活状态(M1表型)或选择激活状态(M2 表型),且其活化与多种细胞因子的产生和分泌相关。M1 表型细胞释放促炎因子,包括介导神经毒性的白细胞介素1β(inter⁃leukin-1β,IL-1β)、IL-6 和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)[7],M2 表型细胞释放抗炎因子,如IL-4 和IL-10,被认为具有保护和修复功能[8]。研究表明,抑制小胶质细胞活化可减少神经元损伤,是治疗神经炎症相关疾病的重要干预措施[9-10]。
在小胶质细胞中,神经生长因子(nerve growth factor,NGF)及其受体表达在炎症刺激下显著升高[11]。NGF是神经营养因子家族的一员,对神经元存活、分化和成熟至关重要[12-13],在调节神经系统和免疫系统之间双向信号网络以维持内环境稳态方面具有重要作用[14]。NGF 的临床研究集中于修复周围神经系统和CNS的神经损伤,包括周围神经病变、视神经损伤、缺血性卒中和神经退行性疾病[15-17]等。重组人神经生长因子(recombinant human NGF,rhNGF)是NGF 的重组蛋白,其生物学功能最接近天然蛋白质分子,能够代替NGF促进神经再生,并为损伤后的神经修复提供营养支持[18]。CHO 细胞表达的rhNGF 具有高活性和低免疫原性,具有广阔的市场前景。rhNGF 滴眼液已用于临床,可缓解干眼症的症状。意大利Dompé 公司研发的rhNGF 滴眼液Oxervate(cenegermin)被美国FDA 批准用于治疗中度或重度神经营养性角膜炎[19]。然而,rhNGF 在炎性状态下的神经保护作用机制尚不清楚。本研究建立BV2 小胶质细胞炎症模型以模拟炎症状态下的神经细胞损伤,评价由本研究室自主研发的rhNGF 对小胶质细胞介导的炎症反应和神经元细胞凋亡的抑制作用,探讨其神经保护作用机制。
1 材料与方法
1.1 rhNGF、细胞、试剂和主要仪器
rhNGF 在CHO 细胞中表达并通过柱色谱纯化,在TF-1 细胞试验中验证了其生物活性,并通过紫外-可见分光光度法确定其浓度[20]。小鼠BV2 小胶质细胞和小鼠脑神经瘤细胞Neuro-2a(N2a),北京协和医学院细胞资源中心。DMEM 培养基、MEM 培养基、青链霉素双抗、胰酶、PBS、非必需氨基酸和胎牛血清(fetal bovine serum,FBS),美国Gibco 公司;TritonTMX-100、牛血清白蛋白(bovine serum albumin,BSA)和脂多糖(lipopolysaccha⁃rides,LPS),美国Sigma 公司;小鼠抗小鼠神经元特异性核蛋白(neuron specificnuclears protein,NeuN)单克隆抗体,德国Millipore 公司;CCK-8 试剂盒,北京索莱宝科技有限公司;多聚甲醛,国药集团化学试剂有限公司;大鼠抗小鼠CD16 抗体和凋亡细胞流式检测试剂盒,美国BD 公司;山羊抗小鼠CD206 抗体,美国R&D 公司;Alexa FluorTM488 标记驴抗大鼠IgG(H+L)、Alexa FluorTM594 标记驴抗山羊IgG(H+L)和Alexa FluorTM488 标记驴抗小鼠IgG(H+L)抗体,美国Invitrogen 公司;RNAiso Plus 溶液、RNA 酶抑制剂、逆转录试剂盒Prime⁃Script™和SYBR Green 实时荧光定量PCR(realtime quantitative PCR,RT-qPCR)试剂盒,日本TaKaRa 公司;细胞因子检测试剂盒(cytometric bead array,CBA),美国BioLegend公司;TUNEL原位凋亡检测试剂盒,南京诺维赞生物科技有限公司;PCR引物(表1)由生工生物工程(上海)有限公司合成。Mastercycler®nexus-PCR仪,德国Eppendorf股份公司;TS100 倒置显微镜,德国Nikon 公司;QuantStudio™3 实时荧光定量PCR 仪,美国ABI 公司;iMark™酶标仪,美国Bio-Rad 公司;Sorvall ST 40R 台式离心机和1300 Series A2 生物安全柜,美国Thermo 公司;0.2 μm 滤膜,德国Millipore 公司;MIR-H163L-PC 电热恒温培养箱和MCO-18AC二氧化碳细胞培养箱,日本三洋公司;AireGard NU-140 细胞超净工作台,美国NUAIRE 公司;Cytation 1细胞成像多功能检测系统,美国Bio-TeK公司;FACS CantoTM流式细胞仪,美国BD公司。

Tab.1 Primer sequences for real-time quantitative PCR(RT-qPCR)
1.2 rhNGF浓度和LPS诱导BV2细胞炎症反应最佳浓度确定
BV2细胞在含10% FBS和1%青链霉素双抗的DMEM 培养基中培养。将BV2 细胞接种至96 孔板(每孔5×103细胞)孵育过夜,设细胞对照组及rhNGF 0.005,0.05,0.5,5,50,500和5000 μg·L-1组,每组6 复孔,分别加入PBS 或相应浓度rhNGF孵育48 h,CCK-8 试剂盒测定细胞存活率,确定rhNGF的浓度。
设细胞对照组及LPS 1,10 和100 mg·L-1组,分别加入PBS 或相应浓度LPS 孵育细胞24 h,CCK-8 试剂盒测定细胞存活率,RT-qPCR 测定促炎细胞因子IL-1β,IL-6和TNF-α及抑炎细胞因子IL-4和IL-10mRNA 表达,确定诱导BV2 细胞炎症反应最佳LPS浓度。
1.3 BV2细胞分组和处理
将BV2 细胞接种于96 孔板(每孔5×103细胞)培养过夜,设细胞对照组、LPS 1 mg·L-1组及LPS+rhNGF 5,50 和500 μg·L-1组。LPS 和LPS+rhNGF 组给予LPS 1 mg·L-1处理24 h,更换为PBS 或rhNGF 5,50 或500 μg·L-1继续孵育48 h;细胞对照组不做处理。
1.4 BV2细胞与N2a细胞共培养分组和处理
BV2 细胞分为细胞对照组、LPS 1 mg·L-1组及LPS+rhNGF 50 和500 μg·L-1组,接种至12 孔板(每孔5×105细胞),按1.3 处理,收集细胞。N2a 细胞在含10%FBS 和1%青链霉素双抗的MEM 培养基中培养,分为细胞对照组、LPS 1 mg·L-1组及与上述处理的4 组BV2 细胞分别共培养组,每组设3复孔,接种于24孔板(每孔1×105细胞)培养过夜。第2 天4 个共培养组分别加入相应处理的BV2 细胞,每孔1×104细胞,共培养12 或24 h;细胞对照组和LPS组分别加入等体积PBS和LPS。
1.5 BV2 细胞条件培养基与N2a 细胞共培养分组和处理
BV2 细胞分为细胞对照组、LPS 1 mg·L-1组及LPS+rhNGF 50 和500 μg·L-1组,接种至12 孔板(每孔5×105细胞),按1.3 处理,收集细胞培养上清即条件培养基(microglial conditioned medium,MCM),分别为MCM-对照、MCM-LPS 及MCMrhNGF 50和500 μg·L-1,于4 ℃,800×g离心10 min,0.2 μm囊式过滤器过滤去除细胞碎片。将N2a 细胞接种到96 孔板(每孔5×103细胞)或12 孔板(每孔5×105细胞)培养过夜,分为细胞对照组、LPS 1 mg·L-1组及4个MCM组,即MCM-对照组、MCMLPS 组、MCM-rhNGF 50 和500 μg·L-1组,每组设6 复孔。LPS 组仅以LPS 1 mg·L-1孵育12 或24 h,4 个MCM 组加入等体积相应MCM 孵育12 或24 h,细胞对照组加入等体积PBS。
1.6 CCK-8法检测BV2和N2a细胞存活率
用CCK-8 试剂盒检测细胞存活率。取1.2,1.3和1.5分组处理的细胞,每孔加入CCK-8试剂10 μL,37 ℃孵育2 h,于酶标仪检测450 nm 处吸光度值(A450nm)。细胞存活率(%)=(实验组A450nm-空白组A450nm)/(细胞对照组A450nm-空白组A450nm)×100%。
1.7 实时定量PCR 检测BV2 细胞炎症因子mRNA表达
取1.2 和1.3 处理的BV2 细胞,Trizol 法提取总RNA,用PrimeScript™逆转录试剂盒逆转录合成cDNA。RT-qPCR 检测促炎因子IL-1β,IL-6和TNF-α及抗炎因子IL-4和IL-10mRNA 表达。反应体系:cDNA 1 μL,上、下游引物(10 μmol·L-1)0.8 μL,ROX Reference Dye Ⅱ0.4 μL,TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)10 μL,无RNA 酶水7 μL。反应条件:95 ℃30 s;95 ℃5 s,60 ℃34 s,共45 个循环;95 ℃15 s,60 ℃1 min。以GAPDH作为内参,待测基因mRNA 相对表达水平用2-△△Ct表示。
1.8 CBA 法检测BV2 细胞培养上清中炎症因子浓度
用CBA 试剂盒测定BV2 细胞培养上清中细胞因子TNF-α,IL-6,IL-4 和IL-10 浓度。取1.3 细胞培养上清和标准品,加入分析缓冲液和检测微球,室温下避光800 rpm振荡孵育2 h。洗涤2次,加入25 μL检测抗体于室温下避光800 rpm振荡孵育1 h 后,加入SA-PE 25 μL继续振荡孵育30 min。洗涤2次后重悬样品,转移至流式管中,于流式细胞仪检测。通过LEGENDplex v8 软件绘制标准曲线并计算细胞因子浓度。
1.9 免疫荧光法检测BV2 细胞中CD16 和CD206阳性细胞百分比
取1.3 分组处理的BV2 细胞,用冷PBS 洗涤,PBS 缓冲条件下用4%多聚甲醛固定20 min 后,用0.2%Triton X-100 透化15 min。细胞用含10%BSA的PBS 封闭1 h 阻断非特异性结合,然后用大鼠抗小鼠CD16 或山羊抗小鼠CD206 抗体4 ℃孵育过夜。PBS 洗涤3 次,细胞在37 ℃条件下与Alexa FluorTM488和Alexa FluorTM594偶联的荧光二抗孵育1 h,DAPI 染色10 min。用Cytation 1 细胞成像多功能检测系统获取荧光图像,每样本随机选择2 个视野,用Image J 软件统计CD16(绿色)和CD206(红色)阳性细胞百分比。
1.10 流式细胞术检测N2a细胞凋亡率
取1.5 分组处理的N2a 细胞,用结合缓冲液重悬,计数并稀释至1×109L-1。各取100 μL细胞悬液转移至流式管,加入5 μL Annexin Ⅴ-PE 和7-AAD混合,室温避光孵育15 min。每管加200 μL 结合缓冲液重悬,样品于1 h 内于流式细胞仪检测,用FACS Diva 软件分析早期凋亡细胞百分比。Annexin Ⅴ+7-AAD-为早期凋亡细胞。
1.11 NeuN和TUNEL共染法检测N2a细胞凋亡率
使用TUNEL 红色荧光原位凋亡检测试剂盒和NeuN 抗体共染色检测N2a 细胞凋亡。取1.4 分组处理的N2a 细胞,PBS 洗涤细胞2 次,4%多聚甲醛固定20 min,0.2% Triton X-100 透化15 min,使用含10%BSA 的PBS 封闭1 h。室温条件用平衡缓冲液平衡细胞10 min,加TdT 工作液在37 ℃孵育60 min。用PBS 清洗细胞后,加入抗小鼠NeuN 单克隆抗体(1∶200),4 ℃孵育过夜。细胞用PBS 洗涤3 次后,加入Alexa FluorTM488 标记驴抗小鼠IgG(H+L)抗体(1∶1000),室温避光孵育60 min。经PBS 洗涤后,用DAPI 进行细胞核染色。用Cytation 1 细胞成像多功能检测系统获取荧光图像,每样本随机选择2 个视野,用Image J 软件统计NeuN(绿色)和TUNEL(红色)双阳性细胞百分率。
1.12 统计学分析
2 结果
2.1 rhNGF浓度和LPS诱导BV2细胞炎症反应浓度的确定
与BV2 细胞对照组比,rhNGF 5,50,500 和5000 μg·L-1干预48 h 可明显提高BV2 细胞存活率(P<0.05,P<0.01)(图1),因此选rhNGF 5,50和500 μg·L-1用于后续实验。

Fig.1 Effect of recombinant human nerve growth factors(rhNGF)on cell viability of BV2 cells. BV2 cells were treated with rhNGF for 48 h. The cell viability was detected by CCK-8 kit.±s,n=6.*P<0.05,**P<0.01,compared with cell control group.
表2 结果显示,LPS 1,10 和100 mg·L-1诱导24 h 后,BV2 细胞存活率显著降低(P<0.01),促炎因子IL-6,IL-1β和TNF-α及抗炎因子IL-10mRNA水平显著升高(P<0.01),但IL-4mRNA 水平下降(P<0.01),表明LPS可有效激活BV2细胞为炎症状态。考虑为LPS浓度过大对BV2细胞可能造成不可逆损伤,本研究采用1 mg·L-1作为造模浓度。

Tab.2 Effect of lipopolysaccharides(LPS)on viability and mRNA levels of inflammatory cytokines of BV2 cells
2.2 rhNGF改善LPS诱导的BV2细胞损伤
与细胞对照组相比,LPS 组BV2 细胞存活率明显下降(P<0.01);与LPS 组相比,rhNGF 5 μg·L-1对BV2 细胞存活率无明显影响,rhNGF 50 和500 μg·L-1显著升高细胞存活率(P<0.01)(图2A)。因此,后续实验中rhNGF浓度选用50和500 μg·L-1。

Fig.2 Effect of rhNGF on LPS-induced cytotoxicity in BV2 cells. BV2 cells were stimulated with LPS 1 mg·L-1 for 24 h. LPS+rhNGF groups were treated with rhNGF 5,50 and 500 μg·L-1,respectively, for another 48 h. A:cell viability;B:cell morphological changes. ±s,n=6. **P<0.01,compared with cell control group;##P<0.01,compared with LPS group.
由图2B 所示,细胞对照组处于“静息”状态的BV2 细胞显示出具有短分叉结构的较小胞体;LPS组细胞则变圆且胞体增大,表现为活化状态;LPS+rhNGF 50 和500 μg·L-1组细胞胞体较小且长出更多的突触,在一定程度上LPS 诱导的BV2细胞形态变化得到改善。
2.3 rhNGF 通过诱导BV2 细胞向M2 型分化抑制促炎反应
与细胞对照组相比,LPS 组BV2 细胞中IL-6,IL-1β,TNF-α和IL-10mRNA 水平明显升高(P<0.01),IL-4mRNA 水平明显降低(P<0.01)。与LPS 组相比,rhNGF 50 μg·L-1处理48 h 后显著降低BV2 细胞IL-6,IL-1β和TNF-αmRNA 水平(P<0.05),并提高IL-4(P<0.01)和IL-10(P<0.05)mRNA 水平(表3)。CBA 法测定结果(表4)表明,与细胞对照组相比,LPS 组细胞上清液中IL-6 和TNF-α 蛋白浓度显著升高(P<0.01);与LPS 组相比,rhNGF 50和500 μg·L-1使IL-6和TNF-α蛋白浓度显著降低(P<0.01)。各组IL-4 蛋白浓度无明显变化,IL-10 蛋白浓度低于检测限。上述结果表明,LPS 刺激BV2 细胞发生炎症反应后,rhNGF 可在mRNA 和蛋白水平抑制促炎因子,并在mRNA水平促进抗炎因子,从而抑制炎症反应。

Tab.3 Inflammatory cytokine mRNA levels in rhNGF-treated BV2 cells by RT-qPCR
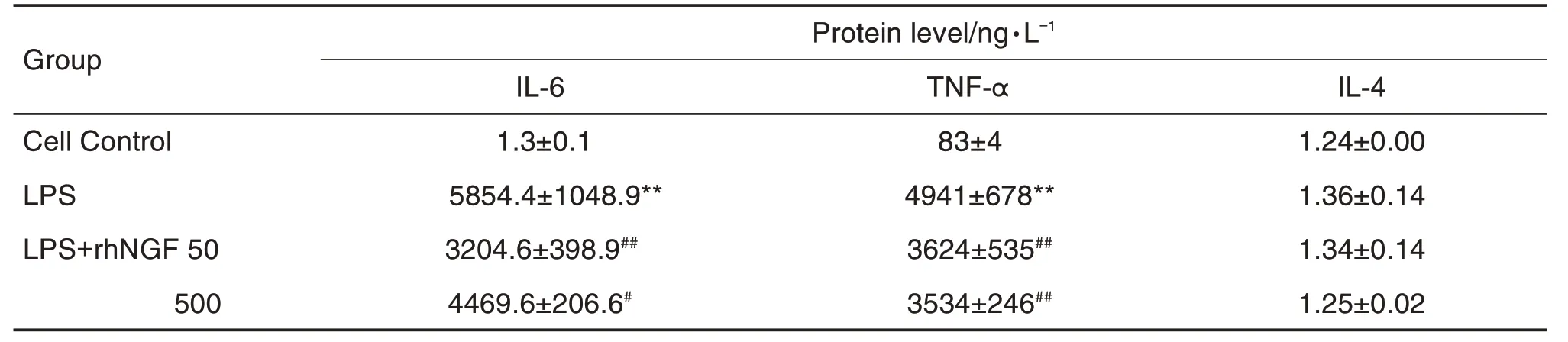
Tab.4 Inflammatory cytokine protein levels in rhNGF-treated BV2 cells by CBA kit
免疫荧光检测M1 表型标志物CD16 和M2 表型标志物CD206 相对表达结果如图3 所示。与细胞对照组相比,LPS 显著增加CD16(绿色)和CD206(红色)表达,CD16 表达增加更显著,表明LPS 激活BV2细胞促进其转化为促炎M1表型。值得注意的是,与LPS 组相比,BV2 细胞经rhNGF 50和500 μg·L-1处理后,CD16 表达水平显著降低(P<0.05),而CD206 表达水平显著升高(P<0.01),表明rhNGF 可诱导BV2 细胞从促炎M1 表型向抗炎M2 表型转化。上述结果提示,rhNGF 通过诱导BV2 细胞向M2 表型极化而抑制炎症反应。
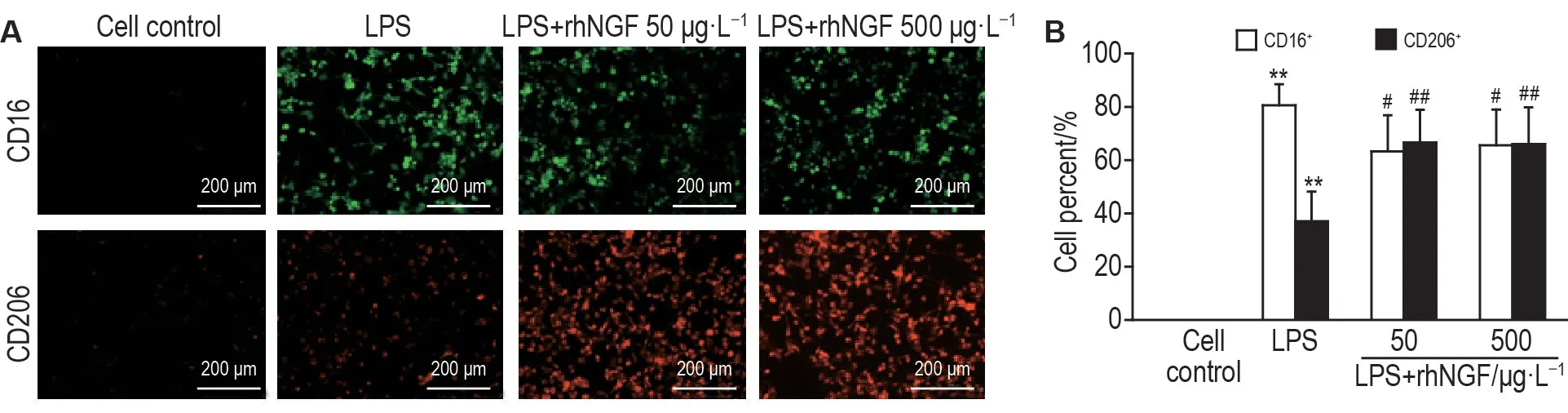
Fig.3 Effect of rhNGF on polarization of LPS-induced BV2 cells. See Fig.2 for the cell treatment. A:immunofluorescence images;green:CD16;red:CD206;blue:DAPI;B:statistical analysis of the percentages of CD16+ and CD206+ BV2 cells. ±s,n=6.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with LPS group.
2.4 rhNGF抑制BV2细胞诱导的N2a细胞凋亡
2.4.1 rhNGF 抑制BV2 细胞-N2a 细胞共培养体系中N2a细胞凋亡
图4A 结果显示,与细胞对照组相比,LPS 直接与N2a 神经细胞培养12 和24 h,TUNEL+NeuN+细胞百分率显著升高(P<0.01)。与LPS 直接作用组相比,LPS 干预后的BV2 细胞与N2a 细胞共培养12 和24 h,TUNEL+NeuN+细胞百分率显著升高(P<0.01)。LPS+rhNGF 50 和500 μg·L-1共同干预后的BV2 细胞与N2a 细胞共培养12 和24 h,与LPS 干预的BV2 细胞与N2a 细胞共培养组相比,TUNEL+NeuN+细胞百分率显著降低(P<0.05,P<0.01)。上述结果表明,炎症状态下BV2 细胞可诱导N2a细胞凋亡,rhNGF可抑制炎症状态下BV2细胞诱导的N2a细胞凋亡。

Fig.4 Iinhibitory effect of rhNGF on inflammation-mediated N2a neuron apoptosis. BV2 cells were divided into cell control,LPS 1 mg·L-1,and LPS+rhNGF 50 and 500 μg·L-1 groups. After treatment as Fig.2,BV2 cells and culture supernatant(microglial con⁃ditioned medium,MCM)were collected. A:N2a cells were co-cultured with BV2 cells collected above for 12 or 24 h before being stained by double of TUNEL and neuron specific nuclear protein(NeuN). A1:representative immunofluorescence images of 12 h(24 h not shown). Green:NeuN;red:TUNEL;blue:DAPI. A2:the proportion of TUNEL+NeuN+/NeuN+cells. ±s,n=6. B:N2a cells were co-cultured with MCM collected above for 12 or 24 h,then N2a cell viability and early apoptotic cell(annexin V+7-AAD−)percent were detected by CCK-8 kit and Annexin V/7-AAD assay,respectively. B1:viability of N2a cells at 24 h. ±s,n=6. B2:early apoptotic cell percent of N2a cells at 12 and 24 h. ±s,n=3. *P<0.05,**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with LPS-group or MCM-control;ΔP<0.05,ΔΔP<0.01,compared with co-culture group with LPS-treated BV2 cells or MCM-LPS group.
2.4.2 rhNGF 抑制BV2 细胞MCM 介导的N2a 细胞凋亡
图4B1 和B2 结果显示,与细胞对照组相比,LPS 组(LPS 直接与N2a 细胞培养)N2a 细胞存活率显著降低(P<0.05),早期凋亡细胞百分率明显增加(P<0.05)。将MCM-对照、MCM-LPS 或MCMrhNGF 50 和100 μg·L-1与N2a 细胞共培养12 和24 h,MCM-LPS 组N2a 细胞存活率显著低于LPS组和MCM-对照组(P<0.01),早期凋亡细胞百分率则明显高于该2 组(P<0.05,P<0.01)。与MCMLPS 组比较,MCM-rhNGF 50 和500 μg·L-1组N2a细胞存活率显著升高(P<0.05,P<0.01),细胞早期凋亡百分率显著降低(P<0.01)。上述结果表明,炎症状态下BV2 细胞分泌至上清的细胞因子可促进N2a 细胞凋亡,rhNGF 可抑制BV2 细胞分泌的细胞因子介导的N2a细胞凋亡。
3 讨论
外源性NGF 能够促进神经修复和调节免疫反应,被认为是中枢神经系统疾病的潜在保护和治疗因子,广泛应用于临床,但rhNGF 神经保护作用机制尚不明确。在中枢神经系统疾病的发生发展过程中,神经炎症是常见的病理特征,也能直接或间接地调节神经细胞功能[21-22]。因此,对免疫系统和神经系统之间的相互作用的控制是预防或治疗大多数中枢神经系统疾病的关键,其中神经元和神经胶质(特别是小胶质细胞)之间的相互作用尤为突出[23]。因此,本研究主要关注rhNGF 对神经元与小胶质细胞相互作用的调节。
促炎因子水平异常升高是导致炎症损伤的关键因素,促炎因子也是神经系统疾病重要的治疗靶标之一[24]。本研究用LPS 刺激BV2 小胶质细胞建立细胞炎症模型,发现rhNGF能明显改善BV2细胞激活后的形态变化并提高细胞存活率,初步证实rhNGF对细胞的保护作用。最近研究表明,NGF的免疫调节作用可减轻脑损伤后的神经炎症[25]。有报道称,在缺血性脑卒中治疗中,抗炎治疗策略比目前主要的基于再灌注的方法具有更好的潜在适用性[26]。然而,通过调节炎症免疫治疗神经损伤仍处于探索阶段。本研究结果表明,在BV2 细胞炎症模型上,rhNGF 显著降低过度激活的BV2细胞促炎因子IL-1β,IL-6 和TNF-α 表达,促进抗炎因子IL-4和IL-10 表达,提示rhNGF 可抑制LPS 诱导的BV2小胶质细胞炎症反应。
目前,对于中枢炎症反应的研究已不局限于抑制小胶质细胞,而是倾向于诱导小胶质细胞从促炎症M1表型转化为抗炎性M2表型,即调节M1与M2表型的比值。本研究结果表明,rhNGF 能够诱导BV2 小胶质细胞从促炎M1 表型转换为抗炎M2 表型,从而调节炎症反应。rhNGF 对小胶质细胞表型转化的调节可能是其抗炎机制之一。因此,调节M1/M2 极化状态比值可能为神经炎症疾病的治疗和新型抗炎药的开发提供一种新的靶向治疗方法。
在许多神经系统疾病中,细胞凋亡是神经损伤的重要环节,而NGF 可减少细胞凋亡,促进神经重建[27-28]。为模拟体内的炎症环境,本研究将LPS 和LPS+rhNGF 活化的BV2 小胶质细胞及其MCM 与N2a 神经细胞共培养。结果表明,rhNGF 显著抑制LPS激活的BV2小胶质细胞及其MCM 对N2a神经细胞的促凋亡作用,增加N2a 神经细胞存活率。由此提示,rhNGF 可通过抑制BV2小胶质细胞炎症介导的神经元凋亡发挥神经保护作用,且该抑制作用可能部分依赖于对BV2 小胶质细胞炎症因子释放的抑制作用。
综上,本研究发现,rhNGF 通过调节小胶质细胞活化状态和抑制炎症介导的细胞凋亡发挥神经保护作用,提高了对rhNGF 神经保护作用机制的理解,并进一步表明小胶质细胞的调节是rhNGF 克服神经炎症相关疾病的一种新的治疗策略。今后将进一步探讨rhNGF 在体内抑制神经炎症和保护神经元的作用,以深入了解rhNGF 治疗神经损伤疾病的可行性。
