绿肥种植对红壤旱地生土细菌群落结构的影响
2023-08-29斯林林王建红
斯林林,徐 静,曹 凯,张 贤,王建红
(浙江省农业科学院 环境资源与土壤肥料研究所,浙江 杭州 310021)
红壤是在我国分布面积居第三位的土壤类型,主要分布在长江以南的15个省(区、市),约占我国南方热带和亚热带地区总面积的1/5[1]。受强烈的风化作用和明显的富铝化作用,以及强降雨和不合理耕作等因素的影响,红壤的pH值相对较低,土壤结构破坏、肥力衰减和土壤退化问题较为普遍[2]。旱地是红壤的重要利用方式,旱地农田约占我国红壤区耕地总面积的40%[3],但红壤旱地的肥力贫瘠程度较水田更加严重。科学合理地改良红壤旱地,重建土壤养分库,提高土壤生产力,充分发挥南方红壤区光、热、水等优越的自然条件,有利于实现我国南方红壤旱地生态系统的健康发展[4]。
种植绿肥不仅是我国传统农业的精髓,而且也是可持续集约化农业生产中一项较有前景的管理措施[5-6]。相关研究已经证实了绿肥在旱地生态系统中的服务功能,如改善土壤质量、提升土壤肥力水平、促进主作物养分吸收、保障主作物优质高产等。此外,旱地绿肥还具有增加休闲期耕地的植被覆盖度、固持土壤养分、增强土壤保墒能力和防止土壤侵蚀等作用[7]。绿肥种类繁多,绿肥作物的类型是影响其作用发挥的重要因素之一。豆科绿肥因根瘤中存在大量的根瘤菌而具有一定的固氮能力,禾本科绿肥因须根发达而有益于土壤团聚体的形成。因此,因地制宜地选取绿肥作物类型是合理利用绿肥的重要前提。
土壤细菌是土壤微生物研究的热点领域,其结构和功能的变化能够灵敏地指示植被或土壤环境的变化,因此受到国内外学者的广泛关注[8]。目前,有关红壤旱地细菌群落的研究多集中于化肥、有机肥和秸秆等不同肥料的影响上[9],涉及发育不成熟的土壤(即生土)的报道鲜见。为此,本研究采用高通量测序技术,以红壤旱地生土为研究对象,分析种植豆科绿肥——大绿豆和禾本科绿肥——高丹草对土壤细菌群落的影响,探明土壤细菌群落对不同绿肥作物类型的响应,揭示驱动细菌群落变化的关键环境因子,以期为绿肥在南方红壤旱地生土上的合理利用提供理论依据。
1 材料与方法
1.1 试验区概况
试验于2021年4—8月分别在浙江省遂昌县三仁畲族乡(28°32′N,119°9′E,海拔453 m)和浙江省景宁畲族自治县澄照乡(27°53′N,119°39′E,海拔1 061 m)进行。试验地均属中亚热带季风气候。遂昌县年平均气温16.8 ℃,年均降水量1 515~1 878 mm,年均日照1 346.5~1 847.8 h,年均无霜期251 d,供试土壤的pH值为5.05,有机质含量4.83 g·kg-1,全氮含量0.13 g·kg-1,有效磷含量5.0 mg·kg-1,速效钾含量126 mg·kg-1。景宁畲族自治县的年平均气温为12.0 ℃,年均降水量2 066.7 mm,年均日照1 600 h,年均无霜期189 d,供试土壤的pH值为5.24,有机质含量8.62 g·kg-1,全氮含量0.31 g·kg-1,有效磷含量3.6 mg·kg-1,速效钾含量139 mg·kg-1。供试土壤均为凝灰岩母质发育的红壤类黄泥生土,作旱地利用。
1.2 试验材料
供试大绿豆为浙江省农业科学院提供的肥田绿豆ZF08-56(PhaseolusvulgarisL. var.humilesAlef),供试高丹草(Sorghumbicolor×S.sudanense)系市售商品。供试有机肥系浙江绿叶生物科技有限公司提供的商品有机肥,有机质含量≥45%、总养分(N+P2O5+K2O)含量≥5%。
1.3 试验设计
试验采用随机区组排列。在遂昌(SC)和景宁(JN)均设置3个处理,分别为不种绿肥的对照(CK),种大绿豆的处理(bean)和种高丹草的处理(ssh)。将试验地点与相应的处理组合,分别标记为SC_CK、SC_bean、SC_ssh、JN_CK、JN_bean、JN_ssh。每个处理均设置3个重复,每个小区的面积为20 m2(4 m× 5 m)。
绿肥作物统一于2021年4月19日条播。大绿豆的播种量为22.5 kg·hm-2,穴播,每穴2~3株,行距80 cm,株距45 cm,10月18日收获;高丹草播种量为30 kg·hm-2,条播,条幅20 cm,行距80 cm,9月27日收获。除对照外,各处理均施用7 500 kg·hm-2有机肥,绿肥生长期间不进行灌溉。
1.4 绿肥生物量测定
大绿豆和高丹草收获期,各处理随机选取15棵整株,装入网袋后带回实验室,用清水将植株冲洗干净,然后在105 ℃杀青30 min,最后于75 ℃烘至恒重,分别测定地上部和根系生物量。
1.5 土壤理化性质测定
2021年8月25日采集CK表层(0~20 cm)土壤,同时在其他处理上选取3株长势相近的绿肥作物,取出全部根系,弃去根系四周松散的土壤,使用毛刷采集与根系紧密结合的土壤作为根际土壤。收集的土壤立即过筛,一部分保存于-20 ℃,用于测定土壤微生物;一部分保存于4 ℃,用于测定土壤活性有机质;剩余部分自然风干,用于测定土壤常规理化性质。具体地:颗粒态有机碳(POC)、颗粒态有机氮(PON)含量均采用六偏磷酸钠分散法测定[10],土壤有机碳(SOC)和全氮(TN)含量采用燃烧法测定,土壤微生物生物量碳(SMBC)、土壤微生物生物量氮(SMBN)含量采用氯仿熏蒸法测定;土壤pH值采用电位法测定;碱解氮(AN)含量采用氢氧化钠水解扩散法测定;有效磷(AP)含量采用盐酸-氟化铵比色法测定;速效钾(AK)含量采用乙酸铵浸提-火焰光度法测定[11]。
1.6 土壤DNA提取、PCR扩增和16S rRNA基因高通量测序
采用E.Z.N.A.土壤DNA试剂盒(美国Omega Bio-Tek)从土壤样品中提取土壤总DNA。使用NanoDrop 2000紫外-可见分光光度计(美国Thermo Scientific)测定提取DNA的浓度和纯度,并通过1%琼脂糖凝胶电泳检测提取DNA的纯度和完整性。
采用GeneAmp 9700型PCR仪(美国ABI)对细菌16S rDNA的V3~V4区进行扩增,引物(序列)为338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)[12]。PCR反应体系(20 μL)如下:5×FastPfu缓冲液4 μL,2.5 mmol·L-1dNTPs 2 μL,5 μmol·L-1正、反向引物各0.4 μL,FastPfu聚合酶0.4 μL,10 ng模板DNA,不足部分用ddH2O补齐。PCR反应条件如下:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,27个循环;72 ℃最终延伸10 min。PCR产物混合后用2%琼脂糖凝胶电泳检测,用AxyPrep DNA凝胶回收试剂盒(美国Axygen Biosciences)切胶回收。
根据Illumina MiSeq平台(美国Illumina)的标准操作规程进行双末端测序。将测序得到的原始数据经过拼接质控与优化数据后,运用UPARSE软件对97%相似度下的OTU(分类操作单元)进行聚类统计分析,通过比对Silva(Release138)数据库,对OTU代表序列进行物种分类注释。基于OTU聚类分析结果,对OTU进行各类多样性指数分析;基于分类学信息,在各分类水平上进行细菌群落结构的统计分析。
1.7 数据分析
利用Microsoft Excel 2010软件整理数据。运用R语言(version 3.3.1)相关包对不同样品间的物种差异进行检验比较。采用Mothur(version v.1.30.2)软件分析Chao1指数和Shannon指数。通过LEfSe软件分析不同土壤样品间的差异细菌标志物。利用Unweighted UniFrac距离算法进行主坐标分析(PCoA)。利用冗余分析(RDA)和皮尔逊(Pearson)相关系数研究土壤因子与细菌种群分布特征之间的相关性。采用Average层次聚类绘制热图。采用SigmaPlot 14.0和R 3.5.2软件制图。
2 结果与分析
2.1 绿肥作物生物量
无论是在遂昌还是景宁,与大绿豆相比,高丹草的地上部、根系和总生物量均显著(P<0.05)更高(表1),高丹草的根系生物量平均约为大绿豆的2倍以上。由此可见,高丹草的根系较大绿豆更为发达。不同地区的大绿豆,其地上部、根系和总生物量间均无显著差异,但在遂昌种植的高丹草的根系和总生物量均显著高于在景宁种植的。

表1 不同处理的绿肥作物生物量Table 1 Biomass of cover crops under different treatments t·hm-2
2.2 土壤理化性质
与CK相比,种植绿肥土壤的有效磷和速效钾含量分别显著(P<0.05)提高150%~974%和36%~110%(表2),说明种植绿肥在一定程度上提高了土壤的速效养分含量。此外,种植大绿豆处理的平均土壤颗粒态有机碳和平均颗粒态有机氮含量分别较CK显著(P<0.05)提高166%和157%,说明颗粒态有机质对种植大绿豆的响应较为灵敏。种植大绿豆处理的土壤微生物生物量碳、氮含量分别平均显著(P<0.05)提高了278%和193%,种植高丹草处理的土壤微生物生物量碳、氮含量分别平均显著(P<0.05)提高了338%和351%。与种植大绿豆相比,种植高丹草更有利于试验条件下根际土壤微生物对碳、氮的利用。

表2 不同处理旱地的土壤理化性质Table 2 Soil properties in dryland under different treatments
2.3 土壤细菌群落组成及其结构
2.3.1 土壤细菌群落的α多样性
种植绿肥对细菌群落多样性的影响取决于试验地点(图1)。例如,在遂昌,与对照相比,种植两种绿肥作物均显著提高了土壤细菌的Chao1指数和Shannon指数;但是,在景宁,种植绿肥作物并没有对细菌群落的多样性产生显著影响,而且种植大绿豆和高丹草的土壤细菌群落多样性亦无显著差异。

“*”和“**”分别表示差异显著(P<0.05)和极显著(P<0.01)。“*” and “**” indicate signficant differnce at P<0.05 and P<0.01, respectively.图1 土壤细菌群落的α多样性指数Fig.1 Alpha diversity index of soil bacterial community
2.3.2 土壤细菌群落组成分析
经高通量测序和优化后,从6个处理的土壤样品中共得到2 293 607条有效序列,经聚类后得到4 598个OTU。将每个试验地区3个处理的样品归为一组,绘制韦恩(Venn)图(图2)。无论是在景宁还是遂昌,种植大绿豆和高丹草处理的OTU数量均高于对照,说明与对照相比,种植两种绿肥作物均增加了土壤中细菌的物种数量。
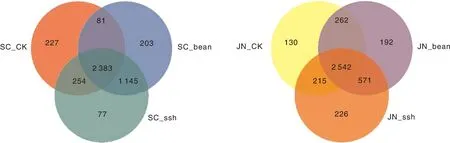
图2 基于细菌OTU(操作分类单元)水平的Venn图Fig.2 Venn diagram of bacterial OTU (operational taxonomic units) level
在门水平上,变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteriota)、酸杆菌门(Acidobacteriota)、浮霉菌门(Planctomycetota)、黏球菌门(Myxococcota)、疣微菌门(Verrucomicrobiota)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、WPS-2和GAL15为主要菌群(图3),其中前7个为优势门类,在各处理上相对丰度的范围分别为21.78%~40.58%、7.76%~24.70%、7.99%~22.54%、8.95%~16.36%、5.07%~7.12%、2.07%~7.12%、1.85%~4.19%,优势门类合计约占84%以上。经过比较分析发现,优势门类在不同处理上的分布比较均匀,相对丰度无显著差异。在主要菌群门类中,土壤拟杆菌门的相对丰度对绿肥种植产生显著正响应,且大绿豆的效果优于高丹草。
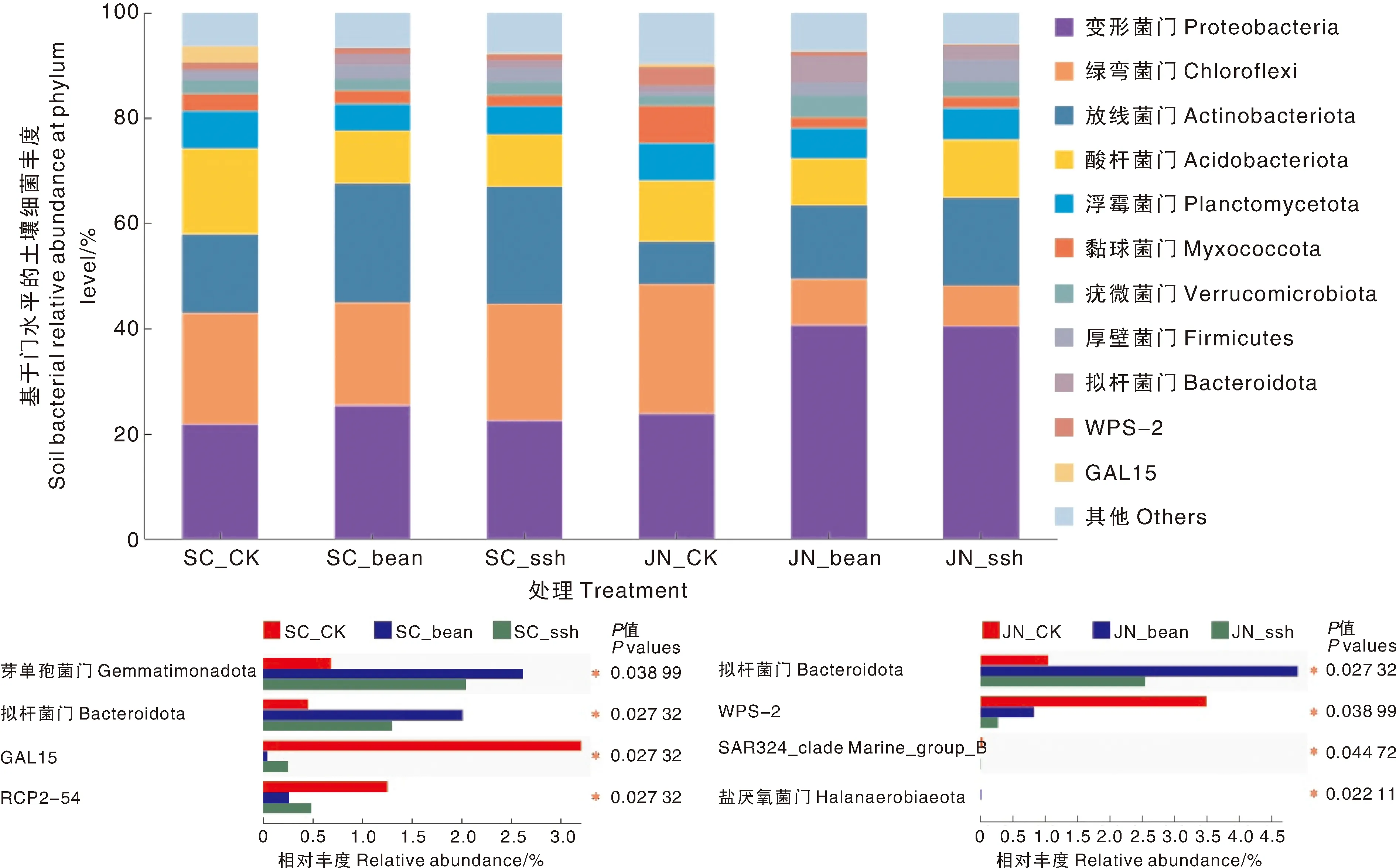
图3 不同处理门水平上的细菌群落组成与差异Fig.3 Bacteria community structure and differences of different treatments at phyla level
LEfSe分析(LDA>4)结果显示,在不同处理间共得到65个差异标志物(图4)。SC_CK的差异标志物主要有酸杆菌目(Acidobacteriales)、Elsterales、Frankiales、Gemmatales、Subgroup_2、黄色杆菌科(Xanthobacteraceae)和HSB_OF53-F07属;SC_bean的差异标志物主要有放线菌门和绿弯菌纲(Chloroflexia);SC_ssh差异标志物主要有纤线杆菌纲(Ktedonobacteria)、嗜热油菌纲(Thermoleophilia)和酸杆菌目;JN_CK的差异标志物主要有绿弯菌门、WPS-2、Myxococcia和亚硝化单胞菌科(Nitrosomonadaceae);JN_bean的差异标志物主要有拟杆菌门和变形菌门;JN_ssh的差异标志物主要有厚壁菌门、α-变形菌纲(Alphaproteobacteria)、微球菌目(Micrococcales)和Burkholderia-Caballeronia-Paraburkholderia。各处理的差异标志物数量分别为对照33个,种植大绿豆处理12个,种植高丹草处理20个。总体上,种植绿肥降低了差异标志物的数量,尤其是种植大绿豆的处理。
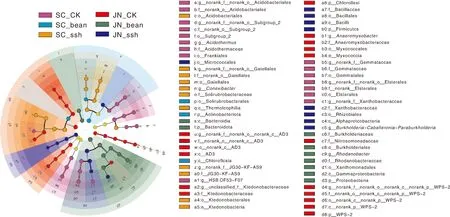
a,酸杆菌目未知科未知属;b,酸杆菌目未知科;c,酸杆菌目;d,Subgroup_2门未知科未知属;e,Subgroup_2门未知科;f,Subgroup_2目;g,酸栖热菌属;h,酸栖热菌科;i,Frankiales目;j,微球菌目;k,Gaiellales目未知科未知属;l,Gaiellales目未知科;m,Gaiellales目;n,束缚菌属;o,土壤红色杆形菌科;p,Solirubrobacterales目;q,嗜热油菌纲;r,放线菌门;s,拟杆菌纲;t,拟杆菌门;u,AD3纲未知目未知科未知属;v,AD3纲未知目未知科;w,AD3纲未知目;x,AD3纲;y,绿弯菌纲;z,JG30-KF-AS9科未知属;a0,JG30-KF-AS9科;a1,HSB_OF53-F07属;a2,Ktedonobacteraceae科未分类属;a3,Ktedonobacteraceae科;a4,细枝菌目;a5,细枝菌纲;a6,绿弯菌门;a7,Bacillaceae科;a8,芽孢杆菌目;a9,Bacilli纲;b0,厚壁菌门;b1,厌氧黏杆菌属;b2,厌氧黏杆菌科;b3,黏球菌目;b4,Myxococcia纲;b5,出芽菌科未知属;b6,出芽菌科;b7,Gemmatales目;b8,Elsterales目未知科未知属;b9,Elsterales目未知科;c0,Elsterales目;c1,黄色杆菌科未知属;c2,黄色杆菌科;c3,Rhizobiales目;c4,α-变形菌纲;c5,Burkholderia-Caballeronia-Paraburkholderia属;c6,伯克霍尔德氏菌科;c7,亚硝化单胞菌科;c8,Burkholderiales目;c9,罗河杆菌属;d0,罗河杆菌科;d1,黄单胞菌目;d2,伽玛变形菌纲;d3,变形菌门;d4,WPS-2门未知纲未知目未知科未知属;d5,WPS-2门未知纲未知目未知科;d6,WPS-2门未知纲未知目;d7,WPS-2门未知纲;d8,WPS-2门。图4 土壤细菌群落LEfSe分析(LDA>4.0)的进化分支Fig.4 Evolutionary cladistic graph based on LEfSe analysis (LDA>4.0) for soil bacterial community
2.3.3 不同绿肥作物根际土壤菌群差异的关键细菌类群分析
在属水平上,进一步分析大绿豆和高丹草根际土壤细菌群落组成的差异(图5)。结果显示,两种绿肥作物间存在显著(P<0.05)差异的根际土壤细菌的相对丰度均不超过3%,其中>1%的属主要为norank_f_Xanthobacteraceae、罗河杆菌属(Rhodanobacter)、norank_f_norank_o_Elsterales、unclassified_f_Ktedonobacteraceae。

图5 属水平上两种绿肥作物根际土壤的细菌群落差异Fig.5 Difference of bacteria community at genus levels between rhizosphere soils of two cover crops
与种植大绿豆相比,在属水平上,种植高丹草的根际土壤细菌群落中norank_f_Xanthobacteraceae、norank_f_norank_o_Elsterales、norank_f_Myxococcaceae的相对丰度分别极显著(P<0.01)提高了80.96%、129.59%和112.79%,norank_f_norank_o_norank_c_norank_p_RCP2-54、链球菌属(Streptococcus)、海藻球菌属(Phycicoccus)的相对丰度分别显著(P<0.05)提高了67.22%、58.00%和95.88%。
与高丹草相比,在属水平上,种植大绿豆的根际土壤细菌群落中罗河杆菌属、unclassified_f_Ktedonobacteraceae、西索恩氏菌属(Chthoniobacter)、norank_f_norank_o_SBR1031、norank_f_Pedosphaeraceae、孤岛杆菌属(Dokdonella)、norank_f_norank_o_Chloroplast、军团菌属(Legionella)、大理石雕菌属(Marmoricola)的相对丰度显著(P<0.05)增加,其中,罗河杆菌属和孤岛杆菌属的相对丰度提高了5~6倍,其余菌属相对丰度的增幅在72.04%~175.49%。
2.3.4 不同绿肥种植方式和试验地点间土壤细菌群落结构差异
基于OTU水平的主成分分析(PCoA)发现,主成分1(PC1)和主成分2(PC2)分别能够解释36.92%和23.56%的方差,累计解释能力达60.48%(图6)。不同试验地点的细菌群落在PC2上发生明显的分离,种植绿肥的处理与对照在PC1上明显分开,种植绿肥后的细菌群落发生明显的聚类(r=0.906 2,P=0.001)。PERMANOVA分析的结果进一步表明,不同种植方式(R2=0.300 2,P=0.001)和不同试验地点(R2=0.239 2,P=0.001)对土壤细菌群落的影响极显著(P<0.01)。

PC1,主成分1;PC2,主成分2。PC1, Principal component 1; PC2, Principle component 2.图6 基于OTU水平的主成分分析(PCoA)和不同处理在PC1轴上的分布离散情况Fig.6 Principal co-ordinates analysis (PcoA) based on OTU levels and distribution and dispersion of different treatments based on the PC1 (principle component 1) axis
2.4 土壤细菌群落与环境因子的RDA分析
RDA分析结果表明,RDA1和RDA2分别解释了微生物群落结构与土壤理化性质关系总变异的26.07%和16.35%,累计解释量为42.42%(图7)。SMBC、AK与pH的射线较长,表明其对细菌群落结构的影响较大且显著(P<0.05),POC的射线较短,表明其对细菌群落结构的影响较小且不显著(P>0.05)。AK与RDA1呈显著(P<0.05)正相关关系(表3),说明速效钾含量是显著影响对照和种植绿肥的处理间土壤细菌群落结构差异的环境因子。

SOC,土壤有机碳;POC,颗粒态有机碳;SMBC,土壤微生物生物量碳;TN,全氮;PON,颗粒态有机氮;SMBN,土壤微生物量生物氮;AN,碱解氮;AP,有效磷;AK,速效钾。下同。SOC, Soil organic carbon; POC, Particulate organic carbon; SMBC, Soil microbial biomass carbon; TN, Total nitrogen; PON, Particulate organic nitrogen; SMBN, Soil microbial biomass nitrogen; AN, Alkaline hydrolysis nitrogen; AP, Available phosphorus; AK, Available potassium. The same as below.图7 基于OTU水平的细菌群落与土壤环境因子的冗余分析(RDA)排序图Fig.7 Redundancy analysis (RDA) ordination diagram of relationships within soil environmental factors and bacterial community based on OTU levels

表3 环境因子对RDA结果的解释权重Table 3 Explanatory weights of environmental factors for RDA results
2.5 土壤细菌群落与环境因子的相关分析
相关性热图的分析结果表明,放线菌门、芽单孢菌门(Gemmatimonadota)、厚壁菌门、髌骨细菌门(Patescibacteria)和拟杆菌门聚为一类,除拟杆菌门外,其余门类与SMBC间存在显著(P<0.05)的正相关关系(图8),髌骨细菌门和拟杆菌门均与pH和AK间存在显著(P<0.05)的相关关系。黏球菌门、绿弯菌门和变形菌门聚为一类,其中黏球菌门与AK和SMBC间存在显著(P<0.05)的负相关关系,绿弯菌门和变形菌门均与pH和AK间存在显著(P<0.05)的相关关系。环境因子对酸杆菌门、浮霉菌门、unclassified_k_norank_d_Bacteria、Armatimonadota的影响较弱。总体上,环境因子中,pH单独聚为一类,其他因子聚为一类。在各环境因子中,颗粒态有机氮影响的土壤细菌种类最少。

“*”“**”“***”分别表示P<0.05、P<0.01、P<0.001。“*” “**” “***” represent significance of P<0.05, P<0.01, P<0.001, respectively.图8 门水平上细菌种类与环境因子的相关性热图Fig.8 Heatmap of correlation within environmental factors and bacterial taxa at phylum level
3 讨论
土壤微生物生物量碳、氮与土壤碳、氮循环密切相关,虽然其在土壤总碳、氮中的比例较低,但其转化速率较快,因此可作为反馈土壤环境变化的较为灵敏的生物学指标[13]。种植大绿豆和高丹草均显著提高了土壤微生物量生物碳、氮,这可能是因为种植绿肥可通过根系向土壤中分泌有机物来改善土壤的理化性质和生物性能[14]。研究表明,不同季节种植豌豆绿肥均提高了土壤的微生物生物量氮[15]。种植高丹草对土壤微生物生物量碳、氮的提升效果优于种植大绿豆,这可能与高丹草发达的根系和较高的生物量有关。微生物生物量碳对细菌群落结构的影响达极显著水平(P<0.01),表明微生物生物量碳是旱地土壤细菌群落结构变化的重要驱动因子[16]。颗粒态有机氮是土壤有机氮的活性组分,是反映土壤氮矿化和周转能力的重要指标[17]。种植大绿豆和高丹草在一定程度上均提高了土壤颗粒态有机氮的含量,且以种植大绿豆的效果更优,这可能与豆科作物的生物固氮能力有关。在土壤有机氮组分中,颗粒态有机氮是矿物态氮的主要来源[18],因此其含量变化会显著影响微生物群落。此外,速效钾也是导致细菌群落结构变化的重要因子,这与已有的研究结果相符[19-20]。
α多样性是对特定区域或生态系统内生物多样性的描述,可反映生物群落中物种的丰富度或均匀度[21]。本研究结果显示,对照与种植绿肥处理之间土壤细菌的多样性差异依赖于试验地点。遂昌试验点的海拔低于景宁,而土壤中细菌的多样性一般随着海拔高度的降低而升高[22];因此,在本试验中,由于海拔高度差异导致的温湿度等气候因子的差异就会对土壤中微生物的多样性产生较大的影响,从而影响试验结果。
土壤中的细菌群落组成较为复杂。本研究中红壤旱地生土细菌的主要优势门类为变形菌门、绿弯菌门、放线菌门、酸杆菌门,其平均相对丰度均高于10%,与亚热带红壤林地不同培肥措施下土壤微生物群落结构的研究结果相似[23]。变形菌门和放线菌门多是富营养型细菌类群,而绿弯菌门和酸杆菌门多属于贫营养型细菌类群。变形菌门的相对丰度是反映土壤养分状况的重要指标之一[24]。本研究中,放线菌门与土壤有机质、碱解氮和有效磷等呈正相关,而绿弯菌门与速效钾呈显著负相关。此外,土壤pH值与绿弯菌门呈显著负相关,而与变形菌门显著正相关。这与周灵芝等[25]对山药根际土壤细菌群落的研究结果一致。大量研究发现,pH是细菌群落结构演替过程中较为重要的主导因子[26]。本研究结果说也明,随着土壤pH值的变化,绿弯菌门与变形菌门的生长呈此消彼长的关系。
与对照相比,种植绿肥的红壤旱地生土中变形菌门和放线菌门的相对丰度有上升的趋势,而绿弯菌门和酸杆菌门的相对丰度呈相反的变化趋势。这可能是因为根系分泌物为根际微生物提供了营养和能源,导致根系会偏好性地选择某些类型的微生物[27-28]。相对于贫营养型细菌,富营养型细菌倾向于在种植绿肥的土壤中富集。种植绿肥在一定程度上提高了土壤中放线菌门的相对丰度,同时显著提高了土壤微生物生物量碳。相关分析表明,放线菌门与土壤微生物生物量碳呈显著正相关。这与Yang等[29]的研究结果一致。与对照相比,种植绿肥有利于提高土壤中放线菌门细菌的相对丰度,促进其对土壤中碳的利用。依据物种丰度,LEfSe分析可发现土壤微生物在不同分类水平上的差异指示种,在土壤质量变化规律预测和微生物多样性保护等方面具有重要意义。本研究中,不同处理下土壤中的细菌差异种明显不同,对照土壤中细菌差异种最多,其次是种植高丹草的处理,而种植大绿豆的处理差异种最少。这表明,随着绿肥的种植,差异指示种的数量减少。这在一定程度上也可反映出不同作物根际微环境的基本特征。
与种植高丹草相比,种植大绿豆显著提高了根际拟杆菌门的相对丰度,这可能与多种因素有关。首先,植物种类对根际微生物群落的结构和活性有较大影响。由于根系形态和根际分泌物不同,各种植物均有其特异性的根际微生物群落。例如,豆科绿肥根系有机酸的分泌量要高于禾本科的高丹草[30],同时,豆科植物分泌的类黄酮能够影响微生物的群体感应[31];而禾本科植物的根系分泌物能显著诱导芽孢杆菌的趋化性、团簇运动和生物膜形成[32]。其次,根际土壤细菌与根部内生菌存在一定的同源性[33],禾本科作物单作时内生的拟杆菌门的相对丰度较低,但与豆科间作时其内生拟杆菌门为优势门类[34]。
4 结论
红壤旱地种植绿肥对细菌群落多样性的影响取决于试验地点。种植绿肥显著提高土壤微生物生物量碳、氮含量,拟杆菌门、罗河杆菌属和孤岛杆菌属的相对丰度也显著增加,但种植绿肥降低了土壤细菌差异标志物的数量,并以种植大绿豆的最少。不同处理下,土壤中的优势细菌门类为变形菌门、绿弯菌门、放线菌门、酸杆菌门、浮霉菌门、黏球菌门和疣微菌门,相对丰度共占84%以上。影响土壤细菌分布的环境因子主要有pH、速效钾和微生物生物量碳,其中pH与髌骨细菌门、拟杆菌门、绿弯菌门和变形菌门间存在显著(P<0.05)相关关系,速效钾与髌骨细菌门、拟杆菌门、黏球菌门、绿弯菌门和变形菌门间存在显著(P<0.05)相关关系,微生物生物量碳与放线菌门、芽单孢菌门、厚壁菌门和黏球菌门间存在显著(P<0.05)相关关系。
