基于光声技术的聚焦超声组织热损伤监测研究
2023-08-28廖怡星刘柯岑喻沁然何峥岩单天琪
廖怡星,刘柯岑,喻沁然,何峥岩,赵 渊,单天琪
(重庆医科大学 生物医学工程学院/超声医学工程国家重点实验室,重庆 400016)
高强度聚焦超声(High intensity focused ultrasound, HIFU)以无创组织消融的特点正迅速发展成为一种公认的临床治疗方式。在HIFU 治疗过程中,聚焦的超声能量被传输到软组织中,超声换能器的聚焦区获得高声强,而聚焦区以外的区域声强较低,高强度超声被软组织吸收后局部温度升高,引发焦域内靶组织细胞凝固性坏死同时保存周围健康组织[1]。HIFU 消融术已被应用于多种良恶性肿瘤的治疗,包括乳腺癌、子宫肌瘤等实体瘤[2-4]。
为了提高HIFU 治疗的有效性,我们需要对靶组织状态进行监测,从而对治疗提供指导和反馈。热效应是HIFU 进行肿瘤消融的主要机制之一,对热损伤的监控是确保HIFU 治疗安全性与有效性的基础[5]。对于HIFU 治疗的监控,目前临床上主要采用的是超声成像和核磁共振成像。超声引导的HIFU 治疗,主要是通过B 超图像的灰阶变化和治疗前后多普勒血流成像来判断热凝固性损伤[6]。但使用B 超监控热凝固性损伤存在许多问题:B 超图像的灰阶变化主要由组织中空化/沸腾泡的出现所引发,而热凝固性损伤可能在空化/沸腾现象之前出现,且并不一定伴随有空化/沸腾,因此,利用B 超图像的灰阶变化对热凝固性损伤进行监测的灵敏度低,在很多情况下无法监测到损伤出现,造成了过度治疗的问题[7];多普勒超声易受多种因素影响,对细小血管及低速血流不敏感,造成其测量精度不高等问题[8]。与基于超声引导不同,磁共振成像(MRI)监测最大的优点是可以获取组织的温度分布,并计算出热剂量分布。然而MRI 的时间分辨率(1~4 s)[9]有限,对于HIFU 治疗中快速温升的情况并不完全适用,并且MRI 的高成本、使用时间较长及使用存在禁忌(对于装有心脏起搏器或植入金属的患者不能使用)等问题很大程度上限制了MRI 引导的HIFU 技术的推广和普及。
因此,建立一种对组织热损伤具有高灵敏度的监测手段对提高治疗的安全性和有效性至关重要。近年来,一些新型成像技术也在探索在HIFU 治疗监测中的应用,光声成像(Photoacoustic Imaging,PAI)以其优秀的光学对比度、时间及空间分辨率,以超声为媒介达到了无损的医学成像目的。光声成像对热病变成像有很大的优势,可以提供生物组织的结构和功能信息,如:氧合血红蛋白及脱氧血红蛋白浓度、黑色素和脂质含量等[10-12]。目前,PAI 在HIFU 治疗中的应用已经有一些研究,例如HIFU 焦域的可视化[13]、损伤前的组织温度检测[14],以及治疗后的热凝固组织评估[15]等。然而在HIFU 治疗组织的过程中,我们往往需要判断靶组织的状态,使其能够达到不可逆的热凝固损伤,同时避免治疗不完全或过度治疗的发生。虽然热凝固损伤引起的组织光吸收系数改变可以反应在光声图像的对比度变化上,但是HIFU 治疗过程中温度持续升高同样会引起靶组织光声图像对比度的变化,因而无法单纯从光声图像上判断治疗过程中组织热凝固损伤形成。此外,由于组织之间的差异性,不同组织达到热凝固性损伤所需要的热计量(加热持续时间和温度的函数)不同,仅对温度成像无法准确判断热凝固损伤的出现及发展过程[16]。并且,目前深部组织内无损测温仍是一个巨大挑战,利用光声技术进行测温的方法大多只能测量相对温度变化[17-19],对于绝对温度的测量仍存在很大局限,无法实现对深部组织内实际温度的测量[20]。因此,如何在HIFU 治疗过程中监测组织热凝固的出现及发展过程仍然是一个有待解决的重要问题。
针对上述问题,本文研究了基于光声信号特征及幅值随加热时间变化规律监测组织热凝固产生及发展过程的可行性。通过构建的光声和HIFU 一体化系统,对离体牛肝组织在HIFU 辐照过程中光声信号幅值变化进行测量,研究了组织热凝固前、热凝固形成过程中及组织完全热凝固后光声信号幅值与加热时间的依赖曲线特征,并通过对不同阶段的组织进行病理分析验证了不同曲线特征与组织状态的对应性。本研究为实时监测HIFU 治疗中组织热凝固的形成过程提供了一种新的技术路径,具有重要的临床意义。
1 材料和方法
1.1 理论背景
光声信号是基于脉冲激光辐射对超声波的热声激励。在应力约束辐照条件下,用入射激光通量为F 的短激光脉冲照射吸收介质,在吸收体内引起瞬时压力上升P
式中:β 为热膨胀系数,℃-1;cs为声速,m/s;Cp为恒压下的热容,J/g℃;F 为激光通量,J/m2;μa为光吸收系数,m-1;Γ 为与温度相关的函数(Grüneisen)。式(1)将局部压力与局部Grüneisen 参数、光通量和吸收系数联系起来,当热沉积过程中的压力弛豫可以忽略时,式(1)在应力约束条件下是有效的。当激光脉冲持续时间τp小于吸收体应力弛豫时间τstr时,满足应力约束条件
因为Grüneisen 系数取决于组织温度,因此光声信号具有一定的温度依赖性,当组织未发生热凝固时(温度低于43 ℃),μa变化可忽略不计,若光通量不变,则光声信号振幅只与温度相关。当组织开始发生热凝固性损伤时(43~55 ℃),组织变化导致μa发生较大变化,同时,温度升高及组织脱水都会导致组织Grüneisen 系数改变,此时光声信号振幅变化受组织变化与温度共同影响。当组织完全热凝固后(温度高于55 ℃),已经脱水的组织Grüneisen 系数的温度依赖性减弱,同时,组织完全热凝固后,其结构和成分不再发生剧烈变化,即μa基本不变,则此时光声信号幅值变化较小。当组织过度治疗时,其结构和成分再次发生较大变化,那么光声信号幅值也会随之发生较大改变。因此,在HIFU加热组织产生热凝固的不同阶段,光声信号随加热时间变化规律不同,由此可根据光声信号随加热时间变化规律的改变来判断组织状态。
1.2 实验设置
实验系统示意图如图1 所示,本系统使用可调谐光参量振荡(optical parametric oscillators,OPO)激光器(NSOPO-L532HF-200,中科思远,中国),以100 Hz的重复频率,输出720 nm 波长的激光,其中脉冲持续时间为5 ns,并耦合入定制高能光纤束(CeramOptec,德国),光纤束末端固定在定制聚焦超声换能器中心开孔处,激光通过换能器中心孔垂直辐照于下方样本组织表面,通过能量计测得样本组织表面的能量密度为6.6 mJ/cm2,小于美国国家标准(American National Standards,ANSI)中720 nm 波长激光的安全标准[21]。组织产生的光声信号由1 个中心频率为1 MHz 的超声换能器(奥索电子科技,中国,带宽:0.39~1.61 MHz)接收,并经由放大器放大后通过示波器(Picoscope5000D,Pico 科技,英国)采集并上传存储至上位机中。样品组织封装在1 个直径为4.5 cm 的2%琼脂糖仿体中与水隔离,仿体放置于亚克力水缸正中心的盛放支架上,水缸中装满脱氧水。聚焦超声换能器匹配层浸入水中,对下方组织以15 W 的电功率进行辐照,整个辐照过程时长约为56 s。
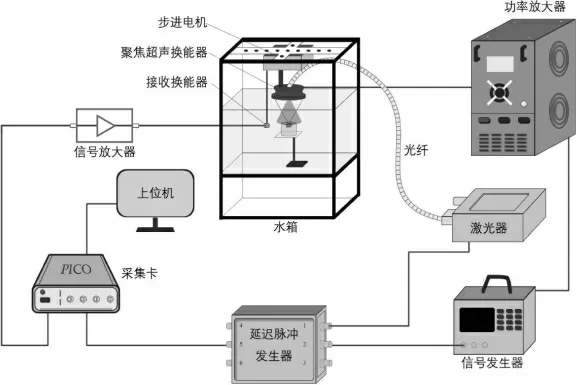
图1 光声与聚焦超声一体化系统
本系统中采用多通道数字延迟脉冲发生器(DG538,中科思远,中国)实现激光器、数据采集及聚焦超声发射的触发。触发时序如图2 所示,在聚焦超声发射间隙进行光声信号采集,实现光声对聚焦超声治疗的实时监测,激光器与数据采集同步触发,延迟1 ms后触发聚焦超声发射,避开光声采集时段,从而避免聚焦超声发射对光声信号的干扰。实验中光声信号经过多次平均,以排除激光能量抖动及实验环境所带来的实验误差。上位机使用LabView 开发程序,实现系统控制及实验结果的实时显示。

图2 聚焦超声治疗与光声采集时序图
聚焦超声通常治疗的部位是一些软组织,所以实验选用血液灌注丰富的牛肝组织作为软组织模型。实验采用新鲜组织(从动物身上取出6 h 以内),将其放入空气泵当中脱气1 h,除去组织中的气泡,防止气泡影响原始光声信号,接着将组织切割为1.5 cm×1.5 cm×1.5 cm 的方块,嵌入仿体当中。取得4 组样本进行实验。
2 结论
2.1 牛肝组织焦点处的时域光声信号特征
利用聚焦超声换能器对样本组织进行加热,会对靶组织造成1 个直径约1 mm 的热凝固损伤,在不同时刻对靶组织光声信号进行采集。图3 是牛肝组织在HIFU 治疗后的焦域形态的示例。

图3 牛肝组织在HIFU 治疗后焦点的形态
牛肝组织在HIFU 治疗开始前、HIFU 治疗结束后及焦域冷却后3 种状态下检测到的光声信号时域剖面图的典型分布如图4 所示。

图4 利用超声换能器对不同状态下的牛肝组织样品当中激发出的光声信号在时域下进行检测
由图4 可知,牛肝组织在HIFU 治疗前后光声信号振幅呈倍数增加,在治疗冷却后焦域处光声信号振幅比刚完成治疗后有所减少,但是依然比治疗前有显著增加,得以证明此时焦域已完成热凝固性损伤,揭示了组织中不可逆的损伤。可以发现,热损伤后的组织样品光声信号前缘信号比热损伤前样品组织的焦点信号前缘斜率变陡了许多。一般地,在光通量不变的情况下,较大的光吸收系数会产生更锋利的前缘信号[22]。光声信号后缘斜率可以定性地反映光学性质(光吸收系数μa或光散射系数μs两者的增加都有可能导致斜率变陡)[23],后缘斜率随着不同时刻发生变化,在不同温度状态下呈不同形态。因此,光声信号振幅及特征可一定程度反映热凝固前后的组织状态。
2.2 牛肝组织光声信号振幅与治疗时间的关系及样本组织焦点处病理切片分析
用采样频率为10 Hz 的热电偶插在聚焦超声焦点处,进行记录组织升温过程,聚焦超声加热过程中焦域处靶组织的温度变化示例如图5 所示,可以看到聚焦超声加热组织温升相对均匀。

图5 聚焦超声加热过程中焦域处靶组织的温度变化
图6 为牛肝样本靶组织的光声信号振幅随加热时间变化的示例图。从图6 中看出,光声信号有3 个变化阶段,在第一个阶段(加热20 s 内),靶组织温度在43~55 ℃(图5),光声信号幅值随加热时间迅速升高,对该区间数据进行最小二乘拟合得到曲线斜率为0.002 44±1.659 59×10-4V/s。在第二阶段(20~53 s),靶组织温度在55~62 ℃,光声信号幅值随加热时间变化率大幅减小,对该区间数据进行最小二乘拟合得到曲线斜率为0.000 51±4.363 56×10-5V/s。在第三阶段(53~80 s),靶组织温度在62~72℃,光声信号幅值随加热时间再次迅速升高,对该区间数据进行最小二乘拟合得到曲线斜率为0.001 59±6.833 09×10-5V/s。表1 为4 组样品在光声信号幅值随时间变化的3 个阶段数据的最小二乘拟合斜率。可以看出光声信号幅值随时间变化均存在相似规律。多组实验中光声信号振幅变化规律基本一致,表示该实验结果的准确性。导致上述光声信号变化规律的原因,可能是靶组织在第一阶段(43~55 ℃)开始产生部分热凝固,此时靶组织成分和结构发生变化,组织开始脱水萎缩,导致组织发色团浓度增加,光吸收系数升高,同时,温度升高及组织脱水导致Grüneisen 系数升高。由式(1)可知,光声信号振幅与光吸收系数及Grüneisen 系数成正比,因此,产生组织热凝固的阶段,牛肝组织光声信号会迅速升高。在第二阶段(20~53 s),靶组织已经完全热凝固,此时,由于已经脱水的组织Grüneisen 系数温度依赖性大幅减弱,且光吸收系数变化较小或基本不变,因此,在已形成完全热凝固的阶段,光声信号幅值变化率大幅减小。在第三阶段,当组织完全热凝固后继续对靶组织加热,随着温度升高,组织结构和成分进一步发生变化,导致光声信号幅值变化率改变,此时组织已经过度治疗。例如,肝脏组织是一种典型的具有丰富血流灌注的组织,血红蛋白是产生光声信号的主要内源发色团,在高温下(60 ℃以上),血红蛋白会转化为高铁血红蛋白,其光吸收系数也会随之增大,因此,光声信号幅值再次快速升高可以指示靶组织过度治疗。

表1 4 组样品在光声信号幅值随时间变化3 个阶段数据的最小二乘拟合斜率

图6 牛肝样本靶组织的光声信号振幅随加热时间变化
为了验证上述光声信号幅值变化规律与HIFU 治疗过程中靶组织状态变化的对应性,本研究对3 个不同阶段的靶组织进行了HE 染色病理分析。根据光声信号振幅随时间变化曲线,取3 个不同阶段的样本组织(同一块肝脏组织取下),图7 为不同阶段组织HE染色图示例。如图7(a)所示,在第一阶段(加热20 s 内,43~55 ℃),开始产生热凝固损伤阶段,肝小叶内可见小叶中央静脉(实线箭头所示),虚线箭头所指部分区域内可见少量炎性细胞浸润,划线箭头处空隙与周围组织间未见细胞破裂,故可见微小组织病变,由此可知组织已开始产生部分热凝固。在第二阶段(加热20~53 s,55~62 ℃),如图7(b)所示,实线箭头所指可见小叶中央静脉,虚线箭头处可见肝细胞索之间少量出血,划线箭头表示肝细胞核,可见损伤点与周围组织边界清晰,并且伴随细胞膜破裂,细胞核露出,细胞收缩颜色变深,表示细胞死亡,靶组织已经形成热凝固损伤。在第三阶段(加热53 s 之后,62~72 ℃),如图7(c)实线箭头所示,治疗区域内肝组织明显破坏,肝细胞完全消失,治疗区域边界周围伴有大量炎性细胞浸润(圆圈内)并且大量出血,划线箭头所示,损伤点与周围正常组织之间边界清晰,细胞膜破碎,肝细胞核萎缩导致边界颜色加深,此时热损伤已经过度。上述病理结果与我们得到的3 个阶段光声信号幅值随时间变化规律相吻合,由此证明了基于光声信号幅值随时间变化规律对HIFU 治疗过程中组织热凝固产生及发展过程监测的可行性。

图7 光声信号幅值随时间变化的3 个阶段中牛肝靶组织细胞层面展示及病理分析
3 讨论
本文研究了基于光声信号特征及幅值随时间变化规律监测HIFU 治疗过程中组织热凝固的产生及发展过程的可行性。该方法避免了深部组织内无损测温的困难,通过热凝固产生过程中组织不同状态下光声信号特征及信号幅值随时间变化规律的不同对组织状态进行监测。在组织开始发生热凝固的阶段,光声信号幅值快速升高,信号幅值随时间变化率较大。这是由于组织在凝固过程中会发生脱水萎缩,由于软组织的热膨胀系数远大于水的热膨胀系数,因此组织脱水会导致热膨胀系数的增大,并且软组织的脱水会导组织内含水量降低,从而使组织比热Cp降低,导致急剧升高。Grüneisen 系数受到热膨胀系数β 及比热Cp的影响而升高,此外,组织脱水萎缩的过程也会导致产生光声信号的发色团浓度增加,从而使光吸收系数升高。Grüneisen 系数与光吸收系数二者同时作用使光声信号幅值快速升高,表现为信号幅值随时间变化率较大,这就是图6 中光声信号幅值变化的第一个阶段。同时对靶组织温度进行测量(图5),靶组织温度处于43~55 ℃,该温度是组织发生热凝固的温度范围。当靶组织形成完全热凝固时,已经脱水的组织Grüneisen系数的温度依赖性大幅降低且光吸收系数变化较小,因此,这一阶段光声信号幅值变化较小且随时间变化率大幅降低。随着HIFU 的持续治疗,组织温度持续升高,组织结构及成分随之发生变化,在高温下(大于60 ℃),组织内的血红蛋白会逐渐转化为高铁血红蛋白[24],使光吸收系数大幅增加,导致光声信号幅值再次快速升高,信号随时间变化率提高。图7 的组织病理分析表明,此阶段存在过度治疗。
综上所述,本文提出了利用光声信号特征及幅值随时间变化规律对HIFU 治疗过程中肝脏组织热损伤进行监测,从多个角度表征热损伤的状态,并且在细胞层面对实验结论进行验证。研究表明该方法可以避免深部组织无损测温的难题,实现对组织热凝固形成过程的无损监测。研究结果为HIFU 治疗中组织热凝固实时监测提供了一种新的技术路径,具有重要的临床价值。
