某院金黄色葡萄球菌耐药性分析及毒素基因与耐药基因检测
2023-08-28陈晓聪李卓禧侯竹如杨娅男严荣荣徐本锦
刘 玲,陈晓聪,李 璟,范 蕾,李卓禧,侯竹如,杨娅男,严荣荣,徐本锦▲
1.山西医科大学汾阳学院医学检验系,山西汾阳 032200;2.山西省汾阳医院检验科,山西汾阳 032200;3.山西医科大学汾阳学院基础医学部,山西汾阳 032200
金黄色葡萄球菌是造成感染性疾病和食物中毒的主要原因,可引起皮肤和软组织感染、坏死性肺炎、败血症、中毒性休克综合征和血液感染等多种疾病[1-3]。近年来,各类抗菌药物的广泛使用及滥用导致金黄色葡萄球菌耐药性增强,并出现超级耐药菌耐甲氧西林金黄色葡萄球菌(MRSA)。MRSA比甲氧西林敏感的金黄色葡萄球菌(MSSA)毒性更强。MRSA不仅对绝大多数β-内酰胺类抗菌药物耐药,而且对氨基糖苷类、大环内酯类、林可霉素类、四环素类及喹诺酮类等抗菌药物产生多重耐药,目前已成为临床抗感染治疗的棘手问题,常导致治疗失败、医疗费用和病死率增加[4]。其中,苯唑西林敏感的耐甲氧西林金黄色葡萄球菌(OS-MRSA),因其对苯唑西林的敏感性,常导致药敏试验的错误识别,可能被错误地归类为MSSA,导致潜在的治疗失败,目前有关山西地区OS-MRSA感染现状的数据仍然有限。金黄色葡萄球菌的感染能力与其携带的毒素基因种类和数量有关。这些毒素基因编码肠毒素(SEs)、肠毒素样毒素(SEls)、杀白细胞素(PVL)、剥脱毒素(Ets)和中毒休克毒素-1(TSST-1)等多种毒力因子。除早期报道的5种经典肠毒素基因(sea~see)外,还鉴定到十余种新型肠毒素基因(seg~sej、sel~seq、ser~set)[5]。杀白细胞素是由lukS-PV和lukF-PV两个基因编码的蛋白复合体,可引起皮肤、软组织感染和严重的坏死性肺炎[6]。剥脱毒素主要引起皮肤散热功能失调,对婴幼儿和儿童危害严重,目前已知的剥脱毒素基因主要有4种(eta~etd),其中剥脱毒素ETA和ETB与人类皮肤损伤关系密切[7]。中毒休克毒素-1是中毒休克综合征的关键致病因子,可引起发热、皮疹、低血压、皮肤脱皮,并累及身体多个脏器[8]。掌握金黄色葡萄球菌的分子特征对于鉴别菌株间的亲缘关系、分析传播因素、查找传染源并有效控制感染意义重大。本研究测定了山西省汾阳医院20株金黄色葡萄球菌对15种常见抗菌药物的耐药性,利用PCR 技术检测了菌株致病基因的携带情况,确定了菌株的耐药谱、耐药基因谱和毒素基因谱,旨在深入了解山西省汾阳医院金黄色葡萄球菌的流行特点、毒力和耐药机制,为有效防治该菌感染提供了科学依据。现报道如下。
1 材料与方法
1.1标本来源 2021年4-9月在山西省汾阳医院分离到金黄色葡萄球菌20株(编号39~58),主要来自分泌物12株(编号40~45、47、49、51、52、57、58)和脓液8株(编号39、46、48、50、53~56),其中耳鼻咽喉科5株(编号39、45、46、50、57),新生儿科7株(编号40、42、44、47、52、55、56),儿科3株(编号41、53、58),骨科2株(编号49、51),内分泌科(编号43)、普外科(编号54)和肛肠科(编号48)各1株。标准菌株ATCC25923和ATCC29213由本实验室保存。
1.2仪器与试剂 dNTPs、Taq DNA聚合酶、10×PCR Buffer及DL1 000 DNA 标志物(大连宝生物),PCR引物(上海生工),6×DNA Loading buffer、Trans2K Plus DNA标志物及EasyPure®bacteria genomic DNA kit(北京全式金),NA-Green及TBE(碧云天),琼脂糖(BIOWEST),PCR仪(Bio-Rad),NanoDrop One超微量紫外分光光度计(赛默飞世尔),VITEK2-Compact全自动微生物鉴定及药敏分析仪及配套药敏卡GP67(法国生物梅里埃股份有限公司),BACTECFX全自动血培养系统及配套的血培养瓶(碧迪公司),血琼脂平板(郑州安图生物)。
1.3方法
1.3.1菌株的分离鉴定及药敏试验 严格按照第4版《全国临床检验操作规程》进行,将临床送检的各种分泌物、尿液等标本直接接种到血琼脂平板,培养18~24 h,挑取可疑的菌落进行分纯鉴定;血液标本注入血培养瓶上机培养,待仪器检测到细菌生长信号后再转种到血琼脂平板上培养18~24 h,挑取可疑的菌落进行鉴定;采用VITEK2-Compact全自动微生物鉴定及药敏分析仪检测细菌的最低抑菌浓度(MIC)。
1.3.2基因组DNA提取 将分离株接种至血平板,37 ℃培养过夜后挑取单菌落于8 mL LB液体培养基,37 ℃振荡培养12 h;取1 mL培养的菌液,用革兰阳性菌基因组DNA提取试剂盒抽提菌株基因组DNA,NanoDrop One超微量紫外分光光度计定量后进行琼脂糖凝胶电泳检测,其余样品置于-20 ℃冰箱保存。
1.3.3PCR反应体系及扩增条件 PCR体系为25.0 μL:灭菌超纯水17.5 μL,10×PCR缓冲液2.5 μL,dNTPs 2.0 μL,DNA模板1.0 μL,正、反向引物各1.0 μL,Taq DNA聚合酶0.125 μL。外排泵基因、耐药基因和毒素基因的引物序列和扩增条件分别参照文献[9-11]执行。
2 结 果
2.1耐药率测定 金黄色葡萄球菌对青霉素的耐药率最高(100%),其次是红霉素和克林霉素(70%)。所有菌株对米诺环素、呋喃妥因、阿米卡星、万古霉素和利奈唑胺敏感。见表1。
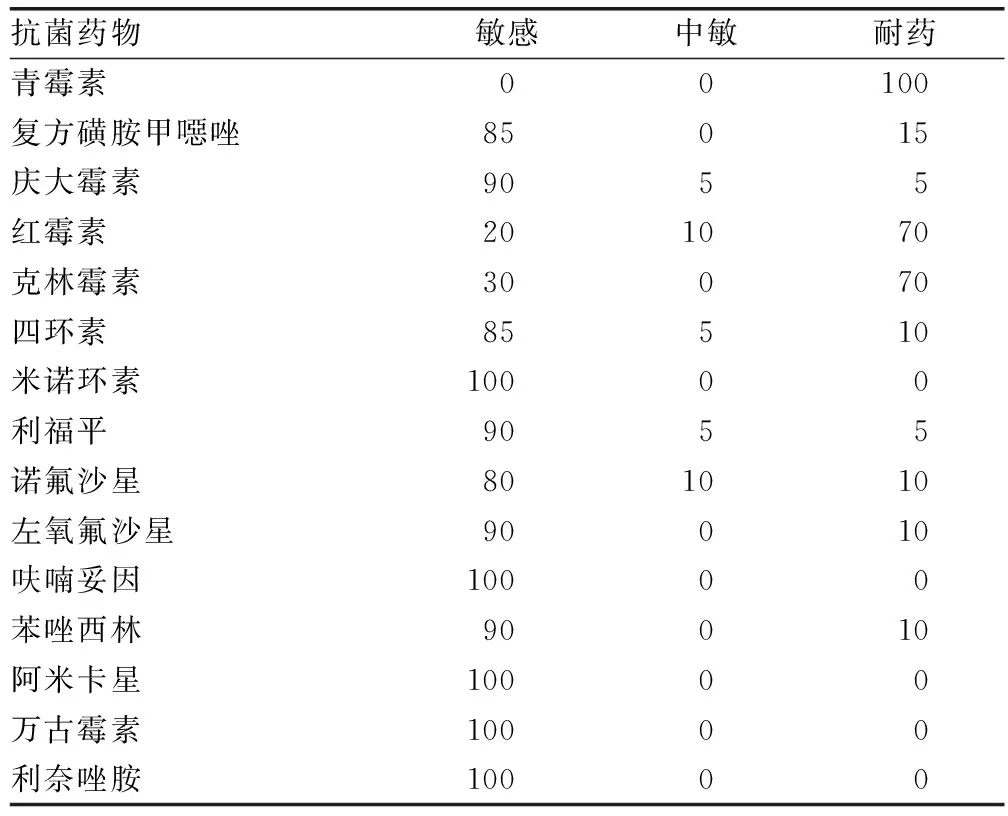
表1 金黄色葡萄球菌的耐药率(n=20,%)
2.2耐药谱分析 所有菌株对青霉素耐药,有14株多重耐药菌(耐药谱≥3种抗菌药物),占比为70%,其中四重耐药菌、五重耐药菌和六重耐药菌各有2株(10%)。见表2。
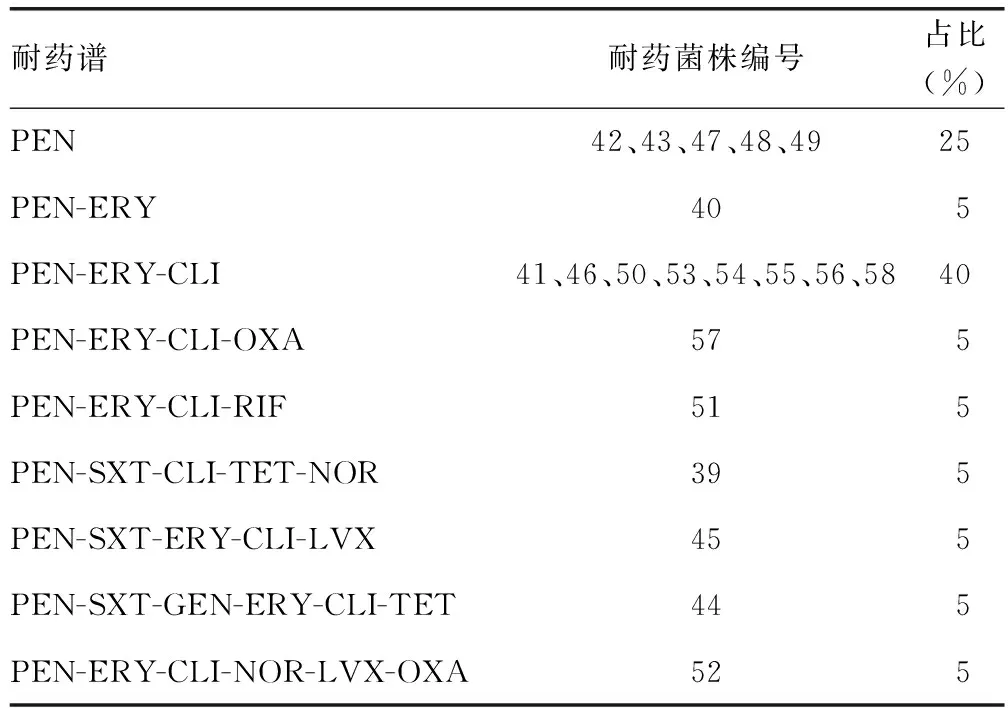
表2 金黄色葡萄球菌的耐药谱
2.3基因组DNA提取 金黄色葡萄球菌是革兰阳性菌,细胞壁较厚,琼脂糖凝胶电泳检测结果显示,DNA条带清晰、单一,相对分子质量大小符合预期。见图1。
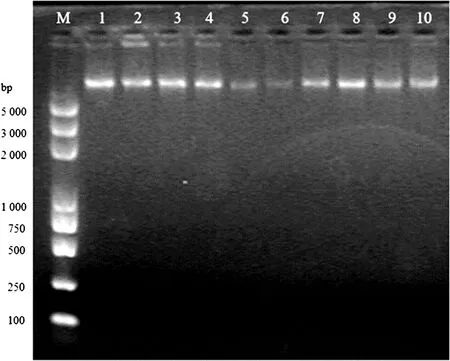
注:M表示Trans2K Plus DNA标志物,1~10泳道表示编号39~48菌株。
2.4耐药基因检测 所有菌株共检出9个耐药基因和3株MRSA,其中1株为OS-MRSA(编号58菌株)。gyrA和grlA检出率最高,均为100%;其次是ermC和tet(k),检出率分别为95%和80%;再次是blaZ,检出率为60%;Lin(A)和ermB检出率分别为30%和20%;52、57和58号菌株为mecA阳性;aacA-aphD检出率为5%;所有菌株均不携带ermA、fexA、tet(L)、tet(M)、tet(O)、optrA和cfr。部分检测结果见图2。
2.5耐药基因谱分析 所有菌株至少携带3种及以上耐药基因,占比最高的耐药基因谱是ermC-gyrA-grlA-tet(k),占比为25%,其次是blaZ-ermC-gyrA-grlA-tet(k)-Lin(A),占比为20%。见表3。
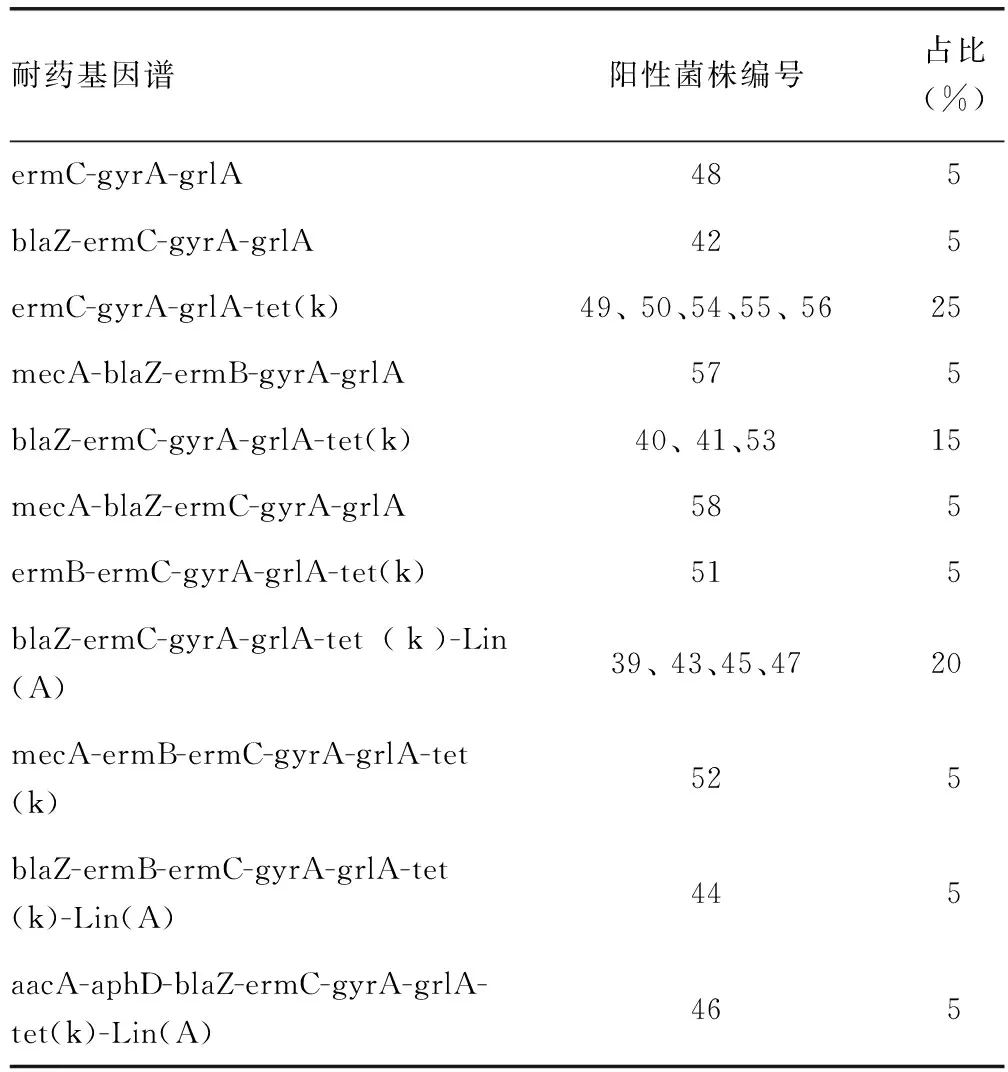
表3 金黄色葡萄球菌的耐药基因谱
2.6外排泵基因检测 所有菌株共检出6个外排泵基因,其中norB和mepA检出率最高,均为100%;其次是norC和mdeA,检出率分别为95%和90%;再次是norA,检出率为70%;sepA检出率为40%;所有菌株均不携带qacA/B和smr,部分检测结果见图3。

注:A表示nuc~smr基因电泳结果,M为DL1 000 DNA 标志物,1为nuc,2为mecA,3为norA,4为norB,5为norC,6为sepA,7为mepA,8为mdeA,9为qacA/B,10为smr;B表示外排泵基因mepA电泳结果,M为DL1 000 DNA 标志物,1~20泳道为mepA基因,菌株编号39~48。
2.7外排泵基因谱分析 所有菌株至少携带3个及以上外排泵基因,占比最高的外排泵基因谱是norA-norB-norC-sepA-mepA-mdeA(35%),其次是norA-norB-norC-mepA-mdeA,占比为30%。见表4。
2.8毒素基因检测 所有菌株共检出18个毒素基因,包括耐热核酸酶基因nuc、杀白细胞素基因pvl、表皮剥脱毒素基因eta及15种肠毒素基因。其中nuc基因的检出率(100%)最高;其次是肠毒素基因sei和selo,检出率分别为55%和50%;再次是肠毒素基因seg和selp,检出率分别为45%和40%;selk检出率为35%;pvl、eta、seln、selq检出率均为30%;seb、see、seh、sell、selm检出率均为20%;sea和selu检出率均为10%;sec检出率为5%;所有菌株均不携带中毒休克症毒素基因tst、表皮剥脱毒素基因etb及肠毒素基因sed、selj、ser。部分毒素基因检测结果见图4。
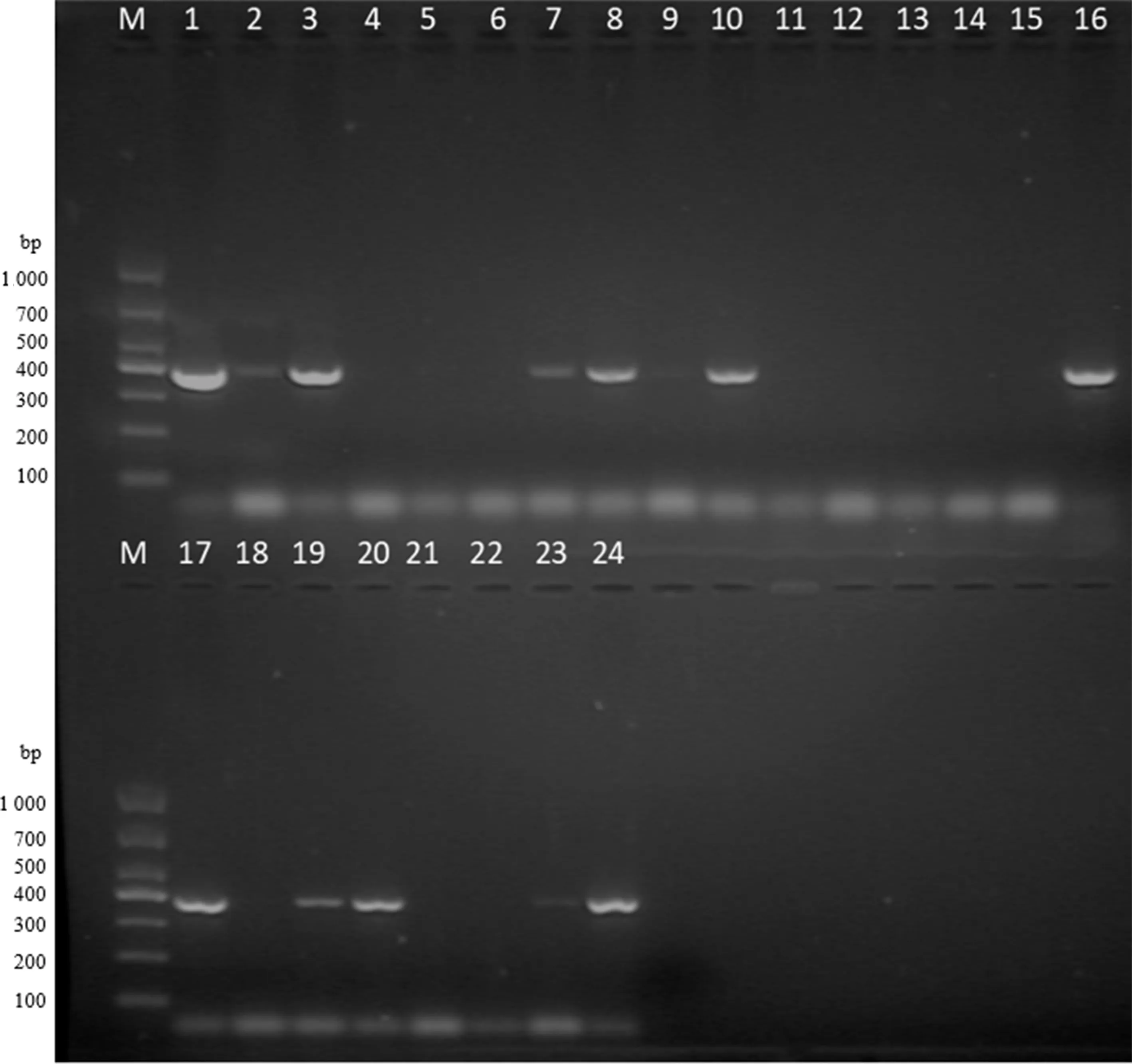
注:M表示DL1 000 DNA 标志物,1~24泳道为seg,1为ATCC29213-1,2为ATCC29213-2,3为ATCC25923-1,4为ATCC25923-2,5~24泳道为编号49~58菌株。
2.9毒素基因谱分析 所有菌株至少携带3种及以上毒素基因,nuc-see-selp和nuc-pvl-sell-selp在所有毒素基因谱中占比最高,均占比为10%,其他毒素基因谱均占比为5%。见表5。
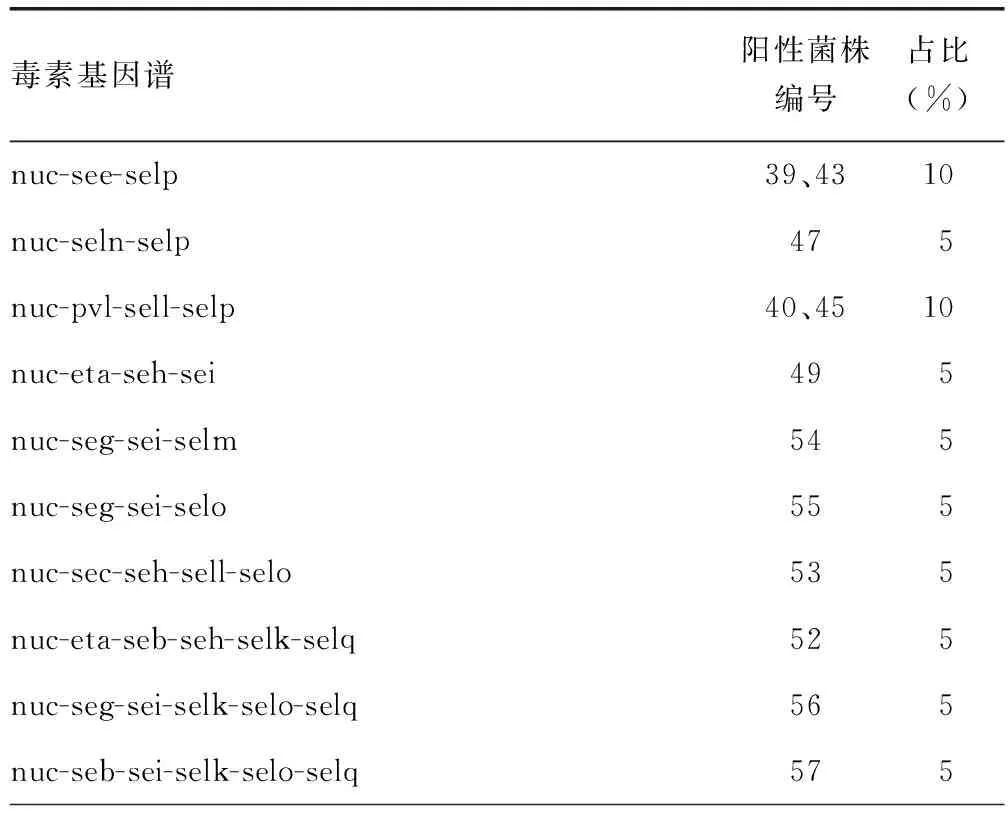
表5 金黄色葡萄球菌的毒素基因谱
3 讨 论
中国细菌耐药监测网(CHINET)显示,中国MRSA分离株的检出率在近五年逐年下降,从2005年的69.0%降低至2020年的31.0%(http://www.chinets.com/)。与CHINET数据相比,本研究MRSA检出率(15%)比中国2020年的检出率降低了16.0%。相比之下,2016年美国和南非的MRSA流行率分别为44%和27%,2017年澳大利亚和英国的MRSA流行率分别为19%和7%(https://resistancemap.cddep.org/)。以上结果表明,不同国家和省份MRSA的流行情况不同。
本研究所有菌株对青霉素耐药(100%),对红霉素、克林霉素的耐药率为70%,这与LIU等[12]的报道基本一致。菌株对青霉素极高的耐药率可能是其作为一种常用药物,长期以来广泛应用于葡萄球菌感染治疗,并在金黄色葡萄球菌中建立了相当稳定的耐药性。然而耐药基因检测结果显示,青霉素酶编码基因blaZ的检出率只有60%,这一差异提示可能存在其他青霉素耐药机制。
本研究中,70%的菌株表现出多重耐药,且大多数对青霉素、红霉素和克林霉素表现出共同耐药,这与PAHLAVANZADEH等[13]报道结果差异不大,但比LIU等[12]报道结果低10%。20株样本中共检出3株MRSA,其余17株为MSSA,其中多重耐药株包括所有MRSA(100%,3/3)和11株MSSA(64.7%,11/17),MRSA中多重耐药菌株的比例是MSSA的1.5倍,低于GAN等[14]报道的结果。这表明MRSA耐药严重,可能是由于MRSA在获得可移动遗传元件方面的亲和力增加,如转座子或携带耐药基因的接合质粒[15]。值得注意的是,编号41菌株对苯唑西林的MIC为2 μg/mL,但未检测到mecA基因,这可能mecA基因发生了点突变或缺失或由于抑制剂存在而导致PCR反应的假阴性[16],也可能是该菌携带其他耐药基因如mecC[17],这一现象还在进一步研究中。菌株对利福平和庆大霉素的耐药率仅为5.0%,且所有菌株对米诺环素、呋喃妥因、阿米卡星、万古霉素及利奈唑胺敏感。这与文献[18-19]报道结果相一致,表明这些药物可能会成为临床抗感染治疗的首选。对耐药谱进行分析后发现,PEN-ERY-CLI(占比为40%)是最流行的耐药谱,20%的菌株为五重和六重耐药。因此,临床治疗应合理选用抗菌药物以控制耐药菌的出现和传播。
本研究所有菌株都携带氟喹诺酮类耐药基因grlA和gyrA,共检出6个外排泵基因,其中norB和mepA检出率最高(100%),其次是norC(95%)和mdeA(90%),再次是norA(70%),这与张行等[9]报道结果基本一致。然而菌株对喹诺酮类药物诺氟沙星和左氧氟沙星的耐药率仅为10%,这种高外排泵基因携带率与较低耐药性之间的差异还有待深入研究。所有红霉素耐药菌除1株携带ermB基因外,其余菌株均携带ermC基因,说明在本研究中ermC基因是红霉素耐药的主要决定子,这与文献[20]研究结果相一致。所有菌株的克林霉素耐药基因Lin(A)检出率为30%,远低于克林霉素耐药率(70%),提示菌株对克林霉素的耐药可能是多基因联合作用的结果。
本研究还鉴定到1株来自儿科分泌物的OS-MRSA,该菌对苯唑西林和头孢西丁敏感但携带mecA基因。OS-MRSA早在多个国家和地区已有报道[21]。文献[22-23]报道的OS-MRSA流行率仅为1.6%和1.8%,远低于本研究的5%,这可能是本研究样本量较小导致的。OS-MRSA对苯唑西林的敏感性容易导致常规药敏试验的错误识别,从而造成潜在的治疗失败[24],因此这种非典型MRSA值得高度关注。最近有研究报道,mecA基因的启动子区、gryA/grlA基因和femA基因的突变与边缘耐苯唑西林金黄色葡萄球菌和OS-MRSA有关[25],mecA基因的序列不稳定性和bla表达调控系统的突变导致苯唑西林和头孢西丁敏感MRSA产生[26-27]。笔者将在后续研究中对这株OS-MRSA进行全基因组测序分析,以深入揭示其遗传和分子特征。耐药基因谱统计结果显示,所有菌株至少携带3个及以上耐药基因,ermC-gyrA-grlA-tet(k)在所有耐药基因谱中占比最高(25%),其次是blaZ-ermC-gyrA-grlA-tet(k)-Lin(A),占比为20%。
毒力因子与细菌的致病性密切相关,毒素基因检测对于金黄色葡萄球菌的流行病学控制具有重要价值。eta和etb在金黄色葡萄球菌临床株中的携带率较低,为0.5%~2.0%[28],而本研究eta基因的携带率高达30%,但未检测到etb,提示剥脱毒素相关基因的全球流行趋势可能具有时空和区域差异性。对毒素基因谱进行统计后发现,所有菌株至少携带3个及以上毒素基因,其中编号46、50、41菌株分别携带8、9、10个毒素基因,后续将对这3株菌进行深入研究,以揭示其毒力和致病机制。
综上所述,本院金黄色葡萄球菌临床分离株携带多种外排泵基因、耐药基因和毒素基因,菌株的耐药谱、耐药基因谱和毒素基因谱广,并出现MRSA菌株。最主要的耐药谱和耐药基因谱分别是PEN-ERY-CLI和ermC-gyrA-grlA-tet(k),norA-norB-norC-sepA-mepA-mdeA是最主要的外排泵基因谱,nuc-see-selp和nuc-pvl-sell-selp是最主要的毒素基因谱。临床治疗金黄色葡萄球菌引起的感染应优先考虑米诺环素、呋喃妥因、阿米卡星、万古霉素、利奈唑胺、复方磺胺甲噁唑及庆大霉素。此外,应继续加强医源性金黄色葡萄球菌的监测和基础研究,以深入揭示其致病性和耐药机制。下一步将对编号41、44、46和50菌株进行深入研究,用这些菌株感染小鼠,筛选合适的抗菌药物进行治疗,并观察治疗前后小鼠各项指标的变化,从而揭示菌株的毒力和致病机制,以及通过全基因组测序、转录组测序和蛋白质组学分析,揭示菌株的分子特征、差异表达基因和关键信号通路,可为开发靶向药物和有效预防金黄色葡萄球菌感染提供科学依据。
