阿维链霉菌中ECF-Sig16对阿维菌素合成的影响
2023-08-26罗帅问亚琴朱华张蓉王晓雯刘丽丽朱建亚
罗帅, 问亚琴, 朱华, 张蓉, 王晓雯, 刘丽丽, 朱建亚*
(1.北京电子科技职业学院生物工程学院,北京 100176; 2.北京市农林科学院水产科学研究所,北京 100068)
链霉菌属是一类高G+C 含量的革兰氏阳性丝状细菌,属于放线菌目。该属不仅广泛分布于有机质丰富、含水量适中的中性或偏碱性土壤中[1],还存在于海水等环境中[2]。链霉菌生活周期比较复杂,生长时感应到营养匮乏信号后能发生明显形态分化,而链霉菌的次级代谢往往与生长分化相偶联,推测这2 种生理过程可能受到相同的蛋白调控。次级代谢物的合成通常受到簇内调控蛋白和多效调控蛋白的调控,对这些调控蛋白进行遗传操作可以显著提高一些重要次级代谢产物的产量。
ECF (extracytoplasmin function)-Sigma 蛋白主要被细胞膜外信号激活,也可响应胞内信号。ECF-Sigma 蛋白调控的生理功能非常广泛,在细菌抵抗环境变化带来的胁迫以适应生存中发挥重要作用。在珊瑚小双孢菌中,ECF-SigMibX 控制卧孔菌素合成[3]。在谷氨酸棒状杆菌中,ECFSigH 响应温度胁迫[4]、巯基氧化胁迫[4]和酸胁迫[5]。在结核分枝杆菌中,ECF-SigE 在维持细胞表面完整性方面发挥重要作用[6]。链霉菌的代谢和生存环境比较复杂,基因组上含有的ECF-Sigma 基因多达几十个[7]。天蓝色链霉菌中有约50 个ECFSigma 调控蛋白,但是只有几个ECF 因子得到深入研究。其中SigR 响应巯基氧化胁迫[8]和抗生素胁迫[9];SigT 负调控气生菌丝形成[10],还能响应氮胁迫信号调控放线紫红素合成[11];SigE 在调控细胞表面压力胁迫中发挥关键作用[12];SCO4417 正调控放线紫红素、钙依赖型抗生素、气生菌丝和孢子产生[13]。在其他链霉菌中,有关ECF-Sigma 调控蛋白的功能研究较少。在白色链霉菌中,antA是抑菌霉素合成基因簇内的ECF-Sigma 基因,SigAntA 通过控制抑菌霉素前体供应调控抑菌霉素生成[14];SigW 负调控盐霉素生成及促进细胞生长[15]。在筑波链霉菌中,SigG1 调控形态分化[16]。在链霉菌KCCM 11116P 中,过表达ECF-Sigma 调控蛋白基因FujE能提高抗生素FK506产量[17]。
阿维菌素是由阿维链霉菌产生的较主要的代谢产物之一,具有广谱、高效、低毒的杀虫特性[18‑19],在农业与医药领域拥有良好的应用市场。随着阿维链霉菌全基因组测序完成和阿维菌素生物合成途径的阐明,通过基因工程手段提高阿维菌素的产量取得了一些进展。aveR 是阿维菌素合成基因簇内正调控基因[20]。阿维链霉菌中SAV151[21]和SAV576[22]、SAV577[22]3个TetR 家族的调控蛋白(TetR-family regulator, TFR)均抑制阿维菌素的合成。AvaR2负调控阿维菌素合成和阿维链霉菌生长,但不影响形态分化[23]。AraC 家族的转录调控因子SAV742 抑制阿维菌素合成[24]。BldD 通过直接调控结构基因aveR 与aveA1、aveD、aveA4、aveF、aveBVⅢ促进阿维菌素合成[25]。ROK家族调节子ROK7B7 通过直接调控aveA1 抑制阿维菌素合成[26]。持家Sigma调控蛋白HrdB 能结合aveR 启动子,突变的hrdB 基因导入阿维链霉菌高产菌能使阿维菌素B1a 产量提高约50%[27]。阿维链霉菌基因组预测有60 个Sigma 基因,其中47 个属于ECF-Sigma 基因,目前仅有关于ECF-Sig6、ECF-Sig25、ECF-Sig5 调控蛋白功能研究的报道。这3 种ECF-Sigma 因子都能间接地负调控阿维菌素的合成,且不影响菌株的生长与形态分化[28-30],表明ECF-Sigma 蛋白可以参与阿维菌素生物合成调控。sig16 基因是阿维链霉菌高表达基因中唯一的ECF-Sigma 基因[31],暗示其在阿维链霉菌生长发育中可能发挥重要作用,但其如何影响阿维菌素产生以及菌株分化尚缺乏深入研究,因此本研究通过构建sig16 缺失和过表达菌株,来考察Sig16对阿维菌素生物合成的影响和调控机制。
1 材料与方法
1.1 菌株、质粒和引物
本研究所用的菌株和质粒详见表1,引物详见表2。

表1 试验菌株和质粒Table 1 Plasmids and strains used in the study
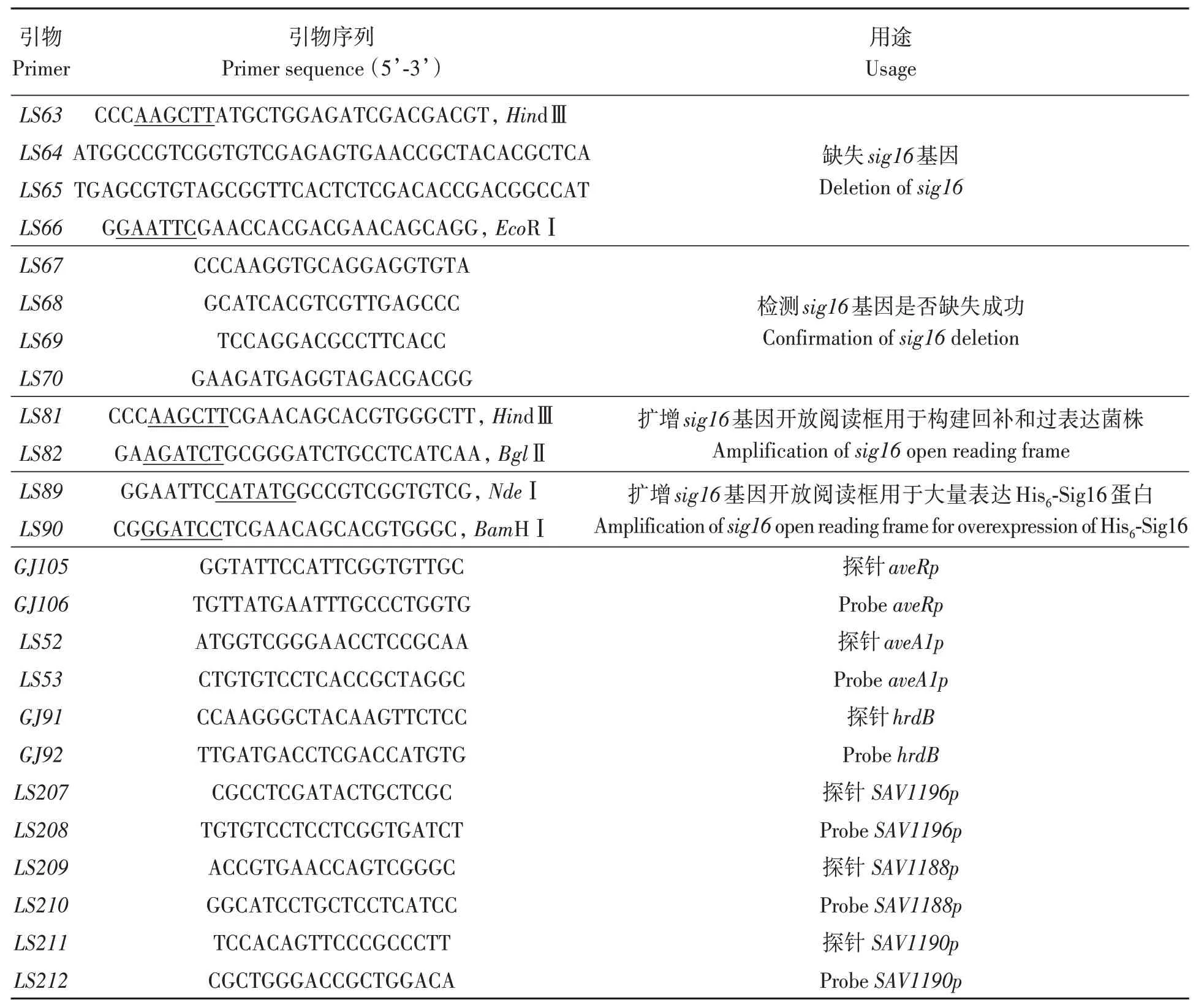
表2 试验用引物Table 2 Primer sequences in this study
1.2 培养基
采用LB (luria bertani)培养基进行大肠杆菌常规培养,MM 培养基用于形态观察[35],YMS 培养基用于固体产孢培养与观察[36],可溶的发酵培养基FM-Ⅱ用于测定菌株的产量曲线与生长曲线[37], 种子培养基和不可溶发酵培养基FM-Ⅰ用于发酵[20]。
1.3 sig16缺失、过表达及回补菌株的构建
以野生型(wild type,WT)菌株总DNA 为模板,通过PCR扩增sig16基因的同源臂后连接到质粒pKC1139, 随后转化入大肠杆菌JM109。通过验证得到用于缺失sig16 基因的载体pDsig16,并将其转化至大肠杆菌ET12567 中进行去甲基化,再转入野生型阿维链霉菌获得突变株。通过PCR方法,以WT和突变株的DNA为模板进行验证,最终获得sig16缺失菌株。
以WT 菌株总DNA 为模板,PCR 扩增含有sig16 基因的DNA 片段,将其连接到pJL117 质粒中的红霉素抗性基因启动子ermEp*下游。将带有启动子的sig16 整合片段与质粒pSET152 连接,获得重组质粒pSET152-ermp-sig16。去甲基化后的重组质粒分别转入sig16 缺失菌株和WT 菌株中,得到sig16回补菌株和sig16过表达菌株。
1.4 阿维菌素的发酵
将孢子悬液进行梯度稀释后涂布平板分离出产孢良好的单菌落。再将单菌落孢子转接于YMS 上,28 ℃倒置培养7~10 d,待长出丰富孢子后接种于500 mL 三角瓶中 (YMS 培养基装量为20%), 28 ℃、230 r·min-1摇床培养24 h 后,按5%的接种量转接至250 mL 三角瓶中(发酵培养基装量为20%), 28 ℃、250 r·min-1摇床培养。
1.5 阿维菌素的产量测定
先取1.0 mL 发酵液,溶解于4.0 mL 甲醇中,浸泡30 min 以上,每隔10 min 用涡旋振荡器振荡1 次,共3 次。6 000 r·min-1离心10 min,取上清液经过有机膜过滤后用高效液相色谱(high performance liquid chromatography, HPLC)测定阿维菌素产量。HPLC 分析条件:流动相为甲醇与水的混合溶液,体积比9∶1;流速1.0 mL·min-1;检测波长246 nm。阿维菌素B1 标准品购自齐鲁制药厂,由质量分数为97%的阿维菌素B1a 和3%的阿维菌素B1b 组成,将该标准品用甲醇溶解配制成200 µg·mL-1的溶液作为对照。
1.6 阿维链霉菌生物量测定
将在可溶发酵培养基FM-Ⅱ中培养的发酵液吸取1 mL用于产量测定,其余发酵液6 000 r·min-1离心10 min 收集菌丝体于80 ℃烘干,待菌体质量基本不变时称量细胞干重。
1.7 Sig16蛋白的大量表达及纯化
PCR 扩增sig16基因片段,与pET-28a(+)质粒相连得到蛋白表达载体pET28-sig16。将重组质粒转化至大肠杆菌BL21 (DE3)中,经异丙基-β-D-硫代半乳糖苷(isopropyl-β -D thiogalactoside,IPTG)诱导后进行超声破碎,变性聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamid gel electrophoresis, SDS-PAGE)检测结果显示His6-Sig16 蛋白大部分存在于在上清液中。用镍离亲和层析介质(Ni-nitrilotriacetic acid, Ni-NTA)进行蛋白纯化,定量分装后置于-80 ℃保存。
1.8 凝胶阻滞试验
凝胶阻滞试验(electrophoretic mobility shift assay, EMSA)按照Roche 公司试剂盒(DIG Gel Shift Kit,2nd Generation)的说明书进行操作。PCR 扩增DNA 后在3’端用地高辛标记得到探针。按照说明书要求配置25 µL 样品体系,在5%的非变性聚丙烯酰胺凝胶中进行电泳,蛋白-DNA复合物和游离的DNA 由于迁移率不同从而得到分离。电泳后通过电转印法将探针转移至尼龙膜上,用碱性磷酸酶发光底物进行检测,暗室压X 光片后显影定影。
2 结果与分析
2.1 sig16及其附近基因的功能预测
sig16全长1 191 bp,编码一个由396 个氨基酸残基组成的ECF-Sigma 调控蛋白,其C-端含有1 个介导蛋白互作的三四氨基酸重复基序(tetratricopeptide repeat,TPR)(图1A)。 上游SAV1196基因编码未知功能蛋白。SAV1196与sig16间有1 bp 重叠,暗示这2 个基因共转录。从间隔区的距离和基因功能推测,sig16下游基因SAV1190~1194是共转录的,它们组成了1 个支链氨基酸ABC 转运系统操纵子。其中,SAV1190基因编码底物结合蛋白,SAV1191编码通透酶,SAV1192编码通透酶,SAV1193编码ATP 结合蛋白,SAV1194编码ATP 结合蛋白。SAV1189是SAV1190的上游基因,编码乙酰胺酶调节蛋白;SAV1188编码MarR 家族的转录调控蛋白(图1B)。

图1 Sig16的保守结构域及sig16在野生型阿维链霉菌基因组中的位置Fig. 1 Conservative domain of Sig16 and organization of sig16 and its adjacent genes
2.2 Sig16对阿维菌素合成的影响
为研究阿维链霉菌中ECF-Sig16 的功能,以WT 菌株作为对照,将sig16基因的缺失菌株和回补菌株在可溶发酵培养基FM-I 中摇瓶发酵10 d。经HPLC 检测后发现,Dsig16 中阿维菌素的产量上升至野生型菌株的1.49 倍;回补株的产量与野生型相比无明显差别;sig16过表达菌株的产量则显著降低61%(图2)。由此表明,Sig16 抑制阿维菌素的合成。

图2 WT与sig16突变株中的阿维菌素产量Fig. 2 Avermectin production in WT and sig16 mutant strains
为明确ECF-Sig16 是否通过影响生物量抑制阿维菌素合成,将WT 菌株、sig16缺失菌株和回补菌株摇瓶发酵10 d,测定并绘制产量曲线和生长曲线。结果(图3)显示,在液体发酵期间,各菌株细胞干重无明显差别,Sig16 不影响阿维链霉菌的菌体生长。sig16缺失菌株的阿维菌素产量较野生型明显提高,说明Sig16 对阿维菌素合成的抑制作用并非通过刺激菌体生长实现。

图3 WT和sig16突变株的阿维菌素产量曲线和生长曲线Fig. 3 Avermectin yield curve and growth curve of WT and sig16 mutant strains
2.3 Sig16与SAV1190启动子区结合
ECF-Sigma 调控蛋白的功能是在接受信号后起始靶基因的转录,所以推测Sig16对阿维菌素合成基因簇基因的转录抑制作用是间接的。为此,首先用重组His6-Sig16 蛋白与aveR和aveA1启动子区探针进行了EMSA 试验,结果如图4A 所示。可以看出,His6-Sig16 不能与探针发生特异性结合,证实Sig16 对aveR和aveA1的转录负调控作用是间接的。
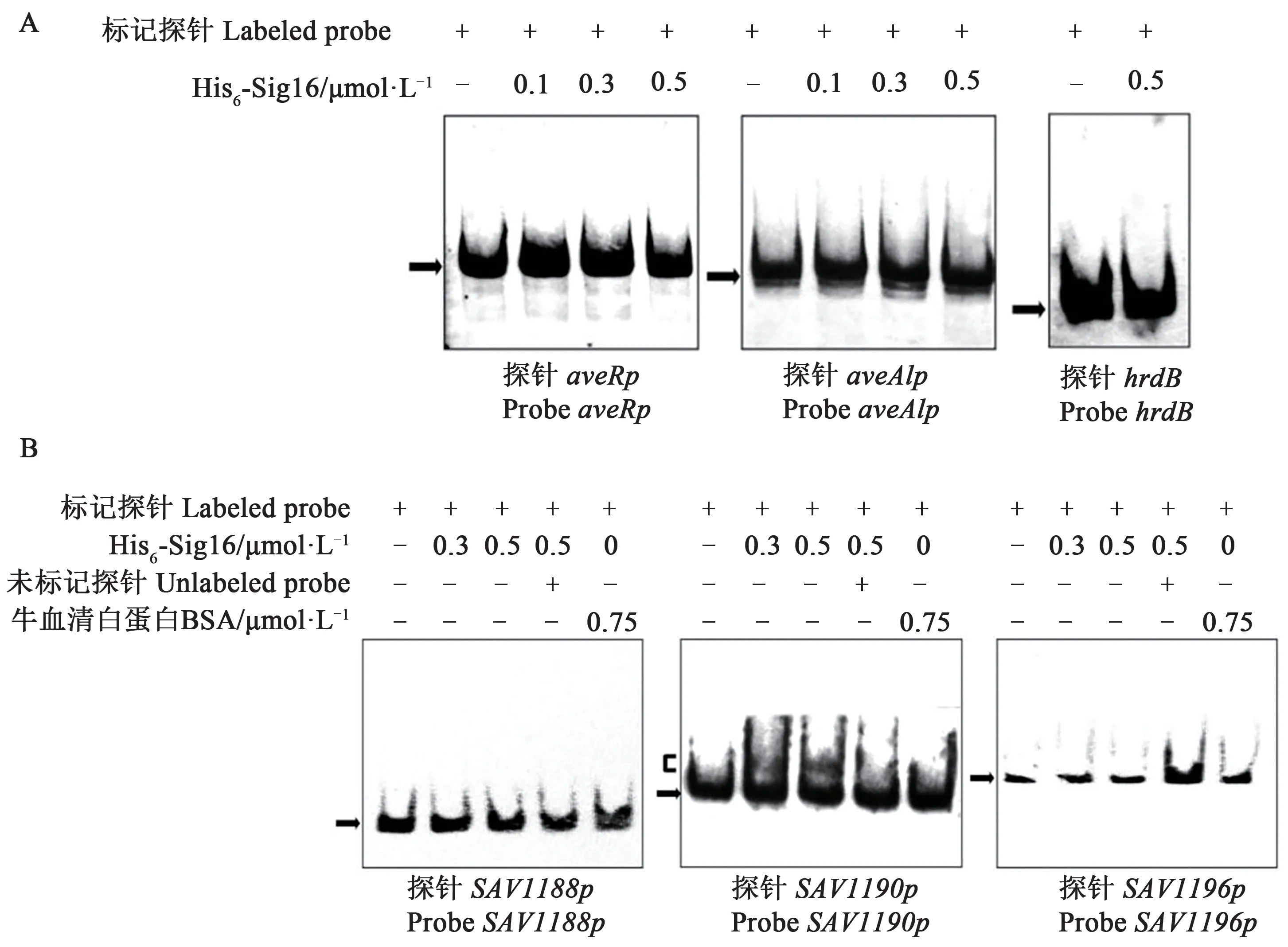
图4 His6-Sig16与探针aveRp、aveA1p、SAV1188p、SAV1190p和SAV1196p的体外EMSA试验Fig. 4 EMSA assays of His6-Sig16 with probes aveRp, aveA1p, SAV1188p, SAV1190p and SAV1196p
ECF-Sigma调控蛋白通常能够结合自身基因启动子从而起始转录[38],因此利用EMSA 检测了Sig16 与自身启动子的结合情况。sig16和上游SAV1196基因有1 bp重叠,推测二者共用启动子。SAV1196和SAV1197转录方向相反,推测这2 个基因的启动子应位于基因间隔区内。PCR 扩增该间隔区片段并标记为探针SAV1196,结果显示,His6-Sig16 蛋白不能使探针发生滞留,表明Sig16不能结合该启动子起始转录(图4)。
推测在SAV1188基因上游区域可能含有自身基因启动子。在SAV1189~SAV1190基因间隔区,可能包含有支链氨基酸ABC转运系统操纵子的启动子。因此利用PCR 扩增并标记DNA 片段,命名为探针SAV1188p与探针SAV1190p。EMSA结果显示,His6-Sig16蛋白不能与探针SAV1188p结合形成滞留条带,但能够与探针SAV1190p特异性结合形成滞留条带(图4B),暗示Sig16 可以结合在SAV1190基因启动子区起始SAV1190操纵子中基因的转录。
2.4 Sig16对阿维链霉菌形态分化的影响
为研究Sig16 是否影响阿维链霉菌的形态分化,在YMS和MM固体培养基上培养,观察野生型菌株、sig16缺失菌株和回补菌株的生长及形态分化,结果如图5所示。在产孢培养基YMS上,各菌株进行正常形态分化,产孢能力无明显差别。在营养物质贫乏的基本培养基MM 上,菌株维持较慢生长状态,且各菌株间生长情况也无明显差别。由此表明,Sig16在上述培养条件下不影响阿维链霉菌的生长和形态分化。

图5 sig16突变株在YMS和MM固体培养基上的形态观察Fig. 5 Morphologic observation of sig16 mutant strains incubated on YMS and MM solid medium
3 讨论
通过对sig16基因突变株进行摇瓶发酵和生长曲线的分析,表明Sig16能够抑制阿维菌素的合成,但不影响阿维链霉菌生长。EMSA 结果显示Sig16 不能直接结合在aveA1和aveR启动子区,暗示Sig16 对阿维菌素合成基因簇中的转录抑制作用是间接的,推测Sig16的靶基因可能直接或间接地负调控aveR和aveA1的表达。在糖多孢红霉菌中,支链氨基酸是红霉素合成的前体物质,对支链氨基酸ABC 转运系统进行遗传操作能提高红霉素的产量[39]。Sig16 能特异性地结合在支链氨基酸ABC 转运系统操纵子的启动子,暗示Sig16 能直接调控支链氨基酸的转运。支链氨基酸包含亮氨酸、异亮氨酸和缬氨酸,它们不但是蛋白质的合成单元,异亮氨酸和缬氨酸还是阿维菌素a 组分和b 组分合成起始单元的前体物质[40],推测Sig16能通过控制胞内支链氨基酸的含量抑制阿维菌素合成。目前对SAV1190~SAV1194的研究还未见报道,它们是否影响阿维菌素合成还需进一步研究。
ECF-Sigma 调控蛋白通常是一种多效调控蛋白,其直接作用的靶基因广泛分布于基因组中,有些靶基因与ECF-sigma 基因相距较远。在阿维链霉菌中,虽然ECF-Sig6、ECF-Sig25、ECF-Sig5 能影响阿维菌素的合成,但具体机制仍不清楚。目前也没有研究发现能够起始aveR转录的ECF-Sigma调控蛋白。深入了解阿维链霉菌中包含ECFSigma 蛋白调控系统在内的阿维菌素合成调控机制有助于改善菌株的基因工程改造效果,选育更加高产的阿维菌素工业生产菌株。在今后试验中还可尝试通过ChIP-seq寻找Sig16的直接靶基因,进而揭示Sig16调控阿维菌素合成的机制。
