不同浓度海藻糖处理对西瓜幼苗低温抗性的影响
2023-08-24贾蓝溪郭延亮宋希梅白如意
贾蓝溪,郭延亮,宋希梅,白如意,张 显
(西北农林科技大学园艺学院 陕西杨凌 712100)
西瓜[Citrullus lanatus(Thunb.)]是我国的重要经济作物之一,起源于热带与亚热带地区,对低温反应敏感,最适生长温度为20~32°C[1]。近年来,随着种植技术水平的提升和种植团队的专业化,我国的西瓜种植规模逐年扩大,有力提高了部分地区的农民收入水平。早春西瓜的种植效益高,是增收的重要方式,然而,伴随季节而来的低温冻害也对幼苗的生长带来不利影响。在西北地区一般在3 月份进行早春大棚的西瓜定植,此时气温较低,会出现倒春寒的现象,无法达到西瓜健康生长的合适温度,造成西瓜幼苗根系发育不良,根系活力下降,地上部生长受阻,叶片光合速率降低,进而影响西瓜后期的生长发育和产量品质。
温度是植物生长和发育过程中的重要影响因素,低温会对植物的生长发育、形态特性等造成不良影响,造成叶片萎蔫黄化、坐果率低,严重影响品质[2]。徐田军等[3]研究表明,低温胁迫会使植物光合效率降低,减缓植物的生长。王洪涛等[4]、王萍等[5]研究表明,低温胁迫会使植物叶片细胞膜损伤,破坏细胞的结构及功能,使叶片相对电导率(REC)和丙二醛(MDA)含量增加。李晶等[6]研究表明,低温胁迫下,植物细胞会产生大量自由基,而超氧化物歧化酶(SOD)、过氧化物酶(POD)可通过消除体内自由基,增强植物在逆境中的抗逆能力。和红云等[7]、杨德光等[8]研究表明,低温胁迫会使植物生长受阻,导致植株地上部、地下部干鲜质量下降。王克安等[9]、康俊梅等[10]研究表明,低温胁迫会导致植株根系活力下降,降低根系吸收转化营养物质的效率。
被誉为生命之糖的海藻糖(trehalose)通常在植物遭受逆境胁迫下产生[11],有着独特的抗脱水、抗冻和抗高渗保护功能[12-14],在促进植物体抗寒性方面起着重大作用[15-16]。已有研究表明,低温胁迫下,海藻糖处理使叶片电导率降低,地上、地下部干物质和叶片中的叶绿素含量增加,从而保证了水稻幼苗在胁迫环境下的抗逆能力[17]。黄瓜幼苗在低温环境中,外源海藻糖会减少幼苗体内活性氧的过度积累,增强幼苗对温度的适应性[13]。同样在对冬小麦低温下幼苗的抗寒性研究中发现,外源海藻糖能够显著提升作物的抗氧化水平,增强植株的抗寒能力[18]。关于海藻糖在西瓜低温胁迫上的作用研究报道较少,因此笔者通过研究叶片喷施海藻糖对西瓜幼苗低温抗性的影响,以期筛选出最适浓度,为生产中使用海藻糖提高西瓜耐冷性提供理论基础。
1 材料与方法
1.1 材料
供试西瓜品种为农科大五号,由西北农林科技大学西甜瓜课题组提供,该品种为早熟品种,果实圆形,单瓜质量6 kg 左右,生育期92~95 d,果实发育期28~30 d,适宜在陕西省及同类生态区早春设施西瓜种植区种植;供试海藻糖为德州汇洋生物科技有限公司生产(海藻糖含量≥98%);供试基质由杨凌裕丰种业有限公司提供。
1.2 试验设计
试验共设6 个处理:常温对照CK,0、5、10、15、20 mmol·L-1海藻糖,各个处理见表1。2022 年7 月于西北农林科技大学科研温室采用50 孔穴盘育苗,待西瓜幼苗1 叶1 心时移栽至10 cm × 10 cm营养钵中,其间注意水分管理。在2 叶1 心时进行叶面喷施处理,以叶面凝成水滴却不滴下为标准,间隔7 d 后再次进行叶面喷施处理,处理结束后于低温培养箱中进行培养(10 ℃/7°C),每个处理15株,3 次重复。低温处理7 d 后进行表型拍照,测定干鲜质量、PSII 最大光化学效率、叶片相对电导率。采集第2 片真叶放入液氮中速冻后储存于超低温冰箱,用于后续生理指标的测定。
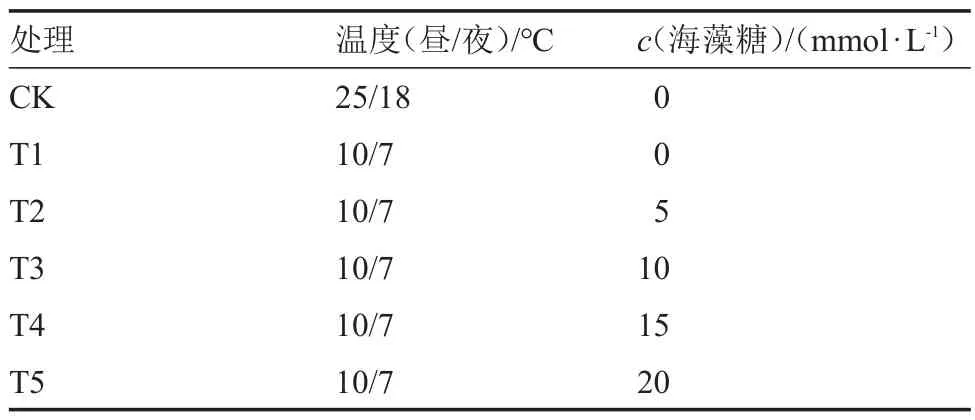
表1 试验设计Table 1 Experiment design
1.3 测定方法
各处理按随机取样法选取西瓜植株3 株进行指标测定,各指标均重复测定3 次,取平均值。除根系活力、鲜质量和干质量外,其余指标的测定叶为第2 片真叶。Fv/Fm(PSII 最大光化学效率)的测定使用便携式调制叶绿素荧光仪(德国WALZ 公司生产),测定前需要将西瓜幼苗暗适应30 min;叶片相对电导率的测定采用Zhou 等[19]的方法;丙二醛含量的测定采用TBA 比色法[20];超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)还原法测定[20];过氧化物酶(POD)活性采用愈创木酚显色法测定[20];根系活力的测定采用TTC 法[21];鲜质量和干质量的测定方法为洗净擦干植株,用电子天平称取鲜质量,再放入80 ℃恒温烘箱中烘干48 h 后取出,称取干质量。
1.4 数据分析
采用IBM SPSS 2019 数据处理系统对试验数据进行统计分析,使用EXCEL 2019 软件作图,利用Duncan 检验方法确定各处理之间的差异显著性。
2 结果与分析
2.1 海藻糖处理对低温胁迫下西瓜幼苗表型的影响
由图1 可知,正常温度下西瓜幼苗生长健壮,叶片舒展,低温胁迫会使得西瓜幼苗叶片卷曲、萎蔫、叶柄弯曲。与T1 处理相比,T2~T5 处理西瓜幼苗后,降低了叶片的萎蔫程度,其中T4 处理叶片萎蔫程度最低,缓解了低温对西瓜幼苗叶片的伤害。

图1 低温条件下不同浓度海藻糖处理对西瓜幼苗表型的影响Fig.1 Effects of different concentrations of trehalose on the phenotype of watermelon seedlings at low temperature
2.2 海藻糖处理对低温胁迫下西瓜幼苗叶片PSII最大光化学效率的影响
由图2 可知,低温胁迫下,西瓜幼苗叶片中的PSII 最大光化学效率显著降低。与T1 处理相比,T2、T4、T5 处理西瓜幼苗叶片中的PSII 最大光化学效率无显著差异;而T3 处理与T1 处理相比,最大光化学效率显著提高了9.77%。
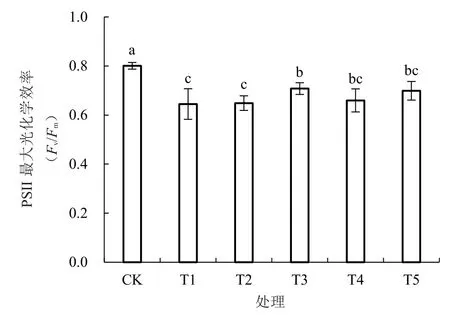
图2 低温胁迫下不同浓度海藻糖处理对西瓜幼苗PSII最大光化学效率的影响Fig.2 Effects of different concentrations of trehalose on the maximum photochemical efficiency of watermelon seedlings PSII at low temperature
2.3 海藻糖处理对低温胁迫下西瓜幼苗叶片电导率和丙二醛含量的影响
由图3-A 可知,低温胁迫下西瓜幼苗叶片相对电导率显著上升。与T1 处理相比,T2、T3、T5 处理西瓜幼苗叶片相对电导率没有显著差异;而T4 处理与T1 处理相比,叶片相对电导率显著降低了23.01%。由图3-B 可知,低温胁迫下西瓜幼苗叶片丙二醛含量显著上升。与T1 处理相比,T5 处理西瓜幼苗叶片丙二醛含量没有显著差异,而T2、T3、T4 处理显著降低了西瓜叶片丙二醛含量,分别降低了18.36%、24.24%和25.32%。

图3 低温胁迫下不同浓度海藻糖处理对西瓜幼苗相对电导率和丙二醛含量的影响Fig.3 Effects of different concentrations of trehalose on the content of REC and MDA of watermelon seedlings at low temperature
2.4 海藻糖处理对低温胁迫西瓜幼苗抗氧化酶活性的影响
由图4-A~B 可知,低温胁迫下西瓜幼苗叶片抗氧化酶活性提高。与T1 处理相比,T4 处理显著提升了西瓜幼苗叶片SOD、POD 活性,分别提高了36.29%和43.65%;而T2、T3、T5 处理西瓜幼苗叶片抗氧化酶活性与T1 处理相比无显著差异。
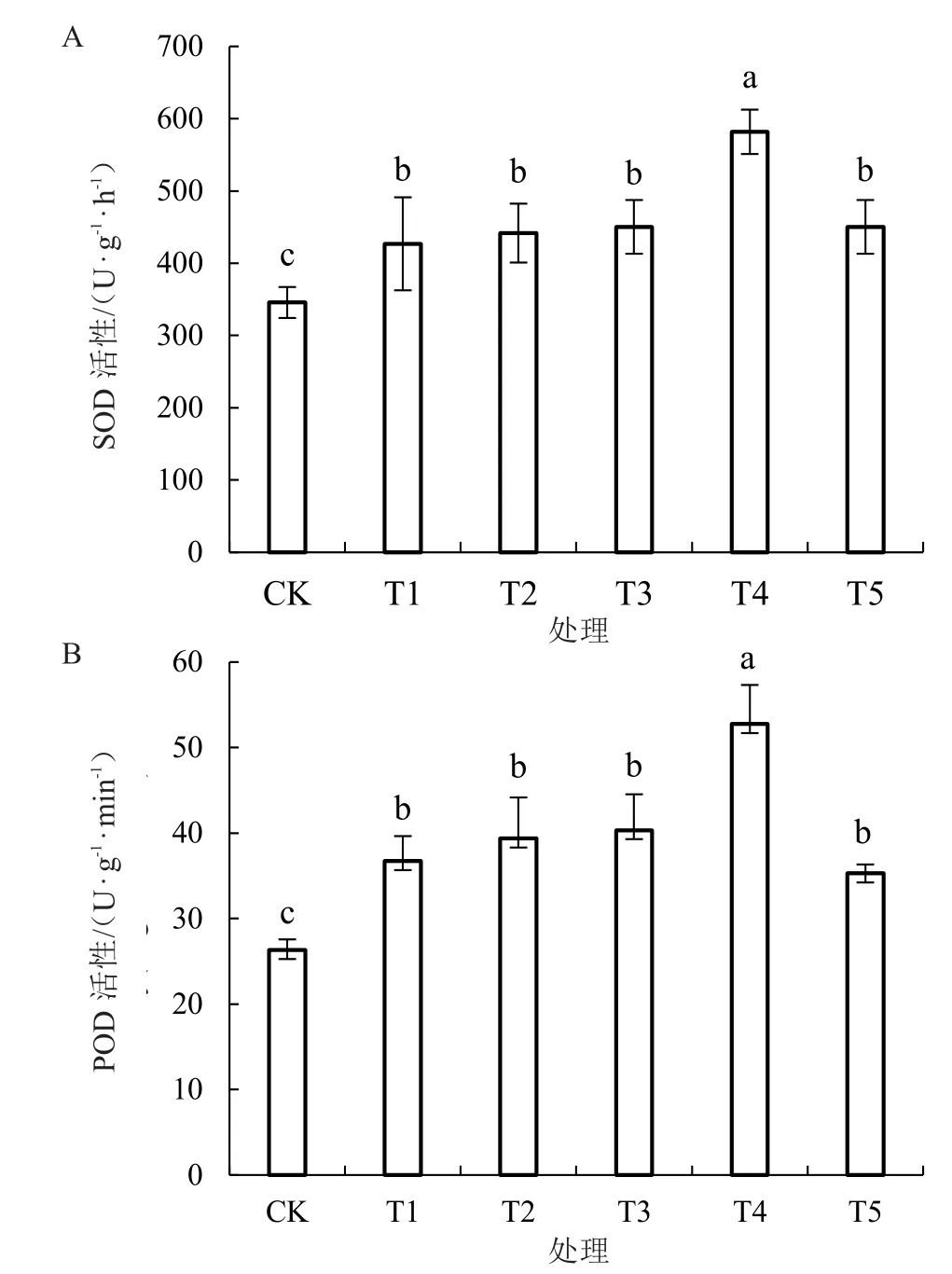
图4 低温胁迫下不同浓度海藻糖处理对西瓜幼苗抗氧化酶活性的影响Fig.4 Effects of different concentrations of trehalose on the autioxidant enzyme activities of watermelon seedlings at low temperature
2.5 海藻糖处理对低温胁迫下西瓜幼苗干鲜质量的影响
由图5-A~D 可知,低温胁迫会使西瓜幼苗地上部鲜质量显著降低,与T1 处理相比,T2~T5 处理能显著提高西瓜幼苗地上部鲜质量,分别提高了30.05%、50.58%、89.20%和40.61%;在地上部干质量方面,与T1 处理相比,T2、T3 处理没有显著差异,而T4、T5 处理显著提高了地上部干质量,分别提高了80.35%和63.65%;在地下部鲜质量方面,与T1 处理相比,T2、T5 处理没有显著差异,而T3、T4 处理显著提高了地下部鲜质量,分别提高了117.28%和166.95%;在地下部干质量方面,与T1 处理相比,T2、T5 处理没有显著差异,而T3、T4 处理显著提高了西瓜幼苗地下部干质量,分别提高了40.26%和107.61%。

图5 低温胁迫下不同浓度海藻糖处理对西瓜幼苗干鲜质量的影响Fig.5 Effects of different concentrations of trehalose on dry and fresh weight of watermelon seedlings at low temperature
2.6 海藻糖处理对低温胁迫下西瓜幼苗根系活力的影响
由图6 可知,与CK 相比,低温胁迫下,除T3、T4 处理外,西瓜幼苗的根系活力显著下降。与T1处理相比,T2、T5 处理对提高西瓜幼苗根系活力无显著影响;而T3、T4 处理显著提升了西瓜幼苗的根系活力,分别提高了66.30%和127.21%。
图6 低温胁迫下不同浓度海藻糖处理对西瓜幼苗根系活力的影响Fig.6 Effects of different concentrations of trehalose on the root viability of watermelon seedlings at low temperature
3 讨论与结论
低温会造成西瓜幼苗根系损伤、根系活力下降,叶片光合速率降低,使幼苗生长受阻、叶片萎蔫,甚至死亡,造成西瓜品质和产量下降[22]。有研究表明,海藻糖可以显著提高植物体SOD 等酶活性,使细胞干物质增加,并使植物相对电导率减少,保持根系细胞膜结构的稳定,减少对根系的伤害,从而提高植物对低温的抵抗能力[23]。
植物能通过叶绿体进行光合作用,而处在低温环境中,植物叶片中叶绿体结构可能无法维持其完整性,从而影响光合进程,使植物正常生长发育受阻[24]。周建等[25]研究发现,低温下植物幼苗PSII 最大光化学效率明显下降。杨芬芬等[26]研究发现,低温胁迫显著抑制了叶片的光合能力,通过喷施适宜浓度的海藻糖,可以提高光合作用能力,说明在低温下适宜浓度的海藻糖处理在恢复植物的光合作用方面有着较好的效果,这与笔者的研究结果一致。在本试验中,低温胁迫下,西瓜叶片中PSII 最大光化学效率显著降低。与T1 处理相比,T3 处理能显著提高西瓜叶片的PSII 最大光化学效率,提高了9.77%。
植物体在受到低温胁迫后,积累的大量活性氧可能造成膜脂过氧化,而丙二醛则是过氧化的主要产物[4],同时膜透性的提高和胞内电解质的外渗也会引起相对电导率的上升[27]。已有研究表明,植物幼苗在遭遇低温胁迫时,海藻糖能减轻植物细胞膜结构所受的影响,使细胞内电解质渗透率和叶片相对电导率明显降低[17],这与笔者的试验结果一致。在本试验中,在叶面喷施不同浓度海藻糖后,与T1处理相比,T4 处理显著降低了西瓜幼苗叶片的相对电导率,T2~T4 处理能显著降低西瓜幼苗叶片丙二醛含量,分别降低了18.36%、24.24%和25.32%。
对于植物细胞而言,处在逆境环境中会加快胞内活性氧生成的速度,而过量的活性氧会损害细胞膜。有些酶如POD、SOD 等则可通过消除体内自由基,从而增强植物在逆境中的抗逆能力[6]。崔莹等[28]研究表明,低温胁迫下,叶片喷施海藻糖减少了植物叶片活性氧的相对含量,显著提高了POD 等抗氧化酶活性,这与笔者的研究结果一致。在本试验中,低温胁迫下西瓜幼苗叶片抗氧化酶活性提高。与T1 处理相比,T4 处理能显著提升西瓜幼苗叶片SOD、POD 活性,分别提高了36.29%和43.65%。
低温胁迫会对植株地上部和地下部的干鲜质量产生影响,前人的研究显示,在低温条件下,海藻糖处理可以使幼苗地下部干质量增加,增强幼苗的抗逆转能力[23],这与笔者的研究结果一致。在本试验中,与T1 处理相比,T4 处理显著增加了西瓜幼苗干鲜质量,且效果最好,其中地上部鲜质量增加了89.20%,干质量增加了80.35%;地下部鲜质量增加了166.95%,干质量增加了107.61%。
根系活力体现了植物根系在吸收营养物质、调节代谢等方面的能力,直接影响植株的抗逆性和地上部的生长量[29]。魏文婧等[30]研究结果表明,随着温度的下降,植物根系活力明显下降。张钰钦等[31]研究发现,海藻糖处理能够提高植物根系活力,更有利于幼苗的生长,这与笔者的研究结果一致。在笔者的试验中,与T1 处理相比,T3、T4 处理能显著提升西瓜幼苗的根系活力,其中T4 处理效果最显著,提高了127.21%。
综上所述,低温胁迫下,叶面喷施适宜浓度的海藻糖可以提高西瓜幼苗的光合作用能力,减少低温对细胞膜的伤害,提高抗氧化酶活性和根系活力,促进了西瓜幼苗生长,其中15 mmol·L-1海藻糖(T4)处理缓解西瓜幼苗低温胁迫的效果最好,可为海藻糖在提高西瓜耐冷性研究中提供理论依据。
