非甾体类抗炎药前处理及检测方法研究进展
2023-08-23孙志轩黄婧洁钱思萱顾雅妮李建成
孙志轩,李 苗,黄婧洁,钱思萱,顾雅妮,李建成*
(1.中国农业大学动物源性食品安全检测技术北京市重点实验室,北京 100193;2.中国农业大学动物医学院,北京 100193)
非甾体类抗炎药(Non-steroidal anti-inflammatory drugs, NSAIDs)是一类没有甾体结构的抗炎药,可以抑制环氧合酶(Cyclooxygenase, COX)以及其同工酶,从而阻断前列腺素、白三烯和血栓素A的合成,达到了抗炎、抗风湿、减轻疼痛和退热的作用[1]。NSAIDs是目前全世界兽医和人类医学中使用最为广泛的药物之一,全世界每天大约有3000万人使用这类药物。尽管NSAIDs是相对安全的药物,带来了许多益处,但其使用也可引起严重的副作用,其中胃肠道并发症是最为常见的,除了严重的胃肠道损伤,药物还可以引起肾脏毒性、肝脏毒性、心血管风险甚至是过敏性休克[2]。
随着NSAIDs使用的持续增加,其药物的安全性和副作用已成为目前全世界医药界关注的热点问题。同时,也正因为NSAIDs是人类与动物临床治疗中最常用的药物,其在世界各地的广泛使用已导致其在水环境中无处不在,最近在许多研究中NSAIDs被认定为新出现的微量环境污染物[3]。在养殖场中,NSAIDs被广泛用于治疗动物的发热、疼痛、炎症、肌肉骨骼疾病以及与抗生素联合用药治疗呼吸道疾病和奶牛的乳腺炎等。并有研究表明,NSAIDs能够提高牛的生育能力,这些益处都使得NSAIDs在食品动物中被滥用[4]。NSAIDs在动物源性食品中的残留对人类健康构成严重威胁,因此对食品中药物残留的分析监测具有重要意义。
目前国内外对动物源性食品中的NSAIDs残留检测技术报道较少,尽管一些NSAIDs已注册为兽药,但仅少数NSAIDs具有确定的最大残留水平(Maximum Residue Limit, MRL)。各国NSAIDs的MRLs见表1。
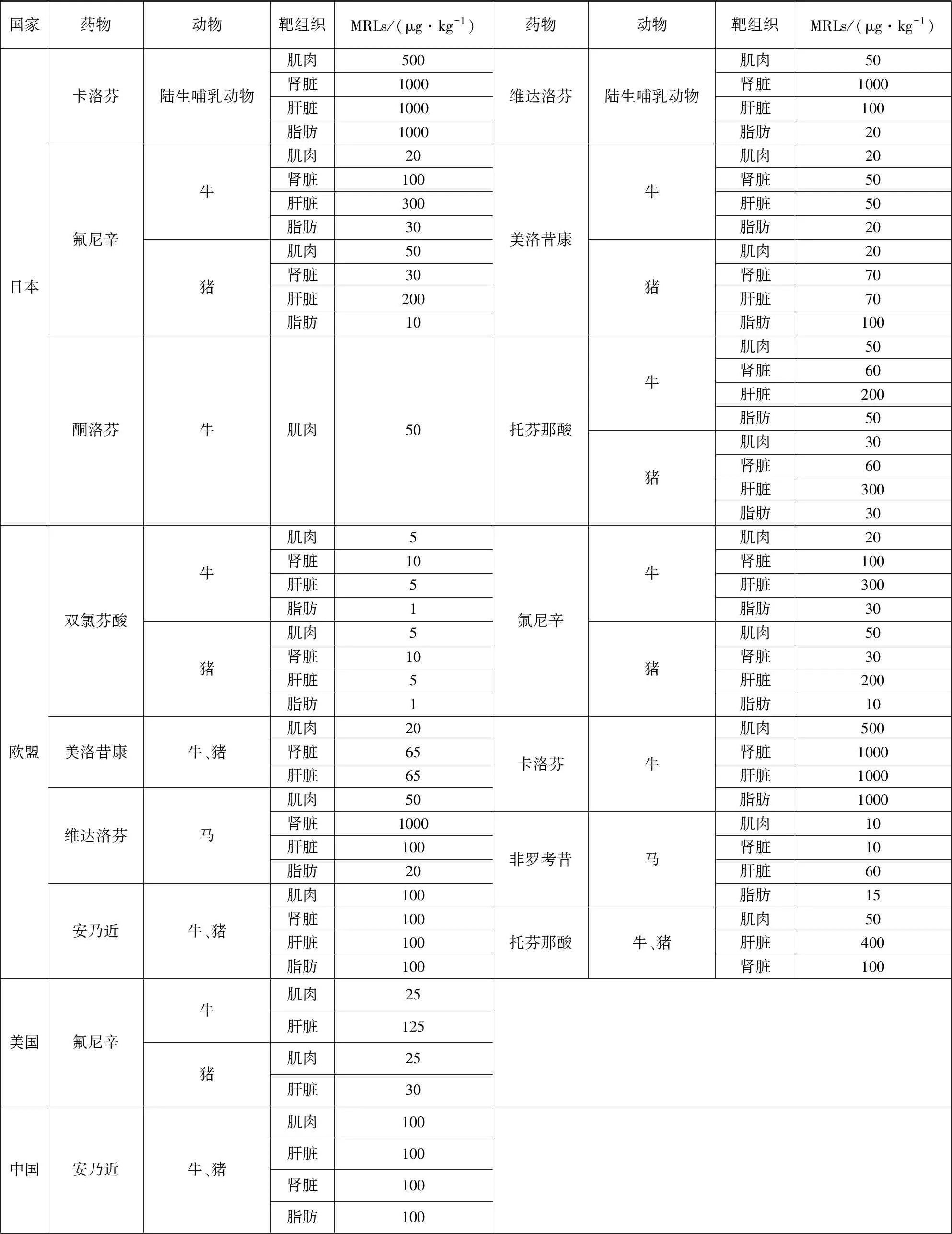
表1 各国NSAIDs残留限量标准Tab 1 MRLs for NSAIDs in various countries
检测动物源性食品中的兽药残留需要进行样品的前处理、检测方法的建立和数据的分析验证,以评估既定方法的稳定性、准确性和灵敏性。兽药残留分析技术的两个主要部分是样品制备的前处理方法和药物残留的检测分析方法。第一部分样品制备的前处理方法主要包括提取、净化和浓缩。其中提取兽药的方法有液液萃取、快速溶剂提取、固相萃取、固相微萃取、QuEChERS和基质分散固相萃取等。第二部分就是用于筛选或测定残留物的检测分析技术,进行定性定量分析的技术大致分为三种类型:微生物法,免疫学法和物理化学方法,包括酶联免疫吸附法、免疫胶体金技术、荧光偏振免疫分析、生物传感器技术、毛细管电泳、液相色谱、气相色谱和液相色谱-质谱、液相色谱-串联质谱等[5]。
1 NSAIDs样品前处理方法
动物源性食品具有复杂的基质和许多内源性干扰物质,无法直接检测兽药残留物。在样品检测之前,通常需要进行样品前处理步骤,如提取、纯化、蒸发或浓缩。因此样品的前处理方法的创新也是当下药物残留分析研究的热点[6]。
1.1 液液萃取(Liquid-Liquid Extraction,LLE) LLE是一种传统的样品预处理方法,包括溶剂萃取和超声波振动介导萃取。LLE方法已被用于从动物源性食品中提取兽药残留物近十几年。该方法操作简单,在准备分离的液体混合物中加入一种与其不溶或部分互溶的液体溶剂,经过充分地混合,利用混合液中各种组分在溶剂中溶解度的差异,从而实现分离。但试剂耗量高、预浓度系数低、样品制备时间长和所需样品量高这些都是LLE方法的一些缺点[7]。2019年Zheng等开发了一种LLE结合液相色谱-串联质谱(LC-MS)的检测方法,检测了鳗鱼、比目鱼和虾中的的萘普生,回收率为70%~117%,相对标准偏差(Relative Standard Deviation,RSD)<9.3%,特异性、线性、准确性和精密度的验证结果令人满意[8]。2020年Di等开发了均相液-液微萃取(Homogeneous Liquid-Liquid Micro-Extraction, HLLME),此方法使得有机相和水相之间的接触面积无限大。在分析之前,对水样中的3种NSAIDs(包括酮洛芬、萘普生和托美汀)进行了富集和纯化,该方法精密度高,回收率为97.2%~105.7%,比Zheng的方法准确性更高[9]。2022年Mashal等开发和验证了LLE以同时定量检测19种NSAIDs,回收率范围为90%~106%,变异系数低于15%,该方法准确性好,但精密度没有以上方法好,仍需进行优化[10]。
1.2 固相萃取(Solid-Phase Extraction, SPE) SPE因其卓越的分离效率和净化能力而成为典型的提取方法。SPE是一种具有快速选择性的样品制备和纯化技术,主要步骤为柱预处理、加样、除去干扰杂质、目的分析物的洗脱和收集。SPE选择性的基本原理与色谱相似,与传统的LLE方法相比,SPE可以提高分析物的回收率,可以更有效地将分析物与干扰成分分离,并减少样品的预处理,使其操作简单,节省时间和精力[11-12]。SPE可以用于从肉、牛奶、鸡蛋和蜂蜜等动物可食用组织中提取兽药。此外,SPE也经常与LLE等其他方法结合使用,以便更好地富集和纯化动物源性食品中的兽药,是使用最广泛的样品前处理技术之一[13]。同时,SPE的效率在很大程度上取决于所用吸附剂的性质,因此,合成具有高吸收能力和选择性的SPE吸附剂的新材料是研究的重点方向[14]。
2022年Hsen等人开发了一种磁性固相萃取(Magnetic-Solid Phase Extraction, MSPE)结合液相色谱-质谱(LC-MS)的分析方法,用于测定水样中的5种NSAIDs。该方法中所有的NSAIDs平均回收率均在90%以上,RSD<17%,精密度良好[15]。2019年Han等制备了一种新型的磁性多孔碳用作MSPE吸附剂,用于测定环境水和生物样本中的3种NSAIDs,并结合高效液相色谱(HPLC)使得该方法回收率为84.67%~113.73%,RSD<7.76%,准确性较高[16]。2018年Ma等合成了新型磁性纳米颗粒用作MSPE吸附剂,从水样本中提取8种NSAIDs,回收率为88.0%~108.6%,RSD<5.5%,准确性与重复性比Han所制备的方法表现的好[17]。2022年Liu等制备了新的复合材料以提高SPE的效率,结合HPLC从水样本中提取NSAIDs,回收效率达到97.7%~105.1%,RSD<6.71%,该方法与以上方法相较,有出色的准确性与重复性[18]。
1.3 固相微萃取(Solid-Phase Micro-Extraction, SPME) SPME是从SPE衍生出来的一种无溶剂的样品处理技术,最初由Belardi等人于1989年首次提出。利用萃取头表面涂有特殊吸附材料,将待测物从水样中吸附和解吸分离富集的技术,旨在解决SPE和LLE固有的局限性。SPME与LLE和SPE等传统萃取技术相比,它具有易于使用,速度相对较快,易于自动化,便携式,无溶剂等优势[19]。但SPME与SPE相比仍然有一些缺点,SPME装置的萃取成本较高,重复性较差,多次使用可能存在交叉污染等问题。
2018年Wang等建立了基于绿色深共晶溶剂制备了聚合物单片柱SPME,用于水样中NSAIDs的检测,回收率为84.5%~113.7%,RSD<4.32%,精密度较好[20]。2019年Ghorbani等建立了新颖的超声波辅助SPME,结合HPLC来测定2种NSAIDs,这种方法成功地用于测定水、人类尿液和牛奶样本分析物的检测,实际样本的平均回收率为103.7%,RSD<6.6%[21]。2019年Mirzajani等首次制备了涂有磁性纳米复合材料的毛细管,并将其用作新型SPME纤维,用于测定生物液体中NSAIDs,平均回收率为94.0%~102.0%,RSD<4.7%,准确性与精密度与以上两种方法比较表现优良[22]。
1.4 基质分散固相萃取(Matrix Solid-Phase Dispersion, MSPD) MSPD是Barker等于1989年首先提出的。作为一种快速样品处理技术,其原理是将浸渍有C18等各种聚合物的单体SPE材料和样品一起进行研磨,得到半干状态的混合物,随后将其作为填料装进柱中,接着用不同强度的溶剂洗脱柱子,将各种目标待测物洗脱下来,MSPD适用于从单个样品中提取多种药物残留物[23]。MSPD可以在简单的环境条件下进行萃取过程,不需要任何特殊的实验室设备,它比传统技术具有优势,只需要几个简单的步骤即可提取少量样品和溶剂。因此,它被认为是一种简单,快速,经济,环保的方法。适用于食品,动物组织,植物材料和环境样品。基于这些优点,MSPD方法被广泛用于从动物源性食品中提取多种兽药残留物,但将其用于NSAIDs的残留检测的研究较少。
2017年Maria等开发了一种涡流辅助MSPD程序来提取母乳中NSAIDs,回收率为78%~86%,RSD<8.3%,精密度良好,仍需优化来进行呈现更好的精密度[24]。2016年Sara等优化了一种MSPD的提取方法测定了污泥中的五种NSAIDs,回收率84%~105%,RSD<4%,精密度较Maria建立的方法好[25]。
1.5 快速溶剂提取(Accelerated Solvent Extraction, ASE) ASE是一种在高温和高压条件下,使用有机溶剂提取的自动化方法。ASE作为一种新的提取程序,使用有机溶剂在更高的压力和更高的温度下提取固体或半固体。ASE方法的优点是有机溶剂含量小,速度快,基质效应低,回收率高,再现性好。与LLE和SPE方法相比,ASE具有操作简单,速度快,样品批量处理等优点,大大提高了效率,节省了时间[26]。随着样品制备技术的发展,自动化ASE方法正在推广用于从动物源性食品中提取兽药残留。2019年Wolecki等在研究中,提出了一种ASE-SPE-GC/MS方法,用于同时测定贻贝中的5种NSAIDs。RSD在0.24%~7.85%,平均回收率在80%~118%[27]。
1.6 QuEChERS(Quick, Easy, Cheap, Effective, Rugged and Safe) 此提取方法广泛用于动物源性食品中不同类型的兽医药物的残留分析。其原理与HPLC和SPE相似,通过利用吸附填料和组织基体中的杂质之间的相互作用来吸附杂质,从而实现杂质去除和净化。Anastassiades等人首先提出了QuEChERS方法,该方法可以提取极性和非极性化合物[28]。最初,QuEChERS方法是为从水果和蔬菜中回收农药残留物而开发的,但QuEChERS方法的有效性取决于实验室中可用的目标分析物特性、基质组成、设备和分析技术。因此采用QuEChERS来检测肌肉等肉类组织中的NSAIDs仍不是首选,所以研究较少。
2020年,孙建等建立了 QuEChERS定性筛查中药材熊胆粉中169种兽药残留,其中包含13种NSAIDs[29]。2021年Ajibola等针对从污水中提取NSAIDs,优化了一种QuEChERS方法,结合HPLC进行了检测分析。回收率为70%~118%,RSD<18%[30]。2021年Zapata等开发了一种QuEChERS分析方法,用于提取和量化条纹鲶鱼肌肉中的NSAIDs,结合UPLC-MS/MS进行量化。其中双氯芬酸的回收率为75%~102%,RSD<8.5%,精密度良好,但其余NSAIDs的回收率并不理想[31]。2016年Daniele等使用QuEChERS提取和LC-MS/MS对双壳类中的NSAIDs进行多残留分析,回收率为78%~117%,RSD<25%,精密度与准确性差强人意[32]。
2 NSAIDs残留检测方法
在样品组织前处理结束后,通过残留检测分析技术来对动物源性食品中的目标分析物进行定性定量分析,目前已经开发了许多技术来检测动物源性食品中的NSAIDs残留。近年来常用的检测NSAIDs残留的方法有很多,包括液相色谱法、气相色谱法、超高相液相色谱串联质谱法、毛细管电泳法、酶联免疫吸附法、传感器技术、免疫胶体金技术。
2.1 液相色谱(Liquid chromatography, LC) LC是一种传统、常见、高效和快速的色谱方法来检测动物源性食物中的兽药残留。LC分离药物的关键是选择合适的色谱柱,并且优化流动相的组成和洗脱梯度。LC具有广泛的适用性,可用于大多数兽药残留分析,并且可以与不同类型的检测器进行结合,如:LC可以与荧光探测器(Fluorescence Detector, FLD)、二极管阵列探测器(Diode Array Detector, DAD)、紫外线探测器(Ultraviolet Detector, UVD)等特定检测器进行结合。
不同类型的检测器与LC相结合用于检测相同类型或不同类型的兽医药物,并有其自身的优缺点。FLD是高度敏感和选择性的探测器,只能检测产生荧光的化合物。DAD和UVD主要用于检测含有紫外线吸收基团的兽医药物,具有高灵敏度、低噪音和广线性范围的优点。
2021年Qiao等使用HPLC-UV方法测定4种NSAIDs。在最佳实验条件下,该方法显示出良好的线性,在5~2000 μg/L线性范围内,R2为0.994~0.999,LOD为0.5~1 μg/L,LOQ为1~5 μg/L,RSD<12.86%,回收率为79.42%~107.52%[33]。2019年Hassan等用HPLC-DAD来确定人类尿液、唾液和牛奶中的4种NSAIDs残留,线性范围为0.13~100 μg/mL,LOD为0.04~0.18 μg/mL,LOQ为0.13~0.61 μg/mL,RSD<7.7%, 回收率为95.7%~109.2%,准确性与精密度良好[34]。
2.2 气相色谱(Gas chromatography, GC) GC也是一种传统、常用的色谱技术,主要使用化合物沸点、极性和吸附性能的不同点来分离混合物。为了分析动物源性食品中的兽药残留物,GC通常与经典探测器相连,主要包括的是氮磷探测器(Nitrogen phosphorus detector, NPD)、电子捕获探测器(Electron Capture Detector, ECD)和质谱探测器(Mass Spectrometry Detector)。与NPD和ECD相比,MS或MS/MS具有良好的恢复性、准确性和可复制性,并可以确认假阳性。一般来说,GC检测兽药需要衍生反应,GC通常要求选择特定的毛细管柱来分离样本中的兽医药物,而不需要像LC方法那样优化移动相位[35],但由于在对NSAIDs进行气相色谱分析之前,必须先进行衍生步骤,以增加这些分析物因其酸性基团而产生的挥发性并降低极性。因此由于基质的复杂性以及NSAIDs提取和衍生反应占用的时间,通常GC不首选用于分析NSAIDs。关于GC用于检测NSAIDs的研究报道较少,不过GC被广泛用于农药分析,也正在逐步开发用于NSAIDs残留检测的研究。
2020年Avino等研究了一种测定动物尿样中NSAIDs的低溶剂消耗方法,并用GC-MS进行检测分析,回收率为94.1%~101.2%,RSD为≤4.1%。线性范围为1~100 ng/mL(R2≥0.995),LOD在0.1~0.2 ng/mL之间,LOQ在4.1~4.7 ng/mL之间,所提出的分析方法可重复,灵敏且简单[36]。
2.3 超高效液相色谱-串联质谱(Ultra-High-Performance Liquid Chromatography Tandem Mass Spectrometry,UPLC-MS/MS) UPLC-MS/MS、HPLC和UPLC都是基于LC开发,将UPLC与FLD、DAD、UVD结合相比,MS可以同时检测动物源性食物中的100多种兽医药物, 同时MS具有高回收率、高选择性、良好的可重复性和低干扰性等优点。此外,串联质谱的使用更是提高了敏感性,并在确认假阳性方面发挥重要作用[37]。
2.4 毛细管电泳(Capillary Electrophoresis, CE) CE是一种较新型的液相分离技术,以毛细管作为分离通道,高压直流电场作为驱动力而进行检测分析。CE具有许多优点,如效率高、样品和缓冲剂消耗低以及速度快,是LC方法的潜在替代技术[42]。但是CE在样品制备能力、灵敏度和分离再现性等方面有一定的限制,限制的原因是注射量小,毛细管直径小,以及样品成分引起的电渗透变化,并且由于注射量小进而导致灵敏度也低。所以许多研究将CE与一些高灵敏度检测器相结合,包括UVD、DAD、MS探测器和化学发光探测器(Chemiluminescence, CL)[43]。
2017年Espina等开发了一种敏感的CE-UV方法用于分析水样品中的NSAIDs,并进行识别和定量,这三种药物的LOD在0.96~1.27 μg/L之间,LOQ在2.91~3.86 μg/L之间,回收率为95%~104%,RSD<13.3%,精密度良好[44]。
2.5 传感器技术(Sensor Technology ) 随着检测技术的不断发展,先进的传感器主导的检测技术已经出现,传统的色谱技术与不同的探测器结合使用,增强了分析方法的灵敏度、特异性和可靠性。传感器技术为检测动物源性食品中的兽药残留物提供了一种快速、高效和具有成本效益的方法。但缺点是它们消耗了大量有机试剂,耗时且昂贵,不适合大量筛选样本。该技术被用作检测动物源性食品中兽药残留物的替代检测方法,包括电化学生物传感器、压电生物传感器、光学生物传感器等的方法[45]。许多研究开发的传感器分析方法不仅操作简单、速度快、成本低,而且在动物源性食品中检测兽药的特异性、灵敏度和精密度方面也取得了令人满意的效果。
2019年Tarahomi等用石墨烯氧化物修饰构建了一种新型一次性电化学传感器,该光盘上装饰有Ag纳米颗粒和β-环糊精,用于定量测量溶液中的萘普生,其在 0.4~80 μmol/L的浓度范围内是线性的。LOD为0.023 μmol/L,LOQ为0.08 μmol/L,回收率在98.5%~101.05%[46]。2020年Qian等报道了一种用于检测萘普生的选择性和灵敏的石墨烯氧化物电化学传感器,电化学传感器表现出广泛的线性范围(10 μmol/L~1 mmol/L),高灵敏度,在相同浓度下进行了多次测量平均回收率为96.9%,RSD为2.5%,LOD为1.94 μmol/L,LOQ为6.47 μmol/L,这些结果验证了传感器的准确电化学量化[47]。
2.6 酶联免疫吸附法(Enzyme Linked Immuno ̄sorbent Assay, ELISA) ELISA是一种超微实验检测技术,基本原则是将特定的抗原抗体免疫反应与酶催化反应进行结合,并通过酶反应的放大显示初级免疫反应。这种方法可以检测抗原和抗体。ELISA具有操作简单、方便、效率高、特异性强、检测成本低的优点,广泛用于检测动物源性食品中的兽药残留。
目前,关于NSAIDs的免疫分析方法较少,主要是因为NSAIDs种类多,抗体制备复杂。2018年Lin等制备敏感的氟尼辛单克隆抗体用于开发IC-ELISA方法检测牛奶中的氟尼辛残留,单克隆抗体IC50为0.29 ng/mL,LOD为0.432 ng/mL,线性范围为0.08664~0.97226 ng/mL[48]。2020年宋炎博制备了吲哚美辛的单克隆抗体,并进一步建立了鲜奶样品中吲哚美辛的ELISA检测方法。抗体IC50为275.05 ng/mL,LOD为2.19 ng/mL,LOQ为40.88 ng/mL[49]。
2.7 免疫胶体金技术(Immune Colloidal Gold Technique, GICT) GICT是一种新型的免疫标记技术,是以胶体金作为示踪目标物应用于抗原及抗体的检测。GICT是一种广泛使用的免疫分析方法,具有分析时间短,肉眼可在10 min内获得结果,以及易于执行和评估的优点。胶体金的物理性状,如颗粒大小、高电子密度、形状和颜色反应,加上结合物的免疫学及生物学的特性,因而使得GICT广泛地应用于细胞生物学、免疫学、病理学、组织学等领域。
2020年Na等制备了针对卡洛芬的高亲和力单克隆抗体,然后开发了用于快速筛选牛肌肉中NSAID的免疫试纸条,以帮助畜牧业强制遵守法规,制作的试纸条的阴阳性界限值为12.5 ng/g,分析牛样品中的NSAIDs残留物具有巨大潜力,IC50值为1.743 ng/g,LOD为0.283 ng/g,测量NSAID的线性范围为0.446~6.804 ng/g,回收率为79.53%~90.55%,RSD<8.81%[50]。2021年Lin等开发了基于单克隆抗体的GICT,用于检测牛奶中6种NSAIDs。6种NSAIDs的IC50为0.31~5.36 ng/mL,结果可在10 min内用肉眼获得[51]。
3 小 结
目前国内外对动物源性食品中NSAIDs的残留检测相关报道很少,并且食品安全国家标准中检测的组织样品和NSAIDs的种类都相对单一。但NSAIDs种类繁多、使用广泛,在环境和动物源性食品中的残留情况愈加严重,难以满足当前NSAIDs的监控需求。
本文重点介绍了NSAIDs在动物源性食品中的前处理方法和检测方法,并比较了各种方法的优缺点。NSAIDs检测方法的发展趋势在仪器检测方向应该进一步优化创新简便、高效的前处理过程,减少样品基质的影响。另外,在免疫分析方向,针对不同类别的NSAIDs,设计合成半抗原,制备广谱识别性单克隆抗体,初步构建NSAIDs免疫分析抗体库,建立并进一步完善NSAIDs及其代谢物的残留检测体系,以保证合理用药,保障人类食品安全,促进畜牧业健康发展。
