重组蛋白疫苗原液中试车间工艺布局设计及案例分析
2023-08-22张生琰孟祥男
张生琰,孟祥男
(绿叶生命科学集团广州派诺生物技术有限公司,广州 510005)
重组蛋白疫苗是一类应用基因重组技术将目标病原微生物的保护性抗原重组到细菌、酵母菌、昆虫细胞、植物细胞、哺乳动物细胞等不同的异源表达系统中,随后这些表达系统经培养、增殖后,纯化制备蛋白抗原可作为疫苗的活性成分[1]。该类疫苗不包含完整病原体,通常需添加佐剂来提高疫苗接种后的免疫反应[2]。相比于传统的灭活疫苗和减毒活疫苗,重组蛋白疫苗具有稳定性和安全性好、成本较低、易于规模化生产等优势,被广泛应用于乙型病毒性肝炎、人乳头状瘤病毒感染、百日咳、白喉、破伤风(简称百白破)等多种传染病的预防[3]。
截止2021 年底,重组蛋白疫苗在全球范围内有74 个上市销售或处于注册状态,适应症包括乙型病毒感染、百白破、流感嗜血杆菌感染、流感病毒感染、脑膜炎奈瑟球菌感染、脊髓灰质炎病毒感染等,其中中国原研疫苗有21 个,占比最高[4]。
当前新型冠状病毒大流行中,重组蛋白疫苗也发挥了重要的作用,在多种技术路线中重组蛋白疫苗项目的数量最多[5]。因此,重组蛋白疫苗是现阶段和未来疫苗开发的主要方向之一,会有越来越多的重组蛋白疫苗进入产业化。本文针对重组蛋白疫苗的生产工艺特点,结合GMP 和国家相关设计要求,对重组蛋白疫苗原液生产工艺流程和中试生产车间的布局进行阐述,并提供原液中试车间设计案例分析。
1 原液中试车间的特征分析
1.1 特殊性
中试是产品从研发进入到商业化生产的重要环节。科研成果经中试后的产业化成功率能达到80%,而未经中试的产业化成功率仅为30%左右[6]。生物制品在实验室研发成功后进入临床实验阶段,临床实验申报样品、I 期和II 期临床样品均需在中试车间生产,因此中试车间的设计需要符合cGMP 和相关法规的要求[7]。
中试车间生产规模较小,尚未达到商业化生产规模,通常是对研发工艺50~ 100 倍的放大生产[8]。另外相比于商业化生产车间,中试车间具有产品不确定性和多产品共线等特点,需要支持产品工艺放大,这都增加了中试车间的设计难度。
1.2 工艺流程及特点
重组蛋白疫苗原液中试生产有以下特点:
(1)生产规模小:重组蛋白疫苗剂量小,通常为20~ 50 ug/剂,因此生产规模相对单抗等治疗性蛋白较小。目前,重组蛋白疫苗原液中试规模的发酵罐/生物反应器规模通常在50~ 200 L;
(2)生产周期长:从细胞复苏、扩增培养到发酵罐/生物反应器培养需要10~ 14 d,发酵罐/生物反应器中培养需要10~ 16 d,整个细胞培养过程历时20~ 30 d;
(3)多产品共线:目前大多数公司的重组蛋白疫苗都在其平台上工艺研发,会有同类型的多种疫苗陆续通过中试放大进入商业化生产,因此多产品共线是中试车间必然的选择。同平台的不同产品在工艺上也会有一定的差异,为防止换品种时的交叉污染,中试车间需要有良好的设计;
(4)完善的病毒控制:重组蛋白疫苗若采用哺乳动物细胞作为表达载体,需要考虑细胞或原材料中潜在引入病毒对产品质量造成的影响,因此需要严格控制病毒引入的风险,还应当有病毒清除灭活的工艺设 置。
重组蛋白疫苗原液的生产工艺流程大致分为两个阶段:
(1)上游,从种子复苏到澄清收获。种子复苏后扩增培养,然后发酵罐/生物反应器进行培养,培养结束后真核体系澄清过滤收获上清液,原核体系经细胞破碎后澄清收获;
(2)下游,从层析到原液。上游收获液经多步层析、超滤后得到原液。哺乳动物细胞表达系统还需考虑病毒灭活和病毒清除步骤。
1.3 生物安全要求
若CHO 细胞为原材料,需要考虑CHO 细胞潜在的病毒污染。CHO 细胞本身无生物学危害,属于生物安全等级一级(ISPE),但需要防止其潜在的污染病毒的风险。病毒污染可能来源于细胞系本身,也有可能是从生产过程中引入的外源病毒[9]。应采取合理的病毒灭活/去除工艺来预防潜在病毒污染。
2 工艺布局设计
2.1 布局设计遵循的标准规范
《药品生产质量管理规范》;
GB 50457—2019《医药工业洁净厂房设计标准》;
GB 50073—2013《洁净厂房设计规范》;
GB 50016—2014《建筑设计防火规范》。
2.2 设计原则
(1)满足GMP 基本要求:GMP(2010 修订版)的“厂房与设施”一章中第一节第一条(原文第三十八条)规定:“厂房的选址、设计、布局、建造、改造和维护必须符合药品生产要求,应当能够最大限度地避免污染、交叉污染、混淆和差错,便于清洁、操作和维护”。按照工艺流程布局,平面布局合理,严格划分区域,防止混淆、防止交叉污染,方便生产操作。
(2)满足操作需求:溶液配制区、准备清洗区与各功能区需布置合理,满足准备的器具、配制的缓冲液或培养基方便进入各自功能区。GMP(2010修订版)的“设备”一章中第三节第一条(原文第七十九条)规定:“设备的维护和维修不得影响产品质量”。车间设备摆放设置合理,有合理的间距便于操作和检修。
(3)满足生物安全要求:重组蛋白疫苗生产中有工程菌或潜在的宿主病毒,因此在车间设计中要考虑严格分开有生物活性区和无生物活性区。GMP(2010 修订版)生物制品(附录3)的“生产管理”一章中第五十二条规定:使用二类以上病原体进行生产时,对产生的污物和可疑污染物品应当在原位消毒,完全灭活后方可移出工作区。有活性区的生产中产生的固体废物和废水需要灭活处理,废气需要过滤后排出。
(4)满足洁净分区要求:种子复苏扩增是敞口无菌操作,需在C 级背景下完成;发酵/细胞培养、纯化在D 级或C 级环境下完成;溶液配制、准备清洗在D 级环境下完成;除菌过滤在A 级单向流保护下完成。
(5)满足安全消防要求:需要满足安全疏散、防火分区的相关规定。
2.3 生产区域划分
根据工艺流程,重组蛋白疫苗原液车间分为种子复苏扩增、发酵/培养、纯化、溶液配制、准备清洗等功能区域。各功能区域布置需按照工艺流程展开,洁净区相对集中,工艺路线顺畅、人流物流分开、物流路线短、不迂回、不折返。
2.4 人、物流的设计
GMP(2010 修订版)的“厂房与设施”一章中第一节第三条(原文第四十条)规定:“厂区和厂房内的人、物流走向应当合理”。人流和物流严格分开,若空间允许,人、物流宜采用单向流设计。
(1)有生物活性的区域:人流和物流的进出宜独立;人员经缓冲间、更衣间、气锁间进入各功能区,操作结束后经退更间、气锁间、缓冲间退回CNC 区,各出入口设置门禁;物料经物净间、物流气锁间进入各功能区,操作结束后固体废物经各区域的灭活设备灭活后传出洁净区。
(2)无生物活性的区域:人流和物流相互独立;人员经缓冲间、更衣间进入各功能区,操作结束后沿原路经更衣间、缓冲间退出洁净区;物料经物净间、物流气锁间进入各功能区,操作结束后固体废物沿原路经物流气锁间、物净间传出洁净区。
2.5 生物安全控制
(1)有活性区和无活性区分开,有毒区和无毒区分开,工艺操作区和溶液配制区、准备清洗区等生产辅助区分开。
(2)采用一次性培养袋、一次性储液袋、无菌连接器等一次性设备最大限度降低污染和交叉污染。
(3)有活性区的固体废物灭活后退出集中处理,废水收集后灭活再排放。
(4)根据工艺各阶段不同污染水平,划分不同的功能区域,设置独立的空间和空调系统。有生物活性区和无生物活性区、有毒区和无毒区采用物理隔离的措施,不同洁净级别间维持法规要求的压差梯度。有生物活性的区域,排风需经过滤处理后排放。
3 案例分析
图1 为依据以上设计理念设计的重组蛋白疫苗原液中试车间工艺布局图。本项目采用哺乳动物细胞系为原材料,经种子复苏扩增、反应器培养、澄清过滤、层析、病毒灭活、超滤、除病毒过滤等步骤制得原液,该工艺流程具有代表性。为满足中试车间多产品共线、多品种生产、产品不确定的需求,最大限度提高中试车间的利用率,本车间采用镜像设计的思路,平行设计两条相互独立的原液中试规模生产线,配液区、清洗准备区等生产辅助区为两条生产线共用区域,这样可以节省车间面积,降低建设成本,但不影响生产。
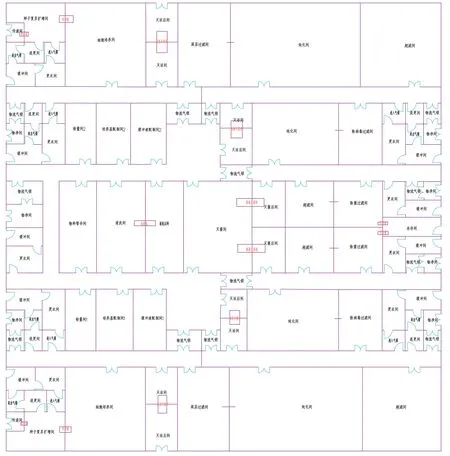
图1 重组蛋白疫苗原液中试车间工艺布局图Fig.1 Process layout diagram of pilot plant for stock solution of recombinant protein vaccine
3.1 平面布局
设计时应用了国际上通用的模块化设计思路,按照工艺流程将生产区域划分开,依次布置种子复苏扩增区、细胞培养区、除病毒过滤前纯化区、除病毒过滤后纯化区、生产辅助区。
(1)种子复苏扩增区为有生物活性区。细胞种子从液氮罐取出后传递至复苏扩增间,然后完成细胞的复苏和扩增培养,该区域的操作均为敞口操作,需在生物安全柜进行,背景环境为C 级。
(2)细胞培养区为有生物活性区,环境的洁净级别为D 级。该区域包括细胞培养间和澄清过滤间,均属于上游生产区,与下游严格物理隔离。细胞培养结束后,将细胞培养液运送至澄清过滤间进行澄清过滤,澄清过滤后上清经穿墙管输送至下游生产区。
GMP(2010 修订版)生物制品(附录3)的“厂房与设备”一章中第二十一条规定:“使用密闭系统进行生物发酵的可以在同一区域同时生产,如单克隆抗体和重组DNA 制品”。因此细胞培养间留有充足的空间来放置2~ 3 台一次性生物反应器,能够满足两台以上的生物反应器在同一区域内同时生产,不但解决了房间因隔断过多导致利用率低的问题,还能够提高车间的使用灵活性。
(3)下游生产区包括除病毒过滤前纯化区和除病毒过滤后纯化区,除病毒过滤前纯化区属于有毒区,除病毒过滤后纯化区属于无毒区,两个区域严格物理隔离,环境的洁净级别为C 级。在下游生产区,常规的生产工艺包括层析、超滤、病毒灭活及除病毒过滤等。该区域工艺操作复杂、人员较多、生产周期短、生产批次更换频繁,因此对人员管理的要求较高,宜按照工艺流程布局房间,以避免交叉污染和产品污染。中试车间的产品不确定,工艺路线不定,因此各区域应预留充足的房间,房间有足够的空间,以满足不同产品的生产。
(4)生产辅助区,该区域包括物料暂存间、称量间、培养基配制间、缓冲液配制间、清洗间、灭菌间等,环境的洁净级别为D 级。为满足不同品种的生产,培养基和缓冲液的配制和暂存均采用一次性储液袋,有较好的工艺灵活性。两条原液生产线共用一个生产辅助区,但培养基配制间和缓冲液配制间为两条线各配置一套的设计,便于人员的操作和管理。
3.2 人流设计
(1)种子复苏扩增区、细胞培养区及除病毒过滤前纯化区:该区域人流进出设计为回字形,人员进出共用一个缓冲间,人员进入依次经缓冲间、更衣间、进入气锁间,人员退出依次经退更间、退出气锁间、缓冲间。人员进出严格分开,防止交叉污染。
(2)除病毒过滤后纯化区和生产辅助区:该区域为无毒区,人员进入依次经缓冲间、更衣间,人员退出为沿原路返回。
3.3 物流设计
(1)种子复苏扩增区:该区域进入的物料均为小物品,如细胞冻存管、移液枪头、移液管、小体积培养基等,因此物料传递应用传递窗,能够控制污染的风险。
(2)细胞培养区、下游生产区及生产辅助区:该区域物料进入依次经物净间、物流气锁间,物料退出为原路返回。物料进出均需拆外包装,外表擦拭消毒后传递。
3.4 污物流设计
(1)种子复苏扩增区和细胞培养区:该区域的污物经洁净走廊传递到灭活间,灭活后间在CNC 区,因此污物灭活后可直接运送到污物暂存间。
(2)除病毒过滤前纯化区:该区域的污物经洁净走廊传递到灭活间,灭活后间在生产辅助区一侧。部分可重复使用的塑料桶、不锈钢桶等器具在灭活后直接运送到生产辅助区的清洗间,用器具清洗机清洗后存放。
(3)除病毒过滤后纯化区和生产辅助区:该区域为无毒区,污物无需灭活处理,装袋密封后清洁消毒经物流退出路径传出到CNC 区,然后运送到污物暂存间。
3.5 空调分区
GMP(2010 修订版)生物制品(附录3)的“厂房与设备”一章中第二十三条规定:“有菌(毒)操作区应当有独立的空气净化系统。来自病原体操作区的空气不得循环使用;来自危险度为二类以上病原体操作区的空气应当通过除菌过滤器排放,过滤器的性能应当定期检查”。
种子复苏扩增区、发酵/培养区、除病毒过滤前纯化区均属于有毒区,其中种子复苏扩增区、发酵/培养区属于有生物活性区,各区域有生物活性暴露的风险。种子复苏扩增区、发酵/培养区、除病毒过滤前纯化区、除病毒过滤后纯化区、生产辅助区分别采用独立的空调系统。
4 结束语
近年来,随着新冠疫情的蔓延,国内有越来越多的疫苗产品由小试工艺进入中试,并且各企业的产品大多采用平台工艺,陆续会有不同的产品进入中试阶段,因此建立一个满足多产品共线、多品种生产需求的中试车间至关重要[10]。中试车间承担了IND 申报样品、临床I/II 期样品的制备工作,其设计建设需符合cGMP 要求。工艺布局设计是中试车间设计的关键,不仅需满足中试车间对不同产品不同工艺流程的需求,还需符合各专业设计规范的要求,因此综合各方面要求的设计方案才是最适合的方案[11]。
随着重组蛋白疫苗生产技术的发展、生产设备自动化程度的提高、一次性设备的广泛应用,对中试车间的设计也提出更高的要求[12]。另外提高车间的经济性、减少车间能耗、降低劳动成本、提升车间利用率也是中试车间重点考虑的方向[13]。本文所提及的设计理念在后续的实践中还需加以检验并不断修正。
