雌马酚对非酒精性脂肪性肝细胞模型的氧化应激作用研究*
2023-08-21崔涵强倪向敏张贵明
崔涵强,倪向敏,张贵明,徐 喆,李 硕,王 建
(陆军军医大学第二附属医院营养科,重庆 400037)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)包括单纯性脂肪肝、脂肪性肝炎、脂肪性肝硬化,晚期可发展为肝癌,现已成世界范围内慢性肝病的重要病因之一。我国NAFLD发病率呈上升趋势,NAFLD已成为一项重大的公共卫生问题[1-2]。NAFLD发病机制复杂,氧化应激是NAFLD发病的重要环节[3]。因此,缓解肝脏的氧化应激反应,可为防治NAFLD带来新思路。核因子E2相关因子(nuclear factor-E2 related factor 2,Nrf2)与氧化应激和炎症反应关系密切。Nrf2是调控氧化应激反应的关键因子,被激活后可以从细胞质转移至细胞核中,促进其下游的抗氧化基因血红素加氧酶-1(heme oxygenase 1,HO-1)、醌氧化还原酶(NADPH quinone oxidoreductase 1,NQO1)等表达,发挥抗氧化效应[4]。有研究表明,Nrf2在被敲除后可加速肥胖和NAFLD发病[5],Nrf2信号通路的激活通过改善氧化应激对NAFLD发挥保护作用[6-7]。
雌马酚(Equol,Eq)是大豆异黄酮类物质在体内的一种特定代谢产物,具有较强的抗氧化作用[8-9],但Eq能否通过调节Nrf2信号通路缓解NAFLD尚不清楚。本研究旨在通过体外NAFLD模型探讨Eq能否缓解氧化应激及改善NAFLD,并探讨其可能的机制。
1 材料与方法
1.1 材料
BRL3A细胞、DMEM基础培养基、胎牛血清购于武汉普诺赛生命科技有限公司;Eq购于大赛璐药物手性技术有限公司;油酸钠(NaOL)购于西安鲲创科技发展有限公司;尼罗红脂肪荧光染色液购于北京普利莱基因技术有限公司;放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解液、二喹啉甲酸蛋白浓度测定试剂盒、过氧化氢酶(catalase,CAT)检测试剂盒、活性氧(reactive oxygen species,ROS)检测试剂盒、超敏增强化学发光(enhanced chemiluminescence,ECL)试剂盒、cDNA第一链合成试剂盒购于上海碧云天生物技术有限公司;甘油三脂(triglyceride,TG)、总胆固醇(total cholesterol,TC)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)检测试剂盒购于南京建成生物工程研究所;细胞核蛋白抽提试剂盒、总RNA提取试剂盒、HO-1抗体、NQO1抗体、LaminB1抗体、GAPDH抗体、过氧化物酶耦联的二抗、引物购于生工生物工程(上海)股份有限公司;Nrf2抗体、SYBR Green Fast qPCR Mix试剂盒购于武汉爱博泰克生物科技有限公司;全波长多功能酶标仪购于美国THERMO公司;倒置荧光显微镜购于日本奥林巴斯公司;超灵敏化学发光成像系统FluorQuant AC600购于美国ACURONBIO公司;CFX connect聚合酶链反应(polymerase chain reaction,PCR)仪购于美国Bio-rad公司。
1.2 方法
1.2.1细胞培养
BRL3A细胞培养于含10%胎牛血清、1%双抗DMEM培养基中,置于37 ℃、5% CO2的恒温培养箱中。根据细胞生长情况,每2~3天更换培养液,当细胞生长密度到80%~90%时,用0.25%胰蛋白酶消化收集细胞并按1∶3传代。
1.2.2细胞活力检测
以2.0×104个/孔细胞量接种于96孔板中,待细胞贴壁后,将NaOL和Eq以浓度梯度分组给药,继续培养24 h,根据CCK-8试剂盒说明书测定细胞活力。
1.2.3细胞干预与分组
将BRL3A细胞接种于6孔板中,2×105个细胞/孔,分为正常对照组(Con,正常培养基培养)、模型组(Mod,0.48 mmol/L的NaOL造模),以及Eq低、中、高剂量干预组(Eq-L、Eq-M、Eq-H,分别采用0.1、1.0、10.0 μmol/L的Eq干预24 h)。细胞贴壁后采用无胎牛血清的培养基饥饿8 h后进行相应干预。
1.2.4细胞TG、TC含量测定
干预结束后,收集细胞于EP管中,加入磷酸缓冲盐溶液(PBS),超声裂解细胞后取细胞匀浆进行测定。具体操作步骤按测定试剂盒说明书进行。
1.2.5尼罗红染色
干预结束后,去除培养基,采用4%多聚甲醛固定10 min,蒸馏水漂洗3次,尼罗红染色工作液染色10 min,PBS清洗两次,于倒置荧光显微镜(激发光492~577 nm)观察细胞脂质蓄积情况,采用Image J软件进行荧光强度分析。
如表5所示,统计1990-2018年刊载情报信息机构知识服务研究成果的文献刊物来源,排在第1位的刊物是《图书情报工作》,文献数量为24篇,《情报理论与实践》位列第2位,文献数量为11篇,《情报杂志》和《情报探索》排在第3位和第4位,刊载的文献数量分别为8篇和7篇列出了刊载知识服务文献数量最多的前十位来源期刊。这些刊物对于我国普及知识服务理论知识,推广各单位的工作实践成果和经验发挥了重要的作用,也是从业工作者获取相关信息的重要渠道。
1.2.6细胞内氧化应激指标测定
测定细胞内ROS水平时,去除培养基,采用PBS漂洗3次,加入含有10 μmol/L的DCFH-DA荧光探针无胎牛血清培养基,37 ℃孵育30 min。采用无胎牛血清培养基洗涤2次并收集细胞,荧光酶标仪检测荧光值,激发光为488 nm,发射光为535 nm。测定细胞内SOD、MDA、CAT水平时,在干预结束后将细胞收集于EP管中,加入PBS,超声裂解细胞,4 ℃、12 000 r/min离心10 min,取上清液测定SOD、MDA、CAT水平,具体操作步骤按测定试剂盒说明书进行。
1.2.7蛋白质印迹法(Western blotting)检测
干预结束后将细胞收集至EP管中,加入含1 mmol/L PMSF的RIPA裂解液,采用超声裂解细胞,然后以4 ℃、12 000 r/min离心10 min,提取细胞总蛋白。根据试剂盒说明书提取细胞核蛋白。各组取等量蛋白样品,采用10% SDS-聚丙烯酰胺凝胶进行电泳,电泳结束进行转膜、封闭,一抗4 ℃孵育过夜,洗涤后加入二抗,室温孵育1 h,充分洗涤。最后采用化学发光成像系统进行蛋白显影,采用Image J软件进行灰度值分析。
1.2.8qPCR检测

表1 引物序列
1.3 统计学处理
2 结 果
2.1 不同浓度的NaOL和Eq对细胞活力的影响
与Con组比较,当NaOL浓度到达0.72 mmol/L时,细胞活力明显下降,差异有统计学意义(P<0.05);与Con组比较,当Eq浓度达到100 μmol/L时,细胞活力明显受到抑制(P<0.05),见图1。
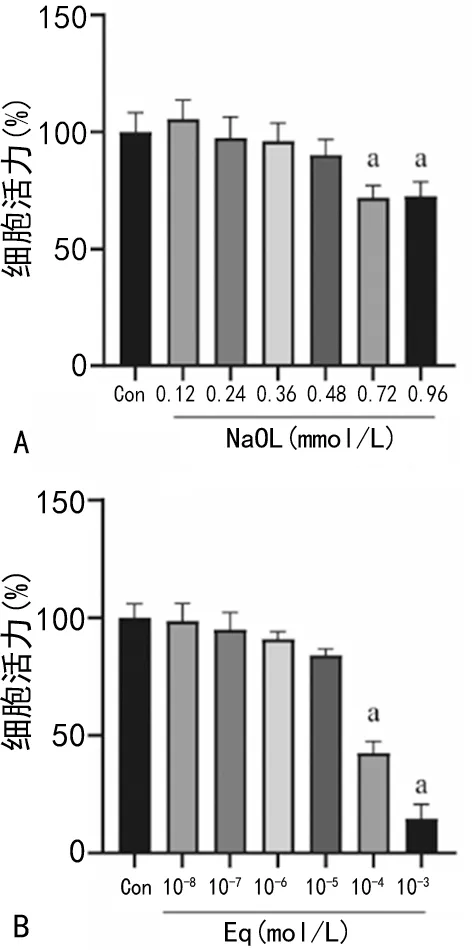
A:不同NaOL浓度对细胞活力的影响;B:不同Eq浓度对细胞活力的影响;a:P<0.05,与Con组比较。
2.2 各组细胞内脂质水平比较
与Con组比较,Mod组细胞内TG、TC水平明显升高,差异有统计学意义(P<0.05);与Mod组比较,Eq干预各组细胞内TG、TC水平明显降低,差异有统计学意义(P<0.05),且呈现出一定的剂量效应,见图2。与Con组比较,Mod组细胞内红色荧光较强;与Mod组比较,Eq干预各组细胞内红色荧光强度较弱,随着Eq浓度的增高,细胞内荧光强度逐步减弱,差异有统计学意义(P<0.05),见图3。

A:各组TG水平;B:各组TC水平;a:P<0.05,与Con组比较;b:P<0.05,与Mod组比较。

A:Con组细胞内脂质累积情况;B:Mod组细胞内脂质累积情况;C:Eq-L组细胞内脂质累积情况;D:Eq-M组细胞内脂质累积情况;E:Eq-H组细胞内脂质累积情况;F:各组荧光强度分析;a:P<0.05,与Con组比较;b:P<0.05,与Mod组比较。
2.3 各组细胞内氧化应激指标的比较
与Con组比较,Mod组细胞内ROS水平明显升高,差异有统计学意义(P<0.05);与Mod组比较,Eq干预各组细胞内ROS水平逐渐降低,差异有统计学意义(P<0.05),并呈现出一定剂量效应,见图4A。与Con组比较,Mod组细胞内的MDA水平明显升高,SOD、CAT水平明显降低,差异均有统计学意义(P<0.05);与Mod组比较,Eq干预各组细胞内SOD、CAT水平升高,Eq-M、Eq-H组细胞内MDA水平降低,差异有统计学意义(P<0.05),见图4B~D。

A:各组ROS水平;B:各组SOD水平;C:各组MDA水平;D:各组CAT水平;a:P<0.05,与Con组比较;b:P<0.05,与Mod组比较。
2.4 各组细胞Nrf2、HO-1、NQO1蛋白表达水平
与Con组比较,Mod组Nrf2(nucleus)、HO-1、NQO1表达水平明显降低,差异有统计学意义(P<0.05);与Mod组比较,Eq干预各组Nrf2(nucleus)、HO-1、NQO1表达水平明显升高,差异有统计学意义(P<0.05),且Eq随浓度的增高呈逐步上升趋势,见图5。

A:Western blotting结果;B:Nrf2蛋白分析结果;C:HO-1蛋白分析结果;D:NQO1蛋白分析结果;a:P<0.05,与Con组比较;b:P<0.05,与Mod组比较。
2.5 各组细胞Nrf2、HO-1、NQO1 mRNA表达水平
与Con组比较,Mod组Nrf2、HO-1、NQO1 mRNA表达水平明显下调,差异有统计学意义(P<0.05);与Mod组比较,Eq干预各组Nrf2和HO-1 mRNA表达水平明显上调,Eq-M、Eq-H组NQO1 mRNA表达水平明显上调,差异有统计学意义(P<0.05),见图6。

A:Nrf2 mRNA相对表达量;B:HO-1 mRNA相对表达量;C:NQO1 mRNA相对表达量;a:P<0.05,与Con组比较;b:P<0.05,与Mod组比较。
3 讨 论
随着人们生活水平的提高、饮食结构和生活方式的改变,以及影像诊断技术的发展,NAFLD的发病率日益增高。目前,尚无特异性治疗NAFLD的药物,控制饮食和改善生活方式是NAFLD防治的基础,但多数人难以长期坚持[10]。研究表明,食用大豆食品对NAFLD具有保护作用,这种有益作用可能归因于其代谢产生的大豆异黄酮[11]。Eq是大豆异黄酮在体内的代谢产物,在动脉粥样硬化、癌症、围绝经期症状和骨质疏松等方面具有保护效应[12]。据报道,Eq可以减轻多种细胞和组织中的氧化应激和细胞损伤[13-14],而且它在所有已知的异黄酮类中具有较强的抗氧化活性[15]。氧化应激反应对NAFLD的发展具有促进作用,Nrf2与氧化应激反应密切相关,但是目前还没有研究报道Eq是否可以调控Nrf2信号通路及对NAFLD发挥保护作用。本研究通过BRL3A细胞建立体外NAFLD模型,研究Eq对细胞内氧化应激的作用和机制。
本研究发现,Mod组细胞内TG、TC、ROS、MAD水平升高,SOD、CAT水平降低,Nrf2信号通路相关蛋白和mRNA表达降低,表明体外NAFLD氧化应激细胞模型建立成功。Eq干预后可见细胞内脂滴明显减少,TG、TC水平降低,提示Eq对NAFLD具有保护作用。ROS可诱导多种炎症细胞因子表达,促进氧化应激,形成炎症-坏死循环,加重肝组织损伤[16]。SOD和CAT是细胞内重要的抗氧化酶,能够有效清除自由基及ROS,抑制过氧化反应,发挥保护作用。MDA为自由基参与脂质过氧化反应产生的毒性物质,其表达过多可严重破坏细胞膜结构,引起细胞肿胀、坏死,加重细胞损伤[17]。本研究结果表明,Eq可以降低细胞内ROS的产生和MDA水平,提高抗氧化酶SOD和CAT活性,且随着Eq浓度增高,细胞抗氧化能力不断增强。GOU等[18]的研究表明,Eq可通过降低MDA和增加SOD、CAT表达,抑制脂多糖诱导的细胞内氧化应激反应;CHOI等[19]研究发现,Eq可以提高HepG2细胞内SOD、CAT水平,发挥抗氧化作用。这与本研究结果一致,提示Eq可通过抗氧化作用,减轻NAFLD体外模型中氧化应激的进展,发挥肝保护作用。
Nrf2通路是机体抵御氧化应激的重要信号通路。在生理条件下,Nrf2主要存在与细胞质中,在受到亲电体或氧化应激刺激后,Nrf2转移到细胞核,促进下游抗氧化反应原件和各种抗氧化酶的表达[20]。HO-1可以通过催化血红素降解为胆绿素Ⅸα、一氧化碳和铁,调节氧化还原反应,还具有抗炎和抗细胞凋亡作用[21];NQO1可以催化内源和外源苯醌化合物及其衍生物的电子还原,同时具有抗炎与抗肿瘤作用[22]。ZHANG等[23]研究发现,Eq可上调Nrf2在小鼠主动脉组织和人脐静脉内皮细胞中的表达,发挥抗氧化和抗动脉粥样硬化作用;WIDYARINI等[24]研究发现,Eq可以通过上调HO-1表达,呈剂量依赖地抑制紫外线诱导小鼠皮肤中的脂质过氧化。本研究结果显示,Mod组细胞中的Nrf2、HO-1和NQO1蛋白和mRNA表达均下降,推测为氧化应激条件下细胞损伤,蛋白合成受到抑制,Eq可以上调上述Nrf2及其下游蛋白表达和mRNA合成,提示Eq是通过激活Nrf2信号通路发挥其抗氧化作用。
综上所述,本研究发现,大豆异黄酮类物质Eq对体外NAFLD细胞具有保护作用,可以减轻脂质累积,并通过激活Nrf2信号通路,抵抗细胞内氧化应激,这对异黄酮类物质在肥胖人群中的应用和膳食指导有重要意义。本研究仍值得改进,Eq是通过何种分子信号介导激活Nrf2通路产生影响仍不清楚,Eq的保护作用仍需在体内和人群试验中得到进一步验证。
