夏季互花米草植物体介导的甲烷排放日进程特征
2023-08-21徐正方

摘要 利用悬管装置,在夏季对闽江河口湿地外来入侵种互花米草植物体介导的甲烷传输排放途径日进程气样进行采集,气相色谱测定甲烷浓度,同时利用静态箱+气相色谱法测定了互花米草沼泽湿地甲烷排放通量的日进程动态。结果表明:在夏季一个日进程中互花米草植物体介导的甲烷传输排放量呈动态变化,在18:00达到相对高峰值。互花米草植株0~20 cm部位甲烷传输释放能力最强,占整株甲烷传输排放量的50%以上,上半株甲烷排放能力最弱;各测定时刻互花米草植物体甲烷传输排放量对于相应时刻互花米草沼泽湿地甲烷排放通量的贡献率呈波动变化,变化范围分别为5.41%~21.08%,平均为10.42%;针对互花米草沼泽湿地,甲烷排放通量平均值为52.31 mg/(m2·h)。
关键词 日进程;植物体传输途径;互花米草
中图分类号: 文献标识码:B 文章編号:2095–3305(2023)06–0182-03
全球变暖已成为当今世界普遍关注的环境问题之一,作为重要温室气体之一的甲烷在全球变暖中也有着较大的贡献。CH4的排放是CH4产生、氧化和传输综合作用的结果,湿地为CH4的产生提供了良好的厌氧环境和产生底物,湿地甲烷传输主要包括液相传输、气泡传输、植物传输3种方式[1]。目前,互花米草已成为我国东南沿海河口海湾潮汐沼泽湿地主要的外来入侵种。仝川等[2](2009)原位测定了闽江河口互花米草湿地甲烷排放通量的季节动态,但是关于互花米草的甲烷传输日进程变化特征当前还极少见报道。以闽江口互花米草沼泽湿地为研究对象,夏季以不破坏植株为前提,对互花米草CH4传输日变化特征进行观测探讨,以更深入地认识湿地植物传输甲烷的能力及其规律。
1 材料与方法
1.1 研究区概况
鳝鱼滩湿地是闽江河口区面积最大的感潮湿地,地理坐标为119°34′12″E~119°40′40″E,26°00′36″N~26°03′426″N,降水多发生在3—9月。
鳝鱼滩湿地中高潮滩分布有较多的湿地物种,包括本地物种和外来入侵物种,其中主要的本地优势植物为芦苇(Phragmites australis)和短叶茳芏(Cyperus malaccensis Lam. var. brevifolius Bocklr.)。
近年来,外来植物互花米草在闽江河口鳝鱼滩湿地的入侵速率较快,尤其是在适合其生长的潮滩和近高潮滩,生长十分迅速,区域内已存在大面积的入侵斑块,在区域的生态系统中占据重要位置。在鳝鱼滩湿地中西部的中偏高潮滩地段选择1个互花米草入侵斑块,设置1个面积为20 m×20 m的大样方开展研究。
1.2 植物体介导的甲烷排放途径气样采集
为减少取样时的践踏干扰,搭设木制栈桥直通取样测定样地。2009年夏季的1个小潮日进行互花米草植物体甲烷传输日进程24 h采样,采样时间均为第1天的12:00至翌日12:00,采样时间间隔为3 h。
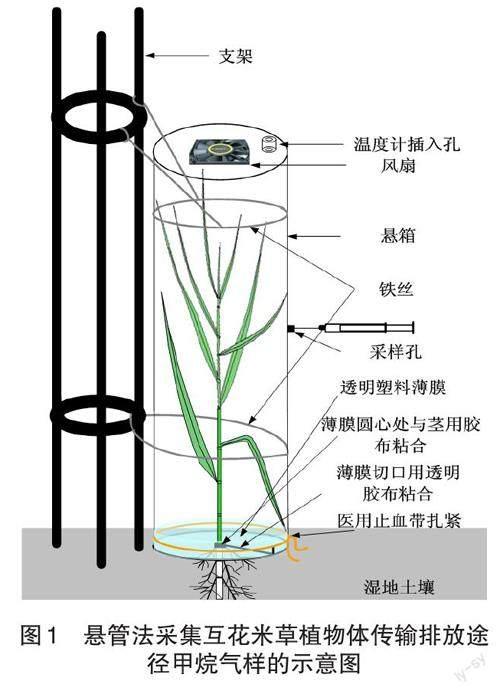
为了采集到互花米草整株和植株不同高度部位的甲烷传输排放的气样,对Lars等[3]测定植物体甲烷传输的装置进行改进,设计了可调整高度,且更适合互花米草植株测定的悬管装置。在研究样地共选择12个高度和长势相近的互花米草植株,3个为1组,分别用以测定不同高度部位及整株的甲烷传输排放量。悬管用透明有机玻璃管制成,壁厚2 mm,直径10 cm,顶部密闭并安装风扇,采样时,打开风扇以混匀管内气体。采样时,将支架提前安放在样地,用有机玻璃管罩住植株,在有机玻璃管上缠上1圈铁丝,将铁丝挂在支架上使管悬空。将透明塑料薄膜裁成圆形,取圆形透明塑料薄膜从边缘裁剪至圆心处,根据试验处理设计,将整株或植株不同部位套上薄膜,使得塑料薄膜圆心与植株茎秆接触并用胶带黏合,薄膜裁剪处也用胶带黏合,最后将塑料薄膜与悬管底部外侧用医用止血带扎紧,保证气密性(图1)。在每个3 h内,用100 mL带三通阀的注射器抽气样4次(间隔15 min采集气样1次),1次采样量为50 mL,采样结束后,将气样带回实验室立刻进行测定。
1.3 互花米草沼泽湿地甲烷通量气样采集
在测定互花米草植物体甲烷传输能力的同时,同步采用静态箱采集互花米草湿地甲烷排放通量的测定气样,在以上大样方内设置3个静态箱重复。静态箱由底座、中箱和顶箱3个部分组成,底座由不锈钢材料制成,长、宽和高分别为35、35和30 cm;中箱和顶箱由2 cm厚的透明有机玻璃板制成,箱体高度因不同生长阶段互花米草植株高度而定做,采样时间同以上植物体甲烷传输气样采集。
1.4 测定甲烷浓度设备及参数
采用岛津GC-2010气相色谱仪分析气样的甲烷含量。甲烷检测器为FID(氢离子火焰化检测器),载气为氮气,流速20 mL/min;氢气为燃气,流速为47 mL/min;空气为助燃气,流速为400 mL/min,检测器温度为130 ℃,分离柱温度为60 ℃。
1.5 植物体传输排放量及甲烷排放通量计算
悬管法植物体介到的甲烷传输排放量(F)计算公式:
式(1)中,F[(mg/(株·h)]为植物体介导的甲烷传输排放量;M(g)为甲烷的分子量;V(L)为标准状态下1 mol甲烷的体积;dc/dt(×10-6/h)为甲烷含量变化率;T(℃)为悬管内温度;V1(L)为悬管体积。甲烷含量变化率通过对每次采集的3个气样的甲烷含量测定值进行线性回归分析获得[4-6]。为了保证数据的质量,只有当以上线性回归分析中的相关系数R2>0.9时,才认为数据有效。
互花米草湿地甲烷排放通量计算公式参照王德宣等[7]和仝川等[2]。
互花米草植株不同高度部位甲烷排放量计算公式:
式(2)中,F0为地面以上20 cm植株部位甲烷排放量计算值;F单为互花米草整株传输排放甲烷量的测定值;F1为地面以上20 cm以上植株部位甲烷排放量测定值;F2为20 cm至半株高部位甲烷排放量计算值;F半为半株高以上部位甲烷排放量测定值。
互花米草植株不同高度部位甲烷传输排放量对整株植物甲烷传输排放量贡献率计算公式:
C=100%×F部位/F单(3)
式(3)中,C为不同高度部位甲烷传输排放量占整株植物甲烷传输排放量的百分比;F部位为公式(2)中的F0、F2或F半,F单为互花米草整株传输排放甲烷量测定值,以此计算互花米草0~20 cm,20 cm至半株高部位、半株高以上部位的甲烷排放量对整株植物传输排放量的贡献率。
单位面积互花米草沼泽湿地互花米草植物体甲烷传输排放量计算公式:
F种群=F单×d(4)
式(4)中,F种群[mg/(m2·h)]为单位面积(m2)互花米草沼泽湿地互花米草植物体甲烷传输排放量;F单为互花米草单株甲烷传输排放量;d (株/m2)为互花米草种群密度。
互花米草植物体甲烷传输排放量占互花米草濕地甲烷排放通量的贡献率:
P=100%×F种群/F湿地(5)
式(5)中,P(%)为互花米草植物体甲烷传输排放量占湿地甲烷排放通量的百分比,F种群为互花米草沼泽湿地单位面积互花米草植物体甲烷传输排放量,F湿地为互花米草沼泽湿地甲烷通量。
1.6 环境因子测定
土壤(20 cm深度)温度、pH值和氧化还原电位分别用IQ150便携式pH/氧化还原电位计(IQ Scientific Instruments)测定;土壤盐度(以电导率表征)采用2265FS便携式电导盐分/温度计(Spec-trum Technologies Inc.)测定。
1.7 数据处理及分析
此次野外试验烟研究的各项指标均值和标准误差可使用工作中常用的EXCEL软件进行计算统计分析,再利用常规数理统计常用的SPSS 13软件进行结果统计,SPSS 13软件中的One-Way ANONY分析白天和夜间植物体介导的甲烷传输排放量的差异[8-12]。
2 结果与分析
2.1 夏季植株介导的整株互花米草甲烷传输排放量日进程动态
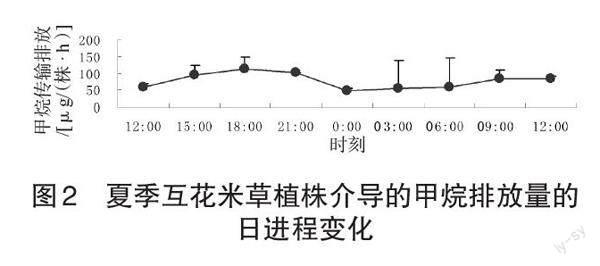
夏季互花米草植物体甲烷传输排放量的日进程变化(图2)在18:00达到1个甲烷排放的相对峰值,为112.5 μg/(株·h),而在00:00降到了1 d的最低值,49.0 μg/(株·h)。通过对各测定时段之间互花米草植株甲烷传输排放量的显著性比较,结果发现它们之间并无显著性差异(P>0.05)。对于植物体介导的互花米草整株甲烷传输排放量,以测定日中06:00~18:00时段的平均值作为白天平均值,得出为84.5 μg/(株·h),测定日中21:00至翌日03:00时段的值的平均值夜间平均值为68.5 μg/(株·h),白天甲烷排放量大于夜间,但他们之间差异性不显著(P>0.05);夏季互花米草植物体甲烷传输日平均值为52.3 μg/(株·h)。
2.2 夏季互花米草沼泽湿地甲烷排放通量的日进程变化
夏季互花米草沼泽湿地甲烷排放通量日进程具有较明显的动态变化,在15:00和03:00分别达到2个排放高峰值,分别为67.43 mg/(m2·h)和66.89 mg/(m2·h),而在21:00降至1 d排放的最低值31.11 mg/(m2·h),其余测量时间点之间的值差异并不大(图3)。白天(55.30 mg/(m2·h)与夜间(47.33 mg/(m2·h)的互花米草沼泽湿地甲烷传输通量并没有显著的差异(P>0.05)。利用每个时段测定结果计算其日平均值,夏季测定日互花米草沼泽湿地甲烷通量平均值为52.31 mg/(m2·h)。
3 结论与讨论
本研究在不破坏植物体与其生长环境的情况下对夏季闽江河口互花米草沼泽湿地进行了不同部位植物甲烷传输、湿地甲烷排放通量与环境因子的日变化的测定。结果表明:互花米草植物体介导的甲烷传输排放量具有明显的日变化特征,在第1天的18:00达到最大值,随后有先下降后上升的趋势,白天平均传输排放量大于夜间。出现此现象主要与甲烷的传输机制有关,传输机制包括有分子扩散和对流传输,湿地范围内植物种类较多,植物内部管径不同,传输的路径不一致也与不同植物种类的内部管径结构相关。
互花米草白天采用的传输机制是对流传输,夜间的传输机制择转为分子扩散,因此,白天传输的量大于夜晚。有研究表明,光合有效辐射被认为是影响甲烷排放日变化的重要因素,表现在完成扩散主导向对流主导的传输方式的转换,增加气孔导度,以及产生更多的与甲烷产生密切相关的光合作用碳(photosynthesized carbon)。
互花米草沼泽湿地甲烷排放通量在1 d中具有一定的波动性,其变化趋势表现为双峰型。在首日的15:00和翌日的03:00均出现1个较大值;白天均值也大于夜间,产生的原因较多,如温度的昼夜差异、白天相对较高的土壤温度是造成湿地甲烷排放通量白天高于夜间的原因之一[13];同时,湿地甲烷排放过程受到许多物理,化学,生物因素的共同影响,单因子关系不足以解释甲烷排放的差异[14],Ding等[15]在东北三江平原沼泽湿地甲烷通量日变化研究的结果为甲烷通量最大值出现在09:00,最低值出现在00:00。
综合图2、图3可以看出,在首日12:00~15:00植物介导的甲烷传输升高的同时,湿地甲烷传输通量也在增加,此时所得到的植物体甲烷传输贡献并没有很大变化,但随后出现了的植物体甲烷传输贡献的上升到最大值,表明湿地甲烷排放中的植物介导的甲烷传输占有更大的比重,而气泡和液相传输的贡献率变得较小。
为了在24 h内以每3 h间隔连续采集互花米草植物体介导的甲烷传输排放气样集,本研究选定在小潮日进行观测和取样,小潮日研究样地基本无潮水水淹,因此,研究结果揭示的只是河口互花米草沼泽湿地小潮日互花米草植物体介导的甲烷传输排放日进程特征。在今后的研究中,需要进一步揭示在有潮水水淹情况下(大、中潮日)的互花米草植物体介导的甲烷传输排放日进程规律,但如何采集一天内潮水水淹阶段(涨落潮阶段,为7~8 h)互花米草植物体介导的排放到大气和潮水中的甲烷气样,需要创新采样气室设计,目前还未见对于包括潮水水淹过程的植物体介导的甲烷传输排放日进程的文献报道。
參考文献
[1] 王维奇,曾从盛,仝川.芦苇湿地甲烷排放机理及排放通量研究进展[J].农业系统科学与综合研究,2008(1):20-25.
[2] 仝川,闫宗平,王维奇,等.闽江河口感潮湿地入侵种互花米草甲烷通量及影响因子[J].地理科学,2008,28(6):826-832.
[3] Lars Kutzbach, Dirk W, Eva-Maria P. Effect of microrelief and vegetation on methane emission from wet polygonal tundra, Lena Delta, Northern Siberia[J]. Biogeochemistry, 2004(69): 341-362.
[4] Gauci V, Dise N, Fowler D. Controls on suppression of methane flux from a peat bog subjected to simulated acid rain sulfate deposition[J]. Global Biogeochemcy, 2002(16): 1-4, 12.
[5] Song C C, Xu X F, Tian H Q, et al. Ecosystem-atmosphere exchange of CH4 and N2O and ecosystem in wetlands in the San jiang Plain, Northeastern China[J]. Global Change Biol, 2009(15): 692-705.
[6] Hirota M, Tang Y H, Hu Q W, et al. Methane emission from different vegetation zones in a Qinghai-Tibetan plateau wetland[J]. Soil Biol Biochemcy, 2004(36): 737-748.
[7] 王德宣,丁维新,王毅勇.若尔盖高原与三江平原沼泽湿地CH4排放差异的主要环境影响因素[J].湿地科学,2003(1):63-67.
[8] Chanton J P,Whiting G J, Happell J D,et a1. Contrasting rates and diurnal patterns of methane emission from emergent aquatic macrophytes[J]. Aquatic Botany, 1993(46): 111-128.
[9] Hwang Y H, Morris J T. Evidence for hgrometric pressurization in the internal gas space of Spartina alterniflora[J]. Plant Physiol, 1991(96): 166-171.
[10] Whitng G J, Chanton J P. Control of the diurnal pattern o f methane emission from emergent aquatic macrophytes by gas transport mechanism[J]. Aquatic Botany, 1996(54): 237-253.
[11] Vander Nat F J W A, Middelburg J J, Van Meteren D, et a1. Diel methane emission patterns from Scirpus lacustris and Phragmites australis[J]. Biogeochemistry, 1998(41): 1-22.
[12] Morrissey L A, Zobel D B, Livingston G P. Significance of stomatal control on methane release from Carex -dominated wetlands[J]. Chemosphere, 1993(26): 339-355.
[13] 段晓男,王效科,欧阳志云.维管植物对自然湿地甲烷排放的影响[J].生态 学报,2005,25(12):3377-3379.
[14] Mikkela C, Sundh I, Svensson B H et al. Diurnal variation in methane emission in relation to the water table, soil temperature, climate and vegetation cover in a Swedish acid mire[J]. Biogeochemistry, 1995(28): 93-114.
[15] Ding W X, Cai Z C, Tsuruta H. Diel variation in methane emissions from the stands of Carex lasiocarpa and Deyeuxia angustifolia in a cool temperate freshwater marsh[J]. Atmos Environ, 2004(38): l8l-l88.
责任编辑:黄艳飞
Daily Process Cha-racteristics of Methane Emission Mediated by Sporobolus alterniflorus Plants in Summer
Xu Zheng-fang (Hunan Zhongsheng Ecological Environment Technology Co., Ltd, Changsha, Hunan 410000)
Abstract The diurnal variation of the plant mediated methane transport from Sporobolus alterniflorus and the methane flux from Sporobolus alterniflorus marsh were measured by using hanging chamber and the enclosed static chamber. The diurnal pattern of Sporobolus alterniflorus plant mediated methane transport and emission, over the course of the 24 hour of measurements in summer, Sporobolus alterniflorus plant mediated methane transport and emission all exhibited one peak at 18:00. The methane transport and emission was the highest in the plant section of 0~20 cm height from the soil surface, and reached more than 50% of the gross methane mediated by plant transport and emission, and it was the lowest in the above parts. The ratio of Sporobolus alterniflorus plant mediated methane transport and emission to gross methane flux from Sporobolus alterniflorus marsh at measured times in measured date in summer varied from 5.41% to 21.08%, the averaged values were 10.42% ;
the methane emission from Sporobolus alterniflorus marsh was 52.31 mg/(m2·h) at measured date in summer.
Key words Diurnal variation; Plant mediated methane transport and emission; Sporobolus alterniflorus
作者簡介 徐正方(1987—),男,江西抚州人,工程师,主要从事环保咨询工作。
收稿日期 2023-03-22
