LncRNA SNHG5/miR-26a-5p/MTDH信号轴促进结直肠癌转移的机制研究
2023-08-17冶俊玲郑小影郭新建陈瑞慧苟笑丹蒋汉梅
冶俊玲,郑小影,郭新建,陈瑞慧,杨 柳,苟笑丹,蒋汉梅
1.青海大学附属医院病理科,青海 西宁 810001;
2.青海大学附属医院消化内科,青海 西宁 810001
结直肠癌(colorectal cancer,CRC)是全球第4大常见癌症[1]。由于CRC缺乏早期症状,且筛查方法存在一定局限性,许多患者确诊时已为晚期[2]。CRC复发、转移率很高,常用的手术治疗、放疗及化疗对患者的预后影响较小[3],因此需要深入研究CRC发生、发展相关的分子机制,以提高CRC的早期诊断和治疗水平。长链非编码RNA小核仁RNA宿主基因5(long noncoding RNA small nucleolar RNA host gene 5,lncRNA SNHG5)位于染色体6q14.3区域,由6个外显子和2个核仁RNA组成,在恶性黑色素瘤、食管癌、乳腺癌等多种肿瘤中表达异常[4-6]。miRNA是由19 ~ 25个核苷酸构成的非编码小分子RNA,能够影响肿瘤的发生、发展,有研究[7]显示,miR-26a-5p在多种癌症中发挥抑癌作用,而lncRNA SNHG5能够通过海绵吸附作用调控miR-26a-5p表达[8]。异黏蛋白(metadherin,MTDH)是一种基因序列高度保守的蛋白,可激活癌细胞增殖、迁移及侵袭,通过多条信号转导通路参与血管生成和化疗耐药,从而发挥促癌作用[9]。本研究通过检测lncRNA SNHG5、miR-26a-5p和MTDH在CRC组织、细胞系中的表达情况,观察细胞增殖、迁移及侵袭等方面的变化,分析lncRNA SNHG5、miR-26a-5p和MTDH之间的相互关系,探究lncRNA SNHG5、miR-26a-5p、MTDH在CRC中的具体调控机制。
1 材料和方法
1.1 组织标本与数据库资料
收集2012年10月—2016年10月经手术切除的100例CRC样本,经术后病理学检查确诊为CRC[10]。所有患者的临床资料完整,术前均未接受放疗和化疗。其中男性59例,女性41例,年龄55 ~ 73(61.86±5.14)岁。同时收集100例癌旁组织,病理学诊断为正常结肠组织,液氮冻存。本研究通过青海大学附属医院伦理委员会批准,所有患者均知情同意并自愿提供组织样本。
通过癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库下载398例CRC和39例正常结肠组织的基因表达数据,使用R 4.0.2软件寻找CRC与正常结肠组织间差异表达的lncRNA,筛选标准:相同lncRNA在肿瘤组织与正常组织间表达量差异在2倍以上,且差异有统计学意义。再从TCGA数据库中获取369例CRC患者的完整临床数据,以lncRNA SNHG5的表达水平中位数将患者划分为高表达组和低表达组,采用Kaplan-Meier法绘制生存曲线。
1.2 实验材料
人结肠癌细胞系HCT-116、HCT-8、SW480、SW620、DLD-1、HT-29购自武汉普诺赛生命科技有限公司,人正常结直肠黏膜细胞FHC购自南京科佰生物科技有限公司,DMEM培养基、胎牛血清、链霉素/青霉素、TRIzol试剂、High-Capacity cDNA Reverse Transcription Kit、mirVana miRNA分离试剂盒、链霉亲和素偶联磁珠、SuperSignal West Pico PLUS化学发光底物购自美国Thermo Fisher公司,慢病毒表达载体的构建、鉴定、包装及滴度测定由广州源井生物科技有限公司完成,SYBR Premix Ex Taq Ⅱ试剂盒购自大连宝森生物科技有限公司,All-in-One miRNA qRT-PCR试剂盒购自亚太恒信生物科技(北京)有限公司,PCR引物与内参购自生工生物工程(上海)股份有限公司,RNA荧光原位杂交(fluorescenceinsituhybridization,FISH)检测试剂盒购自广州锐博生物技术有限公司,双荧光素酶报告基因检测试剂盒购自上海沪震实业有限公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)、H-E染色试剂盒、二辛可宁酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司,Matrigel基质胶购自上海研卉生物科技有限公司,Argonaute 2抗体(AGO2,ab186733)、MTDH(ab227981)、E-钙粘蛋白(E-cadherin)、波形蛋白(vimentin)、细胞周期蛋白D1(Cyclin D1)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)抗体及Ki-67增殖指数分析用抗体购自英国Abcam公司,SP法兔抗体免疫组织化学试剂盒购自福州飞净生物科技有限公司。其他试剂均为市售分析纯。
1.3 实验方法
1.3.1 细胞培养、分组与转染
复苏HCT-116、HCT-8、SW480、SW620、DLD-1、HT-29和FHC,使用含10%胎牛血清、100 mg/mL链霉素/青霉素的DMEM培养基于37 ℃、CO2体积分数为5%、饱和湿度的电热恒温培养箱中培养至对数生长期。SW620分为对照组(正常培养)、si-SNHG5组(转染si-SNHG5)、SNHG5组(转染SNHG5)、SNHG5-MUT组(转染突变型SNHG5)、miR-26a-5p mimic组(转染miR-26a-5p mimic)、SNHG5+miR-26a-5p mimic组(转染SNHG5+miR-26a-5p mimic)、si-SNHG5+miR-26a-5p inhibitor组(转染si-SNHG5+miR-26a-5p inhibitor)、si-MTDH组(转染si-MTDH)和SNHG5+si-MTDH组(转染SNHG5+si-MTDH),按照分组进行瞬时转染,48 h后收集细胞用于后续实验。体内异种移植实验所用SW620分为对照组(正常培养)、sh-SNHG5组(转染sh-SNHG5)和SNHG5组(转染SNHG5),按照分组进行慢病毒转染,构建稳定表达的细胞株。
1.3.2 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测lncRNA SNHG5、miR-26a-5p、MTDH的相对表达
组织、细胞:使用TRIzol试剂、mirVana miRNA分离试剂盒分别提取各组癌组织、细胞总RNA和miRNA。总RNA用反转录试剂盒转录成cDNA。使用1 μg cDNA模板、上下游引物各0.5 μg和SYBR Premix Ex Taq Ⅱ试剂盒配制20 μL PCR体系。miRNA用All-in-One miRNA qRTPCR试剂盒进行检测。反应条件:94 ℃预变性2 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,循环35次。引物序列见表1。使用ABI 7500 RTFQPCR仪完成RTFQ-PCR操作,应用2-△△Ct法计算lncRNA SNHG5、miR-26a-5p和MTDH的相对表达水平。
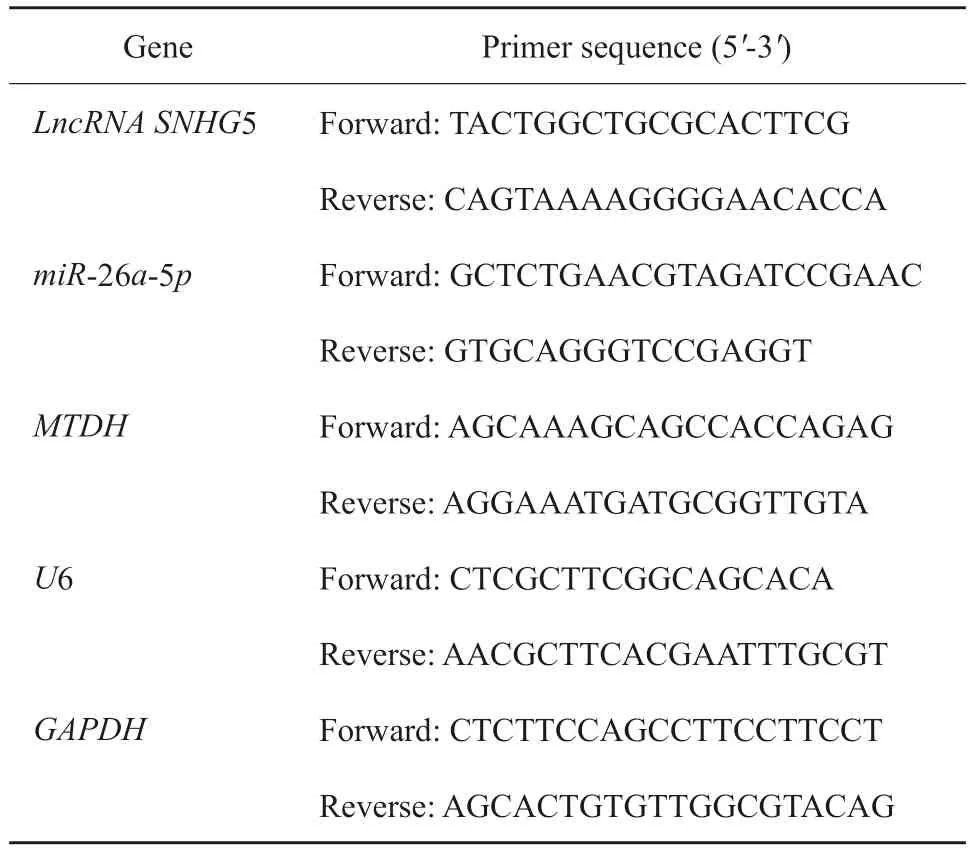
表1 引物序列Tab.1 Primer sequence
1.3.3 FISH检测
使用FISH试剂盒检测SW620细胞中lncRNA SNHG5的定位情况。细胞常规接种于24孔板内的载玻片上,培养24 h后加入4%多聚甲醛溶液固定10 min。加入0.5%的Triton X-100通透处理5 min。预杂交液、杂交液37 ℃预热30 min后加至载玻片上,置于37 ℃环境中反应20 min。用杂交液1∶50稀释lncRNA SNHG5探针,加至载玻片上,37 ℃避光过夜。洗脱未结合的探针,加入4′, 6-二脒基-2-苯基吲哚(4′, 6-diamidino-2-phenylindole,DAPI)避光反应8 min,滴加防荧光淬灭剂,封片,于荧光显微镜下避光观察拍 照。
1.3.4 RNA下拉实验
取SW620细胞,转染生物素标记的miR-26a-5p,正常培养48 h后加入适量裂解液充分裂解细胞,收集裂解产物,加入链霉亲和素偶联磁珠,充分混匀,置于4 ℃环境中温育3 h,洗涤后加入TRIzol试剂提取结合RNA,采用RTFQ-PCR检测lncRNA SNHG5水平。
1.3.5 双荧光素酶报告基因检测
通过生物信息学软件TargetScan预测发现SNHG5内Chr6存在片段GGUUUACUUGA、MTDH 3′非翻译区(3′-untranslated region,3′-UTR)第652 ~ 659片段UACUUGAA为与miR-26a-5p潜在结合的种子序列,扩增miR-26a-5p结合位点的种子序列,构建野生型psiCheck2-SNHG5-Luc、psiCheck2-MTDH-Luc荧光质粒。使用SNHG5 Chr6、MTDH 3′-UTR基因点突变后的片段构建突变型psiCheck2-SNHG5-MUT-Luc、psiCheck2-MTDHMUT-Luc荧光质粒,使用LipofectamineTM3000分别将荧光质粒与miR-26a-5p模拟物(5′-UCUACAGUGCACGUGUCUCCG-3′)共转染至SW620细胞中;将野生型psiCheck2-MTDH-Luc转染至对照组、si-SNHG5组、si-SNHG5+miR-26a-5p inhibitor组、SNHG5组、SNHG5-MUT组和SNHG5+miR-26a-5p mimic组细胞中,使用双荧光素酶报告基因检测试剂盒检测各组细胞的荧光素酶活性。
1.3.6 RNA免疫共沉淀
取SW620细胞,加入适量裂解液充分裂解细胞。磁珠中分别加入AGO2抗体、免疫球蛋白G,室温温育30 min后加入细胞裂解物,置于4 ℃环境中温育过夜,采用RTFQ-PCR检测纯化的免疫沉淀RNA。
1.3.7 CCK-8法检测细胞增殖能力
取处于对数生长期的各组细胞,胰酶消化后以1 000个/孔的细胞密度接种于96孔板上,正常培养5 d,每天进行1次CCK-8检测,每孔加入10 μL CCK-8试剂后避光培养2 h,于450 nm波长下检测各孔吸光度(D)值。
1.3.8 克隆形成实验检测细胞克隆形成能力
取处于对数生长期的各组细胞,胰酶消化后以1 000个/孔的接种密度将各组细胞接种于6孔板中,于37 ℃、CO2体积分数为5%的培养箱中培养10 d,弃去培养基,用1×磷酸缓冲盐溶液(phosphate-buffered saline,PBS)清洗后加入4%多聚甲醛溶液固定20 min,加入1%结晶紫染色10 min,观察拍照并进行克隆计数。
1.3.9 划痕实验检测细胞迁移能力
各组处于对数生长期的细胞以1×106个/孔的细胞密度接种于6孔板中,观察细胞覆盖率达到90%,用200 μL移液器吸嘴划痕,清去脱落的细胞,加入无血清培养基继续培养24 h。分别于划痕后和培养24 h后拍照,用Image J软件测量划痕宽度,计算细胞迁移率=(最初划痕宽度-24 h后划痕宽度)/最初划痕宽度×100%。
1.3.10 Transwell实验检测细胞迁移、侵袭能力
迁移:取处于对数生长期的各组细胞制成细胞悬液,接种于transwell小室上室,向下室中加入含10%胎牛血清的DMEM培养基,正常培养24 h。穿过上室的细胞用4%多聚甲醛溶液固定20 min,1%结晶紫染色10 min,于光镜下观察拍照,计算细胞迁移率=各组迁移细胞数/对照组迁移细胞数×100%。
侵袭:无血清DMEM培养基与Matrigel基质胶按1∶3的比例稀释,混匀后均匀涂抹于小室上室膜底部,置于37 ℃、CO2体积分数为5%的培养箱中过夜,第2天置于紫外线灯下照射30 min。其余步骤与迁移实验方法一致,计算细胞侵袭率=各组侵袭细胞数/对照组侵袭细胞数×100%。
1.3.11 EdU检测细胞DNA复制活性
取处于对数生长期的各组细胞,以4 000个/孔的接种密度接种于24孔板中,于37 ℃、CO2体积分数为5%的培养箱中培养12 h。加入含有EdU工作液的培养基继续培养2 h,用4%多聚甲醛溶液固定后加入TritonX-100通透细胞,加入Click反应液,37 ℃避光反应30 min,加入Hoechst染核,37 ℃避光反应10 min,滴加防荧光淬灭剂,封片,于荧光显微镜下观察拍照,计算EdU阳性细胞的百分比。
1.3.12 蛋白质印迹法(Western blot)检测E-cadherin、vimentin、Cyclin D1、MMP-9、MTDH表达情况
CRC、癌旁组织样本制成匀浆,加入适量预冷RIPA,充分混匀后冰上温育1.5 h;各组细胞加入适量预冷RIPA,充分混匀后冰上温育30 min。4 ℃、10 000 r/min离心10 min,取上清液,BCA定量后加入上样缓冲液,于沸水中煮样5 min。每道上样10 μg蛋白,进行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,使用聚偏二氟乙烯膜完成转膜,截取目的条带浸于5%脱脂奶粉制成的封闭液中,置于摇床上室温封闭1 h。检测E-cadherin、vimentin、Cyclin D1、MMP-9、MTDH,使用吐温-20三羟甲基氨基甲烷缓冲生理盐水洗膜3次,用封闭液1∶500稀释一抗制成温育液,加至条带上,充分摇匀后置于4 ℃环境下过夜。第2天取出膜,平衡至室温后洗膜3次,加入稀释比例为1∶5 000的对应二抗温育液,室温温育2 h,洗膜3次,加入电化学发光(electrochemical luminescence,ECL)液,避光反应5 min,用定量成像仪分析结果。
1.3.13 体内异种移植瘤模型
BALB/c裸小鼠按照各组细胞名称随机分组,每组16只。各组随机分出8只于腋窝两侧注射密度为5×106个/mL的人结肠癌细胞系细胞悬液,每4 d用数字卡尺测量1次皮下肿瘤的体积,计算公式:体积=1/2(长×宽2)。23 d后处死动物,完整取出肿瘤,测量体积并拍照后置于10%甲醛溶液中固定,常规石蜡包埋并制成切片。剩余8只经尾静脉注射密度为3×106个/mL的细胞悬液,60 d后处死动物,完整取出肺组织,拍照后制成石蜡切片。
1.3.14 H-E染色观察CRC转移肺结节
取各组石蜡切片,二甲苯脱蜡、梯度乙醇水化,苏木精染色8 min,蒸馏水冲洗,1%盐酸乙醇分化15 s,蒸馏水冲洗并浸泡10 min返蓝,95%乙醇处理1 min,酸化伊红染液2 min,梯度乙醇脱水,二甲苯透明,中性树胶封片,于光镜下观察,计算肺结节数量并拍照记录。
1.3.15 免疫组织化学检测MTDH、E-cadherin、vimentin表达情况及Ki-67增殖指数
检测CRC、癌旁组织MTDH与裸鼠肿瘤Ki-67增殖指数及E-cadherin、vimentin的表达情况。取各组石蜡切片,二甲苯脱蜡、梯度乙醇水化,1×PBS清洗2次,加入3% H2O2室温封闭10 min,蒸馏水清洗3次,加入抗原修复液,加入对应一抗,稀释比例为1∶100,置于4 ℃环境中过夜。第2天取出,平衡至室温后1×PBS清洗3次,加入对应二抗,室温温育1 h,再加入辣根过氧化物酶标记的链霉亲和素复合物,室温温育1 h,二氨基联苯胺显色后用苏木精复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,光镜下拍摄照片,每张切片随机选择5个不同视野,用Image J软件进行图像分析,取平均值作为MTDH、E-cadherin、vimentin的相对表达量及Ki-67增殖指数的最终判定值。
1.4 统计学处理
使用SPSS 24.0统计软件对数据进行分析处理,计量资料使用±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 LncRNA SNHG5、miR-26a-5p、MTDH在CRC中的表达情况
CRC中存在多种异常表达的lncRNA,TCGA数据库分析结果显示,lncRNA SNHG5是相对丰度较高的显著上调的lncRNA之一(图1A)。RTFQ-PCR检测结果显示,与癌旁组织相比,CRC组织lncRNA SNHG5水平显著上调(P<0.05,图1B),miR-26a-5p水平下降(P<0.05,图1C);在CRC细胞系中,lncRNA SNHG5相对表达量均升高(P<0.05,图1D),miR-26a-5p相对表达量均降低(P<0.05,图1E)。SW620细胞中lncRNA SNHG5相对表达量最高,因此选择SW620细胞进行后续实验。CRC样本免疫组织化学检测结果显示,MTDH在CRC中表达上调,SNHG5高表达的样本MTDH水平也较高(图1F、1G)。
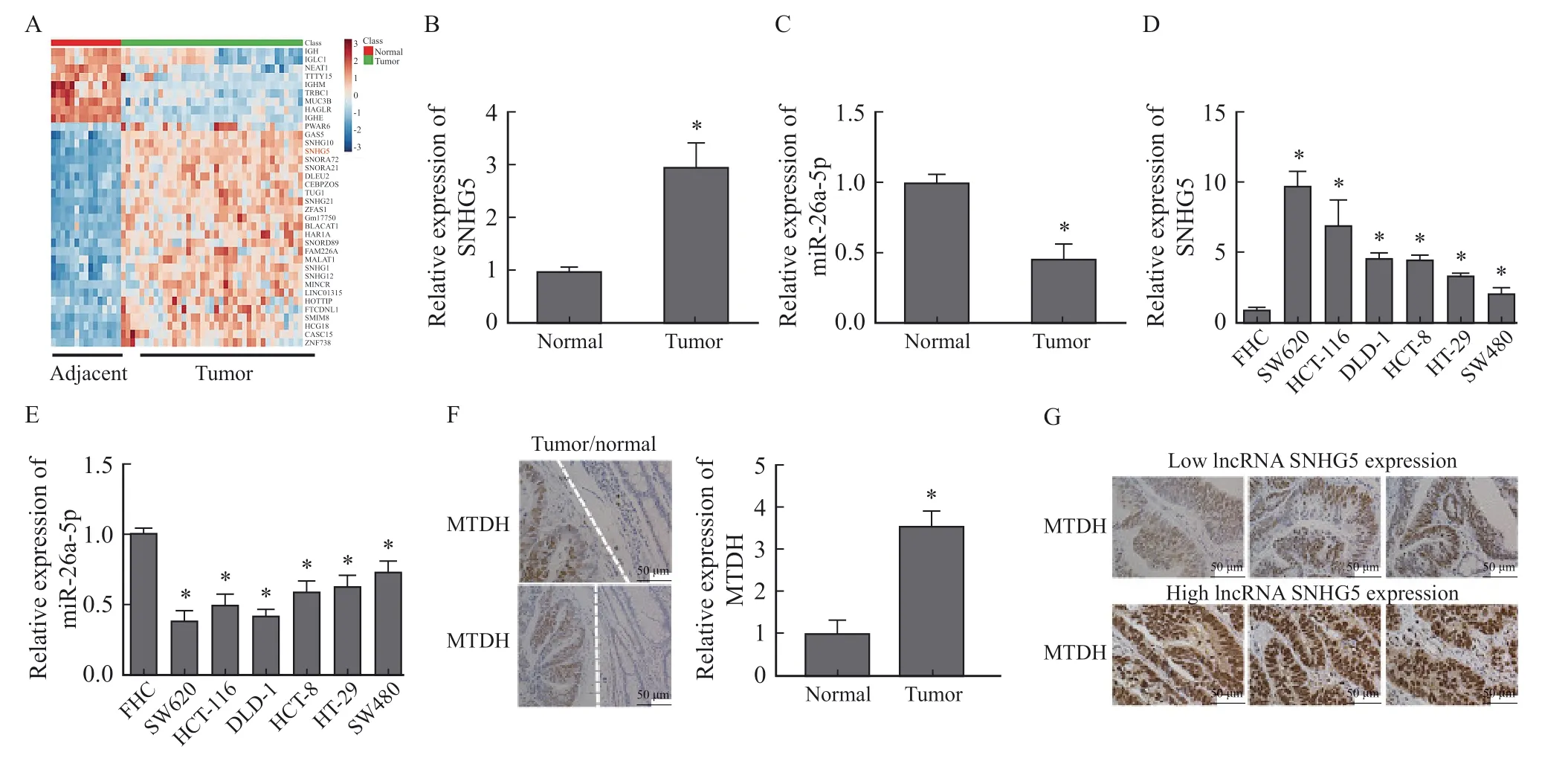
图1 LncRNA SNHG5、miR-26a-5p、MTDH在CRC中的表达情况Fig.1 Expression of lncRNA SNHG5, miR-26a-5p and MTDH in CRC
2.2 LncRNA SNHG5在CRC中的相对表达水平与临床病理学特征及生存期的关系
LncRNA SNHG5表达量与临床病理学特征间的关系见表2。不同性别、年龄与CRC组织lncRNA SNHG5表达量差异无统计学意义(P>0.05);浆膜及浆膜外浸润、远处转移、淋巴结转移、TNM Ⅲ期的CRC组织lncRNA SNHG5表达量高于浆膜下浸润、无远处转移与淋巴结转移、TNM Ⅰ ~ Ⅱ期的组织,差异有统计学意义(P<0.05)。生存分析结果显示,lncRNA SNHG5高表达与总生存率显著相关(P<0.05,图2)。
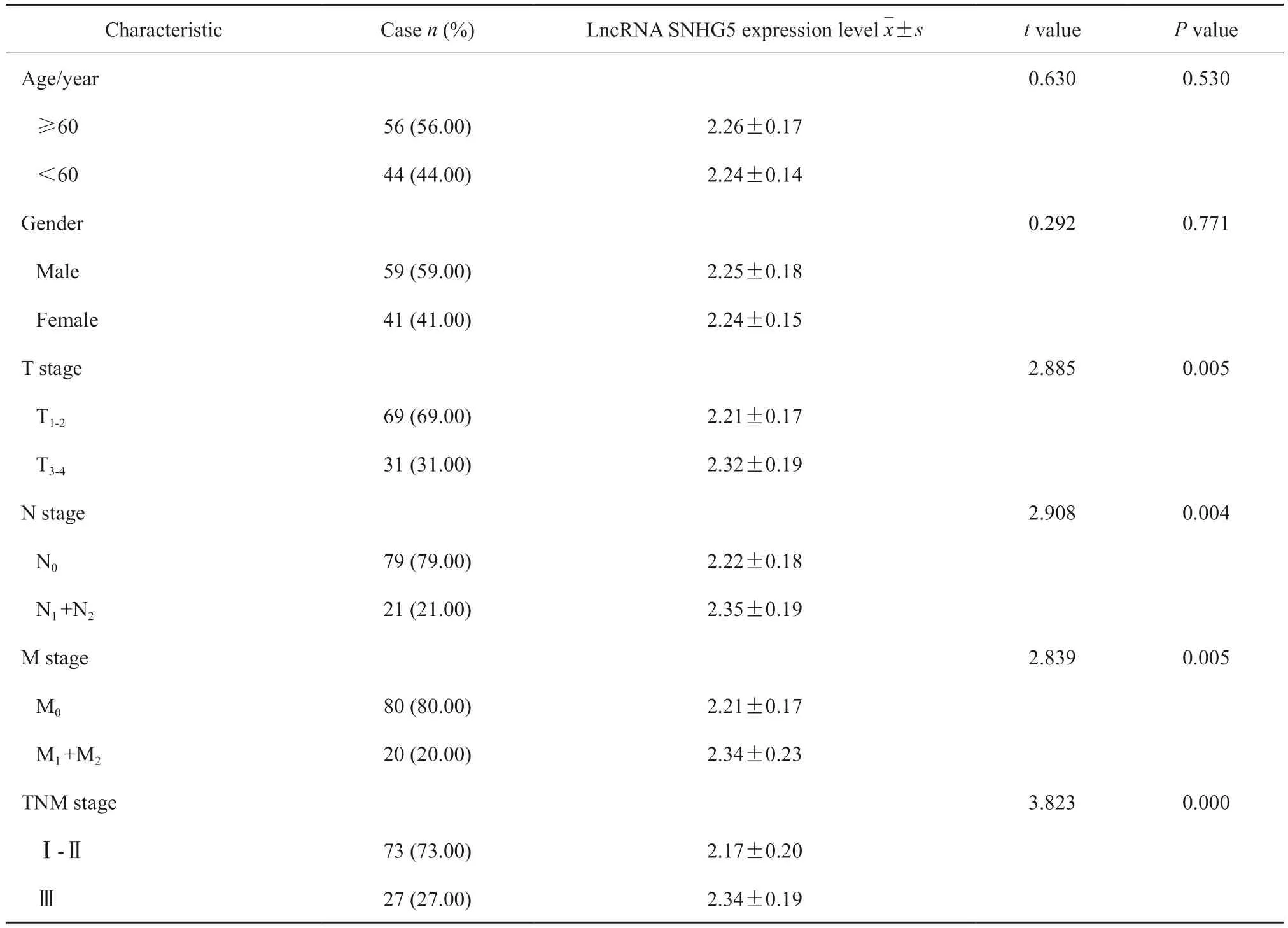
表2 LncRNA SNHG5在CRC中的相对表达水平与临床病理学特征的关系Tab.2 Relationship between relative expression level of lncRNA SNHG5 in CRC and clinicopathological features
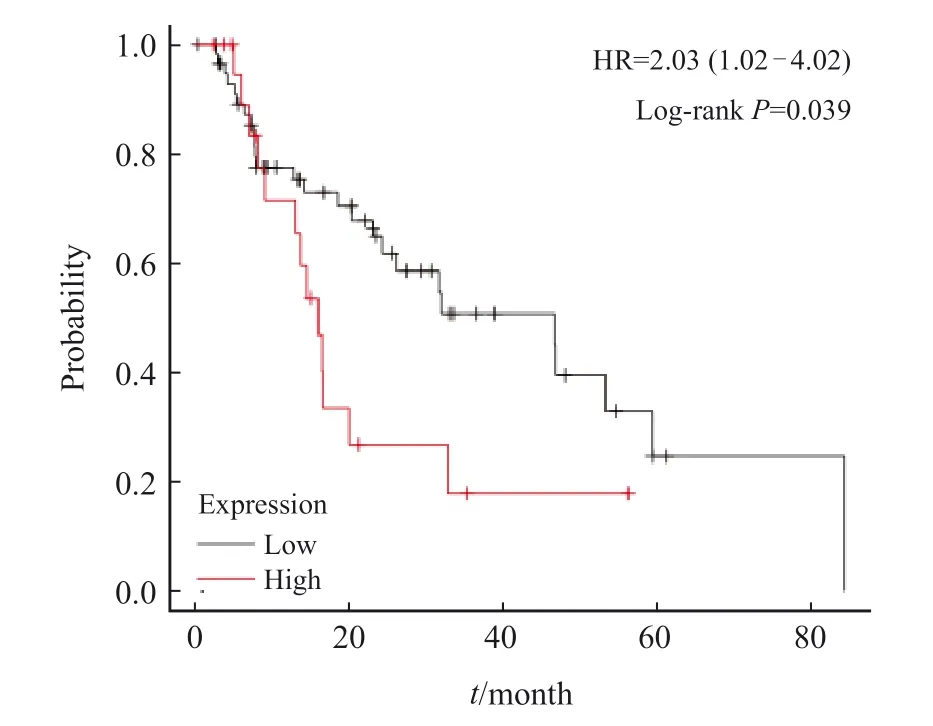
图2 LncRNA SNHG5在CRC中的相对表达水平与生存期的关系Fig.2 Relationship between relative expression level of lncRNA SNHG5 in CRC and survival period
2.3 LncRNA SNHG5对CRC细胞增殖、迁移及侵袭的影响
体外细胞实验CCK-8、克隆形成、transwell和划痕实验结果显示,与对照组相比,s i-SNHG5组增殖、克隆形成、迁移及侵袭能力均明显下降(P<0.05),SNHG5组增殖、克隆形成、迁移及侵袭能力均明显提升(P<0.05,图3A ~ 3D)。体内异种移植实验结果显示,与对照组相比,sh-SNHG5组肿瘤体积明显减小(P<0.05),SNHG5组肿瘤体积明显增加(P<0.05,图3E,表3)。通过RTFQ-PCR检测lncRNA SNHG5水平验证各组重组载体稳定性,与对照组相比,sh-SNHG5组肿瘤lncRNA SNHG5表达量下降(P<0.05),SNHG5组lncRNA SNHG5表达量上升(P<0.05),提示各组重组载体均稳定表达(图3F)。肺组织H-E染色结果显示,与对照组相比,sh-SNHG5组转移肺结节数量减少(P<0.05),SNHG5组转移肺结节数量增多(P<0.05,图3G,表4)。

表3 各组裸鼠移植瘤体积比较Tab.3 Comparison of transplanted tumor volume in each group of nude mice

表4 各组裸鼠转移肺结节数量比较Tab.4 Comparison of the number of metastatic lung nodules in each group of nude mice
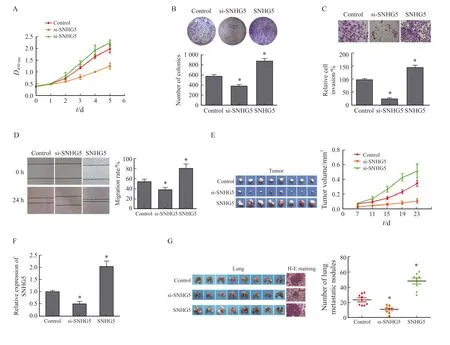
图3 LncRNA SNHG5对CRC细胞增殖、迁移、侵袭的影响Fig.3 Effects of lncRNA SNHG5 on proliferation, migration and invasion of CRC cells
2.4 CRC细胞转移、上皮-间充质转化(epithelial-mesenchymal transition,EMT)相关分子表达水平与lncRNA SNHG5表达水平的关系
Western blot检测结果显示,与对照组相比,si-SNHG5组E-cadherin相对表达水平升高(P<0.05),vimentin相对表达水平降低(P<0.05),SNHG5组E-cadherin相对表达水平降低(P<0.05),vimentin相对表达水平升高(P<0.05,图4A,表5)。免疫组织化学检测结果显示,与对照组相比,sh-SNHG5组Ki-67增殖指数、vimentin相对表达水平降低(P<0.05),E-cadherin相对表达水平升高(P<0.05),SNHG5组Ki-67增殖指数、vimentin相对表达水平升高(P<0.05),E-cadherin相对表达水平降低(P<0.05,图4B,表6)。
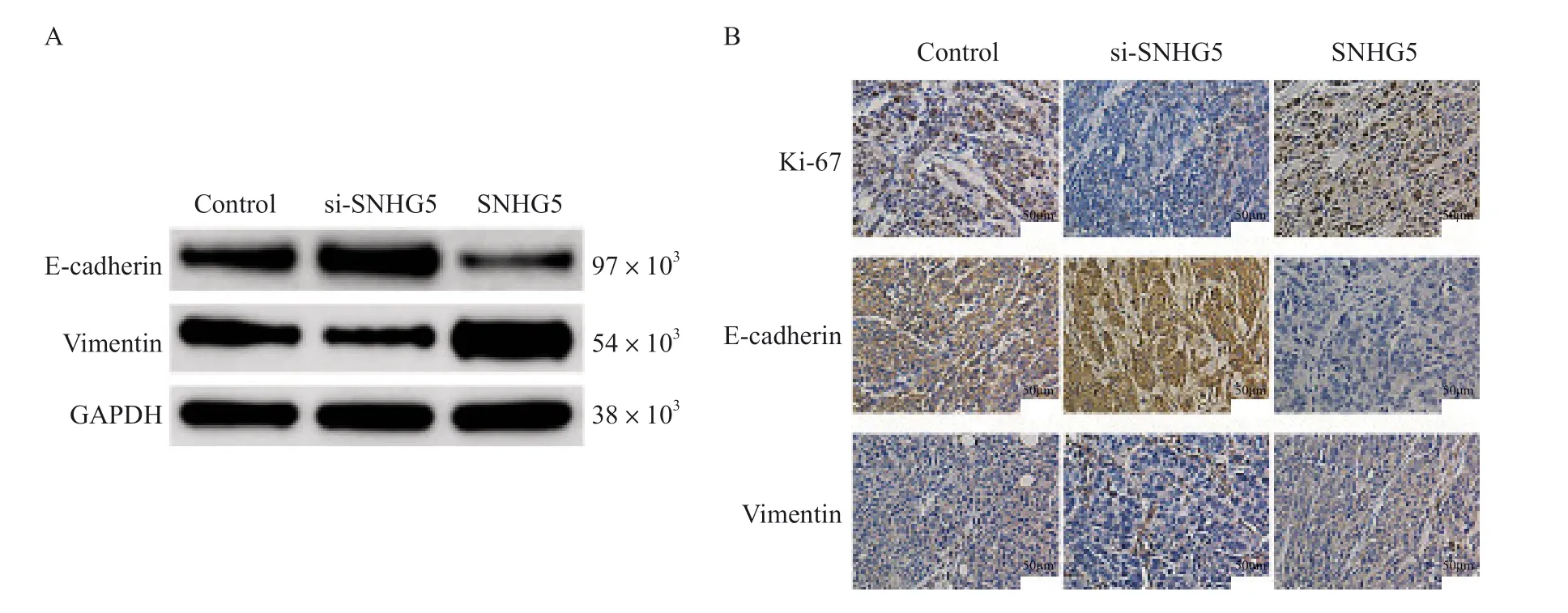
图4 CRC细胞转移、EMT相关分子表达水平与lncRNA SNHG5表达水平的关系Fig.4 Relationship between lncRNA SNHG5 expression and expression of molecules related to metastasis and EMT of CRC cells
表5 各组细胞E-cadherin、vimentin相对表达水平比较Tab.5 Comparison of relative expression levels of E-cadherin and vimentin in cells of different groups (±s)

表5 各组细胞E-cadherin、vimentin相对表达水平比较Tab.5 Comparison of relative expression levels of E-cadherin and vimentin in cells of different groups (±s)
Group E-cadherin/GAPDH Vimentin/GAPDH Control group 0.90±0.08 1.12±0.09 si-SNHG5 group 1.15±0.09 0.81±0.05 SNHG5 group 0.61±0.07 1.44±0.12 F value 122.283 116.203 P value 0.000 0.000
表6 各组移植瘤E-cadherin、vimentin相对表达水平及Ki-67增殖指数比较Tab.6 Comparison of relative expression levels of E-cadherin, vimentin and Ki-67 proliferation index in different groups of transplanted tumors (±s)
表6 各组移植瘤E-cadherin、vimentin相对表达水平及Ki-67增殖指数比较Tab.6 Comparison of relative expression levels of E-cadherin, vimentin and Ki-67 proliferation index in different groups of transplanted tumors (±s)
Group Ki-67 proliferation index E-cadherin Vimentin Control group 2.02±0.20 0.88±0.12 0.63±0.11 si-SNHG5 group 1.20±0.34 1.46±0.32 0.33±0.09 SNHG5 group 2.69±0.17 0.32±0.06 1.04±0.29 F value 78.102 65.896 29.520 P value 0.000 0.000 0.000
2.5 LncRNA SNHG5/miR-26a-5p/MTDH信号轴促进CRC转移的机制
2.5.1 SNHG5与miR-26a-5p、MTDH与miR-26a-5p存在物理上的相互作用
经荧光染色,lncRNA SNHG5呈红色,细胞核呈蓝色,可见lncRNA SNHG5主要表达于细胞质中(图5A)。RNA下拉实验结果显示,miR-26a-5p能够与lncRNA SNHG5相互结合(图5B)。双荧光素酶报告基因实验结果显示,miR-26a-5p能够降低野生型SNHG5、MTDH的荧光信号强度(P<0.05);与对照组相比,SNHG5-MUT组、si-SNHG5+miR-26a-5p inhibitor组、SNHG5+miR-26a-5p mimic组Luc-MTDH荧光信号强度差异无统计学意义(P>0.05),si-SNHG5组Luc-MTDH荧光信号强度显著下降(P<0.05),SNHG5组Luc-MTDH荧光信号强度显著提升(P<0.05,图5C)。免疫共沉淀检测结果显示,lncRNA SNHG5与miR-26a-5p都显著富含AGO2的微核糖蛋白复合体,沉默lncRNA SNHG5后AGO2在SNHG5上的富集量减少(P<0.05),在MTDH上的富集量增加(P<0.05),而过表达lncRNA SNHG5的细胞中AGO2在SNHG5上的富集量增加(P<0.05),在MTDH上的富集量减少(P<0.05,图5D)。
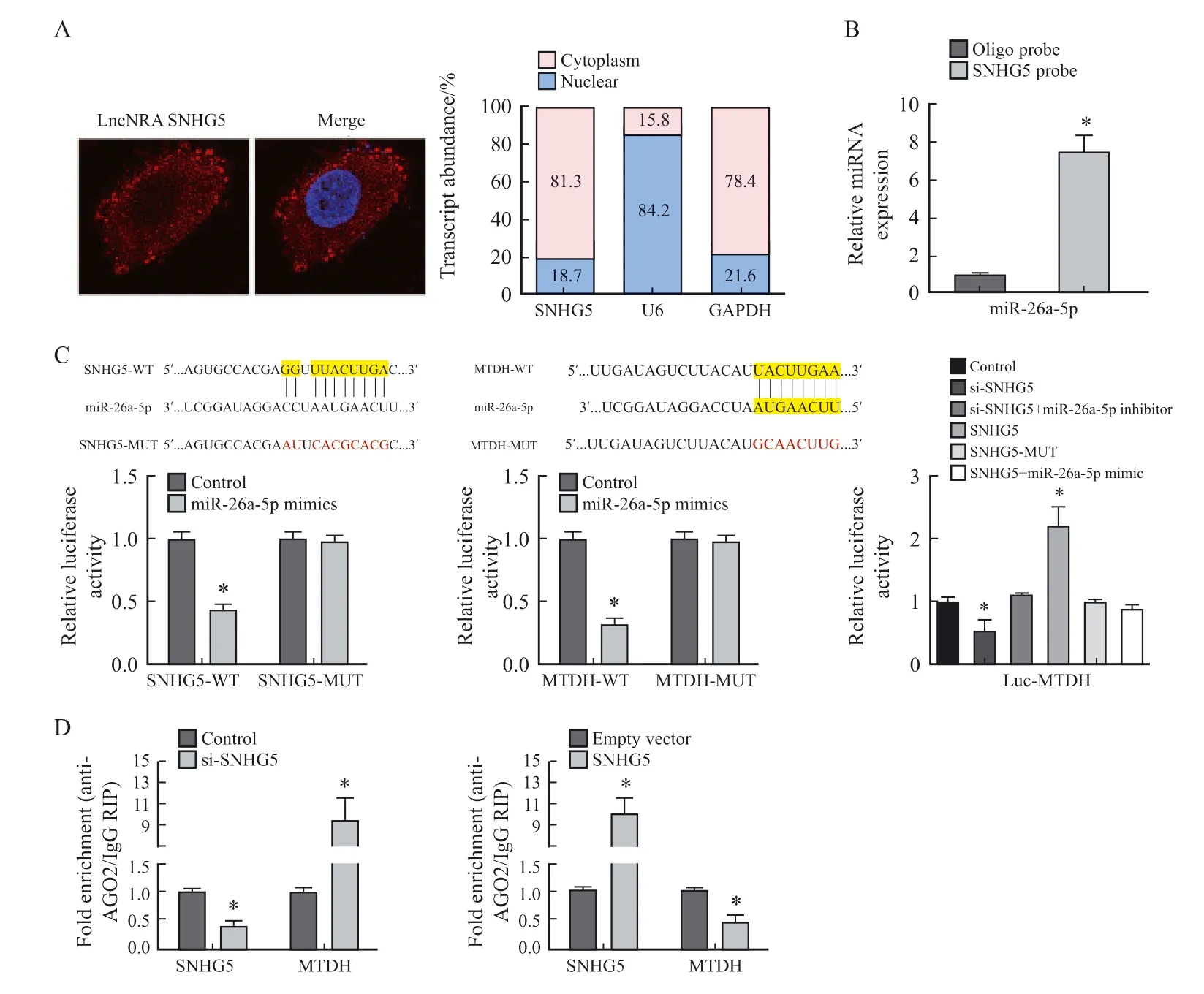
图5 SNHG5与miR-26a-5p、MTDH与miR-26a-5p存在物理上的相互作用Fig.5 Physical interaction between SNHG5 and miR-26a-5p, MTDH and miR-26a-5p
2.5.2 SNHG5、miR-26a-5p、MTDH对CRC细胞增殖、迁移能力的影响
CCK-8、EdU、transwell实验结果显示,与对照组相比,SNHG5组细胞增殖、迁移能力明显提升(P<0.05),miR-26a-5p mimic组、si-MTDH组细胞增殖、迁移能力明显降低(P<0.05),SNHG5+miR-26a-5p mimic组、SNHG5+si-MTDH组细胞增殖、迁移能力差异无统计学意义(P>0.05,图6A ~ 6C)。Western blot检测结果显示,与对照组相比,SNHG5组MTDH相对表达水平升高(P<0.05),si-SNHG5组MTDH相对表达水平下降(P<0.05),si-SNHG5+miR-26a-5p inhibitor组、SNHG5+miR-26a-5p mimic组MTDH相对表达水平差异无统计学意义(P>0.05,图6D,表7)。

图6 SNHG5、miR-26a-5p、MTDH三者存在功能上的相互关系Fig.6 The functional relationship among SNHG5, miR-26a-5p and MTDH

表7 各组细胞MTDH相对表达水平比较Tab.7 Comparison of relative expression level of MTDH in cells of different groups
2.5.3 SNHG5、miR-26a-5p、MTDH与迁移、侵袭相关分子的分析
Western blot检测结果显示,与对照组相比,SNHG5组E-cadherin相对表达水平降低(P<0.05),Cyclin D1、vimentin、MMP-9、MTDH相对表达水平升高(P<0.05),si-SNHG5组、si-MTDH组E-cadherin相对表达水平升高(P<0.05),Cyclin D1、vimentin、MMP-9、MTDH相对表达水平降低(P<0.05),SNHG5+si-MTDH组Cyclin D1、E-cadherin、vimentin、MMP-9、MTDH相对表达水平差异无统计学意义(P>0.05,图7,表8)。
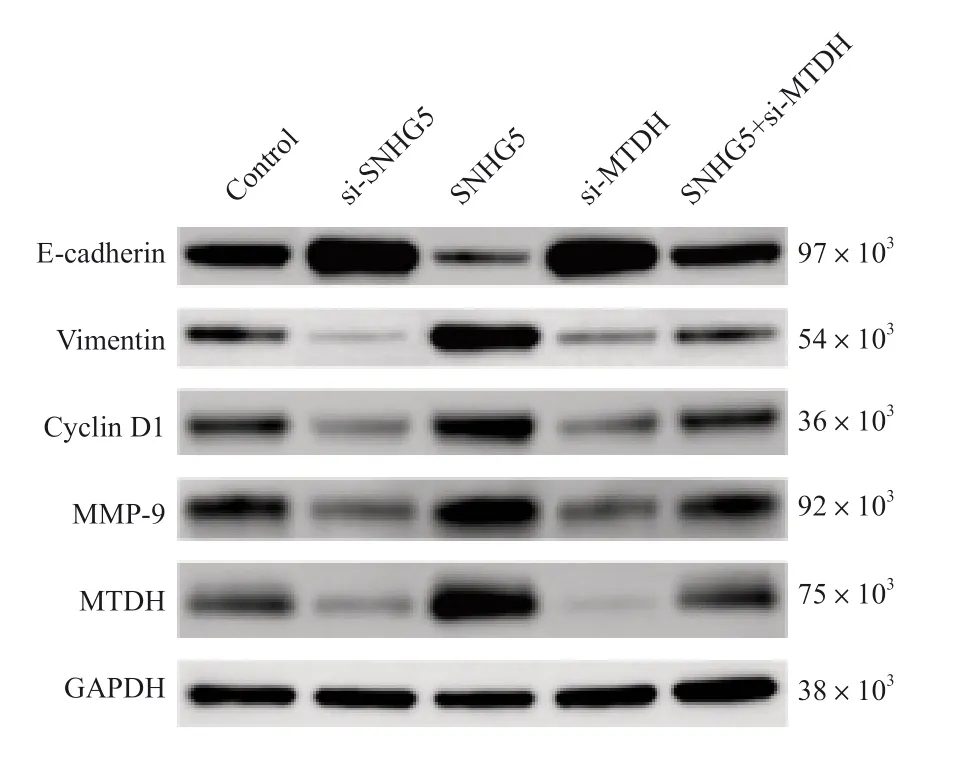
图7 SNHG5、miR-26a-5p、MTDH与迁移、侵袭相关分子的分析Fig.7 Analysis of SNHG5, miR-26a-5p, MTDH and related molecules of migration and invasion
表8 各组细胞MTDH与迁移、侵袭相关分子相对表达水平比较Tab.8 Comparison of relative expression levels of MTDH, migration and invasion related molecules in different groups of cells (±s)
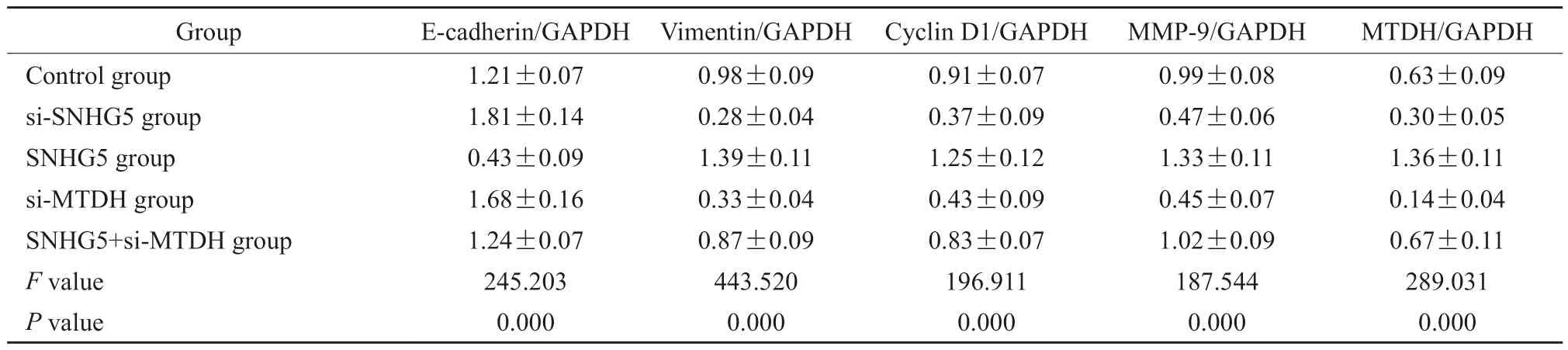
表8 各组细胞MTDH与迁移、侵袭相关分子相对表达水平比较Tab.8 Comparison of relative expression levels of MTDH, migration and invasion related molecules in different groups of cells (±s)
Group E-cadherin/GAPDH Vimentin/GAPDH Cyclin D1/GAPDH MMP-9/GAPDH MTDH/GAPDH Control group 1.21±0.07 0.98±0.09 0.91±0.07 0.99±0.08 0.63±0.09 si-SNHG5 group 1.81±0.14 0.28±0.04 0.37±0.09 0.47±0.06 0.30±0.05 SNHG5 group 0.43±0.09 1.39±0.11 1.25±0.12 1.33±0.11 1.36±0.11 si-MTDH group 1.68±0.16 0.33±0.04 0.43±0.09 0.45±0.07 0.14±0.04 SNHG5+si-MTDH group 1.24±0.07 0.87±0.09 0.83±0.07 1.02±0.09 0.67±0.11 F value 245.203 443.520 196.911 187.544 289.031 P value 0.000 0.000 0.000 0.000 0.000
2.6 LncRNA SNHG5通过miR-26a-5p调控MTDH影响CRC的作用机制
本研究结果显示,lncRNA SNHG5、MTDH在CRC中表达上调并发挥促癌作用,miR-26a-5p表达下调,发挥抑癌作用,且lncRNA SNHG5与miR-26a-5p、miR-26a-5p与MTDH之间存在靶向抑制关系,推测lncRNA SNHG5通过miR-26a-5p调控MTDH,其可能的作用机制见图8。
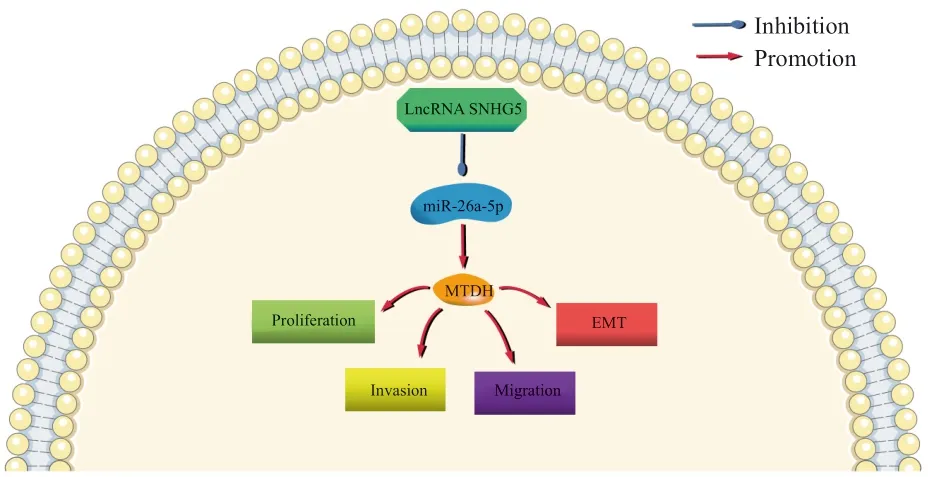
图8 LncRNA SNHG5通过miR-26a-5p调控MTDH影响CRC的作用机制Fig.8 The mechanism of lncRNA SNHG5 regulating MTDH and affecting CRC through miR-26a-5p
3 讨 论
LncRNA可以参与许多生物过程,并在疾病的发生、发展中发挥重要作用[11]。Zhao等[12]研究发现,lncRNA MIR17HG可通过介导糖酵解相关正反馈回路促进CRC肝转移,Zhu等[13]的研究显示,lncRNA NEAT1可通过重塑染色质提高CRC对5-氟尿嘧啶的耐药性和肿瘤细胞的干性。上述研究提示,深入了解lncRNA在CRC中的作用有利于提高CRC的诊断和治疗效率。
LncRNA SNHG5位于染色体易位断裂点,是核仁小RNA U50的宿主基因外显子的剪接体[14]。Guo等[15]研究显示,lncRNA SNHG5能够通过影响抑制CRC细胞存活、迁移及侵袭,促进凋亡的miR-363-3p的表达,促进CRC的进展。本研究中,lncRNA SNHG5在CRC组织和细胞系中均表达异常,其高表达提示CRC处于进展期,预后不良,体外细胞增殖、迁移、侵袭实验与体内异种移植实验结果表明,lncRNA SNHG5在体外和体内均能显著促进CRC的增殖和转移。miR-26a-5p被认为是一种肿瘤抑制因子,在某些恶性肿瘤的抗增殖和抗转移中发挥重要作用[16]。Kong等[17]研究显示,miR-26a-5p在CRC中表达下调,沉默lncRNA生长停滞特异性蛋白6-反义1能够上调miR-26a-5p水平,抑制CRC细胞周期和增殖。本研究中,RNA下拉实验、双荧光素酶报告基因检测及RNA免疫共沉淀检测结果显示,lncRNA SNHG5可作为细胞质中miR-26a-5p的分子海绵,并通过调节MTDH水平发挥其促癌作用。Yang等[18]研究显示,miR-26a-5p是lncRNA SNHG5的直接靶点。Li等[19]通过生物信息学分析发现MTDH是miR-26a-5p的下游靶标,均与本研究结果一致。MTDH在迄今为止分析的所有类型的癌症中都呈高表达,是癌症发生、发展的重要分子[20]。MTDH主要位于内质网膜上,也存在于细胞核和核仁中,可在转移性癌细胞的细胞膜上被检测到[21]。MTDH可与多种蛋白质和蛋白质网络相互作用,从而激活关键的致癌通路,增强癌症的所有特征[22]。EMT是癌细胞转移的关键过程,在此过程中,上皮细胞失去了细胞间的黏附能力,获得了包括侵袭和迁移在内的多种间充质特性,间充质细胞标志物vimentin水平上调、上皮细胞标志物E-cadherin水平下调是EMT的特征[23]。MTDH水平与EMT密切相关,He等[24]的研究显示,MTDH能够激活ERK信号通路和EMT过程,从而促进肾癌细胞的迁移和侵袭;Zhang等[25]观察到正常肝细胞与肝癌细胞中上调MTDH水平均可使E-cadherin低表达、vimentin高表达。本研究中,沉默lncRNA SNHG5可下调MTDH的表达水平,抑制EMT相关蛋白的表达,提示MTDH参与lncRNA SNHG5在CRC中的致癌作用。
综上所述,lncRNA SNHG5在CRC组织和细胞系中表达上调,其高表达与肿瘤进展及生存不良有关。lncRNA SNHG5作为miR-26a-5p的分子海绵调节MTDH表达促进SW620细胞的增殖和转移,可能成为CRC新的生物标志物与治疗靶点。
利益冲突声明:所有作者均声明不存在利益冲突。
