靶向CD30的CAR-T细胞慢病毒转导条件优化研究
2023-08-17田高辉张琴星史江舟赵芬芳赵家旋卢玉琳
田高辉,张琴星,史江舟,赵芬芳,王 宁,赵家旋,卢玉琳,徐 瑶
1.武汉科技大学生命科学与健康学院生物医学研究院,湖北 武汉 430081;
2.天津科技大学生物工程学院,天津 300457
随着分子生物学的发展,各种可以人为操纵DNA和RNA的工具也得到了长足发展,并改变了现代医学的发展进程[1]。基因疗法能够赋予细胞或有机体在自然状态下不存在的能力[2]。在基因改造方面,慢病毒是最典型的代表,因为其具有进入细胞并将遗传物质运送到细胞的天然能力[3]。慢病毒载体经过几十年的发展,目前已经进入了第三代慢病毒载体阶段。第一代慢病毒载体包含人类免疫缺陷病毒(human immunodeficiency virus,HIV)基因组的大部分,以及一种病毒的包膜蛋白,最常见的是水泡性口炎病毒糖蛋白(vesicular stomatitis virus glycoprotein,VSV-G)[4],VSV-G可以识别在细胞上广谱表达的低密度脂蛋白受体[5-6],因此使得该慢病毒载体可转导广泛的细胞;第二代慢病毒载体去除了辅助毒性因子VIF、VPR、VPU和NEF[4],提高了其安全性且不影响慢病毒转运遗传物质的能力;第三代慢病毒载体将病毒基因组gag和pol分裂成单独的质粒[7],进一步降低了由基因重组导致的的复制型慢病毒产生的概 率。
嵌合抗原受体T(chimeric antigen receptor T,CAR-T)细胞技术是通过分子生物学和基因工程改造技术,将靶向特异性抗原的单链抗体的轻重链可变区序列在患者的T细胞膜上表达,进而特异性地杀死肿瘤细胞,达到治疗癌症的目的[8-9]。慢病毒载体的出现极大地推动了CAR-T细胞治疗的发展。目前,已有多种CAR-T细胞治疗进入临床应用阶段[10]。研究[11-13]表明,CAR-T细胞在治疗B细胞恶性肿瘤方面取得了前所未有的疗效,最显著的是应用抗CD19 CAR-T细胞治疗B细胞急性淋巴细胞白血病的完全缓解率高达90%。
对于霍奇金淋巴瘤,CD30是一个理想的候选靶点,因为其在霍奇金淋巴瘤肿瘤细胞中表达丰富且具有特异性,在正常组织中表达有限[14]。抗CD30 CAR-T细胞是最近新兴的靶向CD30分子的CAR-T细胞,对霍奇金淋巴瘤有很好的治疗作用[15]。有临床研究[16-17]表明,抗CD30 CAR-T用于治疗复发或难治性霍奇金淋巴瘤,淋巴清除后产生高应答率并持续一般时间,具有极好的安全性和极小的毒性。随着抗CD30 CAR-T细胞研究的进行,利用慢病毒载体制备CAR-T细胞的技术研究取得了很大进展,然而原代T细胞抗CD30 CAR慢病毒转导条件还没有进行全面细致的研究。
影响慢病毒静止转导的因素通常有感染复数(multiplicity of infection,MOI)、温育密度、转导前活化时间和转导体系高度等[18-20]。本实验旨在优化抗CD30 CAR-T细胞的慢病毒转导参数,以制备出高质量的抗CD30 CAR-T细胞,以期为临床试验所需的大量细胞的制备提供依据,同时也为其他靶点CAR-T细胞的转导优化提供参 考。
1 材料和方法
1.1 试剂
抗CD30 CAR慢病毒和CD30检测蛋白为武汉波睿达生物科技有限公司赠予,人原代T细胞从人外周血中提取,人CD3磁珠和人T cell TransAct购自德国Miltenyi公司,T25和T75细胞培养瓶购自美国Corning公司,转导试剂聚凝胺(Polybrene)购自翌圣生物科技(上海)股份有限公司,胎牛血清购自上海吉泰依科赛生物科技有限公司,DMEM-Basic、RPMI-1640及TexMACSTMGMP培养基均购自美国Gibco公司。
流式抗体:7-AAD、PE抗人CD25抗体和Alexa Fluor 488 Donkey抗兔免疫球蛋白G(immunoglobulin G,IgG)抗体购自美国Biolegend公司,BV421抗人CD69抗体购自深圳市达科为生物技术股份有限公司。
1.2 方法
1.2.1 人原代T细胞的分离
采集健康人群外周血,经等体积的生理盐水稀释后,缓慢加到已预先加入20 mL淋巴细胞分离液的50 mL离心管中,700×g离心20 min,离心时调节离心机升降参数至最低,离心后将环状乳白色淋巴细胞层用移液器吸出,得到单个核细胞。以10 μL/2×107个细胞的比例加入人CD3磁珠,加入4倍体积的分选缓冲液后4 ℃温育15 min,用5 mL分选缓冲液重悬,将悬液通过磁力柱,T细胞会通过磁珠被吸附到柱子上,用2 mL分选缓冲液洗两遍柱子后,在柱子中加入5 mL分选缓冲液,用力快速推动柱子上的活塞将T细胞冲洗下来,收集冲洗下来的细胞。
1.2.2 慢病毒转导T细胞
1.2.2.1 不同MOI对T细胞转导的影响
取需要数目的生长状况良好的原代T细胞于6孔板中,采用MOI为0.00、0.25、0.50、1.00、1.50、3.00的梯度对T细胞进行转导,转导时补加Polybrene使其终浓度为5 μg/mL。转导后持续监测CAR-T细胞的增殖情况,通过流式细胞术检测转导效率和细胞存活率。
1.2.2.2 转导时T细胞温育密度对T细胞转导的影 响
确定最优的MOI后,采用0.2×1 07、0.5×107、1.0×107、2.0×107个/mL的温育密度转导T细胞,转导后监测CAR-T细胞的增殖情况,通过流式细胞术检测转导效率和细胞存活 率。
1.2.2.3 转导前T细胞活化时间对T细胞转导的影 响
确定最优的MOI和温育密度后,选用人T cell TransAct刺激T细胞0、8、16、24、48及72 h后,转导T细胞,转导后监测CAR-T细胞的增殖情况,通过流式细胞术检测T细胞激活情况、转导效率和细胞存活率。
1.2.2.4 转导体系高度对T细胞转导的影响
转导相同数量的T细胞,分别用T25和T75培养瓶作为容器,使转导体系高度分别为0.16和0.53 mm,转导后监测CAR-T细胞的增殖情况,通过流式细胞术检测转导效率,采用钙黄绿素释放法检测抗CD30 CAR-T细胞的体外杀伤效率。
1.2.3 流式细胞术检测
收集大于5×105个CAR-T细胞于流式管中,向每管中加入1 ~ 2 mL流式缓冲液,500×g离心5 min,去掉上清液,重复洗2遍,用流式缓冲液配制好工作浓度的染色抗体重悬细胞,4 ℃避光染色30 min后,加入1 mL流式缓冲液终止染色,500×g离心5 min,弃去上清液,重复洗2遍,加2 μL 7-AAD抗体于100 μL流式缓冲液中重悬细胞,2 ~ 3 h内通过流式细胞术分析检测。
1.2.4 钙黄绿素释放法检测抗CD30 CAR-T细胞的细胞毒性
选取L428细胞系作为阳性靶细胞,人骨髓瘤细胞系K562作为阴性靶细胞,效应细胞为抗CD30 CAR-T细胞。将经钙黄绿素标记、浓度为5×104个/mL的靶细胞接种于U底96孔培养板中,100 μL/孔。按不同效靶比(25∶1、5∶1、1∶ 1)加入各组效应细胞,体积为100 μL/孔。设置阳性对照组(加入裂解液)和阴性对照组(加入磷酸缓冲盐溶液)。各组均设3个复孔,在37 ℃生化培养箱中温育2.5 ~ 3.0 h。后将96孔板以700×g离心10 min,从各孔吸取150 μL上清液对应转移到预先标记好的新的平底96孔板中,置于酶标仪(参数设置:激发光波长为485/20,发射光波长为530/25)扫描读取荧光值。根据以下公式计算各组效应细胞的细胞毒性:特异性裂解百分比(%)=(实验组荧光值-阴性对照组荧光值)/(阳性对照组荧光值-阴性对照组荧光值)×100%。实验重复3次。
1.3 统计学处理
本研究采用GraphPad Prism 8软件进行数据分析,实验数据以±s表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 不同MOI对于抗CD30 CAR-T细胞转导的影 响
MOI对于T细胞转导效率具有决定性的影响,因此我们首先从该条件开始进行转导条件的优化。根据本课题组以往研究[17],分别采用MOI为0.00、0.25、0.50、1.00、1.50、3.00的梯度对健康人群外周血来源的新鲜T细胞进行转导。通过流式细胞术检测不同MOI对于抗CD30 CAR-T细胞转导效率的影响,结果显示,MOI为1.00、1.50和3.00组在第8天的转导效率显著高于0.00、0.25和0.50组[(25.60±3.51)%、(26.33±5.32)%和(32.67±6.47)%vs(1.00±0.00)%、(9.17±2.23)%和(14.50±4.81)%,P<0.01],1.00、1.50和3.00组间差异无统计学意义(P均>0.05,图1A),各组CAR-T细胞在转导第8天的细胞存活率均为80%左右,组间差异无统计学意义 [(84.67±5.20)%、(81.17±2.79)%、(79.50±2.74)%、(79.67±1.63)%、(79.00±1.55)%和(77.83±1.72)%,P> 0.05,图1B]。
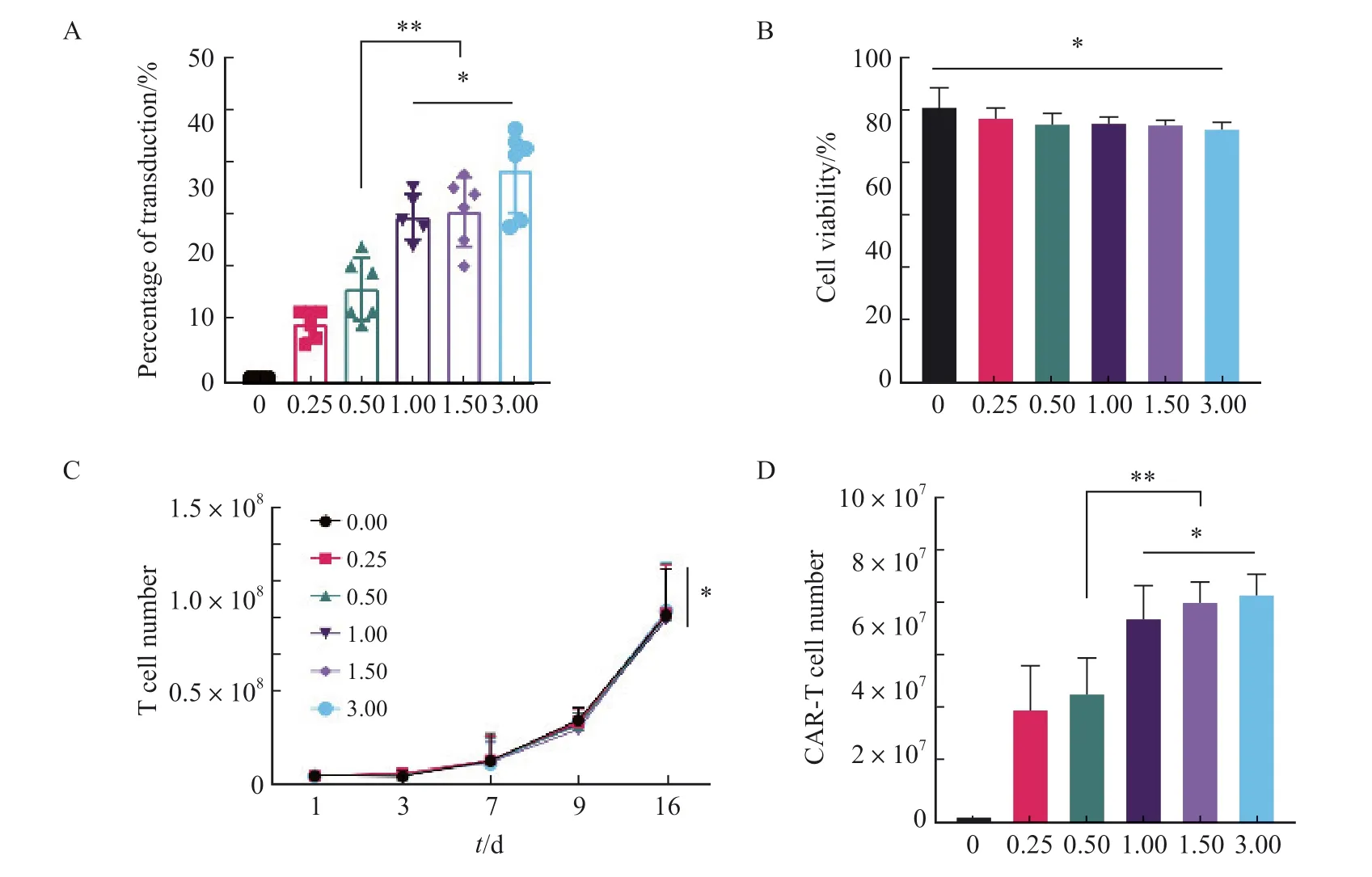
图1 不同MOI对于抗CD30 CAR-T细胞转导的影响Fig.1 Effects of different MOI on transduction of anti-CD30 CAR-T cell
本实验还研究了不同MOI对抗CD30 CAR-T细胞增殖能力的影响,结果显示,不同MOI对于抗CD30 CAR-T细胞的增殖能力的影响差异无统计学意义(P>0.05,图1C),但1.00、1.50和3.00组在第16天的抗CD30 CAR-T有效细胞数(T细胞数×转导效率)显著高于0.00、0.25和0.50组(P均<0.01);1.00、1.50、3.00组间差异无统计学意义(图1D)。根据不同MOI的转导条件下,转导效率、抗CD30 CAR-T细胞总数和有效细胞数等3个方面的情况,综合慢病毒成本,最终选择MOI=1.00作为慢病毒转导T细胞的关键参 数。
2.2 不同温育密度对于抗CD30 CAR-T细胞转导的影响
温育密度会影响细胞与慢病毒之间的接触[19],可能会进一步影响转导效率,因此本研究选取不同的温育密度对转导条件进行优化。通过流式细胞术检测不同温育密度对抗CD30 CAR-T细胞转导效率和细胞存活率的影响,结果显示,各组抗CD30 CAR-T细胞在转导第8天的转导效率和细胞存活率差异均无统计学意义[转导效率:(24.00±8.51)%、(25.50±7.87)%、(25.33±8.09)%和(24.50±7.58)%,P>0.05;细胞存活率:(81.17±1.94)%、(83.50±2.07)%、(83.67±2.66)%和(80.83±3.49)%,P>0.05,图2A、2B]。细胞增殖实验显示,不同温育密度得到的抗CD30 CAR-T细胞之间的增殖情况差异无统计学意义(P> 0.05,图2C);0.2×107组在第16天的抗CD30 CAR-T有效细胞数显著低于0.5×107、1.0×107和2.0×107组(P<0.05),但0.5×107、1.0×107、2.0×107组之间差异无统计学意义(图2D)。

图2 不同温育密度对于抗CD30 CAR-T细胞转导的影响Fig.2 Effects of different incubation densities on transduction of anti-CD30 CAR-T
本实验还研究了不同温育密度对于抗CD30 CAR-T细胞毒性作用的影响,结果显示,0.5×107、1.0×107组抗CD30 CAR-T细胞的细胞毒性显著高于2.0×107组[(46.00±1.41)%vs(45.00±1.41)%vs(35.50±2.12)%,P<0.05,图2E]。综上所述,根据转导效率、细胞存活率、抗CD30 CAR-T有效细胞数及体外杀伤效率等情况得出最佳温育密度为0.5×107和1.0×107个/mL,从生产成本方面考虑,最终选择MOI=1.0、温育密度为1.0×107个/mL作为慢病毒转导T细胞的关键参数。
2.3 不同活化时间对于抗CD30 CAR-T细胞转导的影响
T细胞的激活水平与慢病毒转导效率密切相关[21]。T细胞的激活状态可以根据CD25和CD69的表达水平来衡量[22],通过流式细胞术检测不同转导前活化时间对CD25和CD69的表达情况,结果显示,在加入人T cell TransAct刺激后,T细胞被激活(图3A)。T细胞的持续激活会影响其存活率,结果显示,持续刺激72 h后T细胞的活率低于80%,显著低于其他组[(97.00±0.00)%、(95.67±1.53)%、(93.00±3.46)%、(90.33±3.06)%、(85.67±5.51)%和(77.00±5.57)%,P<0.01,图3B]。转导后通过流式细胞术检测不同活化时间对抗CD30 CAR-T细胞转导效率的影响,结果显示,24、48和72 h组抗CD30 CAR-T细胞的转导效率显著高于0、8和16 h组[(35.00±5.15)%、(42.60±9.45)%、(41.20±8.64)%、(51.83±9.20)%、(56.50±7.87)%和(55.75±2.22)%,P<0.05],但24、48和72 h组间的转导效率差异无统计学意义[(51.83±9.20)%、(56.50±7.87)%和(55.75±2.22)%,P> 0.05,图3C]。
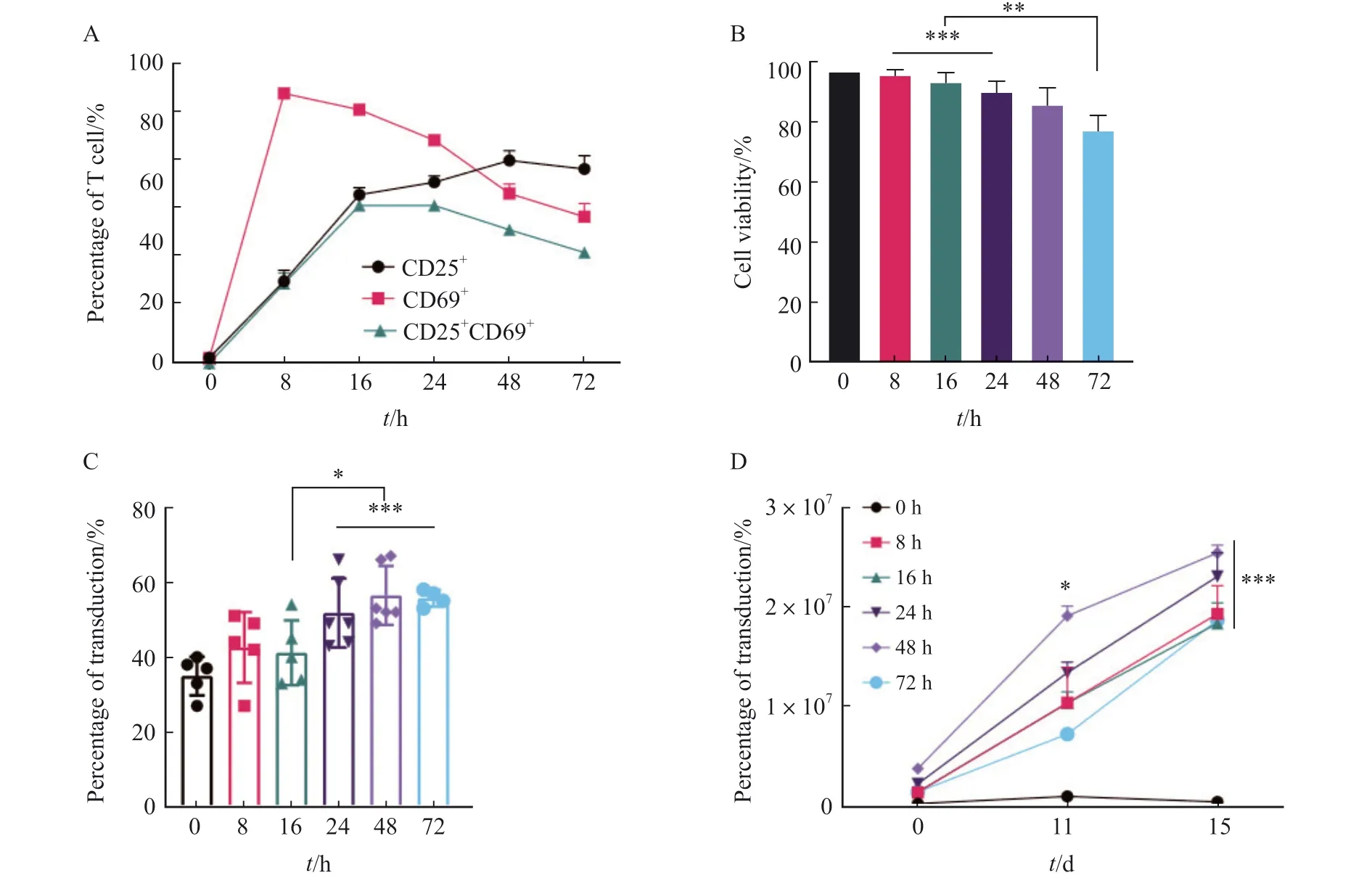
图3 不同活化时间对抗CD30 CAR-T细胞转导的影响Fig.3 Effects of different activation times on transduction of anti-CD30 CAR-T
本实验进一步研究了不同活化时间对抗CD30 CAR-T细胞增殖情况的影响,结果显示,在第11天时,48 h组的有效细胞数显著高于其他组(P<0.05);但在第15天时差异无统计学意义(P> 0.05,图3D)。因此,为了更加准确地验证活化时间对CAR-T细胞的影响,本研究分别选用活化时间为24和48 h进行放大研究。
2.4 24和48 h活化时间对于抗CD30 CAR-T细胞转导影响的放大研究
为进一步验证上述研究结果,我们将转导的T细胞起始量由0.5×107个提高到2.0×107个,培养容器从6孔板改为培养瓶,其他条件与上述一致。通过流式细胞术检测24和48 h活化后CD25和CD69的表达情况,结果显示,48 h组CD69阳性细胞比例及其平均荧光强度(mean fluorescence intensity,MFI)均低于24 h组,48 h组CD25阳性细胞比例略高于24 h,但CD25的MFI明显升高,T细胞被激活(图4A),此结果与2.3结果保持一致。有研究[23]显示,T细胞大小也与其激活有关,因此本研究检测了不同活化时间细胞大小的变化,结果显示,随着刺激时间的延长,T细胞逐渐变大,进一步说明T细胞被激活(图4B)。转导前细胞存活率检测结果显示,24和48 h组间的细胞存活率差异无统计学意义[(81.33±1.15)%vs(82.67±3.51)%,P> 0.05,图4C]。转导后通过流式细胞术检测两组转导效率,结果显示,24和48 h组间转导效率差异无统计学意义(P>0.05,图4D)。细胞增殖实验结果显示,48 h组的增殖速率显著高于24 h组(P<0.01,图4E)。综上所述,根据转导效率、细胞存活率及细胞增殖速率等情况,最终选择MOI=1.0、温育密度为1.0×107个/mL、转导前活化48 h作为慢病毒转导工艺的最佳条件。
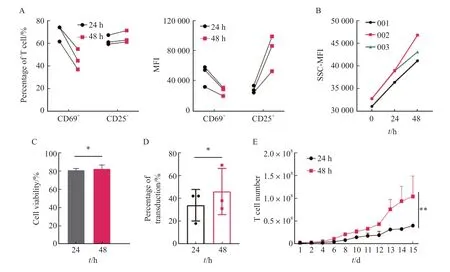
图4 活化时间为24和48 h之间的比较Fig.4 Comparison of activation time between 24 and 48 h
2.5 转导体系高度对于抗CD30 CAR-T细胞转导的影响
转导体系高度为转导体积/底面积。T细胞在转导时迅速沉积在容器底部,导致转导体系顶部溶液中的慢病毒很难与沉积下来的T细胞接触,进而可能影响T细胞的转导。为了验证上述猜想,分别采用0.16和0.53 mm两种转导体系高度对T细胞的转导进行研究。实验结果显示,0.16 mm组在第8天的转导效率显著高于0.53 mm组[(62.00±1.41)%vs(37.00±2.83)%,P<0.01,图5A]。细胞增殖实验结果显示,0.16 mm组抗CD30 CAR-T细胞的增殖倍数显著高于0.53 mm组(P<0.05,图5B)。
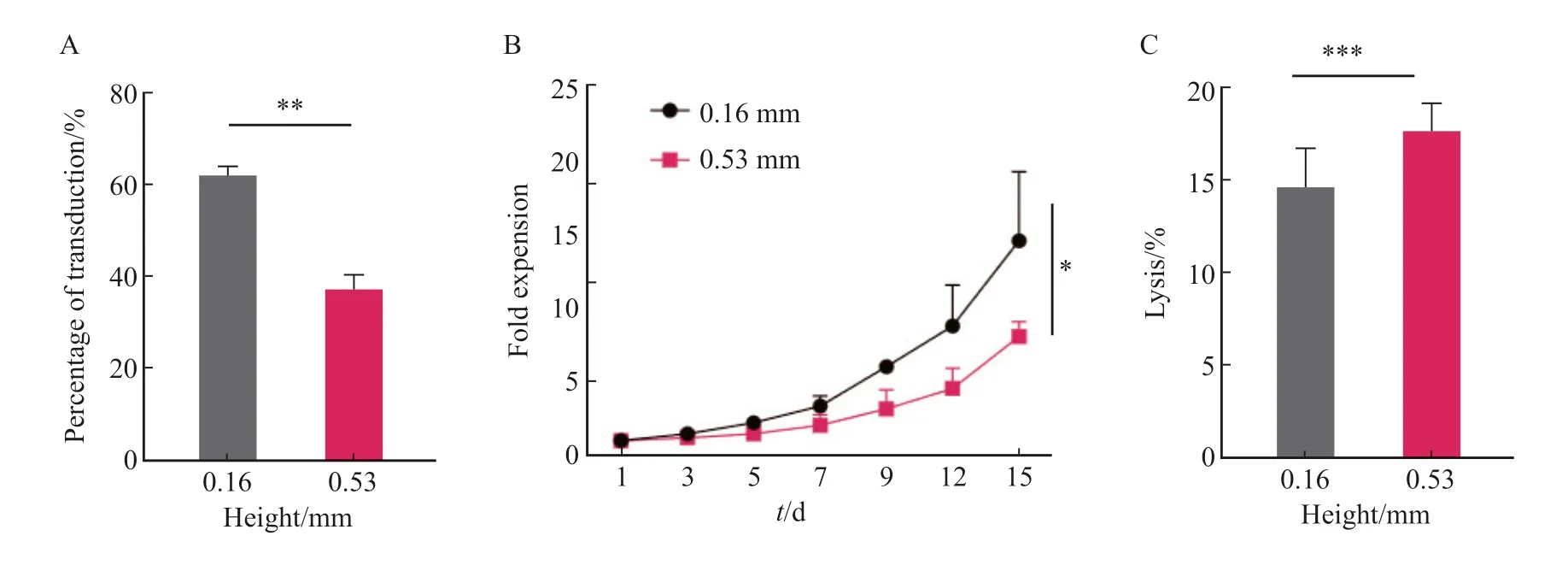
图5 不同转导体系高度对于抗CD30 CAR-T细胞转导的影响Fig.5 Effects of different height on transduction of anti-CD30 CAR-T
本研究还分析了不同转导体系高度对抗CD30 CAR-T细胞毒作用的影响,结果显示,在相同效靶比时,0.16和0.53 mm组对L428肿瘤细胞的杀伤作用差异无统计学意义[效靶比为25∶1时:(14.67±2.08)%vs(17.67±1.53)%,P> 0.05,图5C]。综上所述,根据转导效率、增殖倍数、体外杀伤效率等情况,选择MOI=1.0、温育密度为1.0×107个/mL、转导前活化48 h、转导体系高度为0.16 mm作为最终转导优化条件。
3 讨 论
CAR-T细胞疗法是基于免疫细胞的疗法之一[24]。由于T细胞具有细胞毒性、体外培养增殖良好、病毒载体易转导等特点[25],CAR-T细胞现在已经成为常见且有效的用于癌症治疗的基因修饰细胞[26]。慢病毒可以高效地将基因整合到静止期和增殖期的真核细胞的基因组中并稳定表达[27],临床安全性也高于其他病毒[28],由于上述原因,目前最成熟的CAR-T基因修饰方法是慢病毒转导法[29]。抗CD30 CAR-T细胞的慢病毒转导条件鲜见报道,因此本实验通过对MOI、温育密度、转导前活化时间和转导体系高度等转导条件进行研究,优化慢病毒转导T细胞时的参数,以制备出转导效率更高、功能更强的抗CD30 CAR-T细胞,为抗CD30 CAR-T细胞后续的临床研究提供参 考。
本研究结果显示,MOI等于1、温育密度为1.0×107个/mL、转导前活化48 h、转导体系高度为0.16 mm时,转导得到的抗CD30 CAR-T细胞的转导效率更高,增殖效果更好,但对抗CD30 CAR-T细胞的杀伤功能无影响。原代T细胞取材于不同健康人群外周血,因此原代T细胞间可能存在个体差异。MOI转导参数研究结果显示,MOI大于1时,抗CD30 CAR-T细胞的转导效率处于平台期,可能其他靶点的慢病毒在进行CAR-T细胞转导时也会出现该现象;转导前活化时间决定了T细胞的状态,可能会影响T细胞相关基因的表达水平,进而影响慢病毒的转导效果和表观遗传修饰;T细胞的直径只有8 ~ 10 μm,转导体系过高导致上层慢病毒颗粒无法与T细胞接触,进而影响转导效率。本研究将转导体系高度作为慢病毒静止转导的研究参数,同时也验证了我们的猜想:转导体系的高度趋近于T细胞的直径时,可能会使慢病毒的转导效率不断提高。本研究对不同转导条件下的抗CD30 CAR-T细胞的分析评价指标较少,可通过细胞表型、耗竭程度、表观遗传及细胞因子等[30-33]进行进一步研究,以提高抗CD30 CAR-T细胞的质量。
综上所述,本研究通过对MOI、温育密度、转导前活化时间和转导体系高度等转导参数的研究,最终获得了最优的转导条件:MOI等于1、温育密度为1.0×107个/mL、转导前活化48 h、转导体系高度为0.16 mm。这样的转导条件可以显著提高抗CD30 CAR-T细胞的转导效率,增强抗CD30 CAR-T细胞的增殖能力,且对抗CD30 CAR-T细胞的杀伤能力无显著影响。
利益冲突声明:所有作者均声明不存在利益冲突。
