灵芝抗肿瘤作用及其配伍的研究进展
2023-08-17张文君徐蓓蕾李文兰
张文君,宋 扬,胡 扬,徐蓓蕾,刘 婷,朱 婷,李文兰*
灵芝抗肿瘤作用及其配伍的研究进展
张文君1, 2, 3,宋 扬1#,胡 扬1,徐蓓蕾1,刘 婷1,朱 婷1,李文兰1, 2, 3*
1. 哈尔滨商业大学药学院,黑龙江 哈尔滨 150076 2. 抗肿瘤天然药物教育部工程研究中心,黑龙江 哈尔滨 150076 3. 黑龙江省预防与治疗老年性疾病药物研究重点实验室,黑龙江 哈尔滨 150076
灵芝具有扶正固本、补气安神、延年益寿等功效。现代临床中常采用灵芝与多味中药配伍用于抗肿瘤。近年来研究发现,灵芝的抗肿瘤机制主要涉及调节机体免疫、阻滞细胞周期、诱导肿瘤细胞凋亡和自噬、抑制肿瘤细胞转移以及抗氧化等。通过对灵芝抗肿瘤作用的分子机制和与灵芝配伍的抗肿瘤作用机制进行综述,为灵芝抗肿瘤的临床应用提供参考。
灵芝;抗肿瘤;配伍;多糖;三萜;免疫调节蛋白;甾醇;多糖肽
灵芝为多孔菌科真菌赤芝(Leyss. ex Fr.) Karst或紫芝Zhao, Xu et Zhang的干燥子实体[1]。灵芝在《神农本草经》中被列为上品,具有扶本固正、滋补强壮、延年益寿之功效。灵芝的化学成分丰富,主要包括多糖、三萜,此外还含有甾醇、蛋白质、多肽、生物碱及微量元素等,具有极高的药食两用价值。灵芝多糖、三萜和甾醇共同构成灵芝抗肿瘤作用的物质基础。此外,灵芝蛋白质类化合物也具有抗肿瘤活性。
在临床应用中,灵芝可与多种中药配伍,用于抗肿瘤及辅助化疗。中药配伍在临床应用中具有一定的疗效,药理实验证实,中药合用往往优于单一药物的药理作用,具有协同增效、解毒减毒、双向调节等作用。近年来,已有大量研究者对灵芝的抗肿瘤药理作用机制进行研究,但鲜有文献将灵芝的中药配伍与抗肿瘤作用机制关联。本文对近年来灵芝抗肿瘤机制及配伍应用方面取得的进展进行总结,为灵芝抗肿瘤的临床应用提供理论依据。
1 灵芝抗肿瘤作用分子机制
中药具有多成分、多靶点、多途径的协同调节作用,具有多种活性成分,作用机制复杂多样。在肿瘤的起始、发展、转移和免疫调节等多个阶段发挥着多样化的治疗作用[2]。灵芝多糖、灵芝三萜、灵芝免疫调节蛋白、灵芝甾醇等成分均具有抗肿瘤活性,灵芝可直接或间接作用于肿瘤细胞而发挥抗肿瘤作用。直接作用包括阻滞细胞周期、诱导细胞凋亡和自噬及抑制肿瘤细胞侵袭和转移;间接作用包括调节机体免疫和抗氧化作用。这一过程包括调节细胞内外信号传导、基因表达和免疫分子功能调节等。此外,灵芝可抑制过度激活的免疫系统,改善自身免疫性损伤,维持机体免疫稳态[3]。
1.1 阻滞细胞周期
细胞周期停滞可抑制肿瘤细胞生长发育,进而影响肿瘤发展进程。多种细胞周期调节蛋白,如细胞周期蛋白(cyclin)、cyclin-依赖性激酶(cyclin-dependent kinase,CDK)和cyclin-依赖性激酶抑制剂(cyclin-dependent inhibitor,CDKI)等均可参与细胞周期的调节和肿瘤的形成,因此在抗肿瘤中发挥重要作用。灵芝可诱导肿瘤细胞的周期停滞,抑制其增殖。近年来国内外研究者对灵芝多糖在抗肿瘤作用中的分子机制开展了大量的实验研究。OUYANG等[4]研究表明,灵芝多糖0.5 mg/mL可上调CDKI,下调cyclin,诱导人肝癌HepG2、Bel-7404细胞周期停滞。李建军等[5]通过研究灵芝多糖对S180荷瘤小鼠肿瘤细胞核酸及细胞周期的影响,发现灵芝多糖100、200、400 mg/kg可降低S180荷瘤小鼠肿瘤细胞RNA/DNA的值,下调G2/M期细胞百分比,干扰细胞周期的正常功能,抑制肿瘤细胞的生长。沈瑞等[6]通过研究灵芝多糖对人肝癌SK-HEP-1和Huh-7细胞增殖、迁移、细胞周期及凋亡的影响,发现灵芝多糖3.5、7.0、14.0 g/L通过抑制磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路,进而抑制SK-HEP-1和Huh-7细胞增殖,诱导G1期细胞周期阻滞。灵芝菌丝体的甲醇提取物中分离的9,11-烯过氧化麦角甾醇7~12 μmol/L可通过诱导CDK抑制剂1A的表达,诱导人结肠癌HT29细胞周期阻滞[7]。
1.2 诱导细胞凋亡和自噬
凋亡作为一种细胞程序性死亡方式,其过程由基因严格调控。凋亡过程往往通过上调调控蛋白的表达,如胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)、Caspase-6、Caspase-9、细胞色素C(cytochrome C,Cyt C)、死亡因子(factor associated suicide,Fas)/Fas配体(Fas ligand,FasL)、B淋巴细胞瘤-2相关X蛋白(B-cell lymphoma-2 associated X protein,Bax)、聚ADP核糖聚合酶(poly ADP-ribose polymerase,PARP)等调节蛋白的含量升高。此外,还伴随着抗凋亡蛋白B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)和Bcl-xl等细胞因子含量的减少。而自噬途径则是通过调控哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、PI3K/Akt等信号通路和分子发挥作用[8]。王芷宁[9]和贾怡等[10]发现灵芝可以通过调节细胞自噬等细胞程序性死亡的方式,促进肿瘤细胞死亡。
邢会军等[11]通过体外肿瘤细胞抑制实验及体内抗肿瘤实验,探讨灵芝多糖体内外抗肿瘤作用,发现灵芝多糖100、200 mg/kg可有效抑制人胃癌MKN45、AGS细胞生长,其作用与增加基因表达,抑制基因表达,从而促进肿瘤细胞凋亡有关。已有研究表明灵芝三萜可以通过上调细胞周期蛋白p21、p53、Caspase-3/6/9、Bcl-2、Bax的表达,抑制细胞外信号调节激酶1/2(extracellular signal regulated kinase 1/2,ERK1/2)磷酸化进而诱导癌细胞凋亡[12-13]。Li等[14]研究表明灵芝三萜0~40 μg/mL可通过降低线粒体膜电位,诱导c-Myc释放,从而上调Caspase-3和Caspase-9表达,诱导PARP裂解,引发人结直肠癌SW620细胞凋亡,抑制肿瘤细胞DNA修复。灵芝甾醇25、75 μmol/L可下调磷酸化Akt(phosphorylated Akt,p-Akt)及c-Myc在细胞中的表达,上调促凋亡蛋白、Fas及FasL表达、活化p53上调凋亡调控因子及Bax,继而刺激叉头框蛋白O3a(forkhead box protein O3a,FOXO3a)的表达,从而诱导人乳腺癌MDA-MA-231细胞凋亡[15]。灵芝免疫调节蛋白0.6、1.2 μmol/L可通过活化糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β),继而抑制β-连环蛋白(β-catenin)的表达,导致生存素和cyclin-D1转录的下调,诱导人肺癌H1355、H1299、A549细胞凋亡。此外,灵芝免疫调节蛋白可呈时间和剂量相关性下调p53表达,激活钙离子信号,抑制Akt/mTOR信号通路诱导A549细胞自噬的发生[16]。灵芝多糖肽0.25~4.00 mg/mL可通过下调Bcl-2和生存素的表达,上调p53和Caspase-3,从而诱导人肝癌HepG2细胞凋亡[17]。Pan等[18]研究发现,灵芝多糖2.5、5.0、10.0 mg/mL可通过丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)/细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)信号通路活化引起人结肠癌HT-29和HCT116细胞自噬。灵芝酸D 20、40 μmol/L通过mTOR信号通路,下调PI3K含量、Akt及mTOR磷酸化蛋白的表达,诱导人食管鳞状细胞癌ESCC细胞自噬的发生[19]。
1.3 抑制肿瘤细胞侵袭和转移
肿瘤细胞转移是指肿瘤细胞从原发癌灶向其它器官迁移,是肿瘤蔓延的重要途径。细胞的黏附性对转移起着决定性的影响。E-钙黏蛋白(E-cadherin)和整合素是影响肿瘤细胞黏附的关键分子。提高E-cadherin含量可以增强肿瘤细胞间的同质黏附性,使其难以从原发瘤上分离。整合素与黏着斑激酶(focal adhesion kinase,FAK)结合后,激活PI3K/ Akt和MAPK信号通路,促进FAK磷酸化,增强肿瘤细胞迁移与侵袭。此外,基质金属蛋白酶(matrix metalloproteinase,MMP)和血管内皮生长因子(vascular endothelial growth factor,VEGF)等靶向分子对肿瘤的转移也会产生影响。上皮-间充质转化(epithelial-mesenchymal transition,EMT)也与肿瘤的转移存在关联。在EMT的形成过程中,黏附分子、细胞骨架、锌指转录因子(Snail、Slug等)和其他蛋白表达水平发生变化,导致细胞失去极性、移动能力大幅提高[20-21]。
Liu等[22]通过研究灵芝三萜对肺癌荷瘤裸鼠的抗肿瘤作用,发现灵芝三萜1 g/kg联合吉非替尼15 mg/kg治疗后,BALB/c裸鼠肺癌细胞VEGF受体2、MMP表达显著降低。灵芝免疫调节蛋白2.5、5.0、10.0 μg/mL可诱导FAK失活,增强E-cadherin的表达并增强泛素-蛋白酶体途径介导的Slug的降解。从而干扰肺癌细胞黏附,抑制肿瘤细胞生长、转移和侵袭,提高小鼠肺癌Lewis细胞携带小鼠的存活率[23]。曹琦珍等[24]通过研究灵芝多糖肽对人肺癌PG细胞侵袭性的影响,发现灵芝多糖肽可呈剂量相关性抑制MMP9及VEGF的表达,进而抑制PG细胞的转移。
1.4 调节机体免疫
灵芝通过调节免疫细胞发挥抗肿瘤作用,可活化T和B淋巴细胞、巨噬细胞、树突状细胞和天然杀伤细胞,诱导免疫细胞产生细胞因子、细胞因子受体及趋化因子。这些因子不仅可以调控免疫细胞的活力及某些细胞因子如γ-干扰素、白细胞介素-1(interleukin-1,IL-1)、IL-2、IL-4、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等,还可以作用于肿瘤细胞并对其产生毒性[7]。
灵芝多糖能够增强肿瘤患者免疫力、改善临床症状,提高生活质量和生存率,现已广泛应用于各种肿瘤治疗中[25]。灵芝多糖可激活蛋白激酶C(protein kinase C,PKC)和PKA,诱导γ-干扰素、TNF-α、TNF-β、IL-1α、IL-1β、IL-1和IL-2表达;体外研究表明其可增加培养基中分化簇69(T细胞活化和增殖的共同刺激分子)、FasL的产生[26-27]。康峰[28]通过研究灵芝多糖对长期运动大鼠巨噬细胞吞噬功能的影响,发现灵芝多糖可促进IL-1β和一氧化氮表达,增强吞噬细胞功能。而在体外实验中,其可通过上调IL-1β、TNF-α和IL-6表达,实现巨噬细胞的激活,增强机体免疫功能[29]。
Watanabe等[30]研究发现,灵芝三萜10、50 μg/mL可调节c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)和p38 MAPK活性,增加单核巨噬细胞活性,提高宿主免疫功能的作用。灵芝免疫调节蛋白促进MAPK和核因子-κB抑制蛋白-α(NF-κB inhibitor-α,IκB-α)磷酸化,增强中性粒细胞、淋巴细胞和单核细胞活性,诱导树突状细胞成熟和活化,上调IL-3和IL-4水平[31]。Lin等[16]研究发现灵芝免疫调节蛋白可以增强巨噬细胞的增殖和吞噬功能,并诱导TNF-α、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,)和诱导型一氧化氮合酶(inducible nitric oxide synthase,)等炎症介质的mRNA表达,通过PI3K/Akt和MAPK途径介导巨噬细胞的免疫调节活性。Zhang等[32]证实灵芝生物活性蛋白聚糖可促进巨噬细胞产生IL-1β、TNF-α和活性氮中间体,从而起到一定的抗癌作用。
1.5 抗氧化
灵芝还可通过抗氧化作用来发挥其抗肿瘤活性。Chen等[33]研究发现,灵芝多糖0.2~2.6 mg/mL可降低丙二醛的生成并提高血清抗氧化酶水平、降低氧自由基、羟基自由基和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl radical,DPPH)自由基的含量。此外,潘云霞等[34]通过研究灵芝多糖对人乳腺癌MCF-7、MDA-MB-231细胞凋亡的影响及作用机制,发现灵芝多糖25、50、75 mg/mL可通过抑制抗氧化基因谷氨酸-半胱氨酸连接酶调节亚基(glutamate-cysteine ligase regulatory subunit,)的表达抑制谷胱甘肽的合成,从而诱导活性氧在细胞内大量累积,促进乳腺癌的细胞凋亡。灵芝三萜5~40 μmol/L可以通过下调超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽、和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)水平诱导活性氧积累,使DNA氧化损伤,破坏线粒体的完整性,促使人宫颈癌HeLa细胞凋亡[35]。
1.6 其他
肠道黏膜免疫是机体发挥免疫调节的重要途径。灵芝多糖可通过保护肠黏膜发挥黏膜免疫调节作用。灵芝多糖可不同程度的调节肠道黏膜淋巴细胞的表型及细胞因子的表达,并能明显改善小肠病理损伤,提示灵芝可通过黏膜调节机体免疫功能,发挥抗肿瘤活性[36-37]。Guo等[38]通过研究灵芝孢子粉多糖对炎症的诱导及肠道微生物的影响,发现灵芝多糖200、300 mg/kg可抑制Toll样受体4(Toll-like receptor 4,TLR4)/髓样分化因子88(myeloid differentiation factor 88,MyD88)/核因子-κB(nuclear factor-κB,NF-κB)信号传导,改善微生物群失调,增加短链脂肪酸水平,改善肠道屏障功能。
有研究表明肿瘤代谢途径也可抑制肿瘤生长发育。肿瘤细胞通过异常糖代谢来躲避免疫监视,因此可通过抑制糖酵解限速酶己糖激酶2(hexokinase 2,HK2)在肿瘤细胞中表达而发挥抗肿瘤作用。Bao等[39]证实在紫芝子实体中发现的甾醇类化合物为HK2抑制剂并对其有较高的结合亲和力,可影响肿瘤的糖代谢途径,对于抑制肿瘤细胞繁殖起一定作用。此外,脂代谢也是肿瘤代谢的重要途径,灵芝三萜GL22 10~40 μmol/L可降低脂肪酸结合蛋白的表达水平,诱导线粒体脂质心磷脂流失,引发线粒体功能紊乱,促进人肝癌Huh7.5细胞凋亡[40]。
综上,灵芝多糖、三萜、甾醇、免疫调节蛋白和灵芝多糖肽发挥抗肿瘤作用的分子调控机制主要集中于调控肿瘤细胞周期、抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡和自噬、调节机体免疫功能、抗氧化等,并调节相应的信号通路及蛋白。此外,灵芝多糖和灵芝甾醇类化合物也可通过改善肠道屏障和调节肿瘤细胞糖代谢而发挥抗肿瘤作用。
灵芝不同成分直接抗肿瘤作用机制见图1,间接抗肿瘤作用机制见图2。
2 灵芝配伍的抗肿瘤应用
中医学认为,癌变是以气血不足为基础,以气滞血瘀、湿阻、痰凝和热毒、外感六淫和内伤七情为主要病机引起的。中药具有靶向性多、作用范围广、不良反应少、不易产生抗药性等特点[41]。基于癌症的发生机制,中药配伍多采用扶正抗癌、活血消癥、清热解毒、以毒攻毒、软坚散结、化痰除湿等治法。
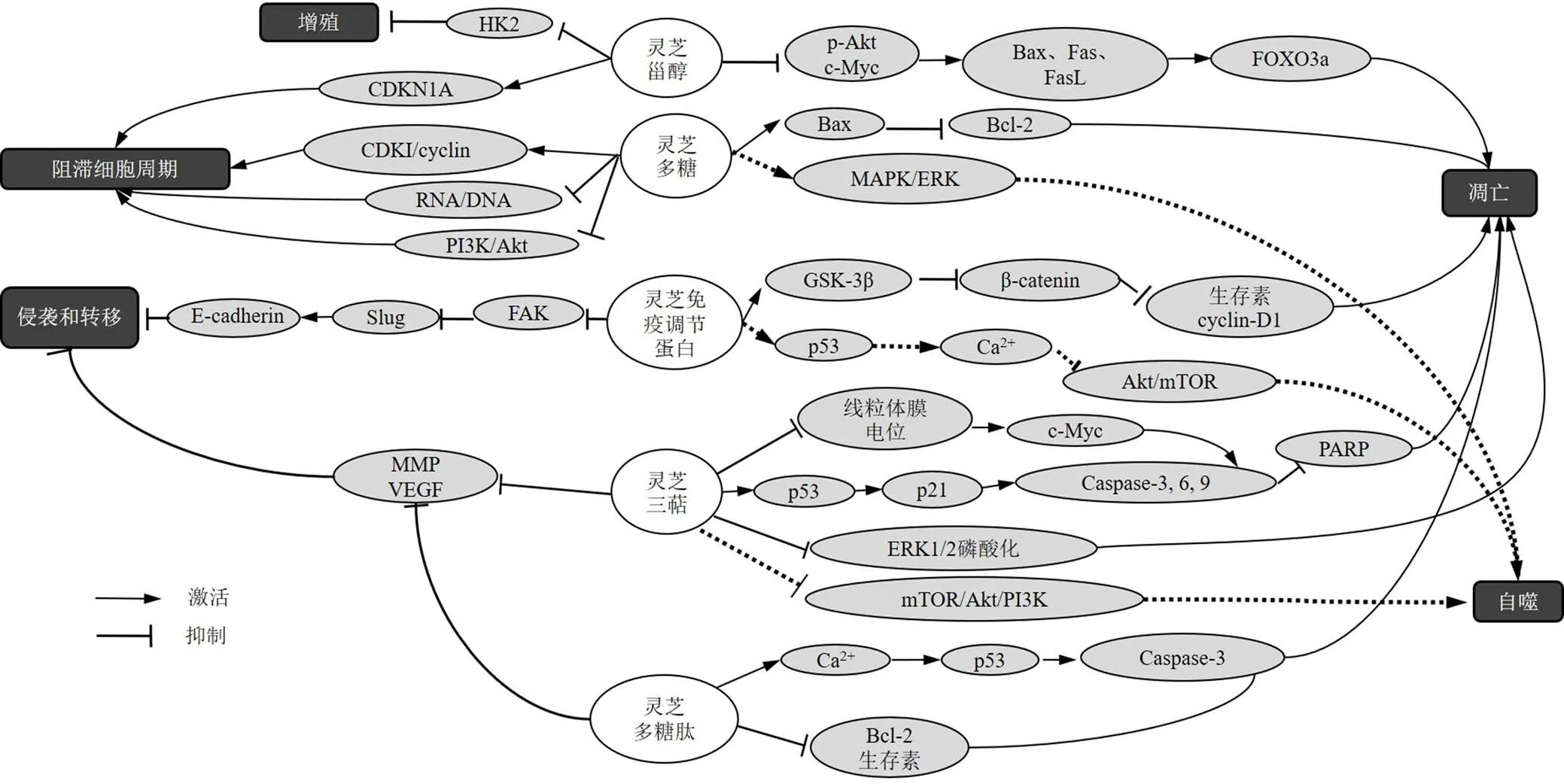
图1 灵芝不同成分直接抗肿瘤作用机制
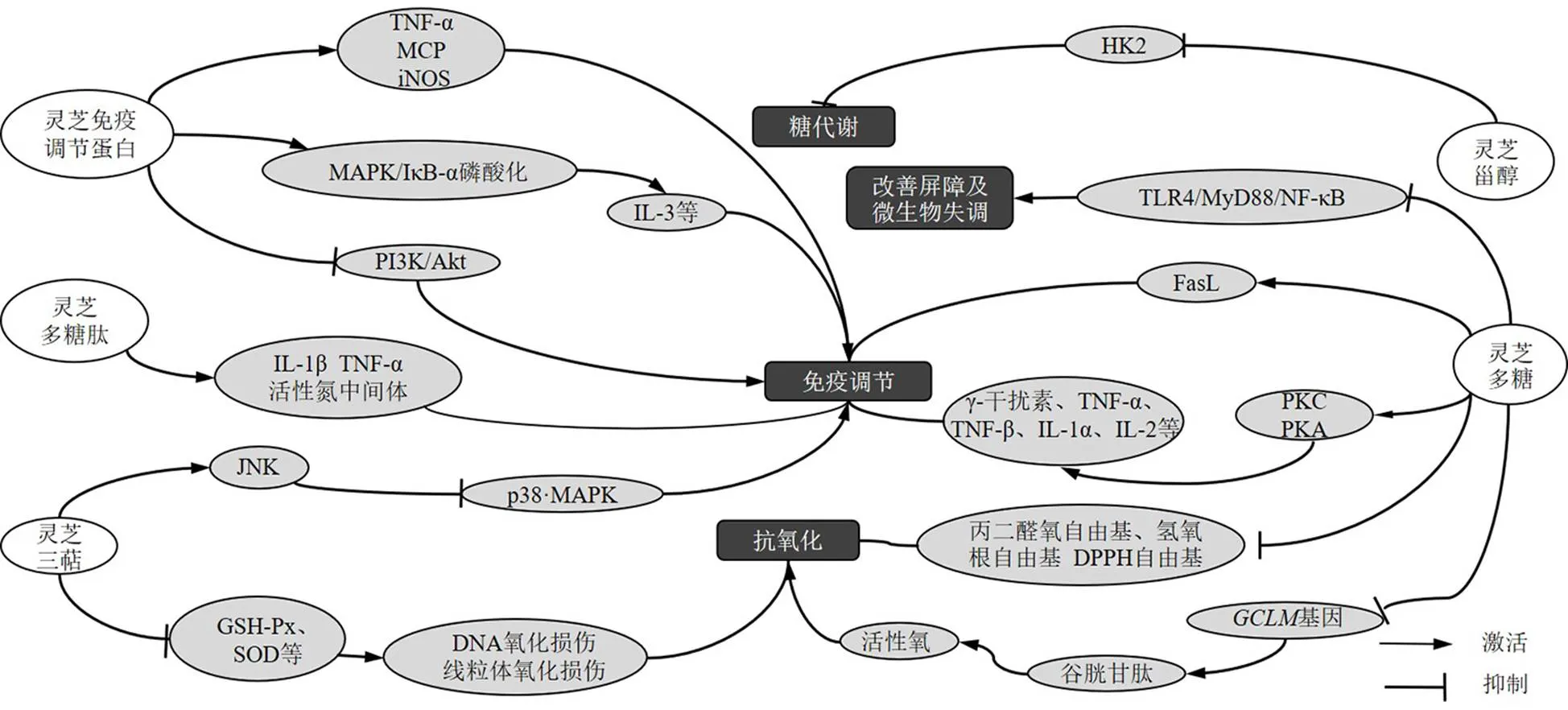
图2 灵芝不同成分间接抗肿瘤机制
灵芝具有补益全身气血、扶正固本、扶正祛邪之功效,在肿瘤系统治疗应用中起到正气内存、邪不可干的抗肿瘤作用。临床抗肺癌验方灵薏方是由灵芝、薏苡仁和百合3味中药组成,方中灵芝为君药,具有滋补强壮、延年益寿、宁心安神、扶正固本之功效;百合养阴安神,薏苡仁健脾利湿,同为臣药,可消瘤软坚、补气养阴、利水渗湿,全方通过调节机体免疫发挥协同抗肺癌作用[42]。灵芝薏苡仁方是以灵芝,薏苡仁合用配伍大枣、蜂蜜,其联合用药相比常规化学药干预恶性肿瘤疗效更确切,可改善患者健康状况,提高机体免疫功能[43]。红灵芝排毒化肿胶囊为灵芝配伍半枝莲、黄芪、川黄连、黄芩等,方中黄芪和灵芝补气固表、排毒消肿,半枝莲清热毒、化瘀肿,对热邪结于肿瘤有较好的治疗作用[44]。益肺败毒汤组成为灵芝配伍生黄芪、丹参、臭牡丹、白参、沙参、石见穿、白花蛇舌草、麦冬、生地黄、百合、甘草、浙贝母、桔梗、瓜蒌,方中白参、生黄芪、灵芝补气益肺;沙参、麦冬、百合、生地黄养阴润肺;臭牡丹、石见穿、白花蛇舌草清热解毒;浙贝母、桔梗、瓜蒌宣肺化痰;丹参活血化瘀,诸药合用,共奏益气养阴、清热解毒、化痰散瘀、攻补兼施之功[45]。六君子汤加味为灵芝配伍人参、当归、茯苓、白术、白花蛇舌草、熟地黄、山药、黄芪、白芍、甘草、败酱草、薏苡仁,方中人参甘温大补元气、健脾养胃、生津,为君药;白术和茯苓善健脾胃、消痰水;制半夏、生姜和旋覆花降胃安冲、止呕消痰;灵芝具有扶本固正之功效;诸药合用,可治疗胃癌术后营养不良及恶心呕吐症状[46]。扶正祛邪方组成为灵芝配伍党参、茯苓、全蝎、白花蛇舌草、醋莪术、白术、山药、黄芪,具有良好的抗肿瘤活性[47]。此外,抗肝癌合剂[48]组成为灵芝配伍半枝莲、茯苓、白芍、猫爪草、蒲公英、焦山楂、猪苓、猫人参、白花蛇舌草、赤芍、柴胡、莪术、郁金,其中半枝莲、白花蛇舌草、猫人参、猫爪草、蒲公英清热解毒;柴胡、白芍疏肝理气,又兼能柔肝养肝;赤芍、莪术、郁金等活血化瘀、软坚散结;茯苓、猪苓、焦山楂健脾利水,和胃消食,以防诸药苦寒败胃伤脾,全方共奏清热化湿、疏肝理气、解毒化瘀、软坚散结、祛积消瘤之功。健脾消癌饮为灵芝配伍薏苡仁、丹参、半枝莲、石见穿、白术、法半夏、广木香、党参、茯苓、淫羊霍、甘草、黄芪、莪术、白花蛇舌草、重楼,黄芪、灵芝、薏苡仁健脾益气;莪术、丹参活血化瘀;白花蛇舌草半枝莲、石见穿清热解毒;全方扶正祛邪、标本同治,可用于大肠癌的辅助治疗[49]。
3 灵芝配伍抗肿瘤机制
现代医学针对于肿瘤的治疗已不拘泥于传统的中药配伍形式,多采取中西医结合的治疗策略。分子配伍是将结构、药效、机制明确的多个活性成分遵循“君臣佐使”及量效最佳原则优化配伍成“分子复方”,形成药效协同、不良反应小的分子配伍新药,精制成剂型先进、多分子、多靶点发挥药效的现代中药天然药物[41]。灵芝配伍的抗肿瘤机制多集中于促进肿瘤细胞凋亡、调节机体免疫、阻滞细胞周期、抑制肿瘤细胞的增殖与分裂等方面。
复方灵芝孢子精油软胶囊(compoundlucidum spore oil soft capsule,CGOC)为超临界流体萃取技术得到孢子精油、人参、黄芪、刺五加及红景天提取物配伍加工而成,其对S180荷瘤小鼠具有显著的抗肿瘤作用[50]。鲍蕾蕾等[51]通过研究CGOC对S180荷瘤小鼠的抗肿瘤作用,发现CGOC 1540、770、385 mg/kg可不同程度地抑制肿瘤,提高S180荷瘤小鼠的胸腺、脾脏指数、白细胞总数、淋巴细胞总数,其中CGOC 770 mg/kg作用最明显。其作用机制是通过调节免疫功能、激活Caspase-3引起细胞凋亡、抑制拓扑异构酶活性,抑制细胞增殖等发挥抗癌作用。复方灵芝胶囊组成为灵芝配伍白术、土茯苓、川芎、黄芪、丹参、甘草,可共奏益气养阴、养心安神、解毒抗癌的功效,是扶正固本、增强机体免疫功能的良药。复方灵芝胶囊对小鼠腹水瘤S180细胞、小鼠肝癌H22细胞和小鼠肺癌Lewis细胞的生长有显著的抑制作用,且与化疗药合用后具有协同效应,较单用化疗药物对S180肿瘤生长抑制作用更强[52]。灵芝合剂为灵芝配伍蛇莓、冬凌草,灵芝合剂0.4~6.4 mg/mL对大鼠肝癌CBRH7919细胞、人胃癌BGC823细胞具有明显的增殖抑制效果,且联合化疗药物组抑瘤率高于化疗药物组,其抗肿瘤机制为上调TNF-α、IL-6水平,调节机体免疫功能[53]。Peng等[54]证实灵芝配伍樟脑、鹿茸提取物具有抑制肿瘤细胞增殖和促进肿瘤凋亡作用;该混合物10、20 mg/mL可通过上调p21,下调CDK-2/4/6,诱导细胞周期停滞在G1期,抑制人结肠癌SW620、SW480和HT29细胞增殖;触发促凋亡蛋白表达,上调Bax和Caspase-9,下调p53,诱导结肠癌细胞凋亡。Jiang等[55]研究发现灵芝配伍姬松茸、冬虫夏草、云芝、猪苓、灰树花0~0.5 mg/mL可下调乳腺肿瘤细胞中的细胞周期调节基因的表达,使细胞周期停滞在G2/M期,从而抑制细胞的分裂和增殖。灵芝孢子油番茄红素复合物(lucidum spore oil-lycopene complex,LZFQ)是以灵芝孢子油为主要成分,与适量的番茄红素作为辅料复合配比组成,LZFQ 0.125、0.250、0.500 mg/mL能够通过诱导细胞凋亡,从而对肿瘤细胞产生抑制作用,且呈剂量相关性的下调抑凋亡蛋白Bcl-2的水平,上调促凋亡蛋白Bax、Caspase-3的水平[56]。
组分配伍在增效减毒和辅助化疗方面有着显著优势。灵芝三萜组分与紫杉醇联用,可显著增强紫杉醇对乳腺癌细胞凋亡的诱导作用。体外实验表明,灵芝三萜和紫杉醇对人乳腺癌SKBR-3细胞的增殖和凋亡有一定的影响,可诱导凋亡相关蛋白的表达,阻断人类表皮生长因子受体2(human epidermal receptor 2,HER2)信号途径的传导;通过体内动物实验,发现灵芝三萜能显著提高紫杉醇对HER2+乳腺癌的抵抗[57]。灵芝可辅助化疗,改善化疗相关疲劳,现已广泛应用于临床。其中,灵芝酸联合5-氟尿嘧啶可改善线粒体功能、增加糖原含量和三磷酸腺苷的产生、降低乳酸含量和乳酸脱氢酶活性并抑制骨骼肌中磷酸化腺苷酸活化蛋白激酶、IL-6和TNF-α的表达;通过抑制TLR4/Myd88/NF-κB通路,抑制5-氟尿嘧啶诱导的中枢疲劳样行为,并下调海马IL-6、iNOS和环氧化酶-2的表达。综上结果表明,灵芝酸可以减轻5-氟尿嘧啶诱导的荷瘤小鼠的外周和中枢疲劳[58]。
灵芝配伍的抗肿瘤机制见图3。灵芝抗肿瘤配伍经方及主治功效见表1。
4 结语与展望
灵芝作为一种珍贵的中药,具有滋补健体、扶正固本的作用,在历代医学典籍中都有记载。古方中灵芝常与其他中药配伍使用,用以延年益寿、补气安神、强身健脑。现代研究发现灵芝多糖、灵芝三萜、灵芝甾醇、灵芝免疫蛋白等均为其有效成分,这些成分在抗肿瘤方面发挥重要作用。随着对灵芝的研究逐渐深入,其在临床中的应用也越来越广泛,灵芝多种活性成分相互协同,发挥广泛的药理作用[59]。灵芝及其配伍发挥抗肿瘤作用的机制研究目前主要集中于阻滞肿瘤细胞周期、诱导肿瘤细胞凋亡和自噬、抑制肿瘤细胞侵袭和转移、调节机体的免疫及抗氧化作用等方面。目前,针对灵芝配伍应用在各种病证中的作用机制尚无系统的论述,仍需要进行深入的研究及整理。
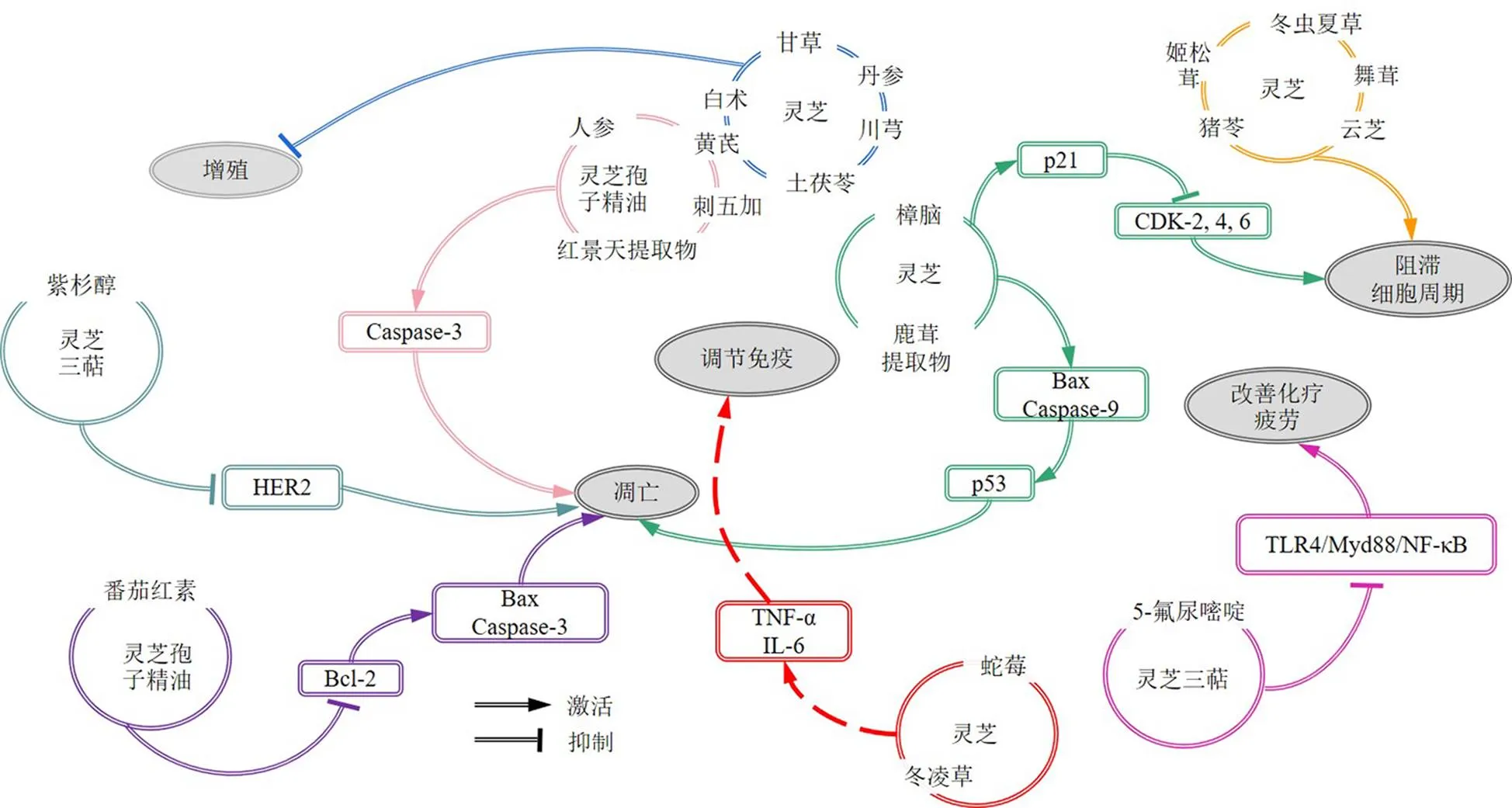
图3 灵芝配伍的抗肿瘤机制
表1 灵芝抗肿瘤配伍经方及主治功效
Table 1 Ganoderma antitumor compatibility prescription and its main treatment effects
方名/商品名配伍药物主治功效文献 灵薏方薏苡仁、百合肺癌消瘤软坚、补气养阴、利水渗湿42 益肺败毒汤生黄芪、丹参、臭牡丹、白参、沙参等清热解毒、化痰散瘀、益气养阴45 抗肝癌合剂半枝连、茯苓、白芍、猫爪草、蒲公英等清热解毒、活血化瘀、软坚散结、祛积消瘤、疏肝理气48 六君子汤加味人参、当归、茯苓、白术、白花蛇舌草、熟地黄等胃癌降逆止呕、扶正固本46 健脾消癌饮薏苡仁、丹参、半枝莲、石见穿、白术、法半夏等大肠癌扶正固本、清热解毒、健脾益气49 膳食补充剂姬松茸、冬虫夏草等乳腺癌扶正固本55 扶正祛邪方党参、茯苓、全蝎、白花蛇舌草等子宫内膜癌扶正固本47 灵芝薏苡仁方薏苡仁、大枣、蜂蜜增强免疫、辅助抗肿瘤扶正固本43 红灵芝排毒化肿胶囊半枝莲、黄芪等清热解毒、活血化瘀44 CGOC人参、黄芪、刺五加等益气固本、补脾益肺、镇痛安神、活血通脉50-51 复方灵芝胶囊白术、土茯苓、川芎、黄芪、丹参、甘草扶正固本、益气养阴52 灵芝合剂蛇莓、冬凌草清热解毒、消肿散结、扶正固本53
市场上的灵芝制品开发已经十分广泛,包括片剂、胶囊、冲剂、灵芝浓缩液、灵芝咖啡、灵芝茶等。但各类灵芝产品缺乏科学有效的质量管理手段,在生产规模、技术水平等方面,尚不能满足市场需要。因此,对灵芝制品的研究与开发仍需进一步深入。
本文对灵芝抗肿瘤的主要作用机制及抗肿瘤配伍的临床应用进行整理,下一步的研究应集中于灵芝有效成分及其机制的系统化研究,对于灵芝配伍机制及成分间的相互作用进行更深入的实验研究,为临床应用提供更科学的理论基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 195-196.
[2] 李小江, 邬明歆, 孔凡铭, 等. 中药有效成分抗肿瘤活性及作用机制研究进展 [J]. 中草药, 2020, 51(9): 2587-2592.
[3] 谢溢坤, 张静, 余茜, 等. 灵芝多糖类成分及其生物活性研究进展 [J]. 中草药, 2021, 52(17): 5414-5429.
[4] OUYANG F J, Wang G B, Guo W,. Akt signalling and mitochondrial pathways are involved in mushroom polysaccharide-induced apoptosis and G1or S phase arrest in human hepatoma cells [J]., 2013, 138(4): 2130-2139.
[5] 李建军, 雷林生, 余传林, 等. 灵芝多糖对S180荷瘤小鼠肿瘤细胞核酸及其细胞周期的影响 [J]. 南方医科大学学报, 2007, 27(7): 1003-1005.
[6] 沈瑞, 徐静, 王雷, 等. 灵芝多糖调控PI3K/Akt信号通路抑制肝癌细胞恶性表型 [J]. 中国实验方剂学杂志, 2023, 29(6): 88-94.
[7] Kobori M, Yoshida M, Ohnishi-Kameyama M,. 5alpha,8alpha-epidioxy-22-ergosta-6,9(11),22-trien- 3beta-ol from an edible mushroom suppresses growth of HL60 leukemia and HT29 colon adenocarcinoma cells [J]., 2006, 29(4): 755-759.
[8] 阚月一, 王娅杰, 李琦, 等. 肿瘤发展过程中自噬与凋亡的相互作用 [J]. 中国比较医学杂志, 2018, 28(02): 106-112.
[9] 王芷宁. 灵芝抗肿瘤肺转移作用的初步评价 [D]. 长春: 吉林农业大学, 2022.
[10] 贾怡, 李艳, 王晓琳, 等. 灵芝酸A-靛红拼合物的合成、抗肿瘤活性及靶点预测研究 [J]. 中草药, 2023, 54(7): 2044-2055.
[11] 邢会军, 侯雷, 孙勇, 等. 灵芝多糖对小鼠胃肿瘤活性的体内外抑制作用 [J]. 中国实验方剂学杂志, 2017, 23(13): 116-120.
[12] 邢康康, 刘艳, 贺宗毅, 等. 灵芝酸研究进展 [J]. 食用菌学报, 2017, 24(3): 96-103.
[13] Cao L P, Jin H L, Liang Q,. A new anti-tumor cytotoxic triterpene from[J]., 2022, 36(16): 4125-4131.
[14] Li P, Liu L X, Huang S,. Anti-cancer effects of a neutral triterpene fraction fromand its active constituents on SW620 human colorectal cancer cells [J]., 2020, 20(2): 237-244.
[15] 李向敏. 皱盖假芝和灵芝孢子中甾醇类化合物抗肿瘤作用机制研究 [D]. 广州: 华南理工大学, 2015.
[16] Lin J W, Chen H, Bai Y D,.immunomodulatory proteins: Mushrooming functional FIPs [J]., 2022, 106(7): 2367-2380.
[17] 何慧. 灵芝内源肽的结构及对肝损伤的干预 [D]. 武汉: 华中农业大学, 2011.
[18] Pan H T, Wang Y J, Na K,. Autophagic flux disruption contributes topolysaccharide-induced apoptosis in human colorectal cancer cells via MAPK/ERK activation [J]., 2019, 10(6): 456.
[19] Shao C S, Zhou X H, Zheng X X,. Ganoderic acid D induces synergistic autophagic cell death except for apoptosis in ESCC cells [J]., 2020, 262: 113213.
[20] Jiang W G, Sanders A J, Katoh M,. Tissue invasion and metastasis: Molecular, biological and clinical perspectives [J]., 2015, 35: S244-S275.
[21] Nagelkerke A, Bussink J, Rowan A E,. The mechanical microenvironment in cancer: How physics affects tumours [J]., 2015, 35: 62-70.
[22] Liu W, Yuan R Y, Hou A H,.triterpenoids attenuate tumour angiogenesis in lung cancer tumour-bearing nude mice [J]., 2020, 58(1): 1061-1068.
[23] Lin T Y, Hsu H Y. Ling Zhi-8 reduces lung cancer mobility and metastasis through disruption of focal adhesion and induction of MDM2-mediated Slug degradation [J]., 2016, 375(2): 340-348.
[24] 曹琦珍, 林树钱, 王赛贞, 等. 灵芝多糖肽对人肺癌细胞侵袭的影响 [J]. 北京大学学报: 医学版, 2007, 39(6): 653-656.
[25] 林梦感, 杨义芳, 李永辉. 多糖抗肿瘤活性构效关系的研究进展 [J]. 中草药, 2007, 38(6): 949-953.
[26] Tang J Q, Zhen H M, Wang N N,. Curdlan oligosaccharides having higher immunostimulatory activity than curdlan in mice treated with cyclophosphamide [J]., 2019, 207: 131-142.
[27] Yoo S M, Lee C J, Kang H C,. Epimagnolin targeting on an active pocket of mammalian target of rapamycin suppressed cell transformation and colony growth of lung cancer cells [J]., 2019, 58(7): 1221-1233.
[28] 康峰. 灵芝多糖对长期运动大鼠巨噬细胞吞噬功能及NO和IL-1β表达的影响 [J]. 动物医学进展, 2017, 38(6): 61-65.
[29] 胡晓祎. 黑灵芝多糖对巨噬细胞、肠上皮细胞-巨噬细胞共培养模型炎症反应的调节作用 [D]. 南昌: 南昌大学, 2020.
[30] Watanabe K, Shuto T, Sato M,. Lucidenic acids-rich extract from antlered form ofenhances TNFα induction in THP-1 monocytic cells possibly via its modulation of MAP kinases p38 and JNK [J]., 2011, 408(1): 18-24.
[31] Zhou H, Sun F, Li H R,. Effect of recombinantimmunoregulatory protein on cyclophosphamide-induced leukopenia in mice [J]., 2013, 35(3): 426-433.
[32] Zhang J S, Tang Q J, Zhou C Y,. GLIS, a bioactive proteoglycan fraction from, displays anti-tumour activity by increasing both humoral and cellular immune response [J]., 2010, 87(19/20/21/22): 628-637.
[33] Chen X P, Chen Y, Li S B,. Free radical scavenging ofpolysaccharides and its effect on antioxidant enzymes and immunity activities in cervical carcinoma rats [J]., 2009, 77(2): 389-393.
[34] 潘云霞, 焦卓亚, 彭灿, 等. 灵芝多糖调控抗氧化因子表达抑制乳腺癌恶性表型研究 [J]. 中草药, 2022, 53(23): 7440-7448.
[35] Liu R M, Li Y B, Liang X F,. Structurally related ganoderic acids induce apoptosis in human cervical cancer HeLa cells: Involvement of oxidative stress and antioxidant protective system [J]., 2015, 240: 134-144.
[36] 周桂琴, 赵宏艳, 吕诚, 等. 灵芝多糖对H22肝癌小鼠肠道黏膜免疫功能的影响 [J]. 中国中西医结合杂志, 2009, 29(4): 335-339.
[37] 陈丽华, 肖新宇, 曾惠瑯, 等. 灵芝多糖对甲氨蝶呤诱导的小鼠肠道损伤的保护作用 [J]. 中国临床药理学与治疗学, 2009, 14(10): 1110-1114.
[38] Guo C L, Guo D D, Fang L,.polysaccharide modulates gut microbiota and immune cell function to inhibit inflammation and tumorigenesis in colon [J]., 2021, 267: 118231.
[39] Bao F Y, Yang K Y, Wu C R,. New natural inhibitors of hexokinase 2 (HK2): Steroids from[J]., 2018, 125: 123-129.
[40] Liu G, Wang K, Kuang S,. The natural compound GL22, isolated frommushrooms, suppresses tumor growth by altering lipid metabolism and triggering cell death [J]., 2018, 9(6): 689.
[41] 张文政, 毛许庆, 孙雪妮, 等. 中西医结合分子配伍治疗肿瘤协同增效及逆转耐药的研究进展 [J]. 中国肿瘤临床, 2021, 48(11): 566-570.
[42] 刘聪燕, 刘玉萍, 马益华, 等. 灵薏方有效组分及其配伍的体内外抗肺癌活性 [J]. 中成药, 2016, 38(10): 2248-2252.
[43] 李灿. 灵芝薏苡仁方治疗恶性肿瘤临床观察 [J]. 四川中医, 2015, 33(12): 138-139.
[44] 李宝鸿, 李佳璐, 陈永华, 等. 红灵芝排毒化肿胶囊与红灵芝抗炎消肿散同治乳腺癌35例临床疗效分析 [A] // 国际中医药临床研究学术会议暨全国第二届中医临床研究学术会议论文集[C]. 昆明: 中华中医药学会, 2011: 34-36.
[45] 陈四明, 谢辉, 蒋益兰, 等. 中西医结合治疗晚期肺腺癌32例疗效观察 [J]. 湖南中医杂志, 2011, 27(6): 25-26.
[46] 胡永春, 雷秋模, 潘志欣. 中药治疗乳腺癌化疗后恶心呕吐60例 [J]. 实用中西医结合临床, 2010, 10(3): 60-61.
[47] 刘春娣, 徐一红, 郭李燕. 扶正祛邪方对预防老年子宫内膜癌患者术后复发的效果 [J]. 中国老年学杂志, 2020, 40(14): 2967-2970.
[48] 钱钧, 黄芳芳. 抗肝癌合剂配合肝动脉灌注化疗与栓塞治疗原发性肝癌43例疗效观察 [J]. 云南中医中药杂志, 2007, 28(8): 6-7.
[49] 蒋益兰, 潘博, 仇湘中. 健脾消癌饮配合化疗治疗大肠癌术后40例总结 [J]. 湖南中医杂志, 2001, 17(5): 9-10.
[50] 鲍蕾蕾, 杨帆, 陈海飞, 等. 复方灵芝孢子精油软胶囊抗疲劳增强免疫力作用研究 [J]. 中国药业, 2015, 24(16): 14-16.
[51] 鲍蕾蕾, 苏羽, 陈海飞, 等. 复方灵芝孢子精油软胶囊对S180荷瘤小鼠的抗肿瘤作用研究 [J]. 中国药房, 2013, 24(15): 1351-1353.
[52] 杨庆敏, 王宪庆, 赵艳, 等. 复方灵芝胶囊的抗肿瘤作用研究 [J]. 中国药房, 2012, 23(11): 982-984.
[53] 唐学敏, 吴仲鑫. 灵芝合剂的体内外抗肿瘤作用研究 [J]. 中医杂志, 2013, 54(15): 1323-1326.
[54] Peng B Y, Singh A K, Chan C H,. AGA induces sub-G1 cell cycle arrest and apoptosis in human colon cancer cells through p53-independent/p53-dependent pathway [J]., 2023, 23(1): 1.
[55] Jiang J H, Sliva D. Novel medicinal mushroom blend suppresses growth and invasiveness of human breast cancer cells [J]., 2010, 37(6): 1529-1536.
[56] 井子良, 吴纯宇, 张慧敏, 等. 灵芝孢子油番茄红素复合物的抗肿瘤作用 [J]. 现代食品科技, 2022, 38(9): 46-51.
[57] 张志强, 夏笠, 熊小文, 等. 灵芝三萜组分增强紫杉醇诱导HER2+乳腺癌细胞凋亡的研究 [J]. 福建医科大学学报, 2016, 50(1): 1-5.
[58] Abulizi A, Hu L, Ma A,. Ganoderic acid alleviates chemotherapy-induced fatigue in mice bearing colon tumor [J]., 2021, 42(10): 1703-1713.
[59] 方雅玲, 张玉琴, 吴长辉, 等. 灵芝孢子油、破壁灵芝孢子粉及灵芝孢子提取物对小鼠急性胃溃疡的保护作用[J]. 药物评价研究, 2022, 45(2): 308-313.
Research progress on antitumor effect and compatibility of
ZHANG Wen-jun1, 2, 3, SONG Yang1, HU Yang1, XU Bei-lei1, LIU Ting1, ZHU Ting1, LI Wen-lan1, 2, 3
1. School of pharmacy, Harbin University of Commerce, Harbin 150076, China 2. Engineering Research Center of Ministry of Education of Natural Antitumor Drugs, Harbin 150076, China 3. Heilongjiang Provincial Key Laboratory of Drugs for the Prevention and Treatment of Senile Diseases, Harbin 150076, China
Lingzhi () has the ability to reinforce healthyand consolidate the root, nourishand calm the mind, and prolong life. In modern clinical practice,is often used in combination with several Chinese herbs for antitumor purposes. Recent studies have revealed that the antitumor mechanism ofmainly involves regulation of body immunity, cell cycle arrest, induction of tumor cell apoptosis and autophagy, inhibition of tumor cell metastasis, and anti-oxidation. This paper reviews the molecular mechanisms of the antitumor effects of, and summarizes the application and mechanisms of’s antitumor herbal combinations to provide a reference for the clinical application of.
; antitumor; compatibility; polysaccharide; triterpene; immunomodulatory protein; sterol; polysaccharide peptide
R285
A
0253 - 2670(2023)16 - 5390 - 09
10.7501/j.issn.0253-2670.2023.16.028
2023-03-20
中央支持地方高校改革发展资金人才培养项目;黑龙江省博士后科研启动基金项目(LBH-Q20104);2019年度哈尔滨商业大学“青年创新人才”支持计划(2019CX12)
张文君,女,教授,从事新型药物传输系统研究。Tel: 18746065251 E-mail: wenjun0501@126.com
李文兰,女,从事中药药效物质基础的研究。Tel: (0451)84866056 E-mail: lwldzd@163.com
#共同第一作者:宋 扬,女,硕士研究生,研究方向为新型药物传输系统。E-mail: sy20171717@163.com
[责任编辑 赵慧亮]
