生地黄炭纳米类成分的发现及其对溃疡性结肠炎的治疗作用
2023-08-17赵金莉孔若岚杨盈欣
陈 瑞,赵金莉,孔若岚,周 龙,杨盈欣,孔 慧*,赵 琰*
生地黄炭纳米类成分的发现及其对溃疡性结肠炎的治疗作用
陈 瑞1, 2,赵金莉1,孔若岚1,周 龙1,杨盈欣1,孔 慧1*,赵 琰1*
1. 北京中医药大学中医学院,北京 100029 2. 江西省中西医结合医院 治未病科,江西 南昌 330000
从生地黄炭(dried,DRC)中发现并提取生地黄炭纳米类成分(driednano-components,DRC-NCs),利用2,4,6-三硝基苯磺酸/乙醇溶液诱导的大鼠溃疡性结肠炎(ulcerative colitis,UC)模型评价其治疗作用及可能的作用机制。利用马弗炉高温煅烧生地黄,并经过萃取、滤过、透析得到DRC-NCs。利用透射电子显微镜(transmission electron microscope,TEM)、X射线衍射(X-ray diffraction,XRD)技术、紫外-可见分光光谱、荧光光谱、傅里叶变换红外光谱以及X射线光电子能谱技术等对DRC-NCs进行表征。利用CCK-8细胞毒性试验评价DRC-NCs的安全性。利用大鼠UC模型,通过比较大鼠一般情况、疾病活动指数(disease activity index,DAI)、结肠组织损伤程度、胸腺指数、脾脏指数、结肠组织中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及白细胞介素-6(interleukin-6,IL-6)、IL-10、丙二醛(malondialdehyde,MDA)的水平、髓过氧化物酶(myeloperoxidase,MPO)和超氧化物歧化酶(superoxide dismutase,SOD)的活力,以评价DRC-NCs的治疗作用及其机制。DRC-NCs在TEM下分散度良好,为近球形且粒径大小均一,粒径分布集中在1.1~2.6 nm,晶格间距为0.354 nm,主要由C、N、O等元素构成,表面含有氨基、羟基、羧基等基团。DRC-NCs的细胞毒性很低,安全质量浓度在2 500.00 μg/mL以内。动物实验结果显示,DRC-NCs可以改善UC模型大鼠的一般情况,显著降低模型大鼠的DAI评分,减轻结肠损伤,升高胸腺指数和脾脏指数。DRC-NCs可以降低TNF-α及IL-6的水平、升高IL-10的水平、降低大鼠结肠组织中MDA的水平及MPO的活力、提高SOD的活力。DRC-NCs具有治疗UC的作用,其作用机制可能与降低炎症因子和氧化应激水平,提高抗炎和抗氧化能力有关。这不仅为中药炭药的探索开发提供了一个独特的研究角度,也为临床应用生地黄炭治疗UC提供了实验依据。
生地黄炭;纳米类成分;物质基础;溃疡性结肠炎;炎症因子;氧化应激;表征;纳米材料
溃疡性结肠炎(ulcerative colitis,UC)是一种以腹痛、腹泻、黏液脓血便为主要临床表现的非特异性炎症性肠病,其病理机制涉及炎症因子表达失衡、氧化应激、细胞凋亡、肠黏膜屏障受损等方面[1-4]。UC在我国的发病率呈逐年升高趋势[5],若未能及时有效干预,可能发展成结肠癌,据相关研究记载,结肠癌已经成为我国第2大恶性肿瘤,位居癌症死亡原因的第4位[6],而UC患者发生结肠癌的几率是正常人群的3~5倍[7-8]。因此,必须采取有效的干预措施来预防和治疗UC,以防止其发展。目前,治疗UC的方法虽多,但大多患者经治疗后仍易反复发作,病情迁延,难以治愈[9],氨基水杨酸类药物是目前治疗UC的主流药物,临床上常存在患者不耐受的现象,且易出现皮疹、肝功能不全等不良反应[10]。其次是皮质激素类的药物、免疫抑制剂,临床可见多种不良反应,如高血压及肾脏毒性等[11]。另外,治疗UC还有生物制剂[12],但对于生物制剂的应用与安全性等,还有待更深一步的研究。因此,UC发病机制复杂,发病人数较多,病理危害较大,且目前治疗手段存在一定的局限性,因此,有必要开发一种疗效更佳,不良反应更少的治疗药物。
生地黄是玄参科地黄属植物地黄Libosch.的新鲜或干燥块根[13],始载于《神农本草经》,具体记载为“味甘,寒。主折跌绝筋,伤中,逐血痹,填骨髓,长肌肉,作汤,除寒热积聚,除痹。”生地黄炭(dried,DRC)最早见于叶天士《临证指南医案》[14]中,明清医家在治疗痢疾、下血、肠红等病时多用生地黄炭,如清代王士雄治疗肠红时方中用生地黄炭(3两)治痔血肠红,便血久治不瘳;丁甘仁治疗脾寒肠湿之血痢时,用黄土汤加味,以温运中阳而清湿热,使阳气得以上升,阴血不致下泄,其将方中干地黄易为生地黄炭。现代研究认为[15-16],生地黄炭可以通过影响机体的内、外源性凝血途径,降低纤维蛋白原含量,全血高切、中切、低切黏度以及血浆黏度促进血液凝固而发挥止血作用,且炒炭后因为炭的吸附性,还可增强止血作用。
随着纳米材料学的深入研究,研究者们成功从数十种中草药中提取并制备了碳点,且经过一系列实验研究证实了其良好的生物活性。如焦三仙碳点的降糖作用[17]、黄柏碳点的保肾作用[18]、金银花碳点的抗炎作用[19]、艾叶碳点的抗寒作用[20]、白芍碳点的保肝作用[21]、甘草碳点的抗溃疡作用[22]等。通过大量药效学实验证实,纳米类成分为炭药发挥作用的物质基础[23]。对生地黄的炮制历史梳理总结后发现,生地黄炭的炮制记载以“烧灰”(《太平圣惠方》)、“焖煅”(《圣济总录》)为主,这与中药碳点制备过程极为相似,且生地黄炭临床应用广泛,疗效突出,然而,生地黄炭的物质基础及药理药效研究较少。基于中药碳点的研究,本研究从纳米材料学角度出发,运用纳米技术和方法研究生地黄炭。
本研究发现生地黄炭中存在纳米类成分,并将其提取分离出,命名为生地黄炭纳米类成分(driednano-components,DRC-NCs),利用HPLC法排除生地黄炭中小分子存在的干扰,利用低分辨透射电子显微镜(low resolution transmission electron microscopy,LRTEM)、高分辨透射电子显微镜(high resolution transmission electron microscopy,HRTEM)、X射线衍射(X-ray diffraction,XRD)技术、紫外-可见吸收光谱(UV- Vis)、荧光光谱(fluorescence spectrum,FL)、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)以及X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)技术获取DRC- NCs的形貌特征和成分测定。通过CCK-8细胞实验评价DRC-NCs的安全性,为临床安全用药提供参考。通过观察和比较大鼠UC模型的一般情况、疾病活动指数(disease activity index,DAI)评分、结肠组织病理变化及结肠组织中细胞因子和氧化应激指标的水平,以评价DRC-NCs对UC的治疗作用。
1 仪器与材料
1.1 仪器
T1612型马弗炉,北京中科澳博科技股份有限公司;1260 Infinity型高效液相色谱仪,美国Agilent Technologies公司;Tecnai G220型透射电子显微镜,美国FEI公司;JEN-1230型高分辨透射电子显微镜,日本Electron Optics Laboratory公司;CECIL型紫外可见分光光度计,英国Cambridge公司;F-4500型荧光分光光度计,日本Hitachi公司;JEN-1230型傅里叶变换红外光谱仪,美国Thermo Fisher Scientific公司;D8 Discover X射线衍射仪,美国布鲁克公司;ESCALAB 250Xi X射线光电子能谱仪,美国Thermo公司。
1.2 材料
生地黄,产地河北,批号201222012,经北京中医药大学中医学院赵琰教授鉴定,为玄参科地黄属植物地黄Libosch.的干燥块根,购自北京仟草中药饮片有限公司;柳氮磺胺吡啶肠溶片(salazosulfapyridine,SASP,0.25 g/片),购自上海信谊嘉华药业有限公司;5% 2,4,6-三硝基苯磺酸溶液(2,4,6-trinitrobenzene sulfonic acid solution,TNBS),购自美国Sigma公司;乙醇和其他分析级化学试剂均购于北京化学试剂公司;透析膜(截留相对分子质量1000)购自北京瑞达恒辉科技发展有限公司;大鼠白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-10 EELISA试剂盒,购自武汉云克隆生物科技有限公司;总蛋白(total protein,TP)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、髓过氧化物酶(myeloperoxidase,MPO)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒,购自南京建成生物科技有限公司;本实验用水均为去离子水,由北京中医药大学提供。
1.3 动物与细胞
SD大鼠,雄性,SPF级,体质量(200±20)g,由北京斯贝福生物技术有限公司提供,质量合格证编号为110324211107181812。实验正式开始前,所有动物饲养在同一环境下,环境温度为(24.0±1.0)℃,相对湿度维持在55%~65%,适应性喂养1周,实验期间,动物自由饮食,明暗循环饲养。实验前12 h所有动物禁食不禁水。本实验相关动物实验遵循北京中医药大学有关实验动物管理和使用的规定,均符合3R原则。RAW264.7巨噬细胞购自国家实验细胞资源共享平台。
2 方法与结果
2.1 DRC-NCs的制备
称取500 g生地黄干燥品于干燥洁净的坩埚中,铝箔纸封口并加盖,置于马弗炉中,关好炉门。设定马弗炉烧制程序:第1阶段5 min内升温至70 ℃,并保持25 min;第2阶段30 min内升温至350 ℃,保持1 h,待马弗炉自然冷却后取出。将烧制的生地黄炭粉碎,称取生地黄炭粉末50 g,放于烧杯中,加入30倍去离子水,置于水浴锅中煎煮,温度为100 ℃,时间1 h,共煎煮2次。混合2次水煎液,先用定性滤纸粗滤,然后用0.22 μm的有机系微孔滤膜滤过,浓缩滤液,将浓缩液装入可截留相对分子质量为1000的透析膜中,透析72 h以上。待透析袋外液体透明取出袋内液体,定容为1 g/mL,4 ℃冰箱中保存,备用。
2.2 HPLC分析
HPLC常用来检测中药提取液的小分子成分,这些小分子成分常常被认为是中药发挥作用的物质基础。本实验利用HPLC检测生地黄生药中含有的小分子成分在DRC-NCs中是否依旧存在。色谱条件:色谱柱为Reliasil-C18柱(250 mm×4.6 mm,5 μm);柱温25 ℃;体积流量1.0 mL/min;检测波长334 nm;流动相为乙腈-0.1%乙酸水溶液,梯度洗脱:0~20 min,10%~25%乙腈;20~30 min,25%乙腈;30~45 min,25%~10%乙腈;45~50 min,25%乙腈;进样量10 μL;采集时间50 min。生地黄与DRC-NCs的HPLC图谱如图1所示,可见在生地黄中含有益母草苷、梓醇、毛蕊花糖苷等多种小分子化合物[24-25],成分复杂,而经过炭化、提取、分离得出的DRC-NCs的HPLC图谱为一条直线,说明在DRC-NCs中不含有传统意义上认为的小分子化合物。
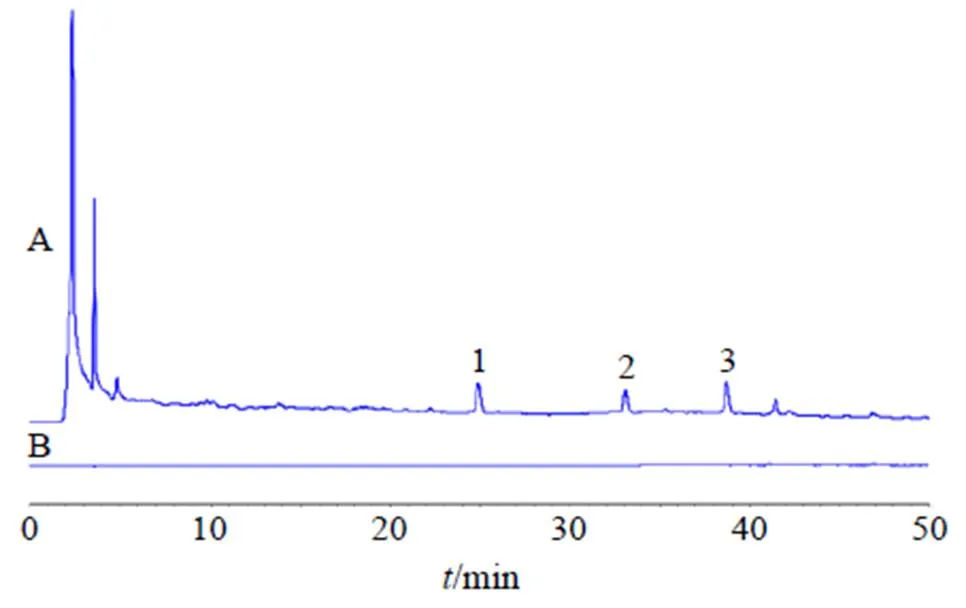
1-梓醇 2-益母草苷 3-毛蕊花糖苷
2.3 DRC-NCs的表征
利用TEM、HRTEM、XRD观察DRC-NCs的外观形态、粒径大小分布、微观结构及晶格间距等特征。图2-A所示为DRC-NCs在50 nm下的粒径分布,分散度良好,外貌形态为近球形,粒径大小均一。图2-B为DRC-NCs的粒径分布图,利用Image J软件对100个颗粒进行统计分析,得出其粒径分布在0.8~3.2 nm,集中在1.1~2.6 nm,平均尺寸在1.75 nm左右。图2-C为DRC-NCs的高倍电镜图,可看到DRC-NCs中存在明显的晶格,其晶格间距为0.354 nm。如2-D所示,测得DRC-NCs的衍射角度2=25.102°。
利用UV-Vis及FL分析DRC-NCs的光学特征。紫外光谱如图2-E所示,DRC-NCs在200~250 nm有吸收峰,推测与DRC-NCs中存在π-π*跃迁有关。DRC-NCs的荧光光谱可知,其最大激发波长为288 nm,在此条件下最大发射波长为449 nm(图2-F)。
利用XPS及FTIR分析DRC-NCs表面官能团信息。红外图谱见图2-G。DRC-NCs的吸收峰在 3 444.28、2 917.93、2 850.01、2 360.79、1 635.06、1 541.52、1 467.89、1 384.34、1 112.55 cm−1,其中3444 cm−1处的吸收峰表示O-H的伸缩振动,2960~2850 cm−1的吸收峰为CH3-和CH2-的伸缩振动;2360 cm−1附近的吸收峰为-NH、-NH2的伸缩振动峰;1650~1560 cm−1的峰为-NH2的伸缩振动峰;1580~1491 cm−1为-NH-的吸收峰;1380 cm−1处的吸收峰为CH3-对称弯曲振动,1150~1070 cm−1附近的峰推测为C-O-C的伸缩振动引起的,可见DRC-NCs的表面含有O-H、CH3-、CH2-、-NH、-NH2、C-O-C等基团。
XPS结果如图3所示,DRC-NCs在284.25、399.17、531.28 eV处有明显的3个峰(图3-A),表明其主要含有C(66.99%)、N(3.74%)、O(28.89%)3种元素。图3-B为C 1s的XPS图谱,峰值在283.86、284.10、285.47、287.42 eV处,分别对应C-C、C=C、C-N/C-O、C=N键。图3-C为O 1s的XPS图谱,530.67、532.01 eV处的峰分别对应C=O、C- OH键。图3-D为N 1s的XPS图谱,峰值在399.12、399.48 eV处,分别对应C-N-C、N-C键[26-28]。
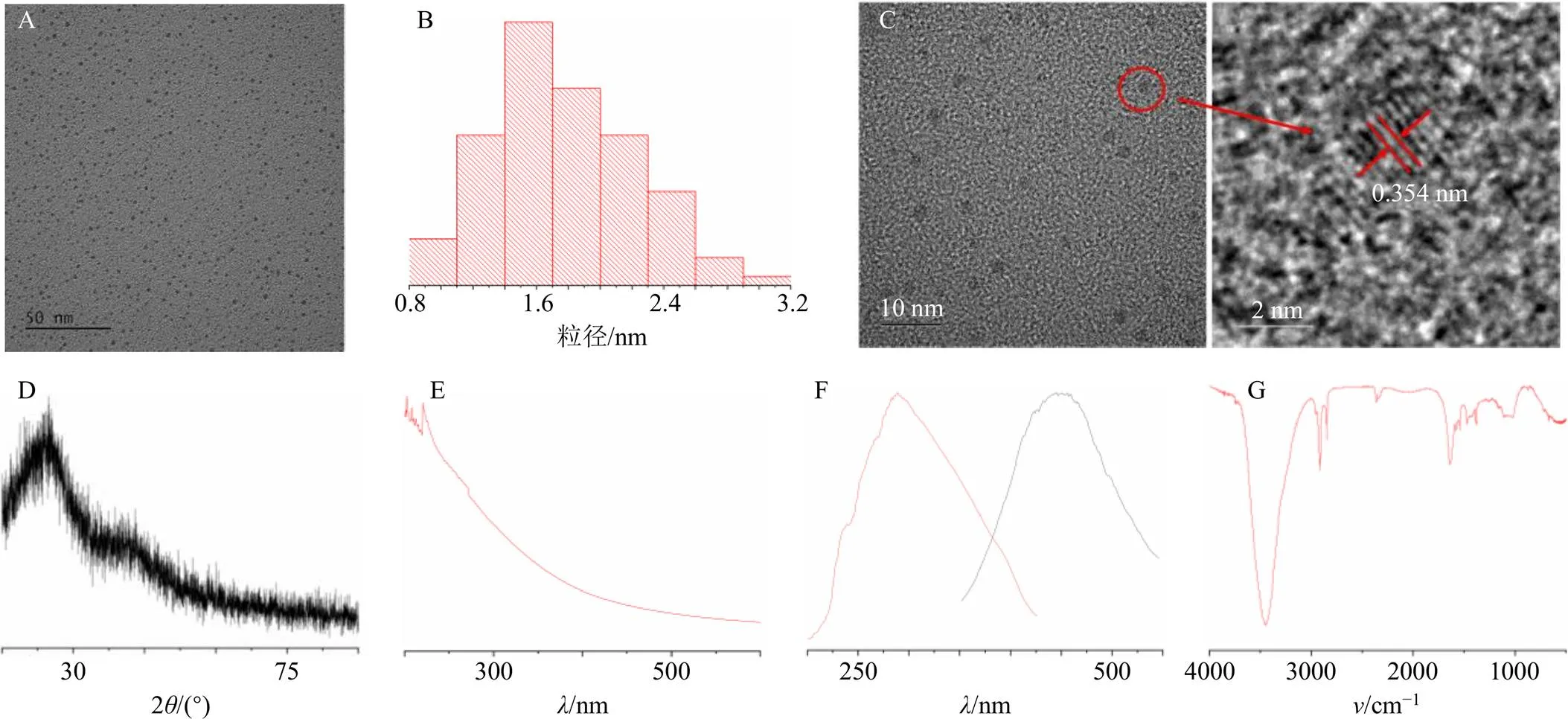
A-TEM图 B-粒径分布图 C-HR-TEM图 D-XRD图谱 E-紫外光谱图 F-荧光光谱图 G-红外光谱图
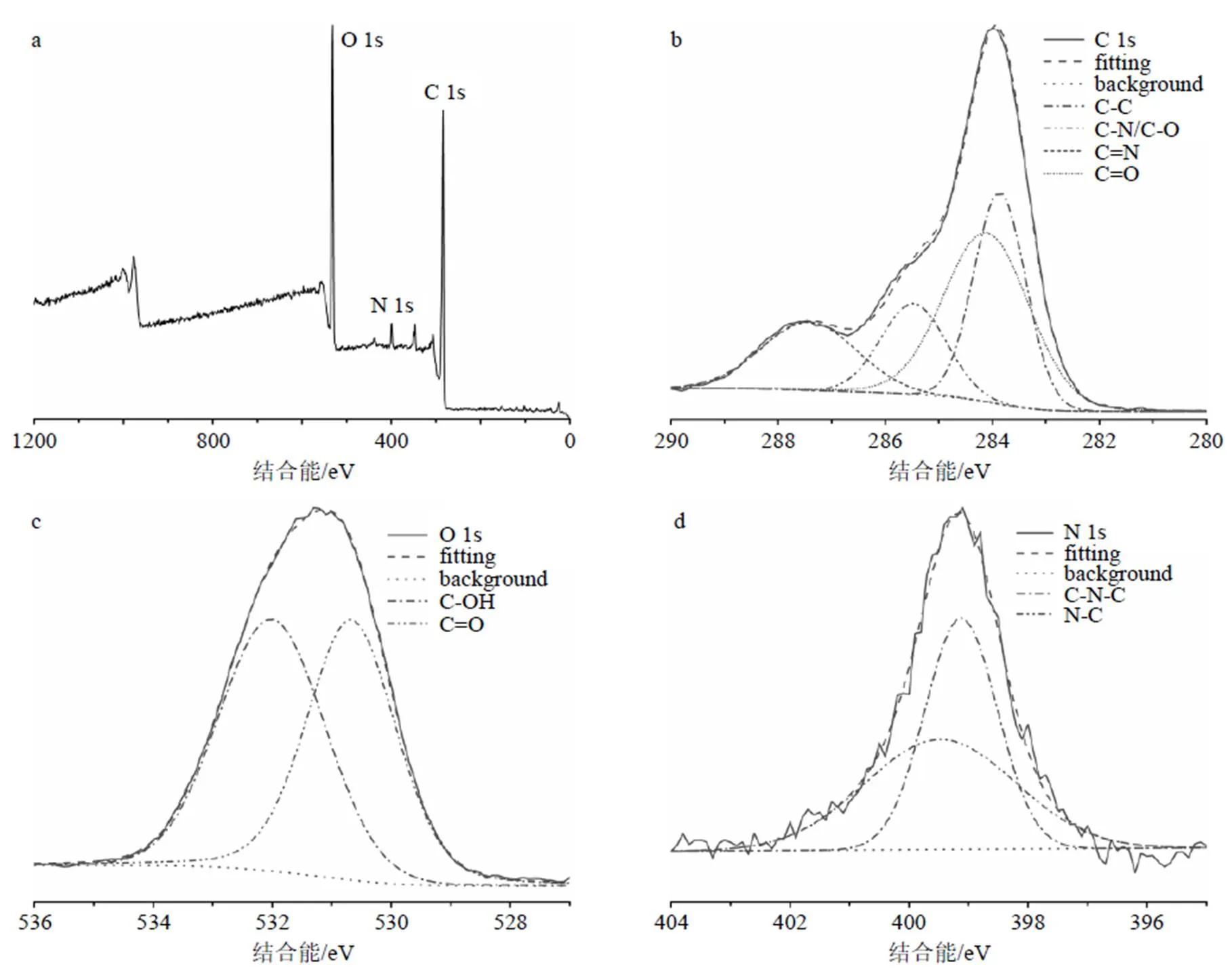
a-DRC-NCs元素峰图 b-碳 c-氧 d-氮
2.4 CCK-8实验
2.4.1 实验设计 吸取RAW264.7细胞悬浮液10 μL,将其平铺到细胞计数板上。计数完成后,将细胞悬浮液稀释成1×105个/mL,然后将其铺在96孔细胞培养板上,边缘加入100 μL/孔的PBS缓冲液,放入条件为5%、37 ℃的培养箱中孵育。培养24 h后,弃去上清液,在对照组中加入细胞培养基,给药组中加入不同质量浓度(10 000.00、5 000.00、2 500.00、1 250.00、625.00、312.50、156.25、78.13、39.06 μg/mL)的DRC-NCs溶液,放入培养箱中孵育24 h。取出细胞培养板,每孔加入10 μL CCK-8试剂(空白组),于培养箱中培养1 h,酶标仪检测波长为450 nm处吸光度()值,计算细胞存活率。
细胞存活率=(e-b)/(c-b)
e、b、c分别表示在450 nm波长下给药组、空白组、对照组的吸光度()
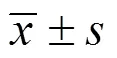
2.4.3 实验结果 从表1可以看出,在DRC-NCs质量浓度为2 500.00 μg/mL时,细胞活力已超过对照组的100%,而当DRC-NCs质量浓度大于2 500.00 μg/mL时DRC-NCs对RAW264.7巨噬细胞的活性有一定的影响,即在大于该质量浓度时DRC-NCs有一定的细胞毒性作用。而在质量浓度低于2 500.00 μg/mL时,DRC-NCs对细胞有一定的促增殖作用。对DRC-NCs进行安全性评价有利于其进一步的开发和利用。
2.5 DRC-NCs对UC的作用
2.5.1 造模及给药 将雄性SD大鼠随机分为6组,分别为空白组、模型组、阳性药组(SASP组,将SASP研碎后,用去离子水配成42 mg/mL的混悬液)及DRC-NCs低、中、高剂量组。空白组以等量0.9%氯化钠溶液灌肠,其余各组参照文献方法[29]制备大鼠的UC模型,大鼠禁食不禁水12 h后,以4%的水合氯醛溶液腹腔注射以麻醉大鼠,将一次性的灌肠硅胶管插入大鼠肛门大约8 cm处,缓慢推入TNBS/乙醇溶液(5% TNBS溶液与50%乙醇溶液等体积配制,现用现配),剂量为3 mL/kg。造模成功后,空白组及模型组给等体积生理盐水;SASP组给SASP混悬液420 mg/kg;DRC-NCs低、中、高剂量组(1、2、4 mg/kg)分别经ig给DRC-NCs溶液0.01 mL/g。每日1次,共给药7 d。末次给药后12 h,禁食不禁水,腹主动脉取血,脱颈处死大鼠,距离肛门2 cm处收集结肠组织,剪取适量结肠组织,用4%多聚甲醛固定,其余结肠组织置于−80 ℃冰箱中保存备用。
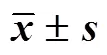
表1 不同质量浓度的DRC-NCs对RAW264.7细胞存活率的影响(, n = 6)
2.5.2 大鼠一般情况与疾病活动指数(disease activity index,DAI) 每日定时称量大鼠体质量并观察其精神状态、饮食、活动、皮毛光泽、大便性状、便血等情况,按照表2进行DAI评分[30]。空白组大鼠精神状态良好,饮食正常,反应灵敏,动作敏捷,毛发干净有光泽,大便正常,垫料干燥且无明显臭味,鼠笼干净。模型组大鼠精神萎靡,饮食量减少,反应迟钝,活动度差,毛发黯淡缺乏光泽,大便稀溏,有时可见肉眼脓血便,垫料湿润且有明显的臭味,鼠笼清洁度差。SASP组及DRC-NCs组大鼠精神状态可,较模型组有很大改善,饮食量增加,活动度增加,毛发逐渐恢复光泽,大便逐渐成形,鼠笼清洁度一般。
各组大鼠的DAI评分如表3所示。给药第1天,各组大鼠的DAI评分大致在同一水平上,给药第2、3天,模型组和DRC-NCs低剂量组的DAI评分呈现缓慢上升的趋势,在第4~7天DAI评分逐渐下降;SASP组、DRC-NCs中、高剂量组从第2天给药起,DAI评分呈下降趋势,至第7天DAI评分明显低于模型组。DRC-NCs可以显著降低模型大鼠的DAI,对UC有一定的治疗作用。
2.5.3 结肠组织病理学观察 结肠组织充分固定后,脱水,石蜡包埋切片,脱蜡后HE染色,用光学显微镜观察结肠组织的溃疡、炎性细胞浸润等病理学特征。各组大鼠结肠组织病理切片如图4所示。空白组大鼠结肠黏膜结构完整,黏膜细胞排列整齐,未见有炎性细胞浸润。模型组大鼠结肠黏膜增厚,黏膜不完整,细胞排列不规则,有大量红细胞及炎性细胞浸润,肌层增厚。SASP组大肠黏膜不完整,细胞排列稀疏,有少量红细胞及炎性细胞浸润。DRC- NCs低剂量组大鼠结肠黏膜增厚,细胞排列不规则,细胞间有炎性细胞及少量红细胞浸润。DRC-NCs中剂量组大鼠结肠黏膜增厚,黏膜上皮较为完整,腺体排列较为规则,炎性细胞浸润明显减少。DRC-NCs高剂量组大鼠结肠黏膜结构基本正常,稍有增厚,细胞排列较为整齐,炎性细胞浸润明显减少。
表2 DAI评分标准
Table 2 DAI scoring criteria
得分体质量下降率大便性状便血情况 0<1%正常(成形)阴形 1[1%,5%)介于两者之间介于两者之间 2[5%,10%)松散,呈糊状,半成形隐血 3[10%,15%)介于两者之间介于两者之间 4≥15%稀水样血便
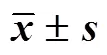
表3 DRC-NCs对UC大鼠DAI评分的影响(, n = 8)
与空白组比较:##<0.01;与模型组比较:*<0.05**<0.01,表5、6同
##< 0.01control group;*< 0.05**< 0.01model group, same as tables 5 and 6
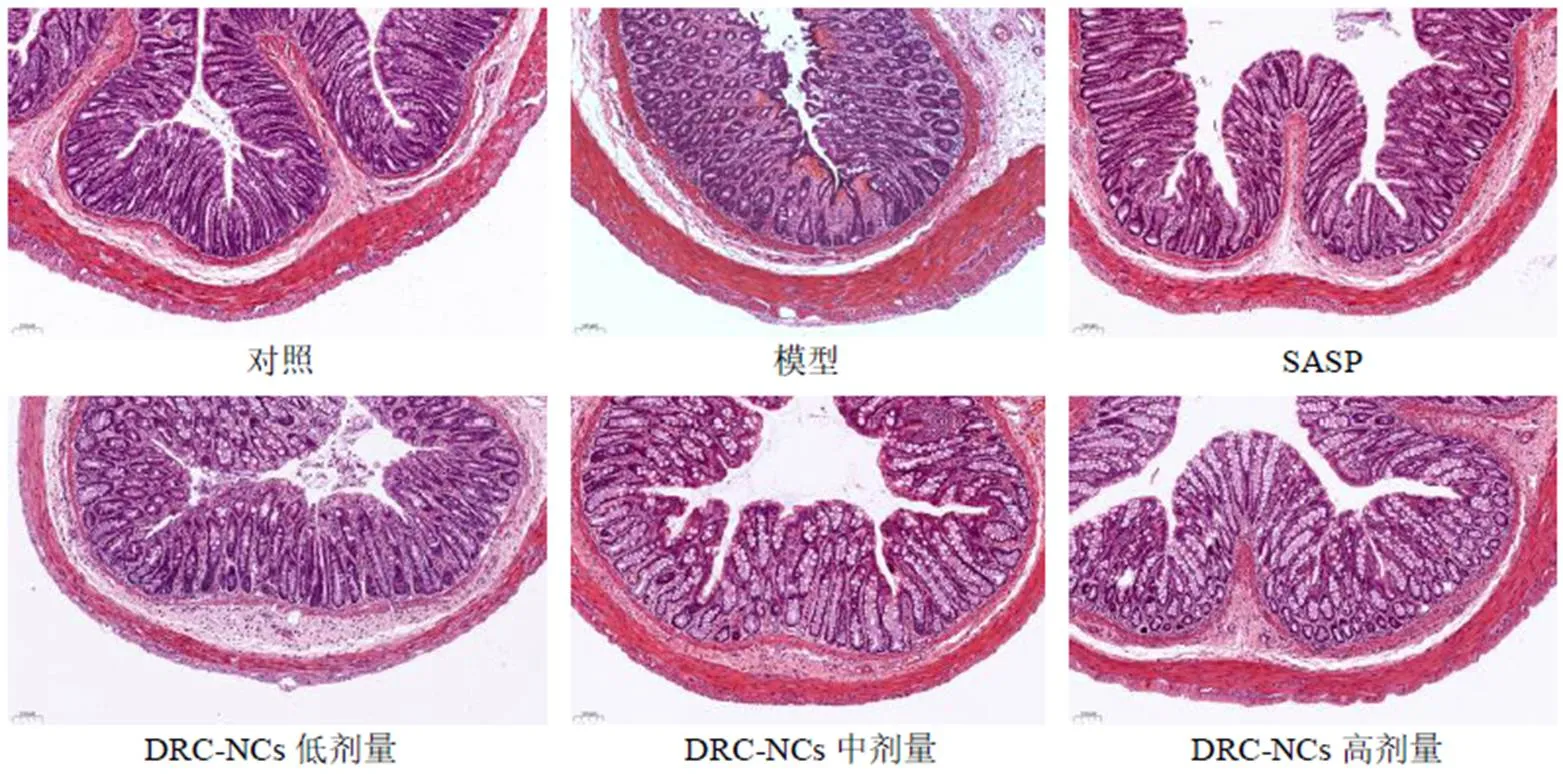
图4 DRC-NCs对UC大鼠结肠组织病理改变的影响(×100)
2.5.4 胸腺指数、脾脏指数计算 免疫因素在UC的发病中占有重要的作用,脾脏和胸腺作为重要的免疫器官,测定胸腺指数和脾脏指数可以了解到机体的免疫情况。
胸腺指数=胸腺质量/大鼠体质量
脾脏指数=脾脏质量/大鼠体质量
模型大鼠的胸腺指数、脾脏指数如表4所示。与空白组相比,模型组的胸腺指数和脾脏指数均降低,提示TNBS/乙醇溶液造的UC模型对大鼠的免疫系统有一定的抑制作用。与模型组相比,SASP组(>0.05)与DRC-NCs组(<0.01)胸腺指数均升高;SASP组及DRC-NCs低、中、高剂量组脾脏指数均能明显升高(<0.05、0.01),提示SASP与DRC- NCs对模型大鼠的免疫系统有一定的干预作用。
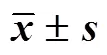
表4 DRC-NCs对UC大鼠胸腺指数、脾脏指数的影响(, n = 8)
2.5.5 结肠组织中细胞因子水平 用ELISA法测定各组大鼠结肠组织中TNF-α、IL-6、IL-10的水平。各组大鼠结肠组织中TNF-α、IL-6、IL-10的水平如表5所示。与空白组相比,模型组大鼠结肠组织中TNF-α、IL-6的水平升高(<0.01);与模型组相比,SASP组、DRC-NCs低、中、高剂量组大鼠结肠组织中TNF-α、IL-6的水平均降低(<0.05、0.01)。模型组大鼠结肠组织中IL-10的水平较空白组降低(<0.01);与模型组相比,SASP组、DRC-NCs中、高剂量组大鼠结肠组织中IL-10的水平均升高(<0.01),DRC-NCs低剂量组升高不明显(>0.05)。综上,SASP和DRC-NCs可以降低UC大鼠结肠组织中TNF-α、IL-6的水平,升高IL-10的水平,且尤以DRC-NCs中剂量组效果最佳。
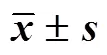
表5 DRC-NCs对UC大鼠结肠组织中TNF-α、IL-6、IL-10水平的影响(, n = 8)
2.5.6 抗氧化水平 精准称取大鼠结肠组织的质量,在冰水浴中按照组织质量-生理盐水体积(1∶9)的比例制备组织匀浆液,并用高速冷冻离心机(3000 r/min,离心半径7.75 cm)离心10 min,取上清液按照试剂盒的说明,测定SOD活力、MDA的含量及MPO活力。各组大鼠结肠组织中SOD活力、MDA含量及MPO活力如表6所示。与空白组相比,模型组大鼠结肠组织中SOD的活力明显降低(<0.01);与模型组相比,SASP组及DRC-NCs中、高剂量组大鼠结肠组织中SOD的活力均升高(<0.01),DRC-NCs低剂量组与模型组无差异。模型组大鼠结肠组织中MDA含量和MPO活力较空白组显著升高(<0.01);与模型组相比,SASP组及DRC-NCs中、高剂量组大鼠结肠组织中MDA含量和MPO活力均降低(<0.05、0.01),DRC-NCs低剂量组MPO活性明显降低(<0.01)。可见,DRC-NCs在一定程度上可以降低UC大鼠结肠组织中MDA含量和MPO活力,提高SOD活力,减轻氧化应激对结肠组织的损伤。
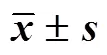
表6 DRC-NCs对UC大鼠结肠组织中SOD、MDA、MPO水平的影响(, n = 8)
3 讨论
本实验借助纳米技术,首次发现生地黄炭中含有纳米类成分,进一步对其表征发现,DRC-NCs分散度良好,为近球形且粒径大小均一,粒径分布集中在1.1~2.6 nm,晶格间距为0.354 nm,具有紫外和荧光光学特性,主要由C、N、O等元素构成,表面可能含有氨基、羟基、羧基等基团,这些基团可能与DRC-NCs发挥药效活性有着密切的关系。
HPLC结果表明,排除了小分子物质的干扰。细胞毒性实验结果显示,DRC-NCs的细胞毒性很低,安全质量浓度在2 500.00 μg/mL以内。UC动物模型实验结果表明,DRC-NCs可以改善大鼠的一般情况并显著降低DAI评分,提高胸腺指数及脾脏指数,减轻结肠损伤,表明DRC-NCs对UC具有一定的治疗作用。
炎症反应常能诱发或加重UC。IL-6是参与炎症反应的主要细胞因子,在机体受炎症刺激后大量分泌,IL-6过度表达能够增加肠上皮细胞通透性,加重肠道的炎症反应,研究发现UC活动期患者的IL-6水平明显增加,且与病情严重程度呈正相关,经过治疗症状好转后,其水平将会下降[31-33],但仍然超出正常范围[34]。
TNF-α可促进血小板活化因子的释放,从而生成白三烯和氧自由基,并诱导合成NO,加重肠黏膜的损伤,诱导肠道上皮细胞凋亡[35-36],此外,可以引起中性粒细胞聚集,刺激淋巴细胞,使得IL-8等炎症因子表达增加[37],加重结肠黏膜组织的炎症浸润。研究发现未经治疗的UC患者TNF-α基因的表达较正常对照组明显增加[38]。IL-10是抗炎性细胞因子,其含量的减少可加重促炎性细胞因子对肠黏膜的损害,使得肠黏膜局部免疫功能紊乱,肠道功能失调而发生炎症和毒性反应[39]。研究表明UC患者活动期体内的IL-10水平明显低于正常水平,且随着病情的加重而减少[40-41],而缓解期IL-10的含量开始升高,因此,IL-10可以作为判断UC病情及预后的关键指标之一[42]。本实验结果表明DRC-NCs对炎性细胞因子的水平有一定的影响,可以下调促炎细胞因子TNF-α及IL-6的水平,且上调抗炎细胞因子IL-10的水平,调整促炎因子和抑炎因子间的平衡,从而减轻结肠损伤。
过度的氧化应激是UC又一重要发病因素。MDA含量通常反映体内氧化应激的程度,当体内的氧自由基含量过高时,引起细胞膜上的不饱和脂肪酸脂质过氧化,产生大量MDA等过氧化产物,引起细胞损伤[43-44]。研究显示UC患者血清中MDA含量明显升高[45-46]。SOD作为体内重要的自由基清除剂[47],其活性水平常受MDA等过氧化产物的含量的影响,当机体产生大量氧自由基后,SOD大量消耗,活性水平降低,因此,结肠组织的损伤程度可通过检测MDA含量和SOD活性水平判断[48]。MPO是髓细胞的特异性标志物,主要存在于中性粒细胞中,少部分存在于单核细胞和巨噬细胞中,是中性粒细胞的衍生蛋白,当机体受到感染或者炎症刺激时,中性粒细胞及巨噬细胞就会释放出大量的MPO,使机体的炎症反应增强。因此,MPO的活性可以反映中性粒细胞在组织的浸润程度[49],间接反映机体的炎症水平。此外,MPO可产生氧自由基,加重对组织的损伤[50]。本研究显示,DRC-NCs可以降低大鼠结肠组织中MDA的含量及MPO的活力,提高SOD的活力,以增强机体的抗氧化能力,减轻氧化应激对结肠组织的损伤从而治疗UC。
本研究首次利用高温热解法从生地黄炭中提取出新型纳米类成分DRC-NCs,并且发现DRC-NCs对UC具有良好的治疗作用,其作用机制可能是通过调节免疫及缓解炎症和氧化应激反应,减轻结肠损伤程度而发挥治疗作用。本研究为UC的治疗提供了实验依据,为中药的开发利用提供了全新的探索模式。
利益冲突 所有作者均声明不存在利益冲突
[1] 王少鑫, 浦江, 刘超群, 等. 炎症因子TNF-α、IL-6和IL-4在溃疡性结肠炎中的表达及临床意义 [J]. 胃肠病学和肝病学杂志, 2015, 24(1): 104-106.
[2] 马旭冉, 王彦礼, 邹迪新, 等. 黄芩汤调控Nrf2通路对溃疡性结肠炎大鼠氧化应激作用的影响 [J]. 药学学报, 2019, 54(4): 653-659.
[3] 屈冬冬, 金世禄. 溃疡性结肠炎发病机制研究进展 [J]. 实用临床医药杂志, 2016, 20(3): 184-187.
[4] 陈璐, 周中银. 溃疡性结肠炎发病机制的研究进展 [J]. 疑难病杂志, 2016, 15(6): 650-654.
[5] Kato S, Ishibashi A, Kani K,. Optimized management of ulcerative proctitis: When and how to use mesalazine suppository [J]., 2018, 97(1): 59-63.
[6] Zheng R S, Zhang S W, Zeng H M,. Cancer incidence and mortality in China, 2016 [J]., 2022, 2(1): 1-9.
[7] Linson E A, Hanauer S B. Epidemiology of colorectal cancer in inflammatory bowel disease - the evolving landscape [J]., 2021, 23(9): 16.
[8] Bopanna S, Ananthakrishnan A N, Kedia S,. Risk of colorectal cancer in Asian patients with ulcerative colitis: A systematic review and meta-analysis [J]., 2017, 2(4): 269-276.
[9] Zeina T, Gandhi S, Mittal A,. Predictors and etiologies of clinical relapse among patients with ulcerative colitis in deep remission [J]., 2023, doi: 10.1097/MCG.0000000000001834.
[10] 刘西洋, 梅浙川. 溃疡性结肠炎发病机制及治疗研究进展 [J]. 实用中医药杂志, 2018, 34(7): 885-887.
[11] 迟伟男, 刘哲鹏. 抗溃疡性结肠炎治疗药物的研究进展 [J]. 医学综述, 2019, 25(4): 742-747.
[12] 李瑾, 李志军, 李明松. 生物制剂在急性重症溃疡性结肠炎中的临床应用 [J]. 中国临床医生杂志, 2021, 49(3): 263-265.
[13] 中国药典[S].一部. 2020: 129.
[14] 清·叶天士. 临证指南医案 [M]. 北京: 中国中医药出版社, 2008: 499.
[15] 高军, 孙浩. 孙浩教授治疗小儿原发性血小板减少性紫癜的经验 [J]. 中国中西医结合儿科学, 2012, 4(5): 414-416.
[16] 李娴, 卫向龙, 秦卫卫. 生地炭对外感热毒出血模型大鼠的影响 [J]. 中华中医药学刊, 2017, 35(3): 534-537.
[17] Sun Z W, Lu F, Cheng J J,. Hypoglycemic bioactivity of novel eco-friendly carbon dots derived from traditional Chinese medicine [J]., 2018, 14(12): 2146-2155.
[18] Zhang M L, Cheng J J, Sun Z W,. Protective effects of carbon dots derived fromagainstvenom-induced acute kidney injury [J]., 2019, 14(1): 377.
[19] Wu J S, Zhang M L, Cheng J J,. Effect of-derived carbon dots on rat models of fever and hypothermia induced by lipopolysaccharide [J]., 2020, 15: 4139-4149.
[20] Kong H, Zhao Y S, Cao P,. The bioactivity of-derived carbon dots: Antiallergic effect [J]., 2021, 17(12): 2485-2494.
[21] Zhao Y S, Zhang Y, Kong H,. Carbon dots from: Hepatoprotective effect [J]., 2020, 15: 9049-9059.
[22] Liu Y H, Zhang M L, Cheng J J,. Novel carbon dots derived frometand their anti-gastric ulcer effect [J]., 2021, 26(6): 1512.
[23] 赵玉升, 屈会化, 赵琰. 炭药纳米类成分的药理作用研究进展 [J]. 中草药, 2022, 53(3): 921-929.
[24] 李惠, 侴桂新, 王峥涛, 等. HPLC测定地黄中麦角甾苷的含量 [J]. 中国中药杂志, 2006, 31(10): 822-824.
[25] 黄莉婷, 孙少平, 郑颖. 生地黄中梓醇和毛蕊花糖苷的HPLC测定及提取工艺优化 [J]. 中药材, 2012, 35(8): 1318-1322.
[26] Liu J J, Lu S Y, Tang Q L,. One-step hydrothermal synthesis of photoluminescent carbon nanodots with selective antibacterial activity against[J]., 2017, 9(21): 7135-7142.
[27] Zhang R Z, Chen W. Nitrogen-doped carbon quantum dots: Facile synthesis and application as a turn-off fluorescent probe for detection of Hg2+ions [J]., 2014, 55: 83-90.
[28] Li Y, Li S, Wang Y M,. Electrochemical synthesis of phosphorus-doped graphene quantum dots for free radical scavenging [J]., 2017, 19(18): 11631-11638.
[29] Hu L H, Liu J Y, Yin J B. Eriodictyol attenuates TNBS-induced ulcerative colitis through repressing TLR4/NF-kB signaling pathway in rats [J]., 2021, 37(9): 812-818.
[30] Kang X H, Jia M D, Zhao L Q,. Bu-Zhong-Yi-Qi Granule enhances colonic tight junction integrity via TLR4/NF-κ B/MLCK signaling pathway in ulcerative colitis rats [J]., 2021, 2021: 6657141.
[31] 张宇翔, 张凯亚. 溃疡性结肠炎患者炎症黏膜中PCT、IL-6、IL-23水平的表达及临床意义 [J]. 中国老年学杂志, 2017, 37(14): 3537-3538.
[32] 陈亮, 景姗, 孙蓓, 等. 健脾化瘀解毒中药复方对溃疡性结肠炎患者血清细胞因子EGF、TGF-β1及TNF-α的影响 [J]. 天津中医药大学学报, 2017, 36(5): 352-355.
[33] Drastich P, Frolova-Brizova L, Zanvit P,. SpontaneousIL-6 production in various intestinal segments in patients with inflammatory bowel disease [J]., 2011, 56(3): 185-190.
[34] Daig R. Human intestinal epithelial cells secrete interleukin-1 receptor antagonist and interleukin-8 but not interleukin-1 or interleukin-6 [J]., 2000, 46(3): 350-358.
[35] 易蕊, 常娟, 刘晓艳, 等. TNF-α、IL-6及IL-8在不同程度溃疡性结肠炎患者血清中的表达及意义 [J]. 现代生物医学进展, 2015, 15(14): 2641-2644.
[36] 黄志刚, 刘有理, 俞善春. 美沙拉嗪联合双岐杆菌三联活菌治疗溃疡性结肠炎的疗效及对氧化应激、炎症因子的影响 [J]. 海南医学院学报, 2016, 22(6): 545-547.
[37] 任韩雯婧, 张川, 乐涛, 等. ICU重症肺部感染患者血清IL-6、IL-1β、IL-8和TNF-α水平变化及其与预后的关系 [J]. 热带医学杂志, 2022, 22(10): 1371-1375.
[38] Olsen T, Goll R, Cui G L,. Tissue levels of tumor necrosis factor-alpha correlates with grade of inflammation in untreated ulcerative colitis [J]., 2007, 42(11): 1312-1320.
[39] 刘凯, 熊晶晶, 刘梅, 等. 酪酸梭菌、美沙拉嗪、蒙脱石散对溃疡性结肠炎大鼠血IL-6、IL-8、IL-10及TNF-α水平的影响 [J]. 免疫学杂志, 2015, 31(11): 931-936.
[40] D'Incà R, Barollo M, Scarpa M,. Rectal administration ofDG modifies flora composition and Toll-like receptor expression in colonic mucosa of patients with mild ulcerative colitis [J]., 2011, 56(4): 1178-1187.
[41] 王建云, 江海燕, 刘果, 等. 解毒活血方灌肠对溃疡性结肠炎小鼠TLR4相关通路蛋白及炎症因子表达的影响 [J]. 中国中西医结合杂志, 2021, 41(8): 944-950.
[42] 沈凤, 李德中. IL-10基因多态性与溃疡性结肠炎易感性的关系及对临床预后的影响 [J]. 中国免疫学杂志, 2016, 32(9): 1369-1373.
[43] Zampeli V A, Lippert U, Nikolakis G,. Disseminated refractory pyoderma gangraenosum during an ulcerative colitis flare. Treatment with infliximab [J]., 2015, 9(3): 62-66.
[44] Deng Q J, Deng D J, Che J,. Hypothalamic paraventricular nucleus stimulation reduces intestinal injury in rats with ulcerative colitis [J]., 2016, 22(14): 3769-3776.
[45] 张晓晨. 溃疡性结肠炎患者血清NO、MDA及LPO水平与病情的相关分析 [D]. 唐山: 华北理工大学, 2021.
[46] Moeser A, Pletz M W, Hagel S,. Lung disease and ulcerative colitis: Mesalazine-induced bronchiolitis obliterans with organizing pneumonia or pulmonary manifestation of inflammatory bowel disease? [J]., 2015, 53(9): 1091-1098.
[47] 安丽婷, 霍丽娟, 师永盛. 美沙拉嗪颗粒联合双歧三联活菌胶囊对溃疡性结肠炎患者血清SOD、MDA的影响 [J]. 山西医科大学学报, 2011, 42(5): 416-419.
[48] Ballal S A, Veiga P, Fenn K,. Host lysozyme- mediated lysis offacilitates delivery of colitis-attenuating superoxide dismutase to inflamed colons [J]., 2015, 112(25): 7803-7808.
[49] Sarlos P, Kovesdi E, Magyari L,. Genetic update on inflammatory factors in ulcerative colitis: Review of the current literature [J]., 2014, 5(3): 304-321.
[50] 关丽华, 龚玉芳, 张弘, 等. 结肠康对恶唑酮诱导小鼠溃疡性结肠炎MPO、NO、iNOS的影响 [J]. 中成药, 2013, 35(4): 669-673.
Discovery of driednano-components and their therapeutic effect on ulcerative colitis
CHEN Rui1, 2, ZHAO Jin-li1, KONG Ruo-lan1, ZHOU Long1, YANG Ying-xin1, KONG Hui1, ZHAO Yan1
1. School of Traditional Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China 2. Department of Preventive Treatment of Disease, Jiangxi Hospital of Integrated Traditional Chinese and Western Medicine, Nanchang 330000, China
To discover and extract driednano-components (DRC-NCs) from dried(DRC), and evaluate its therapeutic effect and possible mechanism in rats with ulcerative colitis (UC) induced by 2,4,6-trinitrobenzene sulfonic acid/ethanol solutionts.The driedwas calcined in a muffle furnace at a high temperature to obtain DRC, which was extracted, filtered and dialyzed to obtain DRC-NCs. Transmission electron microscopy, X-ray diffraction, UV-Vis spectroscopy, fluorescence spectrum, Fourier transform infrared spectroscopy and X-ray photoelectron spectroscopy were used to characterize DRC-NCs, and CCK-8 cytotoxicity assay was used to evaluate the safety of DRC-NCs. According to the rat with UC model, the general condition, disease activity index (DAI), colon tissue injury degree, thymus index, spleen index, the content of tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), IL-10, malondialdehyde (MDA), and the activity of myeloperoxidase (MPO), and superoxide dismutase (SOD) in the colon tissues of rats were compared to evaluate the therapeutic effect of DRC-NCs and its mechanism.DRC-NCs were well dispersed under TEM, nearly spherical appearance with uniform particle size, with a particle size distribution concentrated at 1.1—2.6 nm and a lattice spacing of 0.354 nm, mainly composed of elements such as C, N and O, and the surface contained amino, hydroxyl and carboxyl groups. DRC-NCs had low cytotoxicity and the safe mass concentration was within 2 500.00 μg/mL. Results of animal experiments showed that DRC-NCs could improve the general condition of model rats, significantly reduce DAI score, alleviate colon injury, and increase thymus index and spleen index. DRC-NCs could decrease the contents of TNF-α and IL-6, increase the content of IL-10, decrease the content of MDA and the activity of MPO in colon tissue, and increase the activity of SOD.DRC-NCs had a certain therapeutic effect on UC, and its mechanism may be related to reducing the levels of inflammatory factors and oxidative stress, and improving the anti-inflammatory and antioxidant capacity. This research not only provides a unique research angle for the exploration and development of Chinese herbal charcoal drugs, but also provides an experimental basis for the clinical application of DRC in the treatment of UC.
dried; nano-components; material basis; ulcerative colitis; inflammatory cytokines; oxidative stress; characterization; nanomaterials
R283.6
A
0253 - 2670(2023)16 - 5172 - 10
10.7501/j.issn.0253-2670.2023.16.006
2023-02-17
中央高校基本科研业务费专项基金资助项目(2019-JYB-TD-001)
陈 瑞,女,硕士研究生,研究方向为经典方剂的配伍与应用。E-mail: rchen3219@163.com
孔 慧(1976—),女,硕士生导师,副研究员,研究方向为中药炭药物质基础研究。Tel: (010)64286705 E-mail: doris7629@126.com
赵 琰(1973—),女,博士生导师,教授,研究方向为经典方剂的配伍与应用及中药炭药的物质基础研究。Tel: (010)64286705 E-mail: zhaoyandr@bucm.edu.cn
[责任编辑 郑礼胜]
