灰毡毛忍冬MADS-box家族基因SVP克隆及表达分析
2023-08-17龙丽君刘思思曾慧杰李昌珠马英姿李依民
龙丽君,刘思思,曾慧杰,李昌珠,张 岗,马英姿,李依民*
灰毡毛忍冬家族基因克隆及表达分析
龙丽君1, 2,刘思思2,曾慧杰2,李昌珠2,张 岗3, 4,马英姿1*,李依民3, 4*
1. 中南林业科技大学生命科学与技术学院,湖南 长沙 410004 2. 湖南省林业科学院省部共建木本油料资源利用国家重点实验室,湖南 长沙 410004 3. 陕西中医药大学陕西省中医药管理局“秦药”研发重点实验室,陕西 西安 712046 4. 陕西中医药大学省部共建特色秦药资源研究开发国家重点实验室(培育),陕西 咸阳 712083
克隆获得灰毡毛忍冬家族基因(),并对其进行生物信息学、时空表达特异性和蛋白原核表达等特性分析。根据灰毡毛忍冬转录组数据设计特异性引物,通过PCR技术克隆基因全长;运用生物信息学方法分析其编码蛋白的序列特征;利用实时荧光定量技术(reverse-transcription polymerase chain reaction,qRT-PCR)分别检测该基因在灰毡毛忍冬2个品种“龙花”和“金翠蕾”叶片、花早期和晚期中的表达水平;最后构建pTOPO-D1-LmSVP原核表达载体,转化至大肠杆菌BL21(DE3)中进行蛋白表达。基因全长1472 bp,开放阅读框(open reading frame,ORF)长720 bp,编码239个氨基酸,蛋白质相对分子质量为26 712.63。进化树分析表明,LmSVP蛋白与中华猕猴桃、小粒咖啡的SVP蛋白亲缘关系最近。qRT-PCR结果显示,基因在“龙花”和“金翠蕾”品种中的表达均存在组织特异性表达,其在叶中的表达量显著高于花中;而在花发育不同时期,基因表达量没有明显差异。在大肠杆菌中成功表达出蛋白,蛋白表达结果显示其相对分子质量约为26 710,与预测相符合。通过对基因的全长克隆、序列分析和表达特性鉴定,为进一步研究该基因在调控花蕾型灰毡毛忍冬蕾期长及花冠不开放的功能提供实验基础。
灰毡毛忍冬;;;基因克隆;表达分析;原核表达
灰毡毛忍冬Hand.- Mazz.为忍冬科(Caprifoliaceae)忍冬属L.多年生常绿藤本或灌木,是中国传统中药“山银花”的主要基原植物之一,其药用部位为干燥花蕾及初开的花,具有很高的药用价值和经济价值。其味甘、性寒,具有解热抗毒、疏风散热之功效,多用于治疗热毒血病、风热感冒、温病发热等主要病症[1]。灰毡毛忍冬主要有效成分为绿原酸类化合物,且总绿原酸含量以花蕾期最高,其量随着花冠展开而降低[2-3]。普通灰毡毛忍冬花冠展开、蕾期短,不利于药材采摘,很大程度上降低了其产量和品质[4];但近年来选育出的花蕾型灰毡毛忍冬新品种“金翠蕾”“银翠蕾”和“龙花”等,其花期花冠一直不展开,花蕾整齐均呈棒状,花期长达15~25 d,其优良性状更有利于实际生产[5-6]。为更好地指导实际生产,花蕾型灰毡毛忍冬蕾期长、花冠不展开现象背后的原因亟待研究。
基因在植物花器官发育、调控开花时间等方面有着十分重要的作用[7]。属于基因家族的()基因为开花抑制基因,最早从拟南芥的早花突变体中鉴别出来[8],在大多数双子叶植物中起到调控开花时间和花序发育的作用[9]。同源基因广泛存在于各种植物中,但其所具备的功能可能因物种而异。目前,研究人员已从蝴蝶兰H. G. Reichenbach.[10]、梅花(L.) Link.[11]、中国水仙subsp.(M. Roem.) Masamura & Yanagih.[12]以及细叶百合DC[13]等多种植物中克隆得到同源基因,并证实其在拟南芥中过表达能延迟开花以及参与花序形态结构和花器官发育等生命活动的调控[8],但尚未见基因克隆的相关报道,对其在灰毡毛忍冬开花诱导等花器官发育过程中的功能也尚不清楚。
鉴于基因在植物开花及花器官发育过程中的重要作用,本研究利用前期获得的灰毡毛忍冬转录组测序数据,筛选出基因,根据其序列设计特异性引物,利用实时荧光定量技术(reverse-transcription polymerase chain reaction,qRT-PCR)技术,克隆基因全长,对其进行生物信息学分析。并分析了该基因在灰毡毛忍冬“龙花”和“金翠蕾”品种不同组织、花不同发育时期的相对表达量,构建原核表达载体并转入大肠杆菌BL21(DE3)进行表达,初步了解了该基因的相关特性。以期为研究基因在花蕾型灰毡毛忍冬花器官发育中的功能提供理论依据,为进一步研究花蕾型灰毡毛忍冬蕾期长、花冠不展开的分子机制奠定基础。
1 材料与试剂
1.1 材料
所用植物材料采自湖南省林业科学院试验林场,经湖南省林业科学院王晓明研究员鉴定为灰毡毛忍冬Hand. - Mazz.的“龙花”和“金翠蕾”品种。随机选择3株生长健壮、无病虫害的植株,采集灰毡毛忍冬“龙花”和“金翠蕾”的早晚期花蕾和幼嫩叶片,液氮速冻,保存于−80 ℃超低温冰箱备用。
1.2 主要试剂
EASYspin Plus多糖多酚复杂植物RNA快速提取试剂盒、琼脂糖凝胶纯化回收试剂盒、Zero Background pTOPO-TA/Blunt Simple Cloning Kit、pTOPO-D1 Directional Expression Kit、DL2000 Plus DNA Marker、6×DNA Loading Buffer等均购自北京艾德莱生物科技有限公司,HiScript III 1st Strand cDNA Synthesis Kit(+gDNA wiper)、Phanta Max Super-Fidelity DNA Polymerase等均购自南京诺唯赞生物科技股份有限公司,大肠杆菌菌株DH5α感受态细胞、BL21(DE3)感受态细胞、蛋白Marker等均购自北京全式金生物技术有限公司,异丙基- β--硫代半乳糖苷(IPTG)、5×蛋白上样缓冲液、新型考马斯亮蓝快速染色液、SDS-PAGE凝胶制备试剂盒等均购自北京酷莱搏科技有限公司。引物由湖南擎科生物技术有限公司合成,序列见表1。
表1 引物序列
Table 1 Primer sequences
引物名称序列(5’-3’)产物长度/bp引物用途 LmSVP-FGCGGTACGTGATGCTCTTGATACA1472cDNA全长克隆 LmSVP-RATGGCTTACACTCGTTAGAGAAGGC LmSVP-qFCCTTCCCTCACCTCACCTTACCT127qRT-PCR LmSVP-qRTGTCACTTGCCTTGCCGTTATGT 18S-FCTTCGGGATCGGAGTAATGA118内参基因 18S-RGCGGAGTCCTAGAAGCAACA LmSVP-yFCACCATGGCTAGAGAGAAGATAAAG720原核表达 LmSVP-yRCTAAAAGGGAAGCGCTAACTT
2 方法
2.1 总RNA的提取与cDNA第1条链的合成
参照EASYspin Plus多糖多酚复杂植物RNA快速提取试剂盒操作说明制备样品的总RNA,1.0%的琼脂糖凝胶电泳检测RNA的完整性,Nanodrop 2000检测RNA浓度和质量。以提取的RNA样品为模板,按照HiScript III 1st Strand cDNA Synthesis Kit(+gDNA wiper)操作说明,逆转录合成cDNA,−20 ℃保存备用。
2.2 LmSVP基因cDNA全长克隆
根据前期获得的灰毡毛忍冬转录组数据(PRJNA 667821)相关信息[14-15],选取具有完整开放阅读框(open reading frame,ORF)的序列,应用Primer Premier 6设计基因的特异性引物LmSVP-F和LmSVP-R,引物序列信息见表1。将“2.1”项得到的cDNA原液稀释20倍作为模板进行PCR扩增,反应体系(25 μL):2×Phanta Max Buffer 12.5 μL,dNTP Mix 0.5 μL,SVP-F和SVP-R各1 μL,Phanta Max Super-Fidelity DNA Polymerase 0.5 μL,cDNA模板1.5 μL,ddH2O 8.0 μL。PCR反应程序:95 ℃预变性3 min;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸1 min,35个循环;72 ℃彻底延伸5 min;12 ℃持续。反应结束后,PCR扩增产物进行1.0%琼脂糖凝胶电泳,并按琼脂糖凝胶纯化回收试剂盒回收PCR产物。回收产物与pTOPO载体连接并转化至大肠杆菌DH5α感受态细胞中,涂布于含有氨苄青霉素(Amp)的LB固体培养基平板上,倒置培养过夜。挑取单菌落,振荡培养4~5 h,进行PCR鉴定选出阳性克隆,送至长沙擎科生物公司测序。
2.3 LmSVP基因生物信息学分析
基于基因的测序结果,应用NCBI的ORF finder工具查找ORF以及推导编码的氨基酸序列。通过Prot Param在线工具(http://web.expasy.org/ protparam/)分析LmSVP蛋白的理化性质;利用Prot Scale(https://web.expasy.org/cgi-bin/protscale/ protscale. pl/)软件预测LmSVP蛋白的亲疏水性;使用TMHMM(https://services.healthtech. dtu.dk/service. php?TMH MM-2.0)分析LmSVP蛋白的跨膜结构域;应用SignalP 4.1(https:// services.health tech.dtu.dk/service.php? SignalP-4.1)预测LmSVP蛋白的信号肽;采用WOLF PSO RT(https://wolfpsort.hgc.jp/)在线预测LmSVP蛋白亚细胞定位情况;利用Netphos 3.1 server(https://services.healthtech.dtu.dk/service.php? NetPhos-3.1)对LmSVP蛋白的磷酸位点进行预测分析;使用NCBI网站CD-Search(https://www. ncbi.nlm. nih.gov/Structure/cdd/wrpsb.cgi)在线分析蛋白质保守结构域;通过SOPMA(http:// npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODE L(https:// swissmodel. expasy.org/)预测LmSVP蛋白的二、三级结构;运用DNA STAR 7.1中的MegAlign 程序进行氨基酸序列对比分析;借助MEGA-X中的NJ法构建系统进化树。
2.4 LmSVP基因的表达分析
根据基因cDNA全长序列,设计qRT-PCR的特异性引物LmSVP-qF和LmSVP-qR(表1),以18 S rRNA作为内参基因。提取灰毡毛忍冬“龙花”和“金翠蕾”品种叶片、早期花蕾(花蕾平均长14.49 mm)以及晚期花蕾(花蕾平均长41.85 mm)的总RNA并反转录成cDNA,进行实时荧光定量分析。反应体系:2×RealStar Green Fast Mixture PCR 5 μL,Forward primer 0.4 μL,Reverse primer 0.4 μL,cDNA 1 μL,H2O 3.2 μL。扩增程序:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸20 s,40个循环。反应结束后进行熔解曲线分析,熔解曲线为95 ℃ 5 s,56 ℃ 5 s,95 ℃持续,每个样品重复3次,用2−ΔΔCt法计算基因的相对表达量。利用SPSS26.0进行数据的差异显著分析。
2.5 LmSVP基因原核表达载体的构建及诱导表达
根据测序所得CDS序列,设计原核表达引物SVP-yF和SVP-yR(表1),以稀释20倍的cDNA为模板,经PCR扩增、1.0%琼脂糖凝胶电泳检测后,对PCR扩增产物进行切胶回收,回收产物按照pTOPO-D1一步法定向原核表达试剂盒操作说明于37 ℃连接5 min,产物转化至大肠杆菌DH5α感受态细胞,涂布于含有Amp的LB固体培养基上,次日挑选单菌落进行PCR鉴定、测序及提取重组质粒。将构建好的重组质粒转化至大肠杆菌BL21(DE3)中,挑取单克隆进行菌液验证,将验证正确的原核表达工程菌液按照1∶100比例在50 mL LB液体培养基(含Amp)中培养,培养至菌液600为0.6时向培养基中加入终浓度为0.6、0.8、1.0 mmol/L的异丙基-β--硫代半乳糖苷(IPTG)进行诱导,37 ℃培养4 h。诱导结束后,5000 r/min离心15 min,去上清,加入1×PBS(pH 7.5)缓冲液重悬菌体,冰浴条件下超声破碎20 min,彻底破碎后,12 000 r/min离心20 min。分别取上清、沉淀加入蛋白上样缓冲液,沸水煮沸10 min,经12.0% SDS-PAGE电泳检测目的蛋白表达情况。
3 结果与分析
3.1 LmSVP基因全长cDNA克隆
从灰毡毛忍冬转录组中获得该基因的全长序列,以灰毡毛忍冬cDNA作为模板进行PCR扩增。以1%琼脂糖凝胶电泳检测PCR扩增产物,结果显示在靠近Marker的1500 bp附近出现了一条清晰明显的条带,与预期大小相符,见图1。阳性克隆经测序比对,与转录组中序列一致,测序结果在NCBI网站上利用Blast功能进行比对,显示序列为STMADS11亚家族成员基因,将该基因命名为,基因登录号为OQ507619。通过ORF- Finder分析,基因全长1472 bp,包含1个720 bp的ORF区,编码239个氨基酸,其中5'UTR为382 bp,3'UTR为370 bp。
3.2 LmSVP基因生物信息学分析
3.2.1基因编码氨基酸理化性质分析 通过ExPASy ProtParam在线软件对基因编码蛋白进行预测分析,推测其分子式为C1146H1902N326O372S16,相对分子质量为26 712.63,等电点为6.16,不稳定系数为45.60>40,属于不稳定蛋白,带正电残基(Arg+Lys)为33,带负电残基(Asp+Glu)为35,脂肪系数83.26,亲水性平均系数为−0.501,应用ProtScale在线分析其蛋白亲/疏水性,结果表明LmSVP蛋白亲/疏水氨基酸分布整体上是负值大于正值,亲水区域所占比例大于疏水区域,推测其为亲水性蛋白。利用WOLF PSORT在线预测亚细胞定位情况,结果表明LmSVP蛋白定位于细胞核(nucleus)中。运用在线软件TMHMM2.0分析,发现编码的氨基酸1~239全部在膜外,不具有跨膜区域。SignalP 4.1软件预测LmSVP蛋白不具有信号肽序列,属于非分泌型蛋白。
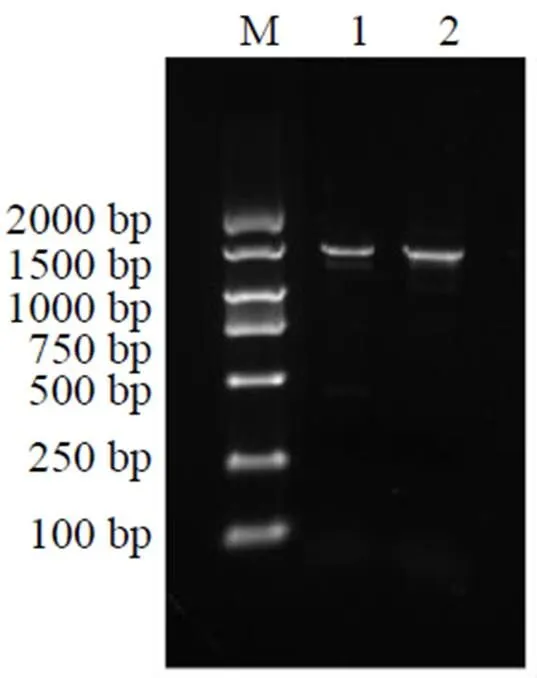
M-Marker 1, 2-LmSVP全长扩增片段
通过Netphos 3.1 server软件在线预测蛋白的磷酸化位点,结果显示编码的氨基酸序列可能发生磷酸化的位点有25个。其中包括丝氨酸(Ser)位点14个,苏氨酸(Thr)位点10个,酪氨酸(Tyr)位点1个。
3.2.2 LmSVP蛋白结构域、二级结构和三级结构预测 利用NCBI网站CD-Search在线分析LmSVP蛋白保守结构域,LmSVP第2~75个氨基酸为高度保守的MADS结构域,第95~170个氨基酸为中度保守的K-box结构域,具有基因家族共有的典型结构域,见图2。
通过SOPMA在线软件预测LmSVP蛋白的二级结构(图3-A),结果显示LmSVP蛋白的构成成分及比例分别为:α螺旋(alpha helix)占59%,无规则卷曲(random coil)占28.03%,延伸链(extended strand)占10.46%,β转角(beta turn)占2.51%,α-螺旋和无规则卷曲为该蛋白二级结构的主要组成元件。
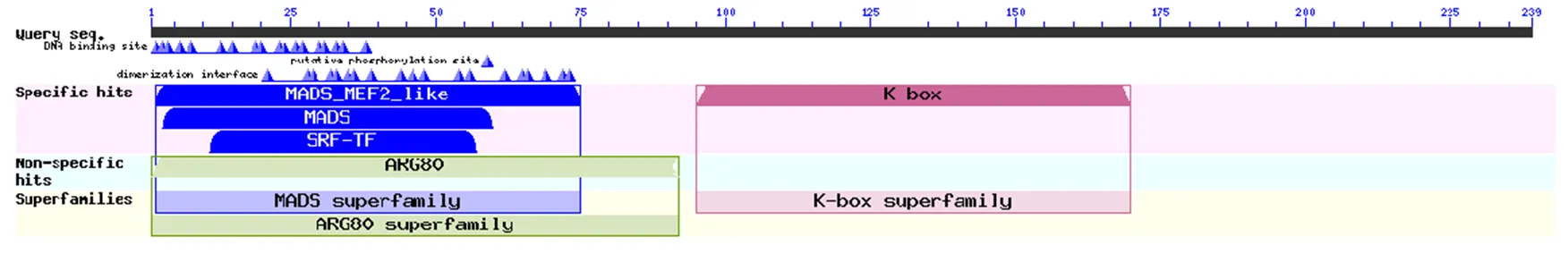
图2 LmSVP蛋白结构域
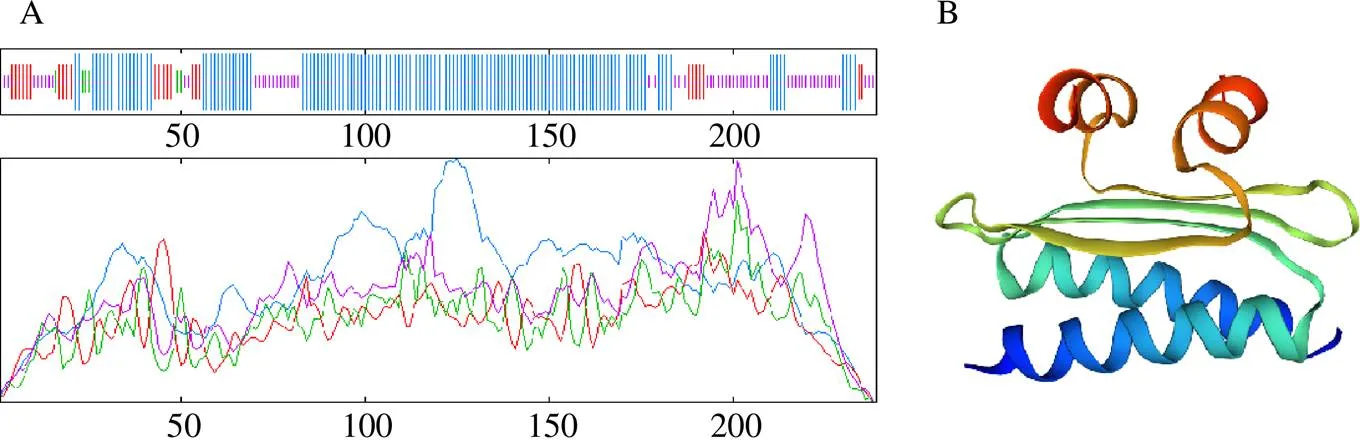
蓝色-α螺旋 红色-延伸链 紫色-无规卷曲 绿色-β转角
使用SWISS-MODEL在线软件对LmSVP进行同源建模,构建其三维结构模型(图3-B)。选择7nb0.1.A作为同源蛋白模板构建LmSVP模型,序列相似性为73.58%,整体评分为0.72。
3.2.3氨基酸序列同源性比对和系统进化分析 运用DNASTAR 7.1中的MegAlign程序对基因编码蛋白与5种植物的LmSVP蛋白进行多序列比对分析(图4)。结果表明,LmSVP与可可L.(XP_007018219.2)、榴莲Murr.(XP_022768443.1)、酸枣Mill. var.(Bunge) Hu ex H. F. Chow.(XP_015885971.1)、葡萄L.(XP_002285687.1)、小粒咖啡L.(XP_027090010.1)SVP蛋白的一致性分别为70.29%、67.36%、66.11%、66.53%和69.26%。LmSVP与可可(XP_007018219.2)的SVP蛋白序列相似性最高为70.29%。
为了进一步了解LmSVP蛋白的系统进化情况,从NCBI数据库中挑选16条与LmSVP氨基酸序列具有一定同源性的MADS-box家族的氨基酸序列,运用MEGA-X 构建LmSVP蛋白的NJ进化树。结果显示(图5),LmSVP蛋白与中华猕猴桃Planch.和小粒咖啡L.的蛋白聚类在同一分支上,表明LmSVP蛋白可能与双子叶植物猕猴桃科、茜草科SVP蛋白在功能上更为接近。

图4 LmSVP与其他植物SVP蛋白的多序列比对分析

图5 LmSVP蛋白的NJ系统进化树
3.3 LmSVP基因的组织特异性表达
以灰毡毛忍冬18S rRNA为内参基因,利用qRT-PCR技术对灰毡毛忍冬“龙花”和“金翠蕾”品种不同组织部位(花、叶)及不同花发育时期基因的表达情况进行分析,见图6。结果显示,无论是在叶片中还是花蕾早期和晚期,“金翠蕾”品种中基因表达量整体高于“龙花”品种;基因在灰毡毛忍冬2个品种“龙花”和“金翠蕾”不同组织部位的表达存在极显著差异(<0.01),叶片中表达量显著高于花中的表达量;基因在灰毡毛忍冬不同花期的表达量差异不明显,变化较平缓。
3.4 LmSVP重组蛋白的表达
将测序结果正确的重组质粒pTOPO-D1- LmSVP及pTOPO-D1空载转化至大肠杆菌BL21(DE3)感受态细胞,挑取单克隆于37 ℃培养,当菌液的600值达到0.6左右时加入终浓度分别为0.6、0.8、1.0 mmol/L的IPTG进行诱导,37 ℃培养4 h,菌液超声波破碎后分别取上清、沉淀进行SDS-PAGE电泳检测。结果(图7)显示,pTOPO- D1空载体经诱导后无特异性条带产生,而重组质粒pTOPO-D1-LmSVP经IPTG诱导后在沉淀中产生一条约26 710的特异性条带,与LmSVP预测蛋白相对分子质量(26 710)一致,说明LmSVP重组蛋白在大肠杆菌中成功表达。菌液上清中无特异性条带产生,说明表达的LmSVP以包涵体的形式存在,其原因可能是由于外源基因的高效表达,导致新生肽链的合成速度超过了正确折叠的速度,从而形成非结晶、无定形的蛋白质聚集体。
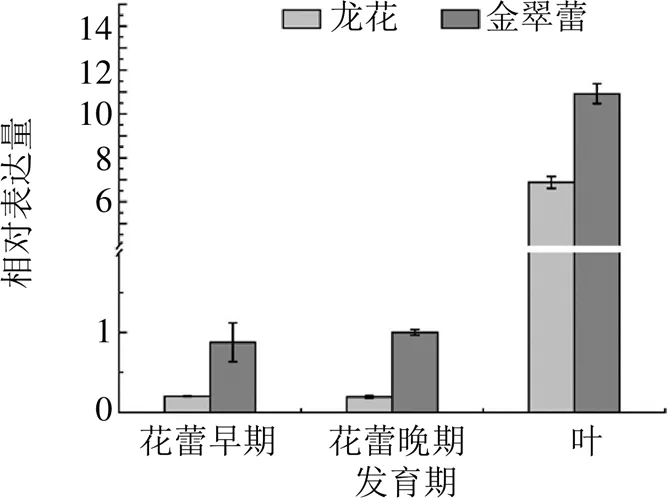
图6 LmSVP基因在灰毡毛忍冬“龙花”和“金翠蕾”品种不同发育期中表达模式
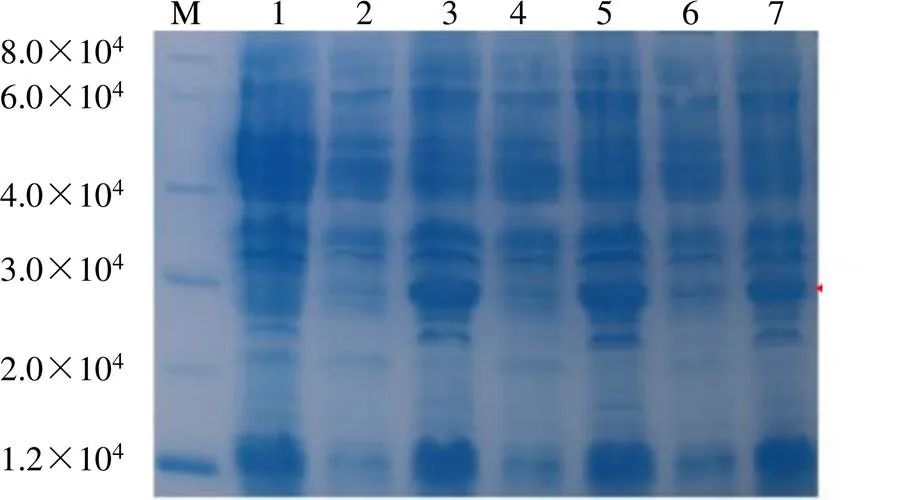
M-Marker 1-空载体pTOPO-D1 2-经0.6 mmol·L−1 IPTG诱导的上清 3-经0.6 mmol·L−1 IPTG诱导的沉淀 4-经0.8 mmol·L−1 IPTG诱导的上清 5-经0.8 mmol·L−1 IPTG诱导的沉淀 6-经1.0 mmol·L−1 IPTG诱导的上清 7-经1.0 mmol·L−1 IPTG诱导的沉淀
4 讨论
转录因子在植物花器官发育过程中发挥着极其重要的作用,其在不同植物中所具备的功能存在较大差异[16],基因作为基因家族的重要成员,在许多植物中均被证实能够参与调控植物开花、花器官发育及休眠等生物过程。近年来,科研人员针对基因对植物花发育的调控作用进行了广泛研究,基因过表达会阻碍下游开花基因()、()、()等的表达,从而延迟植物开花[17],例如百合过量表达至拟南芥后,延迟了植株开花[18]。目前已从腊梅(L.) Link[19]、日本矮牵牛(L.) Choisy.[20]、德国鸢尾L.[21]、棉花L[22]和蔷薇Thunb.[23]等植物中分离得到同源基因,基因参与许多观赏植物的成花机理研究已被报道,而有关基因是否参与调控灰毡毛忍冬花发育进程的研究尚未见报道。
本研究通过对花蕾型灰毡毛忍冬“龙花”基因家族基因进行研究,成功克隆获得灰毡毛忍冬基因全长, 并命名为,该基因全长1472 bp,具有完整的ORF 720 bp,氨基酸239个,预测其为亲水性蛋白,亚细胞定位于细胞核中。结构域预测该蛋白具有高度保守的MADS结构域和中度保守的K-box结构域,与其他植物基因编码的保守结构域相同[24-26],属于基因家族。系统进化树分析表明,LmSVP蛋白与中华猕猴桃Planch.、小粒咖啡L. SVP蛋白聚为一支,说明三者亲缘关系较近。
不同植物中基因调控植物成花的功能不同,一般在花发育初期发挥作用,从而决定花分生组织的特异性[27]。组织特异性分析显示,基因在芍药Pall.不同组织器官中均有表达,但表达量有差异,在根中高表达,特别是在须根中;在花瓣中痕量表达[28]。猕猴桃中同源基因仅在营养器官中大量表达,尤其是在叶、茎尖和腋芽中,在花朵中不表达[29]。本研究中基因在2品种灰毡毛忍冬叶和花中的表达量存在显著差异,其中在叶中的表达量最高,这与前人的研究结果类似。对灰毡毛忍冬花发育不同时期的表达分析结果显示,在“龙花”和“金翠蕾”这2种花蕾型灰毡毛忍冬中,基因在花早期和花晚期的表达量无明显差异。此处由于材料限制,只针对基因在两种花蕾型灰毡毛忍冬中的表达情况进行研究,未来应收集更多植物材料进行研究探讨。
迄今,尚无报道LmSVP重组蛋白的原核表达体系,为更进一步研究基因在灰毡毛忍冬花器官发育中的功能,本研究成功构建了pTOPO-D1- LmSVP载体,并且在大肠杆菌BL21(DE3)中进行表达,成功获得分子量约为26 710的重组LmSVP蛋白。但是由于原核表达系统高效表达时,表达的重组蛋白常常出现不能自发折叠这一现象,二硫键不能正确配对,蛋白间过多的非特异性结合,无法达到足够的溶解性,即以包涵体的形式存在[30]。为了使重组蛋白具有生物活性,需对包涵体进行复性处理[31]。在本实验条件下,LmSVP重组蛋白以包涵体的形式存在。后续将采取复性等方式,以获得有生物学活性的LmSVP重组蛋白,从而对LmSVP重组蛋白的功能进行深入研究。本研究为进一步通过转基因验证基因的生物学功能奠定了基础,为从分子水平探索花蕾型灰毡毛忍冬蕾期长、花冠不展开等优良性状以及培育灰毡毛忍冬优良新品种提供了理论依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 30-31.
[2] 杨苗, 马逾英, 周娟, 等. 细毡毛忍冬采收期动态研究[J]. 时珍国医国药, 2009, 20(1): 34-35.
[3] 耿世磊, 宁熙平, 吴鸿, 等. 山银花不同发育阶段花结构与绿原酸含量变化关系研究 [J]. 云南植物研究, 2005, 27(3): 279-287.
[4] 孙梦姗, 周日宝, 彭晓丹, 等. 灰毡毛忍冬不同品种开花时期内源乙烯动态变化的研究 [J]. 中成药, 2013, 35(9): 1969-1972.
[5] 蔡嘉洛. 毡毛忍冬蕾期延长相关基因AGL15的克隆与表达 [D]. 长沙: 湖南中医药大学,2016 .
[6] 徐玉琴, 王珊, 刘湘丹, 等. 灰毡毛忍冬花蕾总RNA提取方法的研究 [J]. 中医药导报, 2015, 21(24): 31-34.
[7] Liu C, Chen H Y, Er H L,. Direct interaction of AGL24 and SOC1 integrates flowering signals in Arabidopsis [J]., 2008, 135(8): 1481-1491.
[8] Hartmann U, Höhmann S, Nettesheim K,. Molecular cloning of SVP: A negative regulator of the floral transition in Arabidopsis [J]., 2000, 21(4): 351-360.
[9] Lee J H, Yoo S J, Park S H,. Role of SVP in the control of flowering time by ambient temperature in Arabidopsis [J]., 2007, 21(4): 397-402.
[10] 张燕, 许申平, 梁芳, 等. 蝴蝶兰Ph SVP的克隆及其在花发育过程中的表达分析 [J]. 园艺学报, 2020, 47(6): 1111-1125.
[11] 李玉舒, 杨炜茹, 程堂仁, 等. 梅花2个SVP基因的克隆与表达分析 [J]. 西北植物学报, 2019, 39(7): 1163-1171.
[12] Li X F, Wu W T, Zhang X P,. Narcissus tazetta SVP-like gene NSVP1 affects flower development in Arabidopsis [J]., 2015, 173: 89-96.
[13] 汪王, 苏小霞, 杨柳慧, 等. 细叶百合LpSVP基因的克隆及其表达分析 [J]. 西北林学院学报, 2018, 33(4): 89-94.
[14] 刘思思, 乔中全, 曾慧杰, 等. 灰毡毛忍冬转录组SSR位点分析及EST-SSR标记开发 [J]. 分子植物育种, 2021, 19(9): 3015-3021.
[15] 刘思思, 乔中全, 刘新民, 等. 花蕾型和普通型灰毡毛忍冬花冠开裂过程的转录组比较分析 [J]. 分子植物育种, 2021, 19(6): 1822-1829.
[16] 王力娜, 范术丽, 宋美珍, 等. 植物MADS-box基因的研究进展 [J]. 生物技术通报, 2010(8): 12-19.
[17] Blümel M, Dally N, Jung C. Flowering time regulation in crops—What did we learn from Arabidopsis? [J]., 2015, 32: 121-129.
[18] Tang X L, Liang M X, Han J J,. Ectopic expression of LoSVP, a MADS-domain transcription factor from lily, leads to delayed flowering in transgenic Arabidopsis [J]., 2020, 39(2): 289-298.
[19] 候慧芳. 蜡梅CpFUL-like基因的克隆及功能研究 [D]. 重庆: 西南大学, .
[20] Kikuchi R, Sage-Ono K, Kamada H,. PnMADS1, encoding an StMADS11-clade protein, acts as a repressor of flowering in[J]., 2008, 133(4): 786-793.
[21] 王银杰, 张永侠, 刘清泉, 等. 德国鸢尾IgSVP基因的克隆及其表达分析 [J]. 分子植物育种, 2022, 20(23): 7697-7702.
[22] 张文香, 庞朝友, 范术丽, 等. 棉花SVP-like基因GhMADS29的克隆与表达分析 [J]. 安徽农业科学, 2015, 43(15): 28-31.
[23] 任闽. 蔷薇RmSVP基因的进化分析及功能鉴定 [D]. 南京: 南京农业大学, 2020.
[24] 陈微, 惠林冲, 李威亚, 等. 洋葱AcSVP基因的克隆及其表达分析 [J]. 江西农业学报, 2020, 32(6): 17-22.
[25] Liu Y Z, Gao Y K, Yuan L,. Molecular characterization and expression patterns of the HkSVP gene reveal distinct roles in inflorescence structure and floral organ development in[J]., 2021, 22(21): 12010.
[26] 高耀辉, 马斌, 魏光普, 等. 菊花SVP和AGL24基因的克隆及序列分析 [J]. 分子植物育种, 2021, 19(13): 4286-4292.
[27] Gregis V, Sessa A, Dorca-Fornell C,. The Arabidopsis floral meristem identity genes AP1, AGL24 and SVP directly repress class B and C floral homeotic genes [J]. Plant J, 2009, 60(4): 626-637.
[28] 籍凤娇, 马燕, 亓帅, 等. 芍药PlSVP基因的克隆及其花期调控功能分析 [J]. 园艺学报, 2022, 49(11): 2367-2376.
[29] Wu R M, Walton E F, Richardson A C,. Conservation and divergence of four kiwifruit SVP-like MADS-box genes suggest distinct roles in kiwifruit bud dormancy and flowering [J]., 2012, 63(2): 797-807.
[30] Lilie H, Schwarz E, Rudolph R. Advances in refolding of proteins produced in[J]., 1998, 9(5): 497-501.
[31] Francois J, Baneyx R. Recombinant protein expression in[J]., 1999, 10: 411-421.
Cloning and expression analysis offamily genefrom
LONG Li-jun1, 2, LIU Si-si2, ZENG Hui-jie2, LI Chang-zhu2, ZHANG Gang3, 4, MA Ying-zi1, LI Yi-min3, 4
1. School of Life Science and Technology, Central South University of Forestry Science and Technology, Changsha 410004, China 2. State Key Laboratory of Woody Oil Resources Utilization,Hunan Academy of Forestry, Changsha 410004, China 3. Key Laboratory for Research and Development of “Qin Medicine” of Shaanxi Administration of Chinese Medicine, Shaanxi University of Chinese Medicine, Xi’an 712046, China 4. State Key Laboratory of Research and Development of Characteristic Qin Medicine Resources (Cultivation), Shaanxi University of Chinese Medicine, Xianyang 712083, China
To clone thefamily gene() of, analyze the characteristics of bioinformatics, spatiotemporal expression and protein prokaryotic expression.Based on the transcriptome sequencing data ofin the previous study, the full-length cDNA ofwas cloned by PCR. The bioinformatics methods were used to analyze the sequence characteristics of their encoded proteins. Real-time quantitative reverse-transcription polymerase chain reaction (qRT-PCR) was used to detect the expression level ofin leaves, early and late flowers of the “Longhua” and “Jincuilei” varieties of. And then, the pTOPO-D1-LmSVP prokaryotic expression vector was constructed and transformed intoBL21 (DE3) to express.The full-length ofgene was 1472 bp, containing an open reading frame (ORF) of 720 bp and encoding 239 amino acids. The relative molecular weight of LmSVP protein was 26 712.63. Phylogenetic analysis indicated that the LmSVP protein was most closely related toandThe qRT-PCR results showed that the expression level ofgenes were specific in both “Longhua” and “Jincuilei” variety, and expression in leaves were significantly higher than in flowers. At different stages of flower development, the expression level ofgenes were not significantly different.successfully expressed a recombination protein with molecular weight of about 26 710 in theBL21 (DE3), which was consistent with the prediction.Through the full-length cloning, sequence analysis and expression characterization ofgene, it provided experimental basis for further study on the function ofgene in regulating the bud length and corolla non-opening of.
Hand.-Mazz.;;; gene cloning; expression analysis; prokaryotic expression
R282.12
A
0253 - 2670(2023)16 - 5350 - 08
10.7501/j.issn.0253-2670.2023.16.024
2023-02-03
湖南省自然科学基金面上项目(2022JJ30326);湖南省林业科技创新资金项目(XLKY202208);湖南省自然科学基金项目(2020JJ4939)
龙丽君,女,硕士研究生,研究方向为植物学。E-mail: 2351643604@qq.com
马英姿,女,教授,从事植物学及植物资源利用研究。E-mail: ma_yingzi@163.com
李依民,女,副教授,从事中药资源评价与高效利用研究。E-mail: 2051058@sntcm.edu.cn
[责任编辑 时圣明]
