植物细胞壁结构及成像技术研究进展
2023-08-15张曼张叶卓何其邹洪鄂一岚李晔
张曼 张叶卓 何其邹洪 鄂一岚 李晔
(1.北京林业大学生物科学与技术学院 林木遗传育种全国重点实验室,北京 100083;2.北京林业大学生物科学与技术学院 林木育种与生态修复国家工程研究中心,北京 100083;3.北京林业大学生物科学与技术学院 林木、花卉遗传育种教育部重点实验室,北京 100083;4.北京林业大学生物科学与技术学院 树木花卉育种生物工程国家林业和草原局重点实验室,北京100083)
植物作为地球上丰富的可再生资源,其中光合作用获得的生物质大部分贮藏在细胞壁中,植物细胞壁资源不仅为造纸业、化工行业等提供原料,同时也是具有巨大潜力的生物能源。因此,研究植物细胞壁的结构和成分,对更好的利用细胞壁资源,实现我国能源转型具有重要意义。研究发现不同物种、不同细胞类型乃至不同发育阶段细胞壁的结构和功能具有差异性[1]。从1973年Keegstra提出第一个细胞壁结构模型开始[2],到近年来原子力显微镜(atomic force microscope, AFM)、拉曼显微术(Ramanmicroscopy)、点击化学(click chemistry)和傅里叶变换红外光谱(fourier transform infrared spectroscopy,FTIR)等先进技术的发展,为进一步研究细胞壁的精细结构提供了有力工具,使得我们对细胞壁结构的认识不断突破,对细胞壁结构与细胞壁力学性质之间关系的研究也不断深入。2021年发表在Science的最新研究,首次采用分子模拟技术构建了细胞壁模型,并对细胞壁的结构及其力学性质进行了深入的研究。因此,本综述针对近年来植物细胞壁的组成和结构、细胞壁的新型成像技术,以及细胞壁力学性质方面的研究进行了较为全面的总结,旨在为植物细胞壁复杂纳微结构的研究及其加工利用提供参考依据。成分较低[4]。次生壁中主要成分是纤维素、半纤维素和木质素,其中半纤维素的主要类型是木聚糖和葡甘聚糖[5](图1)。通常次生壁的组分与物种和组织器官类型高度相关,例如在棉花纤维细胞中,次生壁主要成分是纤维素,木质素含量较少;而在木质化细胞中,如木材导管、管胞、木纤维的次生壁中,木质素则作为次生壁主要成分。另外,次生壁通常可以按照微纤丝的排列方式区分为 S1、S2、S3三层[6]。除了初生壁和次生壁,连接相邻植物细胞的胞间层也是细胞壁的重要结构,其主要成分是果胶[7]。
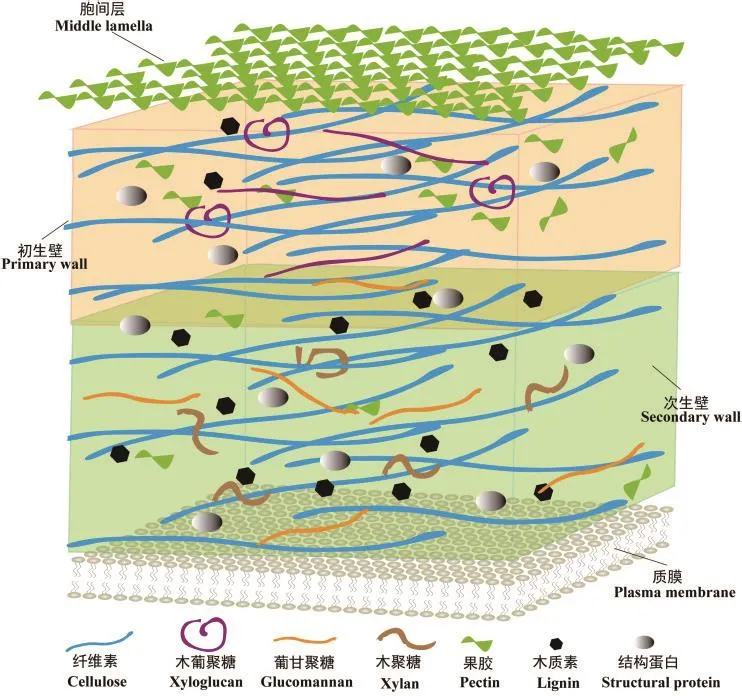
图1 植物细胞壁的结构模型Fig.1 Structural model of plant cell wall
1 植物细胞壁的复杂纳微结构
细胞壁作为非均一的结构,在不同类型细胞中组成和结构不同。细胞壁一般可以分为胞间层、初生壁和次生壁。但并非所有的细胞都既有初生壁又有次生壁,有些细胞仅有初生壁和胞间层,而无次生壁。细胞壁的主要化学成分包括纤维素、半纤维素、果胶、木质素和结构蛋白等数十种天然高分子化合物,它们之间相互交联形成复杂的纳微网络结构。因此,研究植物细胞壁的组成成分和不同组分之间的相互作用对揭示细胞壁的复杂纳微结构具有重要的意义。
1.1 植物细胞壁的组成成分
根据植物细胞壁形成时间的不同,细胞壁可以分为细胞生长发育过程中形成的初生壁,细胞停止生长后在初生壁内侧继续沉积的次生壁,以及连接相邻细胞的胞间层。根据近年来大量的研究工作,总结了植物初生壁和次生壁成分的主要差异(图1)。植物初生壁的主要成分是纤维素、果胶和半纤维素,其中纤维素和果胶含量分别约为15%-40%和30%-50%,木葡聚糖作为初生壁半纤维素的主要类型,含量约为20%-30%[3]。植物初生壁又可以分为两种,I型初生壁在真双子叶植物中很常见,而II型初生壁是草本植物初生壁的主要类型。两者的区别主要在于I型细胞壁中木葡聚糖和纤维素微纤丝相互交联;而II型细胞壁以纤维素-葡萄糖醛酸阿拉伯木聚糖为骨架,木葡聚糖与纤维素结合较少,且果胶
作为细胞壁的主要成分,纤维素是由β-1,4糖苷键连接的葡萄糖大分子,通过非共价力聚合成微纤维,在细胞壁结构中起支架作用。半纤维素在植物细胞壁中普遍存在,主要包括木葡聚糖、木聚糖、甘露聚糖、混联葡聚糖及其衍生物[8]。果胶是自然界中结构和功能最复杂的多糖,其成分种类较多,其中包括同型半乳糖醛酸聚糖(HG)、鼠李半乳糖醛酸聚糖I(RGI)和鼠李半乳糖醛酸聚糖II(RGII)[9]。而木质素主要存在于木质部和厚壁组织细胞,是一种芳香族酚类聚合物,在初生壁中含量较少,主要存在于次生壁中[10]。
不同种类植物细胞壁成分也具有很大差异。木本植物细胞壁的主要成分包括纤维素、半纤维素、果胶以及木质素[11];与木本植物相比,草本植物细胞壁中半纤维素主要是混联葡聚糖和异木聚糖,其中混联葡聚糖是草本植物细胞壁特有成分[12]。另外,草本植物初生壁作为一种II型细胞壁,果胶和木葡聚糖含量相比于木本植物更少[13]。需要注意的是,同一植物培养细胞和生长细胞的细胞壁组分含量之间关系存在一定争议。Blaschek等[14]利用气液色谱对不同来源的烟草细胞壁成分进行研究发现,原生质体再生细胞壁纤维素含量仅占5%,而叶片和培养细胞的细胞壁纤维素含量分别为60%和45%。然而,在利用化学分析方法研究棉纤维细胞生长发育过程中细胞壁成分含量变化时发现,培养细胞和植物生长细胞的纤维素含量十分相似[15]。综上所述,细胞壁不同组分含量具有异质性,依赖于物种和植物细胞的状态。
深入研究细胞壁的成分对农业以及林业发展具有重要意义。研究发现蔬菜和果实在贮藏过程中细胞壁成分会发生明显变化,这种变化会影响其经济价值。Ren等[16]通过研究番荔枝贮藏过程中细胞壁多糖含量、细胞壁修饰酶活性的变化,发现番荔枝果实软化主要是因为细胞壁多糖尤其是果胶的降解。在树木的研究中表明,纤维素含量与木材制浆率成正比,而木质素含量与木材制浆率成反比。李强等[17]利用DFRC法结合气相色谱-质谱法测定出竹柳综纤维素含量为80.16%,木质素含量为19.84%,这为竹柳的工业应用提供了理论支持。除此之外,棉花作为主要的农业作物之一,其纤维素含量的测定对选择优良的棉花品种具有重要意义。Abidi等[18]利用红外光谱法测定棉纤维生长和发育过程中纤维素含量的变化,发现在667 cm-1和897cm-1处的振动带强度和纤维素百分含量相关,从而对棉花纤维素含量进行定量分析,这为棉花优良品种的选择提供了一种新方法。因此,研究植物细胞壁的成分,对细胞壁资源的利用具有重要价值。
1.2 细胞壁不同组分之间的复杂相互作用
针对细胞壁组分之间相互作用的研究可以追溯到1973年,Keegstra等[19]通过分析槭树悬浮细胞细胞壁的降解片段发现,果胶和木葡聚糖之间主要通过共价键连接。随后,基于不同方法,相继有研究者发现共价键连接的果胶-木葡聚糖复合物存在于花椰菜茎、玫瑰悬浮细胞以及黄化豌豆上胚轴细胞壁中[20]。同时也有研究者报道半纤维素和纤维素通过既牢固又灵活的氢键相连,半纤维素通过与木质素形成共价键介导木质素与纤维素间接结合[21],以上发现都表明包括木葡聚糖在内的半纤维素在细胞壁网络形成中起到重要作用。除半纤维素外,果胶成分在细胞壁网络形成中的作用也被广泛研究。木葡聚糖作为半纤维素的主要类型之一,相比于木葡聚糖,果胶与纤维素结合的能力较弱。研究发现当木葡聚糖大量存在时,木葡聚糖与纤维素形成网络;而缺乏木葡聚糖时,果胶可以取代木葡聚糖与纤维素结合[22],起到连接纤维素的作用。
细胞壁的栓系网络模型曾被广泛接受,其中木葡聚糖与纤维素结合,并将微纤丝栓系在一起。木葡聚糖在微纤丝紧密接触的有限区域将微纤丝连接在一起[23],而果胶则填满微纤丝-木葡聚糖网络的空隙[24]。但近些年的研究对此提出质疑,研究发现拟南芥木葡聚糖突变体表型变化并不显著[25]。此外,对于拟南芥原生质体细胞壁再生体系的研究发现,细胞壁的结构不会因缺乏木葡聚糖而受到影响[26]。随着新技术的产生和发展,细胞壁结构的认识不断突破。纤维素-木葡聚糖网络受到质疑,初生壁中的纤维素-果胶网络和次生壁中的纤维素-木聚糖网络成为被广泛接受的细胞壁结构[27]。
2 植物细胞壁结构研究的相关成像技术
成像技术作为支撑细胞壁成分和结构研究的重要方法。一直以来,组织化学染色、荧光标记等成像标记技术,以及荧光显微镜、激光共聚焦显微镜、电子显微镜等成像技术是研究细胞壁成分和结构的重要工具。近年来,随着新技术的不断发展,原子力显微镜、拉曼显微术、点击化学和傅里叶变换红外光谱技术等成像技术在细胞壁结构成像中凸显优势。
2.1 原子力显微镜
原子力显微镜(atomic force microscope, AFM)利用探针与样品表面相互作用力的变化来获取样品表面的形貌信息。与普通光学显微镜相比,AFM具有更高的空间分辨率,而与电子显微镜相比,AFM不需要繁琐的样品制备过程,对样品损害小[28]。AFM的优势在于能从少量细胞中提取精确形态信息,比如细胞表面粗糙度和颗粒大小,但相应的,AFM成像速度较慢,无法进行大量细胞的统计分析[29]。
AFM被广泛应用于生物大分子如多糖、蛋白质、脂质、核酸的直接可视化。例如,杨静慧等[30]利用原子力显微镜研究了灵武长枣贮藏期间果实软化过程发现,螯合性果胶的长链结构随着贮藏时间延长而减少,短链则有所增加。Pieczywek等[31]通过在原子力显微镜下观察苹果中果胶在不同糖苷酶处理后溶解情况发现,阿拉伯糖在稀碱溶性果胶分支结构的形成中具有关键作用。此外,原子力显微镜可以实现细胞壁复杂交联网络结构的原位成像。例如,Adobes-Vidal等[32]利用原子力显微镜观察木材次生壁纳米结构发现,纤维素和半纤维素构成微纤维聚集体的核心,木质素包裹在外层。Crowe等[33]利用原子力显微镜和扫描电子显微镜(scanning electron microscope, SEM)观察拟南芥葡萄糖醛酸木聚糖缺陷突变体中纤维素网络发现,葡萄糖醛酸木聚糖对纤维素网络的组织具有重要影响。值得注意的是,原子力显微镜可应用于研究细胞壁成分在细胞壁力学性质中的作用。例如 Leszczuk等[34]利用AFM评估了在阿拉伯半乳糖蛋白(AGP)功能受到影响的情况下花粉管不同区域的硬度发现,AGP在细胞壁力学性质中起到重要作用。综上所述,原子力显微镜具有分辨率高、样品损伤小等优点,是细胞壁多糖、细胞壁交联结构和细胞壁成分力学性质研究中的重要工具。
2.2 拉曼显微术
近年来,拉曼显微技术被广泛的应用于细胞壁成分的检测。所谓拉曼散射是光与物质作用后发生的非弹性散射。拉曼显微术基于拉曼散射,对细胞壁成分的分子振动能级进行检测,从而获得细胞壁分子水平的结构信息。相比于AFM,拉曼显微技术的优势在于能够在对细胞壁成分进行定性和定量分析,且不需要对样品进行特殊处理,因此其在研究细胞壁成分变化等方面具有不可替代的作用。
共聚焦拉曼显微术(confocal Raman microscopy,CRM)通过在焦平面上放置阻挡器吸收来自样品表面下方的散射光,可以提供微米分辨率的化学信息[35]。其主要的优势在于可以对植物细胞壁实现非侵入性的无损原位成像,从而观察细胞壁成分如木质素在生理状态下的变化。例如,Jin等[36]利用CRM观察杨树木质素脱除的动态过程发现,不同细胞类型脱除木质素的难易程度有差异,导管细胞抗性最强,射线和纤维依次减弱。但在生理条件下,植物自发荧光对拉曼成像会有一定干扰,除此之外,较高的时空分辨率也需要更长的成像时间。
相干反斯托克斯拉曼散射(coherent anti-stokes Raman scattering, CARS)显微术和受激拉曼散射(stimulated Raman scattering, SRS)显微术都属于相干拉曼散射(coherent Raman scattering, CRS)显微术,均利用两束相干光照射样品,使获得的拉曼信号大幅度增强[37]。而自发拉曼散射(spontaneous Raman scattering)作为拉曼光谱仪对样品化学键进行检测的常用技术,通常使用一束单色激光,激光与样品中分子发生非弹性碰撞,散射出来的光可以携带样品中分子水平的信息。其劣势在于仅有极少数的光子(约千万分之一)可以发生自发拉曼散射,信号强度较低[38],CARS信号强度比自发拉曼散射提高了 104-105倍,但存在非共振背景,信噪比较低[39]。而SRS不受非共振背景的干扰,其信号强度仅与分析物浓度线性相关[40],具有更高的信噪比,且成像时间大大缩短。例如,Zeng等[41]用SRS成像玉米秸秆细胞壁木聚糖,发现木聚糖可以从纤维素和木质素中原位分解。有研究利用SRS对枇杷果肉进行大面积快速成像发现,木质素会在贮藏期间增加,进而对细胞进行区域成像后发现木质素主要在枇杷果肉细胞角隅处和中间层积累[42]。此外,He等[43]利用拉曼标签4-氨基硫酚标记果胶,通过表面增强拉曼散射(surface-enhanced Raman scattering)揭示了靶向酶水解后果胶和木葡聚糖的变化,从而成像洋葱表皮细胞壁中果胶和木葡聚糖的分布。由此可见,拉曼显微技术正逐渐成为研究植物细胞壁成分分布和变化的重要工具。
2.3 点击化学
点击化学(click chemistry)是前沿的新型成像标记技术。2022年,Carolyn R.Bertozzi、Morten Meldal和K.Barry Sharpless三位科学家因“对点击化学和生物正交化学的发展”所作出的贡献获得诺贝尔化学奖。点击化学反应是指通过小单元的拼接,来快速可靠地完成各种分子的化学合成。其不仅可以应用于化学领域,更能广泛地应用于生物领域。在生物相关领域的研究中,重点关注通过高效的偶联反应,实现细胞壁和膜组分可视化。点击化学反应条件简单、原料和反应试剂易得、合成反应快速,但使用铜作为催化剂对植物有一定的毒害作用,长时间孵育会损害植物原有的生理状态。
点击化学可以应用于植物不同发育时期细胞壁成分变化的观察。岩藻糖是果胶RG-I的主要成分之一,Anderson等[44]利用含叠氮基团的荧光染料Alexa 488-azide和Alexa 594-azide对岩藻糖类似物FucAl进行标记,成像拟南芥根表皮细胞壁中从根冠到根毛区FucAl的分布发现,细胞壁中岩藻糖的传递和分布的空间模式随着发育时间而改变。点击化学还可以实现细胞壁多糖沉积的可视化。在植物中,Kdo是一种单糖,只存在于果胶RG-II中,Dumont等[45]利用Alexa 488-azide对Kdo类似物Kdo-N3标记,Alexa Fluor 594-N3对岩藻糖类似物进行标记,Kdo-N3和FucAl可以通过代谢整合到拟南芥根的细胞壁中,对两种单糖类似物的共定位表明,新合成的RG-I和RG-II在根细胞壁中有相似的空间分布。由此可见,点击化学弥补了荧光标签只能标记蛋白质的不足,可以实现对活细胞中多糖和脂质的动态追踪,在植物细胞壁生物合成的研究中具有很大应用潜力。
2.4 傅里叶变换红外光谱技术
傅里叶变换红外光谱(fourier transform infrared spectroscopy, FTIR)技术被广泛应用于各种领域,其在植物研究,尤其是在细胞壁研究中也逐渐发挥着越来越大的作用。不同化合物有不同的分子振动频率,FTIR通过检测化合物的红外分子吸收光谱,从而对样品中的不同化合物进行鉴定[46]。FTIR优点在于只需要少量样品,就可以无损快速分析细胞壁结构成分[47],但在定量分析的准确性方面还存在不足[48]。
主成分分析(principal component analysis, PCA)与FTIR的结合可以将复杂的数据降维分析,减少分析程序,降低成本[49]。Wang等[50]利用FTIR和PCA对小麦茎秆细胞壁成分进行研究,筛选出了抗倒伏和茎秆强度高的小麦品种。FTIR还可以成像细胞壁成分分布。如Zhu等[51]利用FTIR成像竹子细胞壁聚合物的空间分布发现,木质素、木聚糖和羟基肉桂酸更多地集中在木质部导管附近的纤维中,而纤维素则均匀分布在整个纤维鞘中。除此之外,尽管无法对细胞壁成分进行精确定量,但FTIR仍然可以应用于细胞壁成分变化的研究。例如,Xiao等[52]利用FTIR对核桃外壳细胞壁进行研究发现,在核桃成熟过程中,其外壳细胞细胞壁中纤维素、木质素等含量都明显增加。值得注意的是,Cuello等[53]基于衰减全反射傅里叶变换红外光谱(attenuated total reflection-fourier transform infrared spectroscopy, ATR-FTIR)将不同类型细胞的细胞壁进行区分,这为研究细胞壁的结构成分提供了一种新方法。综上所述,FTIR可以快速无损的鉴定植物细胞壁结构成分,越来越成为植物细胞壁成分和结构研究的重要技术。
为了进一步对比几种新型的细胞壁成像技术,我们将不同的细胞壁成像技术的原理和优缺点总结在表1中,其中AFM的优势在于可以在生理状态下对细胞表面多糖进行检测和观察,具有原子级分辨率。拉曼显微术可以定位和定量细胞壁成分,如木质素、纤维素等,其中SRS具有成像快、信噪比高等优势。点击化学反应利用多炔分子等标记多糖类似物,可以观察活体状态下细胞壁多糖的积累。与拉曼显微技术类似,FTIR无需标记,可以快速无损对细胞壁不同成分的丰度和分布进行检测,但空间分辨率有限[54]。除了上述技术,超分辨技术如结构光照明显微镜(structured-illumination microscopy,SIM)、随机光学重建显微镜(stochastic optical reconstruction microscopy, STORM)[55]等作为新型的成像技术在推动细胞壁结构的研究中也发挥着重要的作用。

表1 细胞壁成像技术原理及优缺点Table1 Principles and advantages/disadvantages of imaging technologies of plant cell wall
3 细胞壁的结构对其力学性质的影响
3.1 微纤丝的长度和纤维素含量影响细胞壁的力学性质
微纤丝作为细胞壁组成的重要结构,主要由纤维素平行排列而成的基本纤丝聚合而成[56]。2021年,最新发表在Science的文章中,首次采用分子模拟技术构建了细胞壁的纳微结构模型,对洋葱表皮细胞壁的力学性质进行研究发现,纤维素微纤丝越长,细胞壁的力学性能越强,而果胶以及木葡聚糖的长度对细胞壁力学性能的影响并不显著[57]。汪清焰等[58]利用水稻矮杆突变体研究细胞壁组分与力学性质的关系发现,水稻茎秆强度与纤维素含量显著正相关。Kokubo等[59]对大麦茎秆强度进行研究发现,纤维素含量越多,茎秆强度越大。由此可见,通常微纤丝越长,纤维素含量越多,细胞壁的力学性能越好(图2)。

图2 影响细胞壁力学性质的主要因素Fig.2 Main factors influencing the mechanical property of cell wall
3.2 微纤丝角大小影响细胞壁的力学性质
微纤丝角(microfibril angle, MFA)作为微纤丝与细胞主轴的夹角,对细胞壁的力学性能同样具有重要影响。李帅伟等[60]利用纳米压痕技术研究毛竹纤维细胞壁的力学性质发现,毛竹纤维纵向比横向具有更好的抗蠕变变形能力。这是由于微纤丝排列方向与细胞轴几乎平行,当木材纵向受力时,微纤丝角变小,所以木材纵向力学性能通常好于横向[61]。刘苍伟等[62]利用纳米压痕技术和广角X-射线散射法分别测试了毛竹厚壁纤维细胞壁的力学性能和微纤丝角发现,具有较小微纤丝角的成熟期竹材力学性能更好。由此可见,微纤丝角较小时,木材的力学性能较好(图2)。此外,木材不同层次也具有不同的微纤丝角。Bonham 等[63]通过使用X射线衍射仪对白桦由内往外微纤丝角进行比较,发现从髓到树皮,微纤维角减小,而通常木材木质部硬度大于髓,这和微纤丝角影响木材硬度的结论相一致。值得注意的是,细胞壁力学性能也会随着应力的变化而改变。李青林等[64]利用切片技术和纳米压痕技术对黄瓜叶肉细胞细胞壁的力学性能进行测试发现,当应力超过一定范围后,细胞壁的弹性会从线性变为非线性。
3.3 果胶、半纤维素和木质素的含量影响细胞壁的力学性质
纤维素、半纤维素、果胶和木质素等相互交联共同构成细胞壁复杂的纳微网络结构,其细胞壁不同组分之间交联形成的网络结构对其力学性质具有重要的影响。研究发现其中半纤维素随机分布在纤维素表面,结构松散,主要影响细胞壁横向力学性能[63]。此外,也有研究发现半纤维素可能会对木材的蠕变行为产生影响[65]。而木质素取向度较低,决定着木材细胞壁的抗压强度[65]。值得注意的是,果胶酯化是影响细胞壁可塑性和机械强度的重要因素[66]。Lahaye等[67]在针对不同品种苹果细胞壁多糖对其果肉力学特性的研究中发现,果胶侧链通过调节纤维素的滑动来影响组织的硬度。此外,也有研究发现除了微纤丝角、结晶纤维素含量以及木质素、果胶、半纤维素成分比例之外,次生壁S2的结构也影响着细胞壁的力学性质[68]。
4 总结和展望
植物细胞壁作为包裹在原生质体外围的特殊结构,是地球上极为重要的可再生资源,在造纸、纺织、家具等行业发挥着重要的作用。研究细胞壁组分、结构以及对其力学性质的影响,对植物细胞壁优良性状的改良和利用具有重要的意义。植物细胞壁结构和成分复杂,在不同物种、组织和细胞类型中具有差异性。传统的细胞壁化学分析方法通常需要对植物组织进行粉碎、研磨、提取等复杂的过程。此外,在细胞壁标记成像方面,被广泛应用的组织化学染色特异性不足,有机荧光免疫标记光稳定性差,而荧光蛋白则存在着光漂白的问题。近年来,随着新型成像技术的发展,对细胞壁的纳微结构和成分的研究具有重要的推动作用, 如原子力显微镜、拉曼显微术以及傅里叶变换红外光谱技术,可以实现对细胞壁结构信息的无标记原位分析,为深入探究细胞壁的化学成分提供了广阔的空间。与此同时,点击化学作为一种新型标记技术,突破了荧光标签只能标记蛋白质的限制,实现对活细胞中多糖和脂质的动态追踪,对细胞壁的动态形成过程的研究具有重要意义。
近年来随着新型成像技术的发展,虽然对细胞壁结构和成分的研究不断深入,但还有很多方向值得去进一步深入探究:(1)植物细胞壁的形成是一个动态过程,纤维素、半纤维素、果胶以及木质素等多种组分合成后在质膜外形成复杂交联网络,针对细胞壁形成的动态机理仍值得深入研究。(2)建立细胞壁多组分的共标记技术,借助和发展新型的成像技术,实现对细胞壁复杂空间结构和多种成分同时可视化的动态原位观察和分析,对深入探究细胞壁不同组分之间复杂的交联网络结构和形成过程具有重要的意义。(3)随着计算机水平和人工智能的发展,分子模拟技术和高通量的分析技术,也将成为细胞壁研究的有力支撑手段,将推动植物细胞壁结构及其力学性质等相关研究的发展。相信未来,随着新型的标记技术、成像技术、模拟技术和人工智能等研究手段的不断发展,将对细胞壁的成分、结构、动态形成机制及其力学性质等重要方面的研究具有重要的推动作用。
