粗根荨麻不同部位多糖的提取及其对巨噬细胞的调节作用
2023-08-15杨倩何舒婷王重娟吴明一
杨倩,何舒婷,孟 东,王重娟 ,吴明一
(1.大理大学药学院,云南大理 671003;2.昆明医科大学附属延安医院,云南昆明 650051;3.中国科学院昆明植物研究所,云南昆明 650204)
荨麻(UrticaL.)为被子植物门、荨麻科、荨麻属一年生或多年生草本植物,具有悠久的食用和药用历史,其叶子常作为蔬菜用于烹饪,而风干的茎和根则可用于泡茶。早在《本草纲目》、《本草图经》中就有记载,荨麻具有祛风通络、平肝定惊、消积通便、解毒等功效。现代药理学研究也表明荨麻具有抗炎、免疫调节等功效,能够用于治疗前列腺炎、风湿病、扭伤疼痛、荨麻疹、白癜风、皮肤瘙痒等疾病[1−3]。荨麻属植物在我国产量充沛,在全世界现今所知的36 种荨麻属植物中,有23 种分布在我国各地区,其中粗根荨麻(Urtica macrorrhizaHand.-Mazz.)具长而粗的木质化根状茎,产量大,疗效确切且毒副作用小,具有较高的研发价值。
近年来的多项研究表明,荨麻属植物中含有丰富的营养物质,包括黄酮类、多糖类、木脂素类、氨基酸、类胡萝卜素和脂肪酸等[4−8]。其中多糖是细胞组成和生命活动中不可或缺的物质,具有免疫调节、抗肿瘤、抗氧化、抗病毒等多种生物活性[9−12]。Chen等[13]研究表明,荨麻多糖能够有效治疗前列腺增生。本课题组前期研究发现口服粗根荨麻粗多糖对肠道免疫系统具有调节作用,能够显著改善环磷酰胺导致的肠道粘膜损害和免疫低下[14−16]。
然而,由于多糖的生理活性及其他方面的特性取决于其结构基础,多糖分子量大小、单糖组成、单糖的连接方式等均会影响多糖的活性[17−19],因此,不同来源的多糖由于其结构不同,活性也存在较大差异,导致许多学者和消费者对其质量和功效心存疑虑[20]。荨麻属植物的根、茎、叶均可食用和入药,Faleri 等[21]研究表明异株荨麻不同部位多糖的结构或组成存在差异,具有不同的用途及功效。但目前关于粗根荨麻不同部位多糖的化学组成及功效差异尚不明确,这是进一步开发粗根荨麻多糖类的食品及药品亟需解决的问题。
本文以粗根荨麻为研究对象,采用热水提取、乙醇分级沉淀法制备不同部位粗多糖,利用高效凝胶渗透色谱法(HPGPC)、单糖组成、红外等化学及光谱方法,对6 种多糖进行理化性质和结构结构的研究。最后以Raw264.7 细胞为模型,评价不同部位粗多糖对巨噬细胞毒性、形态、吞噬功能、细胞因子分泌水平的调节作用,以期为粗根荨麻多糖的免疫活性研究及质量标准的确定提供一定的科学依据。
1 材料与方法
1.1 材料与仪器
云南粗根荨麻 2021 年7 月采自云南大理,经中国科学院昆明植物研究所杨文光鉴定为粗根荨麻(Urtica macrorrhizaHand.-Mazz.)的全草;D-葡萄糖醛酸(D-GlcA)、D-葡萄糖(D-Glc)、D-半乳糖(DGal)、D-半乳糖醛酸(D-GalA)、D-N-乙酰葡糖胺(DGlcNAc)美国Sigma 公司;L-鼠李糖(L-Rha)、D-甘露糖(D-Man)、D-阿拉伯糖(D-Ara)Alfa Aesar公司;右旋糖苷标准品D0、D1、D2、D3、D4、D5、D6、D7、D8 中国药品生物制品检定所;1-苯基-3-甲基-5-吡唑啉酮(PMP)、三氟乙酸(TFA)上海阿拉丁生化科技股份有限公司;30%过氧化氢(H2O2)天津市大茂化学试剂厂;甲醇和乙腈为色谱纯北京迈瑞达科技有限公司;细胞实验级Lipopolysaccharides(LPS)来源于大肠杆菌055:B5 美国Sigma公司;中性红染色剂、3-(4,5-二甲基噻唑-2)-2(MTT)北京索莱宝生物科技有限公司;青链霉素美国Millipore 公司;DMEM 高糖培养基、胰蛋白酶 美国HyClone 公司;一氧化氮(NO)检测试剂盒上海碧云天生物技术有限公司(批号:061322220805);人肿瘤坏死因子α(TNF-α)ELISA 试剂盒 深圳欣博盛生物科技有限公司(批号:M220906-102a);95%乙醇为市售食品级,其他试剂均为分析纯;小鼠巨噬细胞Raw264.7 加拿大ABM 公司,培养在含10%胎牛血清(FBS)、100 U/mL 青霉素和100 μg/mL链霉素的DMEM 高糖培养基中,培养条件为5%CO2,温度为37 ℃,湿度为95%。
1260 Infinity 高效液相色谱仪 Agilent Technologies 公司;UV-2600 紫外分光光度计 日本岛津公司;Tensor 27 傅立叶变换红外光谱仪 德国Bruker公司;2500A 粉碎机 永康市速锋工贸有限公司;FD-1A-50 低温冷冻干燥机 北京博医康实验仪器有限公司;RE 2000A 旋转蒸发器 上海亚荣生化仪器厂;SQP 十万分之一天平 Sartorius 科学仪器有限公司;Neofuge 13R 高速冷冻离心机 上海力新仪器有限公司;Model 550 全自动酶标仪 美国 Bio-Rad 公司;DMi1 倒置显微镜 德国Leica。
1.2 实验方法
1.2.1 粗根荨麻不同部位粗多糖的制备 采用热水提取、乙醇分级沉淀、H2O2脱色的方法提取纯化粗根荨麻多糖[14,22]。分别称取粗根荨麻不同部位(根、茎、叶)粉末300 g 置于回流装置中,加入95%乙醇1.5 L,搅拌条件下,70 ℃回流3 h,重复2 次,以除去药材中脂溶性小分子物质,收集药渣,室温晾干。将药渣置于回流装置中,加入去离子水3 L,搅拌条件下,70 ℃回流提取3 h,重复提取2 次,合并两次提取液。依次加入95%乙醇,使其终浓度分别为40%、60%(v/v),搅拌后离心(4000 r/min,15 min),分别收集沉淀。加入3 倍量去离子水溶解,调节pH 至9~10。缓慢加入30% H2O2使其终浓度达3%,50 ℃水浴搅拌反应1.5 h。调节pH 至中性后将溶液离心(4000 r/min,15 min),上清液中加入终浓度为70%(v/v)的乙醇,离心收集沉淀,重复操作2 次,收集沉淀。真空干燥箱干燥,即得粗根荨麻叶粗多糖(UML40、UML60)、茎粗多糖(UMS40、UMS60)、根粗多糖(UMR40、UMR60),提取流程如图1 所示。不同部位粗多糖产率或占比计算公式如下:
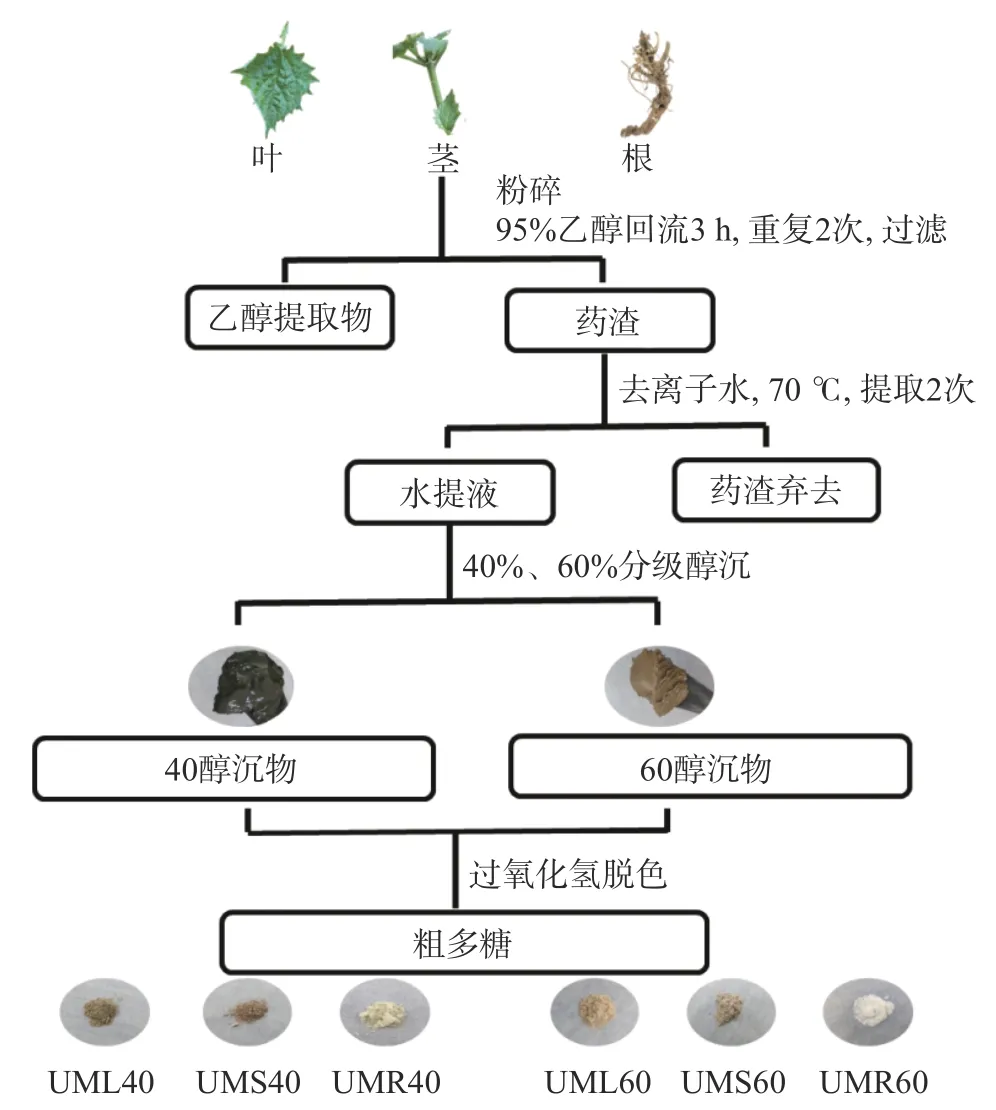
图1 粗根荨麻粗多糖提取分离流程图Fig.1 Extraction and separation procedure of polysaccharides from Urtica macrorrhiza Hand.-Mazz.
1.2.2 多糖分子量的测定 采用高效凝胶渗透色谱法(High performance gel permeation chromatography,HPGPC)对多糖分子量分布进行测定[23]。标准品溶液和供试品溶液的制备:分别称取粗根荨麻不同部位多糖(UML40、UML60、UMS40、UMS60、UMR40、UMR60)和右旋糖苷标准品(180、2700、5250、9750、13050、36800、646500、135350 和2000 kDa)10 mg,加1 mL 去离子水溶解,0.22 μm 滤膜过滤。色谱分析条件:Agilent 1260 HPLC 系统,Agilent 示差检测器,Shodex Ohpak SB-806HQ 凝胶色谱柱,流动相:0.1 mol/L NaCl,流速:0.5 mL/min,柱温:35 ℃,示差检测器温度:40 ℃,进样量:20 μL。应用GPC 软件分析数据,绘制标准曲线,得到回归方程:lgMw=10.96−0.501Rt+0.006049Rt2−4.485e−5Rt3(Mw:重均分子量,Rt :保留时间),R2=0.9999。根据回归方程计算样品的相对分子量。
1.2.3 单糖组成分析
1.2.3.1 单糖标准品溶液和供试品溶液的制备 分别取D-Man、L-Rha、D-Glc、D-Gal 和D-Ara 单糖标准品各10 mg 和D-GlcNAc、D-GlcA、D-GalA 单糖标准品各20 mg,分别加水定容至10 mL。精密量取各对照品溶液100 μL,加水定容至1 mL,混匀,即得混合单糖对照品溶液。各粗根荨麻粗多糖供试品以去离子水配制成4 mg/mL 溶液。
1.2.3.2 多糖水解和衍生化产物的制备 精密量取各单糖标准制品、单糖标准混合溶液制品和粗根荨麻粗多糖样品1 mL,加4 mol/L 的TFA 1 mL,110 ℃水解4 h;蒸干,加200 μL 去离子水溶解,加入200 μL 0.6 mol/L 的NaOH 溶液和400 μL 0.5 mol/L 的PMP甲醇溶液,充分混合;70 ℃衍生化反应1 h,HCl 溶液中和后,加入CHCl3萃取3 次,水相经0.22 μm 的微孔滤膜过滤后供液相色谱分析。
1.2.3.3 色谱分析条件 色谱柱:Hadesil C18-BIO(250 mm×4.6 mm,5 μm);柱温:25 ℃;流动相:0.1 mol/L 磷酸盐缓冲液(pH6.8)缓冲液-乙腈(82:18);流速:1 mL/min;进样体积:3 μL;DAD 检测器,检测波长:250 nm,进样时间:75 min。
1.2.3.4 标准曲线的绘制 以浓度为横坐标,峰面积为纵坐标绘制标准曲线,得到的回归方程如表1 所示。计算样品中各单糖的浓度,将D-Man 的摩尔数定为1,计算其它单糖与D-Man 的摩尔比。
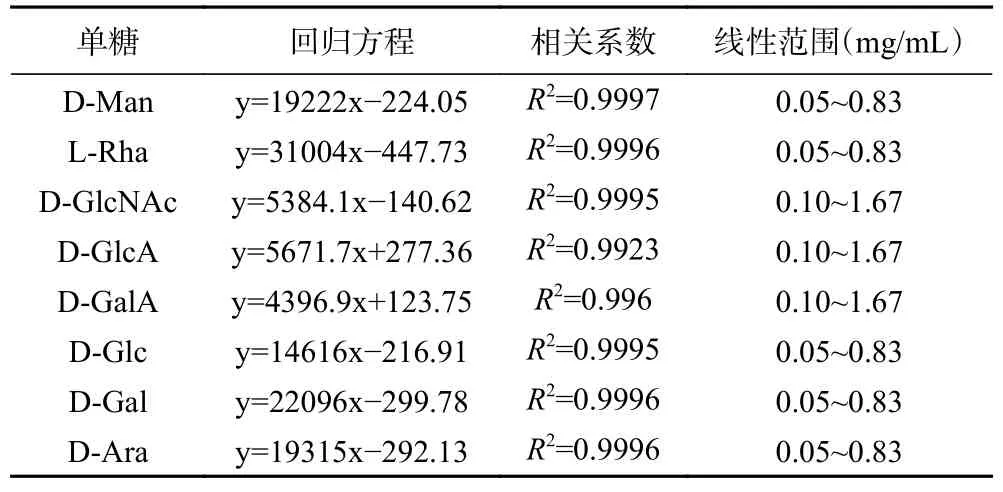
表1 各单糖PMP 衍生物的回归方程和线性范围Table 1 Regression equations and linear ranges of PMP derivatives of each monosaccharides
1.2.4 光谱分析
1.2.4.1 全波长分析 将UML40、UML60、UMS40、UMS60、UMR40、UMR60 加水溶解至0.25 mg/mL,在190~800 nm 波长范围内进行连续扫描。
1.2.4.2 红外光谱分析 根据2020 版《中国药典》第四部的固体压片法[24]:分别称取粗根荨麻不同部位粗多糖各1 mg,加适量KBr 压片,利用傅里叶变换红外光谱在4000~400 cm−1波长下扫描。
机能实验学课程除了由经典教学实验内容归纳的基础性实验以及由“三理”学科实验有机整合的综合性实验项目外,还依托学校的本科生科研训练计划(Student Research Training Program,SRTP),展开了面向本科生的开放实验。SRTP项目的重点在于由学生自主查阅文献、立项开题、书写设计报告,最后完成实验,具有一定的技术含量与难度。机能实验技术人员应该视其为教学相长的过程,积极配合指导教师,协同指导,高效高质量完成开放实验培训计划[7]。不断巩固相关理论知识和仪器操作能力,加强实验仪器使用的统筹安排能力,把机能实验开放工作当做全新挑战,丰富教学科研经验。
1.2.5 MTT 法考察粗根荨麻多糖的细胞毒性 将Raw264.7 细胞以1×104个/孔铺入96 孔板中培养24 h。分别加入含有各浓度粗根荨麻粗多糖的新鲜培养基(低浓度:0.1 μg/mL、中浓度:1 μg/mL、高浓度:10 μg/mL),每孔150 μL,继续培养24 h。每孔加入20 μL 5 mg/mL 的MTT 溶液,37 ℃继续培养4 h,弃去培养基,每孔加入150 μL DMSO 溶液,振荡混匀,在酶标仪上测定490 nm 处吸光度A 值。细胞存活率计算公式如下:
1.2.6 中性红实验考察粗根荨麻多糖对巨噬细胞吞噬活性的影响 将Raw264.7 细胞以1×104个/孔铺入96 孔板中培养24 h。分别加入含有各浓度粗根荨麻粗多糖的新鲜培养基(低浓度:0.1 μg/mL、中浓度:1 μg/mL、高浓度:10 μg/mL),每孔150 μL。以1 μg/mL LPS 为阳性对照。继续培养24 h 后于倒置显微镜观察细胞形态并拍照。弃去培养基,各孔分别加入含有中性红1 mg/mL 的PBS 溶液,继续培养30 min。弃去上清液,用预冷的PBS 洗3 遍,每孔加入细胞裂解液(乙醇:冰醋酸=1:1)100 μL,室温下放置2 h,待细胞溶解后,在酶标仪上测定540 nm处吸光度A 值。吞噬率计算公式如下:
1.2.7 Griess 和ELISA 法检测粗根荨麻多糖对巨噬细胞细胞因子释放的影响 Raw264.7 细胞以2×105个/孔铺入24 孔板中培养24 h。分别加入含有各浓度粗根荨麻粗多糖的新鲜培养基(低浓度:0.1 μg/mL、中浓度:1 μg/mL、高浓度:10 μg/mL),每孔500 μL。以1 μg/mL LPS 为阳性对照。继续培养24 h 后收集培养液,−80 ℃保存备用。分别按照Griess 和ELISA 试剂盒说明书检测培养液中NO 和TNF-α和的含量。
1.3 数据处理
每组试验均重复3 次,计量资料以平均值±标准差表示;采用SPSS 20.0 软件对数据进行差异性显著分析,多组间比较采用单因素方差分析,两两比较采用LSD-t法,检验水准α=0.05;采用GraphPad Prism 9 软件绘图。
2 结果与分析
2.1 粗根荨麻不同部位粗多糖产率及性状
粗根荨麻叶、茎和根的多糖水提液由深绿色至深棕色,考虑含有色素可能性大,进一步脱色,所得粗多糖呈淡黄色,粉末细腻,具引湿性。粗根荨麻不同部位粗多糖产率如表2 所示,叶粗多糖产率最高,占总多糖产量的71.74%,茎粗多糖和根粗多糖占比分别为10.71%和17.55%。
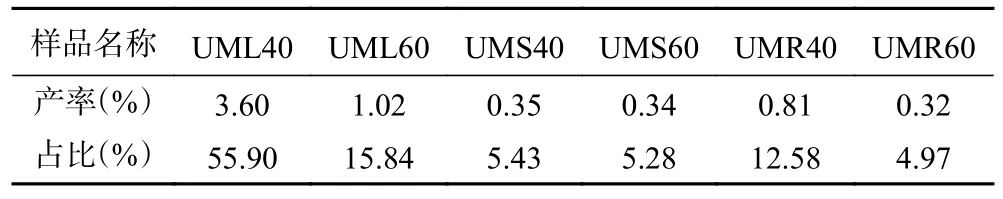
表2 粗根荨麻不同部位粗多糖得率及占比Table 2 The yield and proportion of crude polysaccharide in different parts of Urtica macrorrhiza Hand.-Mazz.
2.2 粗根荨麻不同部位粗多糖分子量及分布
由于不同分子量的多糖在低醇中溶解度不同,随着乙醇量的增加,分子量由大到小的多糖将逐级沉淀出来,本研究分别采用40%(v/v)和60%(v/v)的乙醇对各部分粗多糖进行分级沉淀,不同部位粗多糖的分子量分布曲线如图2 所示,各部位多糖40%(v/v)乙醇沉淀分子量均大于60%(v/v)乙醇沉淀,这与Gu 等[22]的研究结果一致。粗根荨麻叶粗多糖UML40和UML60 的平均重均分子量较小,主要分布在2.11和2.74 kDa;茎粗多糖UMS40 主要分布在68.54 kDa,UMS40 主要分布在61.94 kDa;根粗多糖UMR40分子量较大,主要分布在802.21 kDa,UMR60 主要分布在38.06 kDa。根和茎作为植物能量储存和支撑组织,多为纤维素和果胶等多聚糖构成,因而分子量较大,而叶中的多糖主要为光合作用的初级产物,为低聚多糖,因而分子量较小。
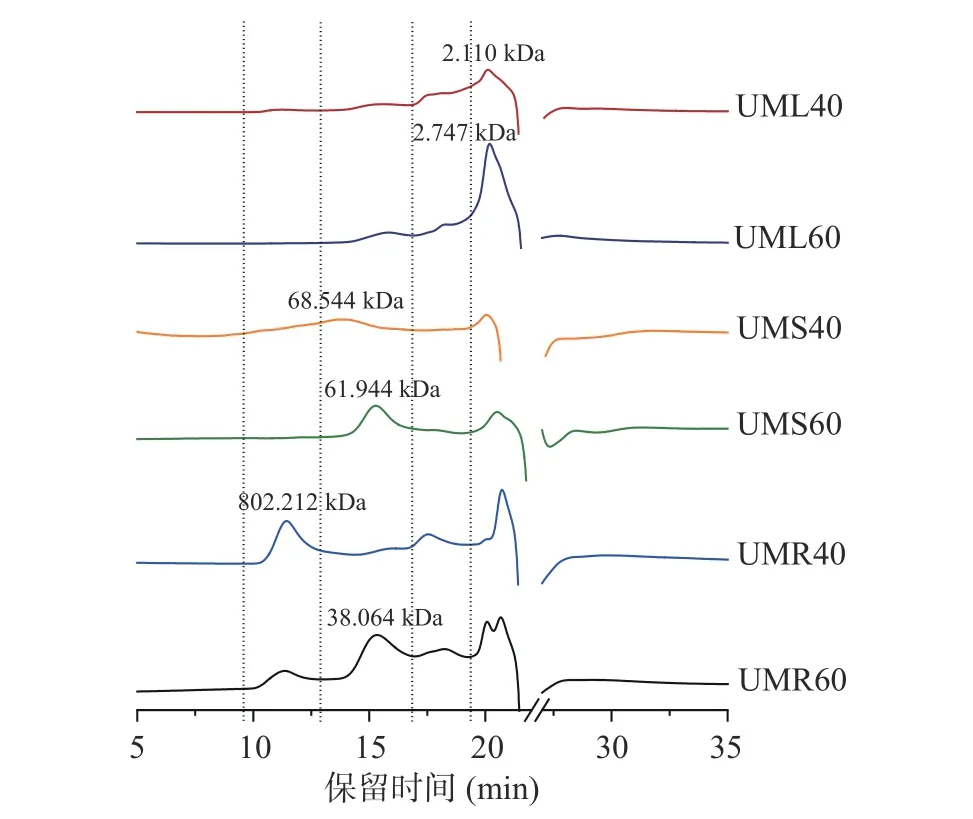
图2 粗根荨麻各部位粗多糖的分子量分布曲线Fig.2 Molecular weight distribution curves of crude polysaccharides from different parts of Urtica macrorrhiza Hand.-Mazz.
2.3 单糖组成分析

表3 粗根荨麻不同部位粗多糖的单糖比例Table 3 Characteristics of monosaccharide composition of crude polysaccharides from different parts of Urtica macrorrhiza Hand.-Mazz.
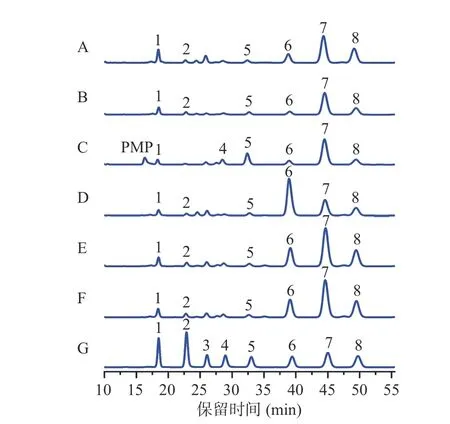
图3 经PMP 衍生化后的HPLC 图UML40(A)、UML60(B)、UMS40(C)、UMS60(D)、UMR40(E)、UMR60(F)、标准混合单糖(G)Fig.3 HPLC chromatogram of PMP derivatives of UML40 (A),UML60 (B),UMS40 (C),UMS60 (D),UMR40 (E),UMR60 (F)and standard mixed monosaccharides (G)
2.4 粗根荨麻不同部位粗多糖的光谱分析
2.4.1 全波长分析 结果如图4A 所示,粗根荨麻叶和根多糖在280 nm 处具有少量吸收,说明样品中有少量蛋白质存在,而茎多糖在260 和280 nm 处均无吸收,说明样品中不存在核酸和蛋白质。
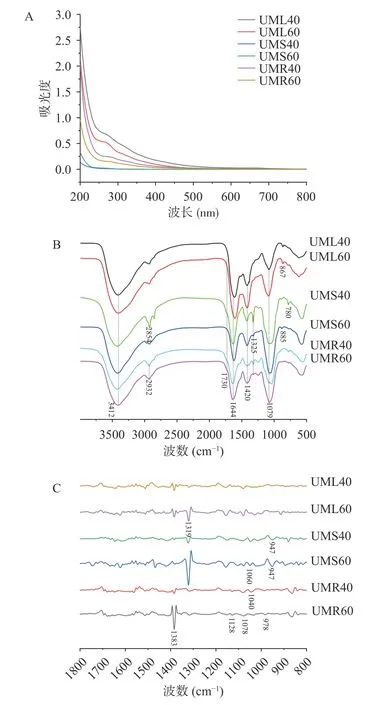
图4 粗根荨麻各部位多糖全波长扫描图(A),红外光谱图(B)与二阶求导红外光谱图(C)Fig.4 Spectroscopic analysis of polysaccharides from different parts of Urtica macrorrhiza Hand.-Mazz.full wavelength scanning (A),infrared spectrum (B) and second derivative infrared spectrum (C)
2.4.2 红外光谱分析 粗根荨麻不同部位粗多糖的红外光谱见图4B,6 种多糖的红外吸收光谱形状相似,均具有糖类复合物官能团特征吸收峰,3412 cm−1处有较强吸收,这是多糖中O-H 的伸缩振动引起的,2932 cm−1处的吸收是C-H 吸收振动峰[28];此外,红外分析显示,在1730 cm−1附近未检测到明显的吸收峰,说明粗根荨麻各部位多糖中的糖醛酸是未酯化的糖醛酸,1644 cm−1处的吸收峰为羧基的C=O 的非对称伸缩振动峰[29]。1400~1200 cm−1的吸收峰是CH 键的角变振动峰;约1000~1200 cm−1显示为C-OC 和C-O-H 键的存在,为吡喃糖的特征峰。920~840 cm−1存在多条吸收带,提示存在α和β构型。红外光谱结果表明,各部位粗多糖的特征官能团和骨架结构基本一致[30]。二阶导数光谱通过求导使斜率变大峰形状变尖,能够更好的分辨红外光谱图中重叠的吸收峰。图4C 为各粗多糖二阶求导红外光谱图,粗根荨麻叶、根多糖在1383 cm−1均存在吸收峰,提示其为蛋白结合多糖;而UMS40和UMS60 在1383 cm−1处无明显吸收峰,与全波长扫描测定结果一致。
2.5 粗根荨麻不同部位粗多糖的毒性
巨噬细胞是研究细胞免疫和分子免疫的重要工具,在机体免疫应答和防御中具有重要作用。因此,本研究选择小鼠巨噬细胞Raw264.7 作为细胞模型,评价粗根荨麻多糖对Raw264.7 细胞的调节作用。首先通过MTT 法考察了各粗多糖对巨噬细胞的毒性。结果如图5 所示,UML60 具有较大的细胞毒性,1 μg/mL 的UML60 即可使细胞存活率降低至80%以下,此外,10 μg/mL 的UMR40 也具有一定的细胞毒性。其余各多糖在10 μg/mL 浓度以内均能使细胞存活率保持在80%以上。
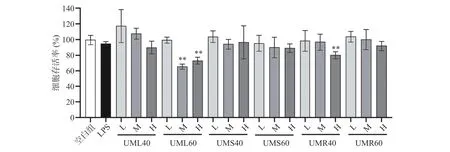
图5 粗根荨麻不同部位粗多糖对巨噬细胞的毒性Fig.5 Toxicity of crude polysaccharides from different parts of Urtica macrorrhiza Hand.-Mazz.to macrophages
2.6 粗根荨麻不同部位粗多糖对巨噬细胞形态的影响
巨噬细胞的形态在一定程度上可以反应其被激活的程度,本研究考察了不同浓度的粗根荨麻多糖对巨噬细胞形态的影响,结果如图6 所示。空白对照组中巨噬细胞呈圆形或椭圆形,较少见突起,细胞内未见空泡。采用LPS 处理24 h 后,细胞体积变大,出现较多伪足和细胞内空泡(白色箭头所示),细胞变为梭形、椭圆形或不规则形,呈现激活状态。UML40在中浓度和高浓度下能够促进巨噬细胞分化,UML60不能促进巨噬细胞分化,且中、高浓度下可见巨噬细胞死亡,说明其具有一定的细胞毒性,与MTT 检测结果一致。茎多糖UMS40 和UMS60 激活巨噬细胞的活性均较弱,仅UMS40 在高浓度下能够促进其分化。根多糖对巨噬细胞的激活作用最强,各浓度的UMR40 和UMR60 均能够促进巨噬细胞分化。

图6 粗根荨麻不同部位粗多糖对巨噬细胞形态的影响Fig.6 Effect of crude polysaccharides from different parts of Urtica macrorrhiza Hand.-Mazz.on macrophage morphology
2.7 粗根荨麻不同部位粗多糖对巨噬细胞吞噬活性的影响
通过采中性红实验考察粗根荨麻不同部位粗多糖对巨噬细胞吞噬活性的影响,结果如图7 所示。低、中浓度的UML40 和各浓度的UMR40 均能显著促进巨噬细胞的吞噬活性(P<0.05),且以UMR40 促进细胞吞噬的活性最强,但UMR60 表现出一定的抑制巨噬细胞吞噬的作用。

图7 粗根荨麻不同部位粗多糖对巨噬细胞吞噬活性的影响Fig.7 The phagocytic activity of macrophages of polysaccharides from different parts of Urtica macrorrhiza Hand.-Mazz.
2.8 粗根荨麻不同部位粗多糖对巨噬细胞细胞因子分泌的影响
首先采用Griess 法检测了各粗多糖对巨噬细胞NO 释放量的影响,结果如图8A 所示,粗根荨麻根多糖促进巨噬细胞释放NO 的活性最强,各浓度的UMR40 和UMR60 均能够高度显著促进巨噬细胞释放NO(P<0.001),UMR60 的活性随着浓度的增加而增加,而UMR40 在1 μg/mL 时活性最强。此外,1 μg/mL 以上的UML40 以及10 μg/mL 的UMS40也能够显著促进巨噬细胞释放NO(P<0.05)。进一步采用ELISA 法检测了各粗多糖在高浓度(10 μg/mL)下对巨噬细胞TNF-α的影响,结果与NO 检测结果一致,UMR40 和UMR60 促TNF-α分泌的作用最强(P<0.001),UML60 和UMS60 不能促进巨噬细胞分泌TNF-α。
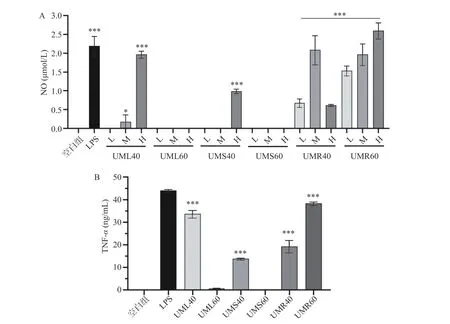
图8 粗根荨麻不同部位粗多糖对巨噬细胞细胞因子释放的影响Fig.8 Effects of polysaccharides from different parts of Urtica macrorrhiza Hand.-Mazz.on cytokine release from macrophages
结合上述巨噬细胞活性调节实验表明,本研究提取的6 个粗根荨麻多糖对巨噬细胞的调节作用存在差异,可能是由各多糖之间的结构差异导致的。一方面是分子量不同的多糖,其活性可能不同,Zhang等[31]的研究也表明,从云芝中提取的两种多糖,由于分子量不同,对巨噬细胞的激活作用也不同。另一方面单糖组成及其比例不同的多糖活性也不同,如Shen 等[32]的研究发现,柑橘中的两种多糖CAVAPI 和CAVAP-II 由相同类型的单糖组成,但D-Ara、D-Man、D-Glc 和D-Gal 的比例存在差异,CAVAPII 表现出更强的免疫增强活性。上述研究表明,来自不同部位的6 个粗根荨麻多糖在分子量及单糖组成上均存在一定的差异,因此对巨噬细胞的激活作用也不同,结合粗根荨麻多糖对巨噬细胞的分化、吞噬活性、以及细胞因子NO、TNF-α分泌的影响这3 个方面的实验数据分析,粗根荨麻根多糖具有更强的巨噬细胞激活作用。
3 结论
本研究通过热水提取和乙醇分级沉淀从粗根荨麻叶、茎、根中提取得到6 种粗多糖UML40、UML60、UMS40、UMS60、UMR40、UMR60,产率分别为3.60%、1.02%、0.35%、0.34%、0.81%、0.32%;平均重均分子量分别为2.11、2.74、68.54、61.94、802.12、38.06 kDa;6 种粗多糖均为酸性多糖,主要由DGlc、D-Gal、D-Ara 和D-GalA 组成,但不同部位粗多糖的单糖组成摩尔比不同。进一步研究了这些多糖对巨噬细胞的调控作用,结果表明,不同部位、不同分子量、不同单糖组成的粗根荨麻多糖活性存在较大差异,其中UML40、UMS40、UMR40 均能够显著活化巨噬细胞,促进巨噬细胞吞噬活性,并显著提高巨噬细胞免疫因子NO、TNF-α分泌水平;UMR60虽然不能促进巨噬细胞吞噬活性但能显著促进细胞因子的分泌;UML60 细胞毒性较大且活性较低;UMS60 在检测浓度范围内不能激活巨噬细胞。总体来说,粗根荨麻不同部位多糖在组成及免疫调节活性上存在一定差异,粗根荨麻根多糖具有更高的免疫调节活性,因此在对其进行研究及开发利用时应当注意质量控制并对根多糖给与更多的关注。本研究为今后深入研究粗根荨麻有效成分的结构鉴定及其免疫调节机制奠定基础,也可为开发粗根荨麻多糖的相关健康产品提供理论依据。
