电针对佐剂性关节炎大鼠膝关节滑膜组织血管内皮生长因子受体2/细胞分裂周期蛋白42信号通路的影响
2023-08-14张亮,唐丽亚,龙轶映,曹佳男,刘梨,赵凌云,瞿启睿,祁芳,艾坤
张亮,唐丽亚,龙轶映,曹佳男,刘梨,赵凌云,瞿启睿,祁芳,艾坤


〔摘要〕 目的 觀察电针对佐剂性关节炎(adjuvant arthritis, AA)大鼠膝关节滑膜组织内血管内皮生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR2)/细胞分裂周期蛋白42(cell division cycle 42, Cdc42)信号通路的影响,探究电针治疗类风湿关节炎(rheumatoid arthritis, RA)的可能机制。方法 采用随机数字表法将40只SPF级SD雄性大鼠分成空白组、模型组、西药组和电针组,每组10只。模型组、西药组、电针组大鼠采用尾根部皮下注射不完全弗氏佐剂(0.1 mL/只)制成AA大鼠模型。造模后第2天即开始干预,电针组进行电针干预,每次20 min,每天干预1次,共21次,西药组给予甲氨蝶呤灌胃给药,每周1次,共3次。观察各组体质量、关节红肿等一般情况;每3 d测量1次大鼠后双侧足跖容积,干预结束后,通过大鼠一般情况、体质量、足跖容积分析各组大鼠足跖肿胀程度, HE观察各组大鼠滑膜组织的病理形态学变化,免疫组织化学法检测膝关节滑膜组织内VEGFR2、CD34表达变化,Western blot检测大鼠膝关节滑膜组织VEGFR2、Cdc42蛋白表达量。结果 与空白组相比,模型组大鼠第21天足跖容积均明显增大(P<0.01),膝关节滑膜组织出现了显著性病理改变,CD34表达量明显升高(P<0.01),VEGFR2、Cdc42蛋白表达量显著升高(P<0.01)。与模型组相比,西药组、电针组大鼠足趾容积明显减小(P<0.01),膝关节滑膜组织病理改变明显改善,VEGFR2、Cdc42表达量显著下降(P<0.05,P<0.01)。结论 电针改善RA的作用机制可能与降低VEGFR2、Cdc42的表达从而抑制血管新生有关。
〔关键词〕 佐剂性关节炎;电针;VEGFR2;Cdc42;血管新生;内皮细胞;伪足
〔中图分类号〕R245.9 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.07.024
Effects of electroacupuncture on VEGFR2/Cdc42 signaling pathway
of knee synovial tissue in rats with adjuvant arthritis
ZHANG Liang1, TANG Liya1, LONG Yiying1, CAO Jianan1, LIU Li2, ZHAO Lingyun1, QU Qirui1,
QI Fang1*, AI Kun1*
1. School of Acupuncture-moxibustion, Tuina and Rehabilitation, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China
〔Abstract〕 Objective To observe the effects of electroacupuncture on vascular endothelial growth factor receptor 2 (VEGFR2)/cell division cycle 42 (CDC42) signaling pathway of knee synovial tissue in rats with adjuvant arthritis (AA), so as to explore possible mechanism of electroacupuncture in alleviating rheumatoid arthritis (RA). Methods A total of 40 male SPF SD rats were randomly divided into blank group, model group, western medicine group, and electroacupuncture group, with 10 rats in each group. AA rat models were made by subcutaneous injection of incomplete Freund's adjuvant (0.1 mL/rat) at the tail root of rats in model, western medicine, and electroacupuncture groups. On the second day after modeling, the rats in electroacupuncture group were given electroacupuncture for 20 min, once a day, for a total of 21 times, while the rats in western medicine group were given methotrexate intragastrically once a week for 3 times. Then, the general conditions including redness and swelling of joints, body weight, and others in each group were observed. And the volume of bilateral hind paws was measured once every 3 days. After the intervention, the degree of paw swelling of rats in each group was analyzed through the observation of general conditions and the measurement of plantar volume. Meanwhile, the pathomorphological changes of knee synovial tissue was observed by HE staining, the expressions of VEGFR2 and CD34 in synovial tissue of knee joint were determined by immunohistochemistry (IHC), and the protein expressions of VEGFR2 and Cdc42 were examined by Western blot. Results Compared with blank group, the plantar volume of rats in model group increased significantly on the 21st day (P<0.01), the synovial tissue of knee joint showed significant pathological changes, the expression level of CD34, and the protein expression levels of VEGFR2 and Cdc42 were significantly higher (P<0.01). Compared with model group, the plantar volume of rats in western medicine and electroacupuncture groups significantly reduced (P<0.01), the pathological changes of synovial tissue of knee joint were significantly improved, and the expression levels of VEGFR2 and Cdc42 were significantly lower (P<0.05, P<0.01). Conclusion The mechanism of electroacupuncture in improving RA may be related to the inhibition of angiogenesis by reducing the expressions of VEGFR2 and Cdc42.
〔Keywords〕 adjuvant arthritis; electroacupuncture; vascular endothelial growth factor receptor 2; cell division cycle 42; angiogenesis; endothelial cells; pseudopod
类风湿关节炎(rheumatoid arthritis, RA)是一种以侵蚀性关节滑膜炎症为主要临床表现的慢性自身免疫性疾病,血管翳是RA病变过程中的特征性产物,滑膜血管新生被认为是构成和维持血管翳的关键[1]。因此,抑制滑膜血管新生可作为治疗RA的重要靶点之一。研究证实,血管内皮生长因子(vascular endothelial growth factor, VEGF)及其信号通路参与血管新生的全部过程,血管内皮生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR2)是影响血管生成重要的受体之一[2-3]。VEGFR2活化后可通过细胞内信号转导途径诱导其胞浆内位点Tyr1214磷酸化后激活细胞分裂周期蛋白42(cell division cycle 42, Cdc42),促进内皮细胞伪足生成及其迁移,从而促进血管新生[4-5]。因此,抑制VEGFR2/Cdc42信号通路可作为抑制RA血管新生的重要思路。本课题组前期研究证实,电针能有效治疗RA,缓解炎性反应,且组织形态学结果发现电针干预后滑膜血管新生受到抑制且未见明显血管翳[6-7];CHEN等[8]研究表明,电针调控子宫内膜细胞血管新生与VEGFR2表达密切相关。目前,围绕电针抑制RA滑膜组织血管新生的机制研究尚不多见。因此,本研究选用佐剂性关节炎(adjuvant arthritis, AA)大鼠模型,采用电针干预,从调控VEGFR2/Cdc42信号通路抑制血管新生角度,探讨电针治疗RA血管新生的作用机制,为电针治疗RA的临床运用提供科学支持。
1 材料与方法
1.1 实验动物及分组
由湖南斯莱克景达实验动物公司提供的40只SPF级SD雄性大鼠,体质量(100±10) g,动物合格证号:430727211101621817,实验动物生产许可证号:SCXK(湘)2019-0009。40只大鼠以3只一笼饲养在湖南中医药大学动物实验中心,饲养室温度为(23±3) ℃,相对湿度60%±10%。适应性饲养7 d后开始实验,按随机数字表法将其分成空白组、模型组、西药组、电针组,每组10只。实验全程遵从《关于善待实验动物的指导性意见》(2006年版)中动物伦理学有关条规,本实验伦理编号:LLBH-202203140004。
1.2 主要试剂与仪器
灭活结核分枝杆菌(美国BD公司,批号:231141);矿物油(美国Sigma Aldrich公司,批号:M8410);VEGFR2抗体、Cdc42抗体、β-actin抗体、Rabbit二抗(美国Proteintech Group公司,批号分别为26415、10155、20536、SA00001-2)。
华佗牌电针治疗仪(苏州医疗用品有限公司,型号:SDZ-Ⅱ型);超净工作台(苏州净化设备厂,型号:SW-CJ-1FD);高速低温离心机(美国SCILOGBX公司,型号:D3024R);电泳仪(美国BIO-RAD公司,型号:041BR126545);GloMax酶標仪(美国Promega公司,型号:GM3030);磁力恒温搅拌器(金坛市城西峰峥嵘实验仪器厂,型号:HJ-4A);足跖容积测量仪(济南益延科技发展有限公司,型号:YLS-7C)。
1.3 模型制备
本实验采用不完全弗氏佐剂注射尾根部皮下组织造成的佐剂性关节炎大鼠模型[9-10]。将定量的灭活结核分枝杆菌与矿物油在通风柜中混合研磨至溶液清透无杂质,制成2.5 mg/mL的不完全弗氏佐剂。然后依次将模型组、西药组、电针组大鼠用异氟烷呼吸麻醉,用0.1 mL的微量注射器于尾根部皮下缓慢注射佐剂(0.1 mL/只)。观察关节外表现进行模型评价,若大鼠出现足爪红肿,全身及关节继发症状,提示造模成功。大鼠造模3 d后尾根部开始红肿,第9~12天尾根部脱皮甚至溃烂,后足关节出现红肿,第15~18天到达峰值,后足红肿加剧,甚至前肢、耳部也出现红肿、体质量下降等。
1.4 干预方法
于造模第2天开始干预,空白组、模型组大鼠以仰卧位固定于自制鼠板上20 min,不做其他处理,每天1次,共21次。电针组大鼠同法仰卧位固定于鼠板上,牙齿用牙线固定,使用华佗牌针灸针(0.25 mm×25 mm),遵循大鼠标准穴位定位图谱定位,左侧足三里与关元配穴,右侧足三里与同侧阿是穴配穴,接电针,选择疏密波(20/50 Hz的频率),电流强度通过观察针柄处抖动情况来判断,轻微抖动即可,留针20 min,每天1次,1个疗程7次,共3个疗程(21次)。西药组使用阳性对照药物甲氨蝶呤,按0.35 mg/kg每只计算灌胃给药[11],每周1次,共3个疗程(3次)。
1.5 取材
于干预第21天后禁食禁水,隔天在无菌操作台上用刀片拨开大鼠膝关节囊,取出清透淡黄色的滑膜组织,放入做好标记的冻存管中,于液氮中保存。
1.6 指标检测
1.6.1 一般情况观察 于实验过程中观察大鼠饮食、毛发、体质量、关节肿胀等一般情况,进行前后比较。
1.6.2 足跖容积测量 测量前,用防水不掉色黑色记号笔在大鼠后足踝关节处标好测量标线,为减少人为误差,注意每次测量标线以及测足肿均由专人完成,并且每次标线的位置不宜有较大偏差,应在第1次测量时使用墨水针头标记作为标线固点。将足跖容量测量仪放置水平固定的台面上,进行校零,量杯中装适中蒸馏水,测量时测量者先将大鼠一侧后足抻直,放进装有适量水的量杯中,直到后足的标线与量杯中液面平行,重复3次,再换下一侧后足,记录读数,后取其平均数进行数据统计。在造模后第1、9天及以后每隔3 d进行1次足跖容积的测量。
1.6.3 HE染色 备取已经固定好的膝关节滑膜组织,标定组号,流水清洗2 h,然后取出滑膜组织进行脱水,于56 ℃的石蜡浸泡进行包埋,包埋成块后,将石蜡置于切片机中,切分成5 μm的石蜡片,石蜡片放入水浴锅后展开贴在载玻片上进行烘干,60 ℃烘箱2 h。脱蜡后放入苏木精溶液中染色5 min,接着使用蒸馏水冲洗,浸透于1%氨水中返蓝,清水冲洗30~60 s后,于显微镜下观察细胞核的分色程度,之后置于1%伊红中染色,蒸馏水冲洗后脱水,最后每个组织滴加一点中性树胶,盖上盖玻片。每个片子分别拍100×视野。
1.6.4 免疫组织化学检测 备取已经固定好的膝关节滑膜组织,标定组号,流水清洗2 h,然后取出滑膜组织,依次浸透于不同浓度的乙醇、二甲苯中进行脱水,然后于56 ℃的石蜡浸泡进行包埋,包埋成块后将石蜡置于切片机中,切分成5 μm的石蜡片,石蜡片放入水浴锅后展开贴在载玻片上进行烘干,60 ℃烘箱2 h。脱蜡后放置于高压喷气中抗原修复,喷水致冷后将石蜡片放入10%羊血清中,室温进行封闭1 h,去除封闭液后,滴加抗体,37 ℃孵育1 h后,PBS清洗5 min,4次。接着加相对应的二抗孵育,孵育后PBS摇洗5 min,10次。之后配备DAB显色液,即配即用,显微镜观察显色,然后复染、脱水。每个切片上滴注些许中性树胶后盖上盖玻片,每个片子分别拍400×视野。
1.6.5 Western blot检测 备取100 mg膝关节滑膜组织样本,随后加定量混有蛋白酶、磷酸酶抑制剂的RIPA裂解液,搅匀混合溶液,使用匀浆机进行匀浆4 min,再将得到的样品裂解30 min,裂解全程均在冰上操作,裂解完全后4 ℃、12 000 r/min离心20 min,利用BCA蛋白质定量法测定离心后得到的上清液蛋白质浓度,得到蛋白质样品液。取蛋白质样品液30 μg,加上一定蛋白质上样缓冲液,放入恒温槽中沸水浴10 min,再10 000 r/min离心10 min;随之计算蛋白质分子量,来选择制备10%或是12%的分离胶、浓缩胶,将之电泳,接着进行电转,将胶上的蛋白质转移至PVDF膜;下一步进行封闭,将PVDF膜全部浸泡于封闭液里,室温25 ℃,孵育1 h后摇洗3次,每次10 min;而后分别加入VEGFR2、Cdc42蛋白的一抗,放入4 ℃冰箱过夜,隔天用PBST洗膜,每次20 min,摇洗3次后,使用移液枪吹打入相对应的二抗溶液,室温25 ℃孵育1 h;随之再用PBST摇洗3次,每次10 min,最后滴加显影液,反应2 min后进行曝光显影,得到条带采用Image J软件施行灰度分析,数据根据相对应的内参对比,以对照组进行归一化处理,用于分析最终结果。
1.7 统计学分析
采用SPSS 22.0对数据进行统计学处理。计量资料以“x±s”表示,所有资料均进行正态性和方差齐性检验:符合正态分布者采用单因素方差分析;不符合正态分布者采用非参数检验。均以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
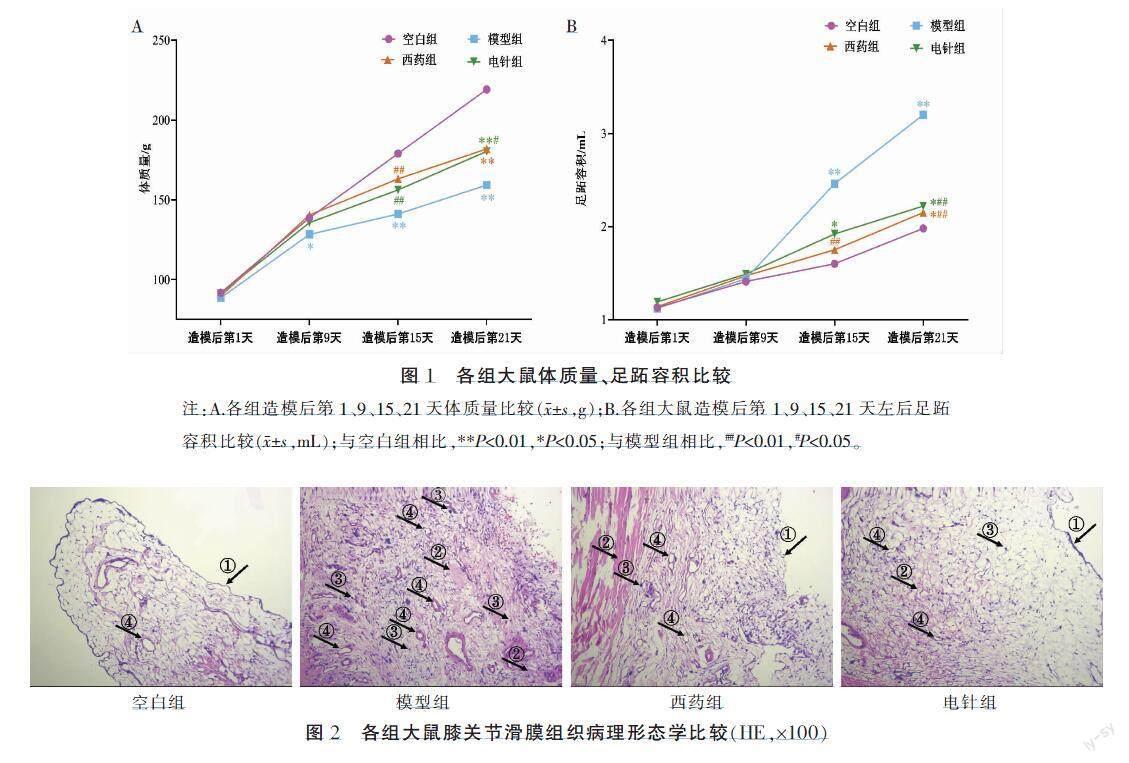
模型组大鼠活动及饮食减少,于造模后第3~5天尾根部出现脱皮红肿,甚至出现溃烂,第9~12天后足、关节、耳朵、眼角陆续出现肉眼可见的红肿,第15~18天症状達到高峰期。与空白组相比,其余3组体质量于造模后第1天差异均无统计学意义(P>0.05);模型组体质量于造模后第9天增长缓慢(P<0.05),第15、21天增长明显缓慢(P<0.01);西药组、电针组体质量于造模后第9、15天差异无统计学意义,第21天增长明显缓慢(P<0.01)。与模型组相比,西药组、电针组造模后第1、9天差异无统计学意义(P>0.05),造模后第15天增长明显缓慢(P<0.01);西药组造模后第21天差异无统计学意义(P>0.05);电针组造模后第21天增长明显缓慢(P<0.05)。详见图1A。
2.2 各组大鼠足跖容积比较
与空白组相比,其余3组足跖容积于造模后第1、9天差异均无统计学意义(P>0.05);模型组在第15、21天足跖容积均明显增大(P<0.01),提示模型制备成功;电针组与西药组第15、21天均明显增大(P<0.05)。与模型组相比,其余3组于造模后第1、9天差异均无统计学意义(P>0.05);西药组足跖容积在第15、21天均显著减小(P<0.01);电针组在第21天明显减小(P<0.01)。详见图1B。
2.3 各组大鼠滑膜组织病理结果的比较
空白组大鼠膝关节滑膜组织内衬层细胞排列规则(图2箭头①),未见炎性细胞浸润。与空白组相比,模型组大鼠滑膜组织结构呈现异常,滑膜组织出现一定增生,胶原纤维组织可见大面积增生(图2箭头②)、诸多炎性细胞浸润(图2箭头③)、大量血管增生(图2箭头④)。与模型组相比,电针组和西药组大鼠滑膜结构较好,细胞密度明显降低,一定程度缓解滑膜增生,出现较小面积的胶原纤维组织增生,炎性细胞浸润较模型组少,偶见血管生成。
2.4 各组大鼠滑膜组织中VEGFR2、CD34表达水平比较
空白组大鼠滑膜组织显见极少量VEGFR2表达,与空白组相比,模型组大鼠VEGFR2表达明显增加(P<0.01);与模型组相比,西药组和电针组VEGFR2蛋白表达量减少(P<0.01)。空白组大鼠滑膜组织见少量CD34蛋白表达,与空白组滑膜组织相比,模型组CD34表达明显增加(P<0.01),表明血管生成增加;与模型组相比,西药组和电针组CD34蛋白表达明显减少(P<0.01)。详见图3。
2.5 各组大鼠滑膜组织中VEGFR2、Cdc42蛋白表达水平比较
与空白组相比,模型组大鼠滑膜组织中VEGFR2、Cdc42蛋白表达量显著增加(P<0.01)。与模型组相比,西药组、电针组VEGFR2、Cdc42蛋白表达量均明显下降(P<0.05,P<0.01)。详见图4。
3 討论
RA在中医学中属于“痹病”范畴,多由“正气不足,复感外邪”,内外相合发病。虚实夹杂、本虚标实为其病机特点,临床多采用扶正祛邪、标本兼治的治疗原则。针灸治疗RA历史悠久,具有扶正祛邪、通经活络等功效[12-13]。针灸治疗痹病一般情况下配方选穴以炎症累及部位的局部选穴为主,同时配以远部取穴[14]。局部选穴多选疼痛剧烈处,即“阿是穴”,能通经活络、消肿止痛;远部取穴多选用“足三里”“关元”等培正固元、补益气血的穴位。故本研究选用电针“足三里”“关元”和“阿是穴”干预AA模型大鼠。
本实验研究结果显示,相比于空白组,模型组大鼠足跖容积在第15、21天显著增加(P<0.01),电针干预后第21天明显减小(P<0.01),这与既往研究[6-7]一致。组织形态学结果显示,模型组大鼠滑膜组织结构排列异常,炎性细胞浸润明显,血管生成增多,电针干预后滑膜组织结构较好,炎性细胞浸润、血管生成明显减少。CD34为血管特异性标志物[15],免疫组化结果显示与空白组比较,模型组表达明显增加(P<0.01),电针干预后CD34表达明显下降(P<0.01),提示电针干预后RA滑膜血管数量减少。因此,初步证实电针可有效抑制RA滑膜组织血管新生。另外,Western blot结果显示,与空白组相比,模型组大鼠关节滑膜组织中VEGFR2、Cdc42表达均明显增多(P<0.01),电针干预后,电针组VEGFR2、Cdc42表达量明显下降(P<0.05,P<0.01),VEGFR2的免疫组化结果也佐证了这种趋势,这提示VEGFR2/Cdc42信号通路可能在这一过程中发挥了重要的作用。
血管新生是RA病程中侵蚀骨与软骨的重要病理基础,是促进滑膜增生和炎症发展的早期核心病理事件[16-17]。内皮细胞(endothelial cell, EC)迁移是滑膜血管新生的重要环节,伪足生成在细胞迁移中占有重要位置[18-19],因此,可以通过抑制伪足生成来抑制血管新生。伪足生成由多条复杂的信号传导通路共同调控的,研究表明,VEGF可特异性作用在EC上,通过与EC 表面的VEGFR2结合,激活小鸟苷酸三磷酸(Rho GTP)酶,引发一系列的信号转导,刺激EC伪足生成[20]。Rho GTP酶是调节EC迁移、形态发生的关键因子,是细胞骨架的中心调节者,可以调节伪足的形成,Cdc42是其关键成员之一[21-22]。VEGF与VEGFR2 结合后将胞外信号传递至胞内,引起VEGFR2细胞内结构域中的Tyr1214位点磷酸化并激活下游Rho GTP酶的成员Cdc42,Cdc42从不活跃的GDP结合态转换到活跃的GTP结合态,活化的GTP结合态的Cdc42通过调控下游信号分子介导EC上丝状伪足的动态变化,直接影响EC迁移方向,最终导致血管新生[23-25]。
CD34是公认的血管特异性标志物,标记的细胞是血管内皮细胞。本实验以VEGFR2及其下游Cdc42为切入点展开研究,结合组织形态学结果及血管内皮细胞标记物CD34免疫组化结果,观察到模型组大鼠滑膜组织中CD34较空白组表达明显升高(P<0.01),说明模型大鼠血管新生增多,电针干预后CD34表达降低(P<0.01),提示血管新生较少。VEGFR2免疫组化结果也同样符合这种趋势,这表明VEGFR2可能是电针发挥抑制血管新生的关键信号途径。同时,本研究Western blot结果显示,模型组大鼠滑膜组织中VEGFR2、Cdc42较空白组大鼠表达均明显增多(P<0.01),电针干预后VEGFR2、Cdc42蛋白表达量明显下降(P<0.05,P<0.01),提示电针可能通过抑制VEGFR2的表达,从而下调Cdc42的活性,抑制血管新生,减少血管翳浸润,减轻关节肿胀。因此,这提示电针抑制AA模型大鼠滑膜血管新生可能是由VEGFR2/Cdc42信号通路所介导。
综上所述,电针治疗RA的效应机制可能是通过抑制VEGFR2/Cdc42信号通路,抑制内皮细胞伪足生成及其迁移,从而抑制RA血管新生,改善关节症状,为电针抑制RA血管新生提供了一定的证据支持。为了更进一步确定VEGFR2/Cdc42信号通路在电针抑制RA血管新生的作用机制,后续将通过设置其信号通路关键蛋白的阻断剂或激动剂展开研究,同时补充内皮细胞伪足生成直接证据的检测。
参考文献
[1] WANG Y, WU H, DENG R. Angiogenesis as a potential treatment strategy for rheumatoid arthritis[J]. European Journal of Pharmacology, 2021, 910: 174500.
[2] OLSSON A K, DIMBERG A, KREUGER J, et al. VEGF receptor signalling-in control of vascular function[J]. Nature Reviews Molecular Cell Biology, 2006, 7(5): 359-371.
[3] GARRETT T A, VAN BUUL J D, BURRIDGE K. VEGF-induced Rac1 activation in endothelial cells is regulated by the guanine nucleotide exchange factor Vav2[J]. Experimental Cell Research, 2007, 313(15): 3285-3297.
[4] PARADOWSKA-GORYCKA A, STYPINSKA B, PAWLIK A, et al. KDR (VEGFR2) genetic variants and serum levels in patients with rheumatoid arthritis[J]. Biomolecules, 2019, 9(8): 355.
[5] LAMALICE L, HOULE F, HUOT J. Phosphorylation of Tyr1214 within VEGFR-2 triggers the recruitment of Nck and activation of Fyn leading to SAPK2/p38 activation and endothelial cell migration in response to VEGF[J]. The Journal of Biological Chemistry, 2006, 281(45): 34009-34020.
[6] 龍轶映, 张 亮, 祁 芳, 等. 电针对佐剂性关节炎大鼠滑膜组织中mTOR磷酸化水平的影响[J]. 湖南中医药大学学报, 2021, 41(12): 1881-1885.
[7] AI K, LI Y L, QI F, et al. Effect of electroacupuncture on c-IAP1 mRNA and c-IAP2 mRNA in synovial tissues of rats with adjuvant arthritis[J]. Journal of Acupuncture and Tuina Science, 2019, 17(1): 16-23.
[8] CHEN W, CHEN J, XU M H, et al. Electroacupuncture facilitates implantation by enhancing endometrial angiogenesis in a rat model of ovarian hyperstimulation[J]. Biology of Reproduction, 2019, 100(1): 268-280.
[9] 黄淑敏, 钟森杰, 廖晓倩, 等. 基于中西医临床病症特点的类风湿性关节炎动物模型分析[J]. 中国中药杂志, 2021, 46(19): 5152-5158.
[10] 祁 芳, 李艳玲, 艾 坤, 等. SD大鼠佐剂性关节炎模型的建立与评估[J]. 湖南中医药大学学报, 2016, 36(1): 23-26.
[11] 张梦颖, 姚 瑶, 葛卫红. 甲氨蝶呤治疗类风湿性关节炎骨破坏的研究进展[J]. 中国药房, 2012, 23(41): 3926-3928.
[12] 魏淑凤, 李秀兰, 梁丽娜, 等. 独活寄生汤加减联合针灸治疗类风湿性关节炎40例临床观察[J]. 中医药导报, 2012, 18(9): 67-69.
[13] 张 政, 蒙兴文, 张世俊, 等. 针灸疗法治疗类风湿关节炎的研究进展[J]. 中国疗养医学, 2021, 30(2): 136-138.
[14] 廖家鑫, 朱 钰, 王润鹏, 等. 针灸治疗痛风性关节炎选穴规律研究[J]. 中医临床研究, 2020, 12(32): 13-15.
[15] LIU L, SHI G P. CD31: Beyond a marker for endothelial cells[J]. Cardiovascular Research, 2012, 94(1): 3-5.
[16] QIAN K, ZHENG X X, WANG C, et al. β-sitosterol inhibits rheumatoid synovial angiogenesis through suppressing VEGF signaling pathway[J]. Frontiers in Pharmacology, 2022, 12: 816477.
[17] OUYANG B S, GAO J, CHE J L, et al. Effect of electro-acupuncture on tumor necrosis factor-α and vascular endothelial growth factor in peripheral blood and joint synovia of patients with rheumatoid arthritis[J]. Chinese Journal of Integrative Medicine, 2011, 17(7): 505-509.
[18] 黄 蕾, 滕春莹, 雷 鹏, 等. 伪足、有氧糖酵解与肿瘤细胞迁移的研究进展[J]. 癌变·畸变·突变, 2020, 32(1): 72-75.
[19] BISCHOFF M C, BOGDAN S. Collective cell migration driven by filopodia-New insights from the social behavior of myotubes[J]. BioEssays, 2021, 43(11): e2100124.
[20] ZHU J, SU C G, CHEN Y Z, et al. Electroacupuncture on ST36 and GB39 acupoints inhibits synovial angiogenesis via downregulating HIF-1 α/VEGF expression in a rat model of adjuvant arthritis[J]. Evidence-Based Complementary and Alternative Medicine, 2019, 2019: 5741931.
[21] UEMURA A, FUKUSHIMA Y. Rho GTPases in retinal vascular diseases[J]. International Journal of Molecular Sciences, 2021, 22(7): 3684.
[22] JIN Y X, LIU Y, LIN Q, et al. Deletion of Cdc42 enhances ADAM17-mediated vascular endothelial growth factor receptor 2 shedding and impairs vascular endothelial cell survival and vasculogenesis[J]. Molecular and Cellular Biology, 2013, 33(21): 4181-4197.
[23] LI Y J, YANG W D, WANG F. The relationship of blood CDC42 level with Th1 cells, Th17 cells, inflammation markers, disease risk/activity, and treatment efficacy of rheumatoid arthritis[J]. Irish Journal of Medical Science, 2022, 191(5): 2155-2161.
[24] SHEN J H, ROSSATO F A, CANO I, et al. Novel engineered, membrane-tethered VEGF-A variants promote formation of filopodia, proliferation, survival, and cord or tube formation by endothelial cells via persistent VEGFR2/ERK signaling and activation of CDC42/ROCK pathways[J]. FASEB Journal, 2021, 35(12): e22036.
[25] BASAGIANNIS D, ZOGRAFOU S, MURPHY C, et al. VEGF induces signalling and angiogenesis by directing VEGFR2 internalisation through macropinocytosis[J]. Journal of Cell Science, 2016, 129(21): 4091-4104.
(本文編辑 匡静之)
