盲肠/子宫填充盆底缺损在腹腔镜Miles术中临床应用研究
2023-08-14袁海波白真真胡孔旺
袁海波,白真真,包 伟,胡孔旺
(安徽医科大学第一附属医院东城院区 普外科三病区,安徽 合肥 231600)
结直肠癌的发病率在全球所有恶性肿瘤疾病中排名第三,腹会阴切除术(abdominoperineal resection,APR)加结肠造口术目前仍是24%~38%低位直肠癌患者的根治性治疗方法之一[1]。腹腔镜在结直肠癌根治手术中已经得到充分应用,其安全性及可行性得到了大多数外科专家的临床实践证实。2020年6月以前,安徽医科大学第一附属医院东城院区外科收治的低位中晚期直肠癌行腹腔镜Miles术的患者,如果不能直接缝合盆底腹膜,选择不闭合盆底;随着腔镜技术的进步,自2020年6月后,对于中晚期低位直肠癌,因盆底腹膜缺损较大无法直接缝合的患者,选择行盆底盲肠/子宫填充术来部分填补骶前空隙,本研究通过对比探讨盲肠/子宫填充盆底在中晚期低位直肠癌患者恢复过程中的优势,现报道如下。
1 资料与方法
1.1 一般资料 选择2019年3月~2020年6月及2020年6月~2021年9月两个时间段内的低位中晚期直肠癌Miles术患者。按手术方式盲肠/子宫填充和盆底腹膜不关闭各随机选择20例,分为优化组(前者)和传统组(后者)进行比较。两组患者性别、年龄、肿瘤分期差异均无统计学意义,见表1。

表1 两组一般资料比较
1.1.1 排除标准 ①早中期低位直肠癌患者;②肝脏、肺部等多脏器广泛转移患者;③心肺功能严重异常,经内科调理后仍不能耐受手术的患者。
1.1.2 纳入标准 ①肿瘤位置低(距离肛缘<5 cm);②术前排查无手术禁忌,或经过短期治疗后能耐受手术者;③肿瘤较大,术中见直肠周边有癌结节;④术前行辅助放化疗造成盆腔腹膜水肿,术中缝合时出现撕裂现象。
1.2 手术方法 在全身麻醉下,手术时患者取左下肢抬高右下肢外展的改良截石位,并且保持头低右倾斜位。在脐上缘放置10 mm Trocar作为观察孔,充气提高腹腔内压力,稳定在12 mmHg左右,进行腹腔探查,了解腹腔内转移及有无粘连等情况,明确肿瘤位置。在右锁骨中线与两髂骨前上棘结线的交点和右锁骨中线的平脐上分别穿刺12、5 mm Trocar作为手术刀的操作孔。将5 mm Trocar置入左锁骨中线与脐的交点位置和反麦氏点位置作为辅助操作孔。助手提起乙状结肠暴露肠系膜根部的黄白界线,主刀用超声刀切开其系膜,沿骨盆方向游离至骶前间隙,沿头侧方向游离至肠系膜下动脉根部,结扎并切断肠系膜下动静脉,自上而下仔细分离Toldt间隙至骶骨直肠韧带,然后切开进入骶前间隙,再分离至肛提肌平面[2]。分别游离左、右两侧盆壁与直肠的间隙及前侧与直肠的间隙(邓氏筋膜),注意保护前侧前列腺或阴道壁,裸化直肠至肛提肌层面或肿瘤下方2 cm以上,从肿瘤近心端距离肿瘤10 cm处离断,在左髂前上棘与脐连接线的中、外1/3交界处作一直径约3 cm的圆形切口,将近端乙状结肠断端自切口处拉出腹腔外3~5 cm,采用开放吻合法做人工肛门;经会阴切除肛门直肠与经腹组会合后取走肿瘤,并关闭会阴切口[3]。优化组关闭会阴切口后,再次打开气腹,在腹腔镜下松解游离升结肠至结肠肝区,然后将盲肠拉入骨盆内,将其浆膜层与骨盆附近腹膜固定缝合4~5针即可。女性患者可翻转子宫,填充骶骨前残腔,或者将大残腔变成小残腔。检查腹腔无渗血等后,放入腹腔引流管,拔出套管缝合切口,术毕[4]。
1.3 观察指标 手术相关指标:手术时间、术中失血量、术后人工肛门排气时间、半流质饮食开始时间、术后引流量、术后住院时间。术后并发症:盆腔感染、腹壁切口感染、腹壁切口疝、会阴疝、肠梗阻。患者排气后即开始给予稀流质饮食,术后患者有腹胀情况的行腹部立位片或口服造影剂全消化道造影或行盆腔CT检查观察有无活动性会阴疝及肠梗阻等情况。无腹胀情况者出院前查盆腔CT了解有无盆腔积液、会阴疝等情况,术后5 d左右,根据患者肠功能恢复情况给予适量半流质饮食。
2 结果
2.1 两组术后近期疗效比较 优化组手术时间较传统组长,差异有统计学意义(P<0.05);两组患者术中失血量、术后人工肛门排气时间、半流质开始时间、术后引流量、术后住院时间差异无统计学意义(P>0.05),见表2。
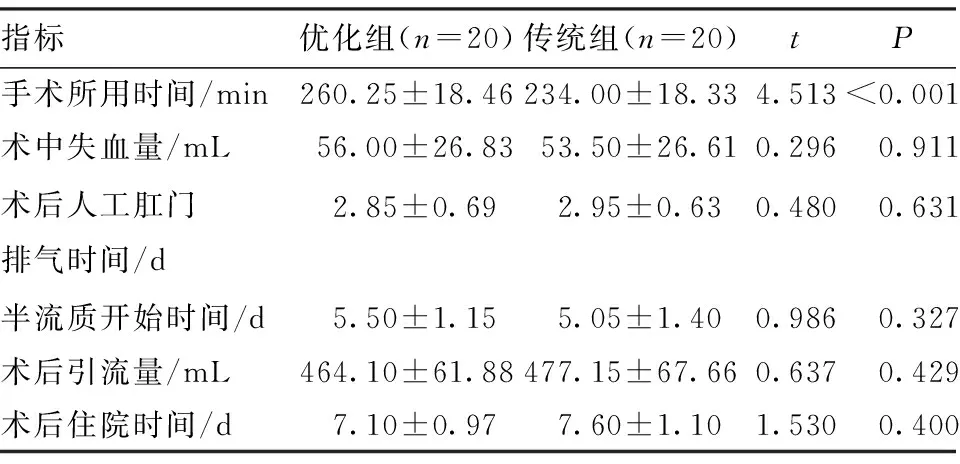
表2 两组术后近期疗效比较
2.2 两组术后相关并发症发生情况 两组患者术后盆腔感染、腹壁切口疝、腹壁切口感染、不全性肠梗阻等差异均无统计学意义(P>0.05),优化组患者半流饮食后腹胀情况及术后会阴疝发生率优于传统组,差异有统计学意义(P<0.05),见表3。两组均无死亡病例。
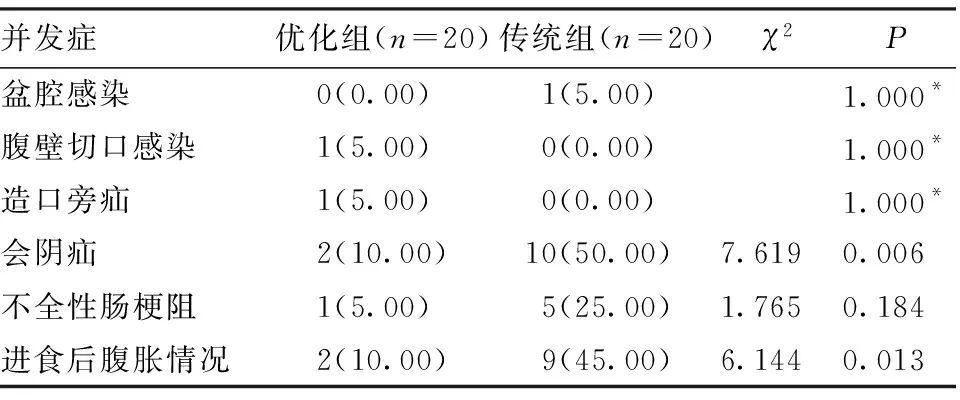
表3 两组术后相关并发症发生情况比较[n(%)]
3 讨论
腹腔镜技术是传统手术的重要替代方法,已成功用于消化道肿瘤根治手术中,并日渐趋于成熟。这种真正的微创手术除了技术新、手术过程直观、层次分明、创伤小及术后并发症少等优势外,还有一些重要的相关益处,如无需腹部切口即可为患者建立永久性结肠造口术、更快的恢复、更美观的切口和更短的住院时间[5]。
行腹腔镜下直肠癌根治术时盆底会形成缺损,易造成盆腔积液继发感染,甚至蔓延至腹腔;另外,大约1%的腹会阴直肠切除术(APRs)和3%~10%的盆腔恶性肿瘤切除术后会发生继发性会阴疝(小肠等腹腔内器官落入骨盆和手术创面粘连引起的疝气、肠梗阻等并发症)[6]。在两侧残留腹膜松弛度允许的情况下,我们通常采用直接缝合两侧残存腹膜关闭盆底,这样有利于患者术后早期下床,防止会阴疝等情况发生,但由于一部分直肠癌患者就诊时已处于中晚期,甚至超晚期,肿瘤在盆底有局部浸润扩散,为了减少腹膜缝合的张力,可能会留下过量的腹膜,提高肿瘤残存的概率[7-8];为了达到根治的目的,需切除更多的盆底腹膜,这必然导致盆底腹膜无法直接缝合关闭,这时候就出现两种选择:选择不关闭盆底腹膜或重建盆底腹膜。重建盆底腹膜是腹腔镜手术者们一直努力去完善的工作,但在长期临床实践中,除了直接关闭以外,通常采用大网膜盆底铺垫、盲肠/子宫填充或生物网重建,从而消除骶前残腔,取得了良好效果[9-11]。盆腔重建保持了腹膜的完整性和连续性,并在很大程度上恢复了盆底的解剖和生理,盆底重建后可以不必延迟下床时间,减少深静脉血栓、粘连性肠梗阻、掉入盆腔小肠浆膜层损伤等并发症的发生[12];有文献报道采用生物网重建盆底的方法,然而,生物网植入后的并发症,如感染、瘘管和侵蚀也是一个问题,更不用说额外的高成本了[13-14],盆底不关闭会增加因粘连造成的机械性肠梗阻的发生[15]。权衡上述利弊,我们选择采用患者腹盆腔内组织重建盆底来减少因盆底组织缺如造成的术后并发症。
通过本次研究我们发现,优化组与传统组相比多了盆底填充手术步骤,所以手术所用时间较传统组略长,差异有统计学意义(P<0.05),但两组相差时间在可控范围内,对患者的恢复无特别影响。两组患者均是肛门排气后即给予少量少渣流质饮食,待肠功能恢复后(约5 d)给予半流质饮食,两组患者饮食方案无差别。但传统组患者术后早期进食后出现腹胀的例数多于优化组(9vs.2,P<0.05),曾有国外专家通过大量数据得出过结论:开始饮食的时间与肠梗阻的发生没有显著相关性[16];再结合术后腹部立位片或全消化道造影或盆腔CT检查情况判断,传统组术后腹胀发病率高与饮食开始时间无关,主要考虑是小肠坠入盆腔造成。1939年国外首次出现会阴疝报道,盆腔手术术后会阴疝的发生率高,许多因无症状而未被发现,需要手术修复的发生率<1%[17]。针于我院这些术后早期会阴疝患者,我们通过控制饮食、臀高头低体位训练等方法能逐渐恢复正常。优化组术后检查发现盆腔内小肠坠入引起会阴疝的情况优于传统组(2vs.10,P<0.05),说明通过填充能有效防止腹腔内脏器因重力因素坠入盆底,能有效防止会阴疝的发生。本研究还发现,两组患者术中出血量、术后引流量等差异无统计学意义。优化组术后住院时间与传统组相比,差异无统计学意义。
综上所述,在临床实践操作中,我们通常是在保证无瘤的前提下尽量缩短手术时间,对于盆底缺损少和术前无放化疗的患者,尽量通过直接缝合关闭盆底,而对于一些盆底缺损大的患者,则考虑重建盆底腹膜,减少术后并发症的发生。我们选择的盆底盲肠/子宫填充术在一定程度上恢复了盆底的解剖和生理,降低了小肠坠入盆腔粘连形成肠梗阻的发生概率,对患者的早期恢复具有一定优势,值得在临床中推广。
