PD-1/PD-L1抑制剂相关甲状腺功能异常的影响因素分析
2023-08-14潘行山冯双双袁小龙魏浩洁申金付汪晓娟
潘行山,冯双双,袁小龙,魏浩洁,孙 华,胡 骅,申金付,汪晓娟
(1.阜阳市人民医院 a.药剂科;b.内分泌科,安徽 阜阳 236000;2.皖南医学院第二附属医院 药剂科,安徽 芜湖 241000;3.皖南医学院第一附属医院 弋矶山医院 药物临床评价中心,安徽 芜湖 241001)
近年来,免疫检查点抑制剂作为癌症治疗领域的突破性进展,改变了许多癌症患者的预后。程序性细胞死亡蛋白受体1(programmed cell death receptor 1,PD-1)及其配体1(programmed cell death ligand 1,PD-L1)抑制剂是其代表性药物,目前国内已批准上市多种制剂,在恶性黑色素瘤、非小细胞肺癌、食管癌、尿路上皮癌等恶性肿瘤治疗中表现出显著疗效。随着临床使用的增多,PD-1/PD-L1抑制剂引起的免疫相关性不良反应成为不可忽视的问题。甲状腺是最常受累的内分泌器官,免疫相关甲状腺异常(immune-related thyroid dysfunction,irTD)如甲亢、甲减和自身免疫性甲状腺炎均有报道[1-2]。目前国内对于甲状腺功能异常发生风险及临床特点报道较少。本研究旨在分析PD-1/PD-L1抑制剂临床使用过程中irTD发生情况,探索可能的影响因素。
1 资料与方法
1.1 研究对象 收集阜阳市人民医院2019年10月~2022年6月使用PD-1/PD-L1抑制剂相关病例资料,进行回顾性分析。本研究经阜阳市人民医院伦理委员会批准(No2022[59]号),所有患者知情同意均豁免,病例发生irTD的临床处理由医师根据患者病情及相关指标情况调整。纳入标准:①诊断为恶性肿瘤;②接受PD-1/PD-L1抑制剂单药或联合其他抗肿瘤药物治疗;③至少完成两周期PD-1/PD-L1抑制剂治疗;④具有可分析的临床病例资料(治疗前后有持续监测的甲状腺功能指标TSH、FT4、FT3)。排除标准:①治疗前即存在甲状腺功能疾病且疾病处于活动期或正在使用其他影响甲状腺功能的药物;②所患肿瘤为甲状腺癌或甲状腺转移癌;③未规律进行甲状腺功能监测。
1.2 方法
1.2.1 资料收集 通过查阅电子病历资料,利用Excel软件收集年龄、性别、肿瘤类型、PD-1/PD-L1抑制剂类型、给药次数、治疗前后的甲状腺功能、抗肿瘤治疗既往史等信息。
1.2.2 甲状腺功能异常评判及评价标准 异常类型①甲亢:TSH降低伴FT4或FT3升高;②亚临床甲亢:TSH降低伴FT4、FT3正常;③甲减:TSH升高伴FT4或FT3降低;④亚临床甲减:TSH降低伴FT4、FT3正常。本院实验室参考值为TSH:0.550~4.780 μIU/mL,FT4:0.89~1.76 ng/dL,FT3:2.30~4.20 pg/mL。irTD严重程度分级参考2021版《中国临床肿瘤学会免疫检查点抑制剂相关毒性管理指南》。
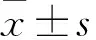
2 结果
2.1 患者一般资料分布及临床特征比较 符合纳入标准共101例,男90例,女11例,平均年龄(63.23±9.58)岁。纳入病例原发性肿瘤主要为非小细胞肺癌、肝细胞癌、食管癌,其他肿瘤包括黑色素瘤(皮肤、黏膜)、尿路上皮癌、淋巴瘤。多数患者病程较短(<1年),曾接受过化疗并出现肿瘤的转移。最常用的PD-1/PD-L1抑制剂为卡瑞利珠单抗、信迪利单抗,帕博利珠单抗次之,使用量较少的为替雷利珠单抗、特瑞普利单抗及度伐利尤单抗。异常组基线TSH水平高于无异常组,差异有统计学意义(P<0.01)。异常组治疗前肿瘤转移史比例低于无异常组,靶向药物治疗史比例高于无异常组,差异均有统计学意义(P<0.05),见表1。
表1 两组患者一般资料比较
2.2 甲状腺异常特点及转归 101例患者中,43例出现irTD,发生率为42.57%。irTD的临床特点见表2。初次irTD为用药的2~17周期,中位时间为3周期。在随后治疗过程中,进展为甲亢4例,亚临床甲亢10例,甲减20例,亚临床甲减9例。进展甲亢者病程中最低TSH为0.255 μIU/mL;进展甲减者病程中最高TSH为35.435 μIU/mL。
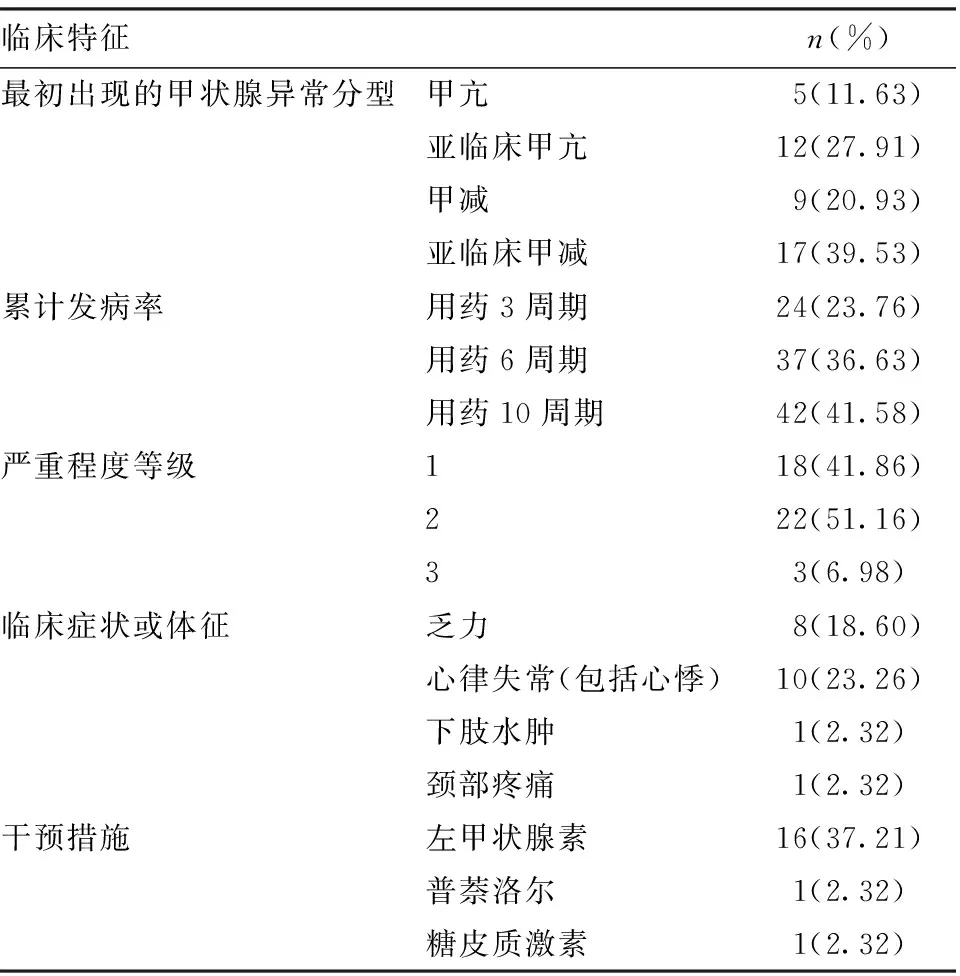
表2 发生irTD的患者临床特征
irTD患者中有13例进行了甲状腺自身抗体检测,其中8例抗甲状腺球蛋白抗体(TGAb)水平显著升高,5例抗甲状腺过氧化物酶抗体(TPOAb)水平显著升高,5例两种抗体均在正常范围内。6例进行了甲状腺B超检测,其中5例提示异常。3例B超提示甲状腺弥漫性病变,1例甲状腺双侧叶片低回声区考虑亚甲炎,1例提示甲状腺低密度灶。
多数irTD患者未进行临床干预,部分药物干预情况见表2。43例irTD患者中5例因甲状腺功能异常停止使用免疫药物,1例发生过敏性休克而停用,4例因其他原因停用。在观察期内,irTD患者整体预后良好。2例甲亢、5例亚甲亢、6例甲减、2例亚临床甲减患者甲状腺功能完全恢复正常。
2.3 甲状腺功能异常风险因素的多因素分析结果 根据单因素分析结果,按照P<0.10标准,共有肿瘤转移史、靶向药物治疗史、基线TSH水平、肿瘤手术史、肿瘤类型变量进入多因素Logistic回归模型(向前法)。结果显示,有靶向药物治疗史、基线TSH水平上升是甲状腺功能异常的危险因素(P<0.05)。见表3。
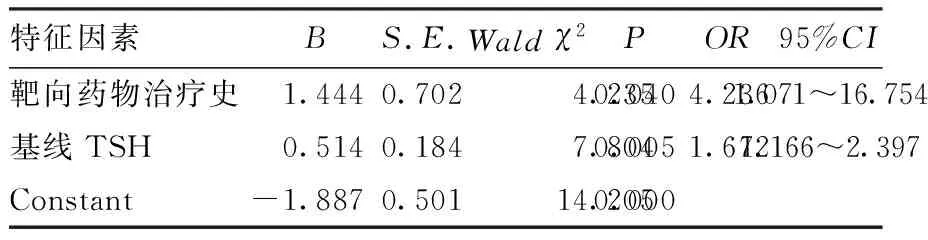
表3 甲状腺功能异常风险的多因素Logistic回归分析
2.4 ROC曲线分析结果 根据多因素回归分析结果绘制ROC曲线显示,基线TSH水平对甲状腺功能异常预测的曲线下面积为0.688(95%CI:0.569~0.791)(截断值1.496 μIU/mL),灵敏度74.07%,特异度60.87%,约登指数0.3 494,见图1。
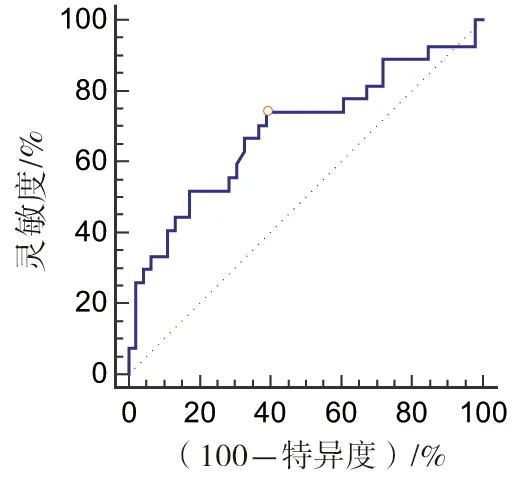
图1 基线TSH水平对甲状腺功能异常预测的ROC曲线
3 讨论
irTD是PD-1/PD-L1抑制剂治疗中独特的现象。一项Meta分析显示纳武利尤单抗、帕博利珠单抗的甲减发生率为8.0%和8.5%[3]。国内信迪利单抗一项Ⅱ期临床试验[4]显示治疗相关甲减发病率为20%,国内外报道发生率存在差异。有研究提示PD-1/PD-L1抑制剂治疗后irTD的发生与抗肿瘤治疗生存获益相关[5-6]。因此,研究国内相关人群的irTD发生特点及可能的影响因素,对于提高临床免疫治疗的安全性具有一定意义。
本研究以101例肿瘤患者为研究对象,经PD-1/PD-L1抑制剂为基础免疫治疗过程中,43例(42.57%)发生irTD,与Pollack、魏芬芬等[7-8]报道类似,发生率均明显高于相关临床试验数据[3],提示真实世界中我国患者irTD发生率可能被低估。
应用PD-1/PD-L1抑制剂后,irTD多发生在1~4个月内[9]。本研究中初发irTD的患者,23.76%为用药后3周期内诱发,36.63%为用药后6周期内诱发,41.58%为10周期内诱发,该发现与相关报道一致。因此,建议在使用PD-1/PD-L1抑制剂前期常规进行甲状腺功能监测。
初发irTD者临床表现既有甲亢(亚临床甲亢),也有甲减(亚临床甲减),甲减较甲亢多,病程中有进展为甲减的趋势。大部分甲状腺功能异常者症状较为轻微(1~2级)。观察期内16例甲减患者接受左甲状腺素片替代,仅5例暂停免疫治疗,大部分病例未停止免疫治疗,且整体预后良好。
本研究对irTD的风险进行多因素Logistic回归分析,提示靶向药物治疗史、基线TSH水平是独立危险因素。ROC曲线分析发现,当基线TSH水平>1.496 mIU/L时,发生irTD的风险增加,低于Pollack等[7]研究(TSH>2.19 mIU/L),提示可能存在人群差异。病例中既往使用的靶向药物为安罗替尼、索拉菲尼、仑伐替尼等,少量为贝伐珠单抗,主要为酪氨酸抑制剂(TKIs)抗肿瘤药。相关临床试验及研究提示酪氨酸激酶抑制剂类抗肿瘤靶向药物索拉菲尼和仑伐替尼可能引起甲状腺功能异常[10],李芳等[11]报道使用安罗替尼患者38.2%出现甲状腺功能异常。临床试验发现瑞戈非尼单药组有18.1%患者出现甲状腺功能异常[12],尚未有贝伐珠单抗对甲状腺功能影响的报道。建议对于有抗肿瘤靶向药物史的患者,在使用PD-1抑制剂前常规检查甲状腺功能,使用过程中密切监测。
irTD确切机制尚不清楚。研究发现在桥本甲状腺炎患者免疫细胞及甲状腺基底膜细胞中存在PD-1和PD-L1阳性表达[13]。相关假说认为使用PD-1/PD-L1抑制剂破坏了相关细胞的免疫平衡,导致甲状腺自身反应性的T和B淋巴细胞浸润,最终导致甲状腺炎[14]。TPOAb和TGAb是自身免疫性甲状腺损伤诊断中广泛使用的实验室指标。相关报道显示发生irTD的患者,约22%~80% TPOAb和TGAb阳性[9]。本研究中13例irTD患者中5例TPOAb阳性,8例TGAb阳性。
本研究存在一定的局限性,由于属于单中心回顾性研究,存在病例数量及地域性限制,同时回顾性研究虽然进行了单因素和多因素分析,但仍存在一些不可避免的混杂因素。
综上所述,本研究通过分析发现,PD-1/PD-L1抑制剂所致irTD发生率较高,多在早期发病,可表现为甲减,也可表现为甲亢,甲减发生率高于甲亢;一般症状轻微,大部分不影响药物继续使用。既往使用靶向药物及较高的基线TSH水平可能增加用药后irTD发生风险。因此,建议临床医师及药师在PD-1/PD-L1抑制剂治疗前期密切监测及评估甲状腺及相关内分泌功能,及时按照相关指南调整治疗策略,改善患者生活质量,提高治疗效果。
