MMR及PD-L1在胃癌中的病理学表达特征及相关性研究
2023-08-14韩艳丽邹俊伟汪俊茹
韩艳丽,邹俊伟,汪俊茹
(皖南医学院第二附属医院 1.病理科;2.胃肠外科,安徽 芜湖 241000)
胃癌作为发病率第四及病死率第三的恶性肿瘤[1],我国医学界对其的研究从未停止。随着胃镜等检查手段在基层医疗机构逐渐开展,胃癌的诊断率及5年生存率逐渐上升,但仍明显低于日本、韩国等国家[2-3]。随着越来越多的胃癌患者使用免疫检查点抑制剂,免疫治疗取得了一定的临床收益,让临床医生有了更多的选择。同时,随着免疫治疗在临床的大量应用,耐药性的产生及使用免疫治疗后出现的机体免疫功能障碍等问题逐渐凸显出来,免疫疗法用于胃癌患者依旧有着很长的路要走。
1 资料与方法
1.1 一般资料 收集2019年1月~2022年11月皖南医学院第二附属医院收治的105例胃癌手术患者的临床资料,男80例,女25例,年龄26~86岁。纳入标准:①手术切除标本;②术前未行化疗放疗;③病历资料完整。排除标准:①合并其他恶性肿瘤者;②合并免疫功能缺陷者。
1.2 临床病理资料 收集105例胃癌患者的年龄、性别、肿瘤部位、肿块大小、分化程度、浸润深度、脉管有无癌栓、有无淋巴结转移等资料。
1.3 错配修复(mismatch repair,MMR)蛋白 免疫组织化学采用SP法,MMR蛋白(MLH1、MSH2、MSH6、PMS2)一抗试剂购自上海基因科技有限公司。MMR蛋白定位于细胞核,细胞核着色视为阳性表达,未着色为缺失。4种蛋白均表达判定为MMR表达正常(pMMR),见图1A;至少一种不表达判定为MMR表达缺失(dMMR),见图1B。
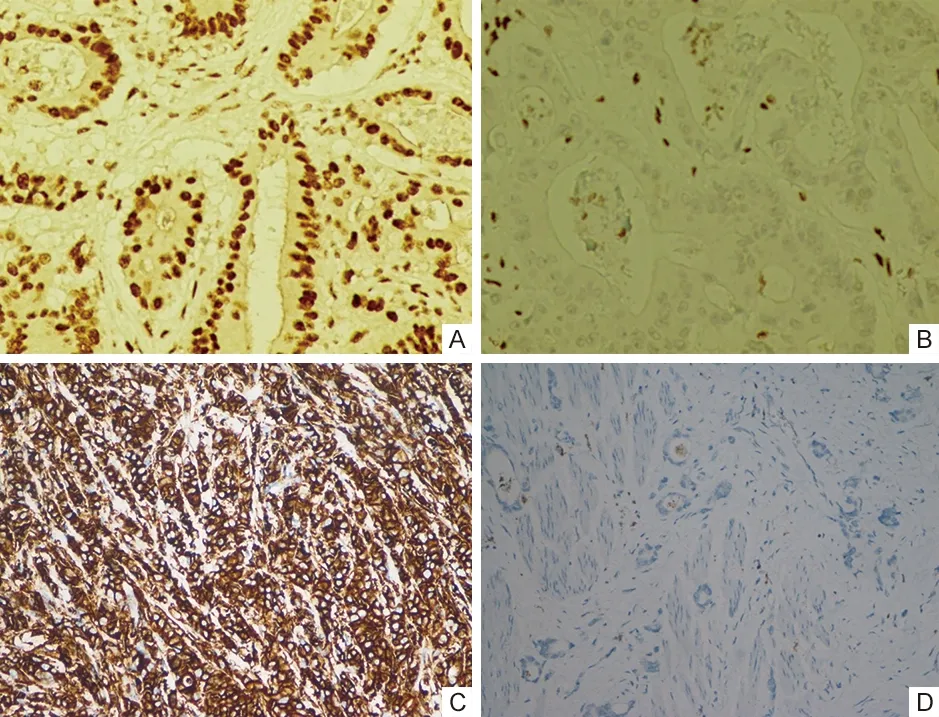
A.MLH1表达(10×20);B.PMS2缺失(10×20);C.PD-L1(CPS=95,10×20);D.PD-L1(CPS<1,10×20)。图1 胃癌患者MMR、PD-L1表达情况
1.4 程序性细胞死亡受体配体-1(programmed death ligand 1,PD-L1)检测 免疫组织化学采用SP法,检测标本PD-L1表达情况。兔抗人PD-L1单克隆抗体购自迈杰转化医学研究有限公司(克隆号:E1L3N)。以联合阳性分数(combined positive score,CPS)为判断标准,CPS=(PD-L1阳性的肿瘤细胞、淋巴细胞、巨噬细胞数)/活的肿瘤细胞总数×100。CPS值≥1即PD-L1表达阳性,见图1C,反之为阴性,见图1D。肿瘤浸润淋巴细胞数目分组:每例在低倍视野选取10个肿瘤间质区域,在20倍物镜下计算淋巴细胞数,平均每个视野<10个淋巴细胞为低密度组,≥10个为高密度组[4]。
1.5 统计学方法 采用SPSS 26.0软件进行统计分析。计数资料以n(%)表示,组间比较采用χ2检验和Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 胃癌患者MMR表达情况 dMMR 12例(11.4%),dMMR与胃癌患者肿块大小、分化程度有关(P<0.05),与年龄、性别、浸润深度、发生部位、淋巴结有无转移相关性无统计学意义(P>0.05),见表1。

表1 胃癌患者MMR蛋白表达与临床病理指标的关系[n(%)]
2.2 胃癌患者PD-L1表达情况 PD-L1阳性表达21例(20.00%),PD-L1阳性率与胃癌患者肿块大小、分化程度、浸润深度、肿瘤浸润淋巴细胞数目相关(P<0.05),见表2。
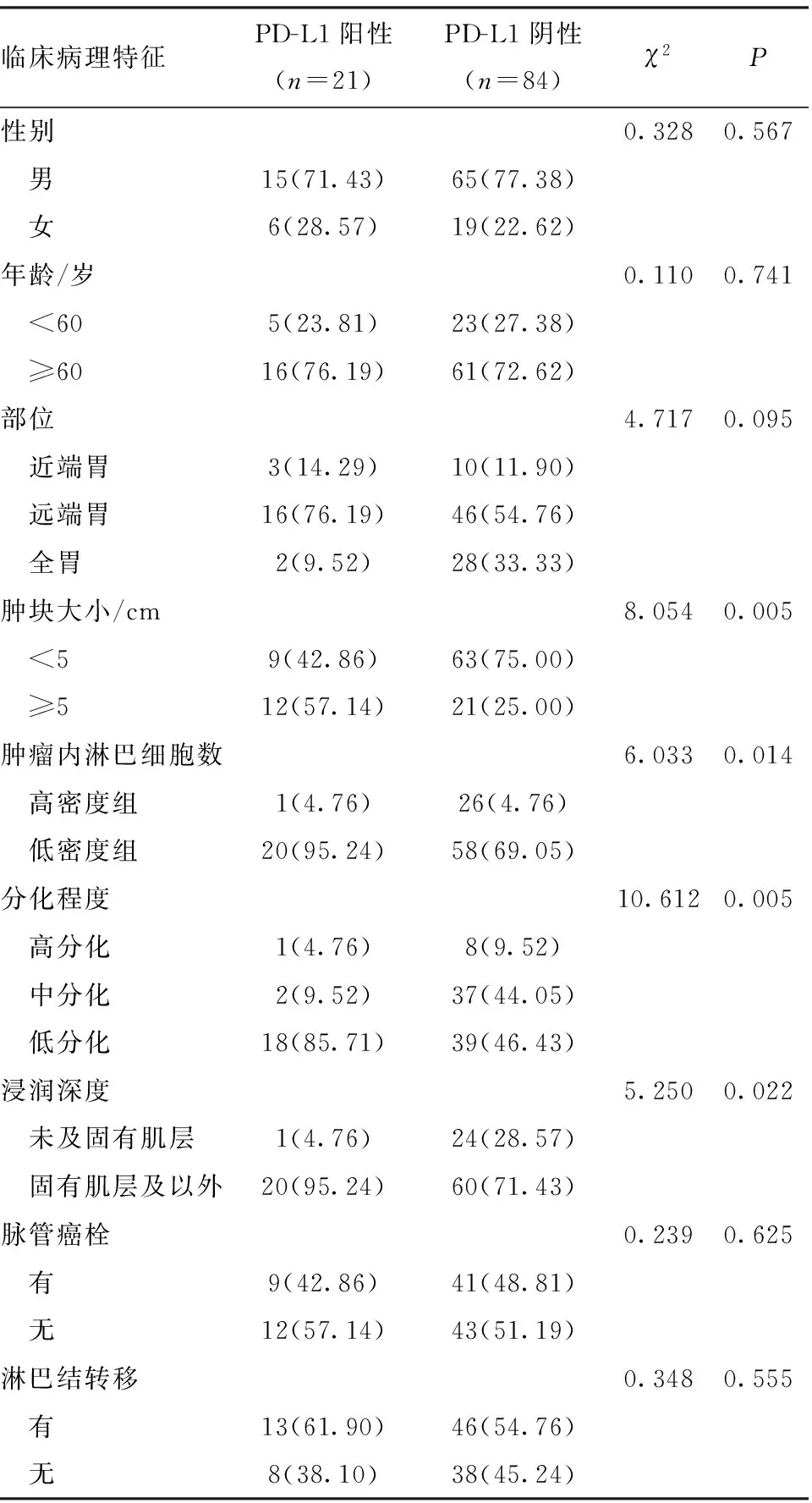
表2 胃癌患者PD-L1表达与临床病理指标的关系[n(%)]
2.3 胃癌患者MMR表达情况与PD-L1相关性研究 dMMR组中的PD-L1阳性表达率高于pMMR组(58.33%、7/12vs.15.05%、14/93),χ2=9.885,P=0.002,差异有统计学意义。
3 讨论
胃癌在我国呈高发状态[5-6]。研究显示,随年龄增长,胃癌的病死率和患病率逐渐增高[7]。随着内镜在临床的广泛应用,胃癌的早期诊断率得以明显提升,但中晚期胃癌的诊断治疗依然不容乐观。
肿瘤的发生是多因素作用的结果,微卫星不稳定(microsatellite instability,MSI)状态是肿瘤发生的基础之一。MSI是指DNA在复制时发生错误,出现缺失或插入等突变引起基因的变化。MMR具有修复DNA碱基错配的功能,可维持基因的稳定性并降低基因突变的概率,是维持生物进化稳定性的捍卫者。当机体出现MSI时,MMR可修复DNA错误。但当MMR发生缺失时,MSI现象得不到修复,逐渐积累到一定程度,则会发生高度微卫星不稳定(MSI-H)。MMR于1993年在研究结直肠癌时被发现,之后散在发现于胃癌、子宫内膜癌等实体肿瘤中。MMR系统成员包括MLH1、MSH2、MSH6和PMS2等蛋白。DNA复制过程中偶尔会出现小DNA错配错误,可以被这些蛋白识别并纠正。MMR蛋白异常时,引起dMMR,则不能发现和修改微卫星复制错误而造成弥漫的MSI。尽管大部分微卫星位于非编码区,但错配的碱基会导致编码突变,导致肿瘤相关基因异常,从而诱发癌症。免疫组化法(IHC)染色分析MMR蛋白表达是最常用的方法,MMR蛋白阳性表达定位于胞核。
本研究发现dMMR与肿块大小、分化程度有关,与肿瘤部位相关性无统计学意义,这与TCGA的分类结果一致[8]。而Mathiak等[9]研究认为dMMR更常见于远端胃。Bae等[10]研究认为,dMMR与老年患者、远端胃、肿块大小、Lauren分型等因素相关。研究结果的差异可能与研究方法、dMMR划分标准及样本数量差异等有关。
程序性细胞死亡受体-1(programmed death 1,PD-1)与其配体PD-L1结合,传递抑制性信号。这种信号对免疫细胞产生抑制作用,从而使肿瘤细胞逃避机体免疫监视[11-12]。抗PD-1/PD-L1治疗通过抑制PD-1与其受体结合,消除对免疫细胞的抑制作用,发挥免疫细胞抗肿瘤作用。免疫识别具有专一性,可很好地识别肿瘤细胞,且对于机体正常细胞不产生免疫应答,这也是免疫治疗相较于化疗药物副反应较小的原因之一。多数情况下,肿瘤患者PD-L1表达越高,PD-L1抑制剂的临床患者获益越高[13]。
目前,PD-L1抑制剂被广泛用于肿瘤患者的治疗,获得明显的临床收益[14-16]。抗PD-L1免疫治疗以联合治疗为主。PD-L1的CPS≥1者一线使用化疗联合PD-L1抑制剂免疫治疗[17-18]。和传统化疗相比,患者生存时间、临床缓解率都有明显提高。免疫治疗配合化疗也获得越来越多的循证医学支持[19]。
本研究表明,不同微卫星状态下,胃癌微环境中的免疫反应不同,dMMR中PD-L1阳性表达率高于pMMR,预示MMR缺失患者可能会在PD-L1抑制剂的使用中获得更多临床收益。PD-L1的阳性表达与肿瘤间质内淋巴数目有关,部分癌细胞PD-L1表达阳性的标本,肿瘤间质内的淋巴细胞PD-L1不表达,可能是由于胃癌细胞PD-L1的表达抑制了周围淋巴细胞浸润或诱导其凋亡所致。本实验室PD-L1(克隆号:E1L3N)主要用于非小细胞肺癌检测,表达较好,本研究中用于胃癌的PD-L1检测,阳性率为20%,相关研究显示,胃癌中的PD-L1的阳性率为20.2%~50.8%[20-21],本研究中PD-L1的阳性率与文献报道中基本一致。
相较于化疗,免疫治疗通过调整自身机体免疫系统来识别并杀灭肿瘤细胞,具有副反应小、疗效较持久等优点,已成为胃癌治疗的有效手段,但优势人群的选择仍是一道难题。基因突变与免疫治疗关系密切,而免疫治疗与基因靶点及上、下游通路间有无联系,目前研究较少,还需要前瞻性大样本的临床病例研究。因此,如何扩大免疫治疗的适用人群,提高免疫治疗的疗效,减少免疫治疗的副反应,依旧是医生的奋斗目标。
综上所述,MMR、PD-L1与胃癌患者临床病理学参数具有明显相关性。MMR缺失患者可能会在PD-L1抑制剂的使用中获得临床收益。因此,MMR及PD-L1的检测对于胃癌患者具有明显的临床价值。由于本研究的病例数偏少,且MMR缺失及PD-L1的表达率不高,可能会造成数值的偏倚,在今后的研究中,应尽可能扩大样本量,减少系统性偏差。
