两个菜心CBL 基因的克隆、生物信息学分析及其表达特性分析
2023-08-11朱云娜符质冯慧敏王斌沈雪晴汤婉君刘建国
朱云娜,符质,冯慧敏,王斌,沈雪晴,汤婉君,刘建国
(1.广东省粤北食药资源利用与保护重点实验室,广东 韶关 512005;2.韶关学院英东生物与农业学院,广东 韶关 512005)
钙作为第二信使在植物信号转导中具有重要调控作用[1,2]。 钙调蛋白(calmodulin,CaM)、类钙调蛋白(CaM-likeprotein,CML)、类钙调磷酸酶B亚基蛋白(calcineurin B-like protein,CBL)和钙依赖型蛋白激酶(Ca2+-dependentproteinkinase,CDPK)是植物体内常见的钙感受器种类[3,4]。 除CDPK 中含有蛋白激酶结构域外,其他3 个钙感受器都不含激酶结构域,必须与靶蛋白结合形成复合体才能传递钙信号[4,5]。
CBL 起源于绿藻和苔藓,现广泛存在于被子植物和裸子植物中,是一种古老的钙感受器[6],具有典型的结合Ca2+结构域——EF 手臂(EFhand)[1]。 类钙调磷酸酶B 亚基蛋白激酶(CBLsinteracting protein kinases,CIPK)是CBL 特异结合的蛋白激酶,通过形成CBL-CIPK 复合体参与调控植物生长发育和非生物胁迫响应[1,4,5]。 不同植物CBL 成员数量不同,拟南芥[1,7]、烟草[8]、黄瓜[9]、大白菜[10]中分别有10、20、6、13 个CBLs 成员。
植物CBLs 参与种子发芽、花粉管萌发等生长发育过程[1,2],也参与响应高盐、低温、干旱等逆境胁迫[1,4,11-13]。 CIPK23 在调控矿质营养转运蛋白方面具有重要作用[1,4,11-14]。 低钾胁迫下,AtCBL1/AtCBL9 可将AtCIPK23 定位到质膜,使其通过磷酸化激活钾离子通道蛋白(ArabidopsisK+transporter 1,AKT1),从而增加拟南芥细胞对K+的吸收[15]。 近年来的研究表明,水稻早期氮响应因子在蛋白质磷酸化等方面富集[16],而氮转运蛋白活性也依赖于外界氮信号所触发的磷酸化[17],因此,蛋白磷酸化在氮信号传导、氮代谢方面发挥重要作用。 如:CBL-CIPK 复合体通过调控氮转运蛋白磷酸化水平调控拟南芥氮信号通路[18-20];AtCBL1/9-AtCIPK23 通过磷酸化修饰,调控拟南芥硝态氮转运蛋白(nitrate transporter 1.1,NRT1.1)亲和性的转变,以适应不同浓度硝酸盐(NO-3) 条件下对NO-3的吸收[18];在高铵(NH+4)胁迫下,AtCBL1-AtCIPK23 可调控铵态氮转运蛋白(ammonium transporter,AMT)AMT1.1 和AMT1.2 的磷酸化,使其失去活性,避免吸收过量NH+4[19,21]。 我们最近研究发现,菜心铵转运蛋白BcAMT1s 可与CIPK23 互作[22],菜心CIPK23表达受氮素水平和氮素形态的影响(待发表)。 不同CBLs 可能参与同一种非生物胁迫,相同CBL可能参与不同非生物胁迫响应[1]。 为此,本文选择可与CIPK23 互作的CBL1、CBL9 为研究对象,采用同源克隆法获得菜心CBL1和CBL9的全长序列,并分析其生物学特性、组织表达特性以及对不同氮素形态的响应,以期为提高菜心氮素吸收利用的作用机理研究提供一定的理论支撑。
1 材料与方法
1.1 试验材料及样品处理
供试菜心(Brassica campestrisL.ssp.chinensisvar.utilisTsen et Lee)品种为‘油绿501’(由广州市农业科学研究院选育),于2021 年3—5 月在广东省韶关市韶关学院英东生物与农业学院生态园玻璃温室内培养。 将菜心种子用7.5%的NaClO消毒10 min,用无菌水清洗4 ~5 次,然后播种于海绵块上进行育苗,待幼苗长至三叶一心时移植到改良霍格兰营养液中进行培养。 之后根据不同试验要求进行处理、取样。
1.1.1 基因表达组织特异性分析的样品采集菜心幼苗移栽后生长30~40 d,待角果结荚后,分别取根、茎、叶、花、叶柄、荚果、花蕾、薹茎等组织样品,用于基因表达的组织特异性分析。 每个样品设3 个生物学重复,每重复取4 ~6 株,液氮速冻后保存在-80℃冰箱中备用。
1.1.2 不同水平氮素处理试验的样品处理 菜心移苗后在1 个剂量的改良霍格兰营养液中培养4 d,取出用蒸馏水冲洗根部,然后转移到缺氮营养液中再培养4 d,将菜心苗分苗移栽到1、4、8 mmol/L NH4Cl/NaNO3营养液中处理2 h,分别对叶片和根系进行取样,每个样品设3 个生物学重复,每重复取4~6 株,液氮速冻后置于-80℃冰箱保存备用。
1.2 总RNA 提取及cDNA 合成
采用Eastep®Super 植物总RNA 提取试剂盒[普洛麦格(北京)生物技术有限公司]提取总RNA,采用PrimeScriptTMRT reagent Kit with gDNA Eraser 试剂盒[宝生物工程(大连)有限公司]反转录合成cDNA。
1.3 菜心CBLs 基因克隆
在NCBI 数据库(https:/ /blast.ncbi.nlm.nih.gov/Blast.cgi)查找拟南芥(Arabidopsis thaliana)AtCBL1、AtCBL9的基因序列,然后在大白菜(Brassica rapa)基因组进行BLAST 比对,得到与其同源性最高的BrCBL1(XM_009138607.3)、BrCBL9(XM_009130690.3)基因序列。 菜心是大白菜的一个变种,亲缘关系较近,因此根据大白菜BrCBL1、BrCBL9基因序列设计同源引物用于克隆菜心相应的基因。 利用Primer Premier 5.0 软件设计引物,引物序列见表1。 设置20 μL PCR 反应体系:Primer star Max primer 10 μL,cDNA 模板链1 μL,上下游引物各1 μL,加ddH2O 补充至20 μL。 PCR 反应程序:98℃预变性5 min;98℃20 s,58℃20 s,72℃1 min,35 个循环;72℃延伸1 min。

表1 所用引物及其序列
回收扩增产物,连接到pMD20-T 载体并转化大肠杆菌DH5α 感受态细胞,将经PCR 鉴定的阳性克隆送广州擎科生物技术有限公司测序。
1.4 生物信息学分析
利用表2 所列软件对菜心CBL1、CBL9基因编码蛋白及其氨基酸序列进行分析。

表2 所用软件及其网址
1.5 基因表达量的qRT-PCR 分析
按照1.2 中的方法提取菜心样品的RNA 并反转录为cDNA,cDNA 样品用RNase-Free ddH2O稀释5 倍后作为模板,利用SYBR Green®PremixEx TaqTM进行荧光定量PCR 分析。 扩增体系:2×SYBR GreenTaqTM10 μL,10 μmol/L 上下游引物各0.4 μL,cDNA 模板2 μL,用RNase-Free ddH2O 补充到20.0 μL。 扩增程序:95℃预变性3 min,95℃10 s,60℃30 s,循环40 次。 以GADPH和Actin2为内参基因,用2-ΔΔCt计算基因相对表达量[23]。
1.6 数据统计分析与作图
用Microsoft Excel 2010 整理数据,用SPSS 19.0 进行统计分析,用Duncan’s 法进行显著性分析,用SigmaPlot 11.0 作图。
2 结果与分析
2.1 菜心CBL1、CBL9 基因的克隆
以菜心叶片cDNA 为模板,用CBL1-F、CBL1-R 和CBL9-F、CBL9-R 引物进行PCR 扩增,均获得约650 bp 的基因片段(图1)。 经测序,克隆得到的基因片段长度均为642 bp。 通过BLAST 在线比对,菜心CBL1基因片段与拟南芥的AtCBL1(NM_001341238.1)、甘蓝型油菜(Brassica napus)的BnCBL1(XM_013881846.3)、大白菜的BrCBL1(XM_009138607.3)的核苷酸序列同源性分别为91.12%、98.29%、98.44%;而菜心CBL9基因片段与AtCBL9(NM _ 124081.4)、BnCBL9(XM _013840912.3)、BrCBL9(XM_009130690.3)的核苷酸序列同源性分别为92.21%、99.69%、99.69%。初步表明所克隆的两个基因片段分别为菜心CBL1、CBL9基因序列。 将这两个基因分别命名为BcCBL1、BcCBL9。
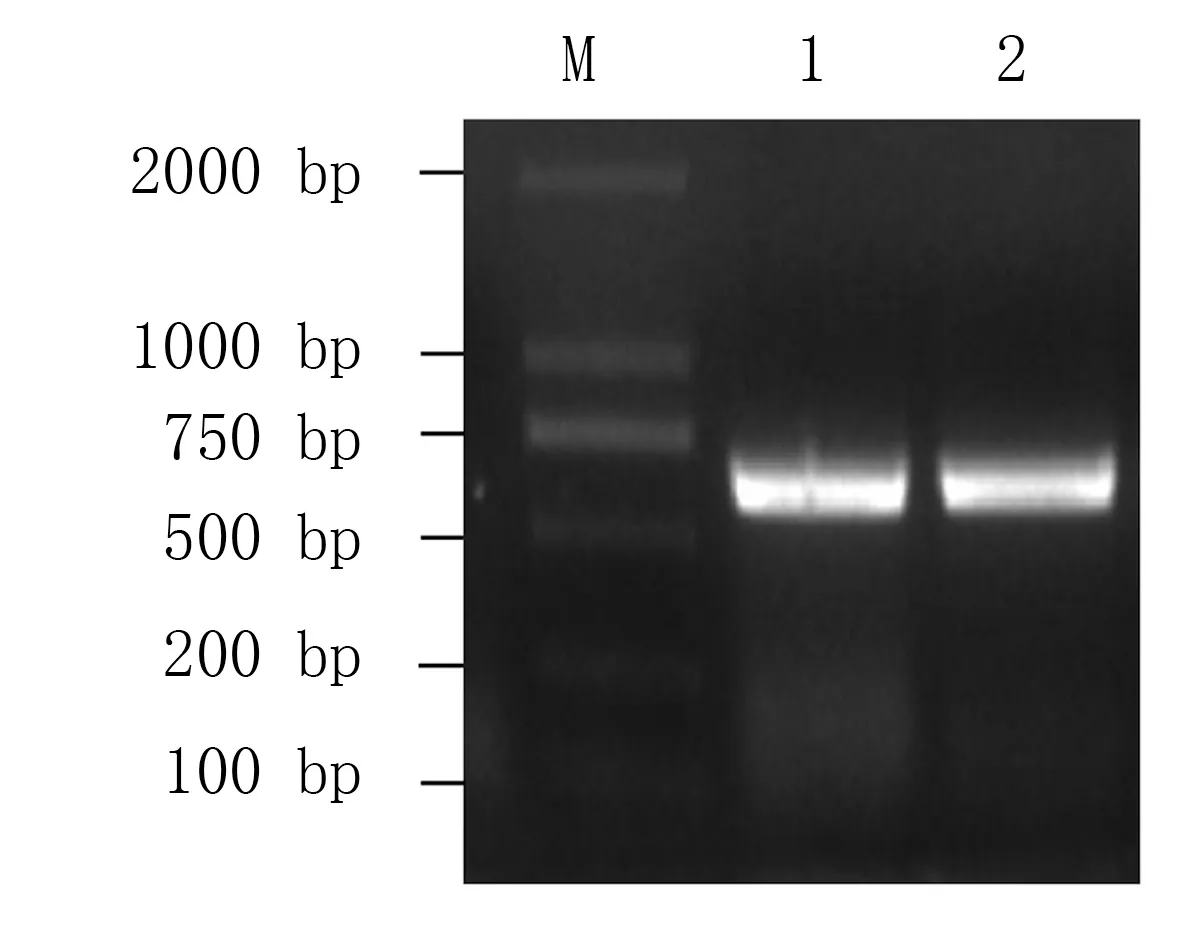
图1 菜心CBL1、CBL9 基因的PCR 扩增图谱
2.2 BcCBL1、BcCBL9 的氨基酸序列分析
利用ProtParam 和ExPASyProtScale 对Bc-CBL1、BcCBL9 编码蛋白序列进行分析,结果显示,BcCBL1 编码213 个氨基酸,分子量为24.60 kD,原子组成为C1109H1725N277O336S9,理论等电点(pI)为4.64,平均疏水率为-0.173,脂肪酸系数为89.20,不稳定系数为36.35。 BcCBL9 编码213 个氨基酸,分子量为24.41 kD,原子组成为C1097H1703N275O338S8,pI 为4.58,平均疏水率为-0.185,脂肪酸系数为88.31,不稳定系数为34.69。 BcCBL1、BcCBL9 均为可溶性亲水蛋白。 通过SignalP 5.0 预测分析发现二者均无信号肽序列,为非分泌型蛋白。
BcCBL1、BcCBL9 均有多个丝氨酸磷酸位点(ser)和苏氨酸磷酸位点(Thr)。 利用Cell-Ploc 2.0 和ProtCompv.9.0 预测BcCBL1、BcCBL9 亚细胞定位,均定位于细胞膜上;TMHMM Server 2.0分析结果表明二者均无跨膜结构。
2.3 BcCBL1 和BcCBL9 的二、三级结构分析
运用Expasy 的SOPMA 对BcCBL1、BcCBL9蛋白的二级结构进行预测分析,结果(图2)显示,BcCBL1 蛋白含有α-螺旋(alpha helix)50.70%、β-折叠延伸链(extended strand)11.74%、β-转角(beta turn) 5.16%、 无 规 则 卷 曲(random coil)32.39%,而BcCBL9 蛋白的α-螺旋、β-折叠延伸链、β-转角、无规则卷曲分别为52.11%、7.98%、6.57%、33.33%。 可见,两者的主要组成部分均为α-螺旋,β-折叠延伸链、β-转角、无规则卷曲则散布于蛋白结构中。 三级结构预测结果与该结果一致。 另外,BcCBL1 蛋白三级结构为单体结构,而BcCBL9 蛋白三级结构为二聚体结构(图3)。
图2 BcCBL1 和BcCBL9 蛋白二级结构预测
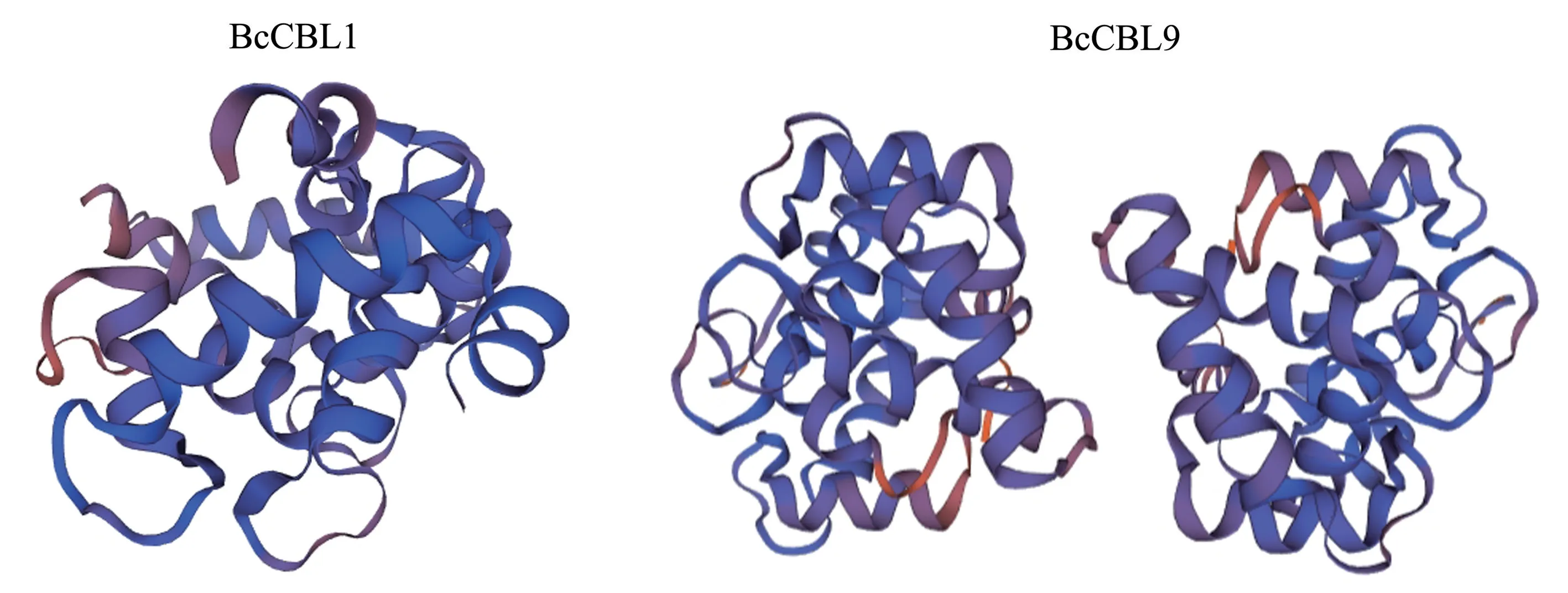
图3 BcCBL1、BcCBL9 蛋白三级结构预测
2.4 BcCBL1、BcCBL9 氨基酸序列同源性比对及系统进化分析
将BcCBL1、BcCBL9 与AtCBL1(NP_567533.1)、AtCBL9(NP_199521.1)、BrCBL1(XP_009136855.1)、BrCBL9(XP_009128938.1)进行氨基酸序列多重比对分析,结果(图4)显示,BcCBL1、BcCBL9 与两个物种CBL1、CBL9 的氨基酸相似性介于95.31%~100%,其中, BcCBL1 与BrCBL1 相 似 性 高 达100%,BcCBL9 与BrCBL9 相似性为99.53%。

图4 菜心、拟南芥、大白菜CBL1、CBL9 氨基酸序列多重比对结果
利用SMART 在线工具对两个菜心CBL基因编码氨基酸进行保守结构域分析,结果(图5)表明,Bc-CBL1、BcCBL9 均具有CBL 蛋白结合Ca2+所必需的EF-hand 型结构域(EFh),保守结构域均为3 个且位置相同,位于第71~99、108~136、152~180 位氨基酸,FANRIFDMFDVKRKGVIDFGDFVRSLNVF(BcCBL1)和FANRIFDLFDVKRKGVIDFGDFVRSLNVF(BcCBL9),KIDFTFRLYDMDCTGFIERQEVKQMLIAL (BcCBL1)和KTDFTFRLYDMDCTGFIERQEVKQMLIAL(Bc-CBL9),ILDKTFEDADVNQDGKIDKLEWSDFVNKN(BcCBL1)和ILDQTFEDADVDRDGKIDKTEWSDFVIKN(BcCBL9)。
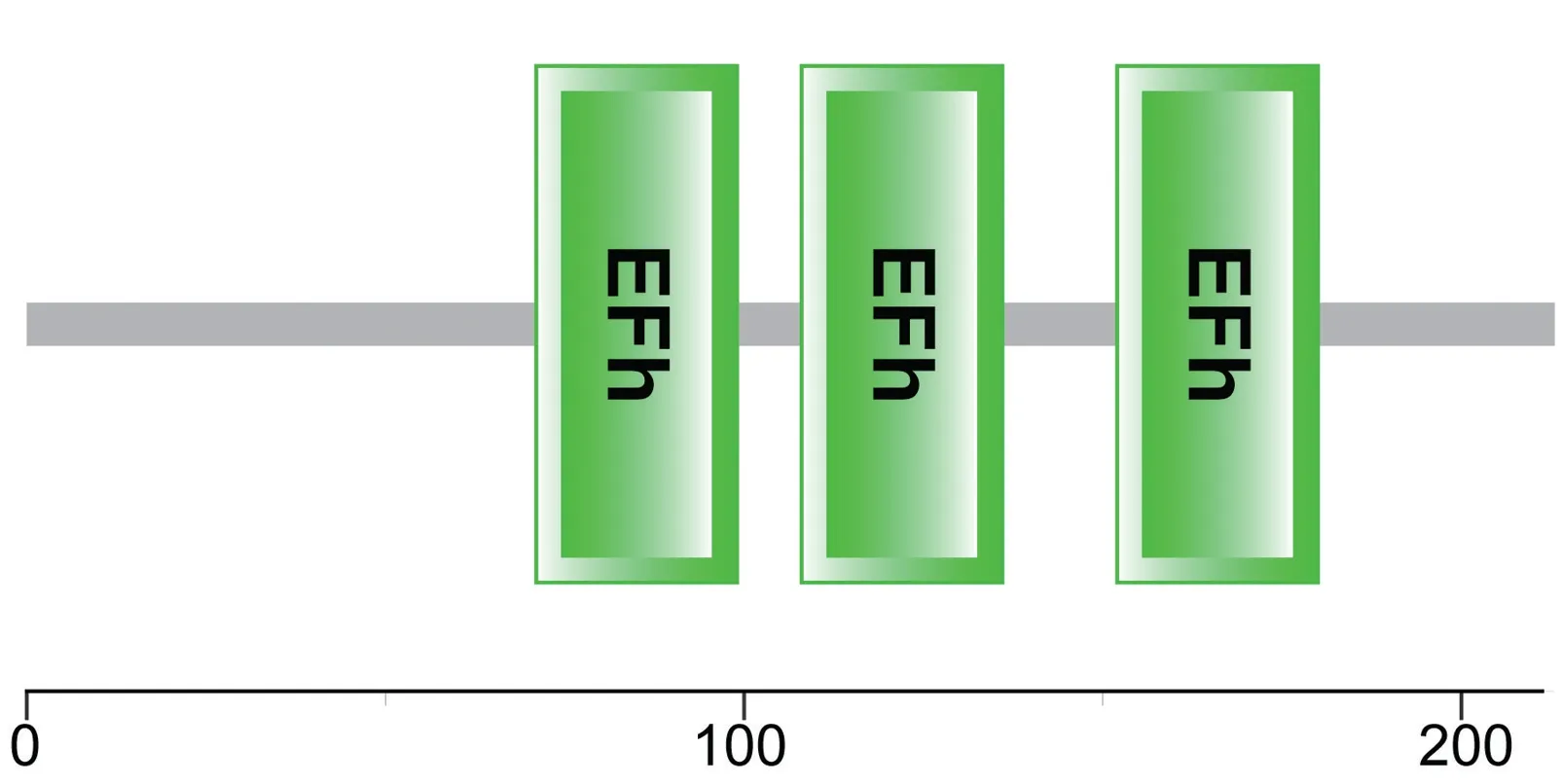
图5 BcCBL1、BcCBL9 保守结构域分析
进化树分析结果(图6)表明,BcCBL1 与BrCBL1亲缘关系最近,BcCBL9 与BrCBL9 亲缘关系最近,其次分别为AtCBL1 和AtCBL9,且菜心、大白菜、拟南芥的CBL1 与CBL9 同聚类在一个分支,而与拟南芥、大白菜的其他CBL 成员相距较远。进一步表明本研究分离得到的2 个菜心CBL基因属于植物CBLs基因家族成员,编码类钙调磷酸酶B 亚基蛋白。
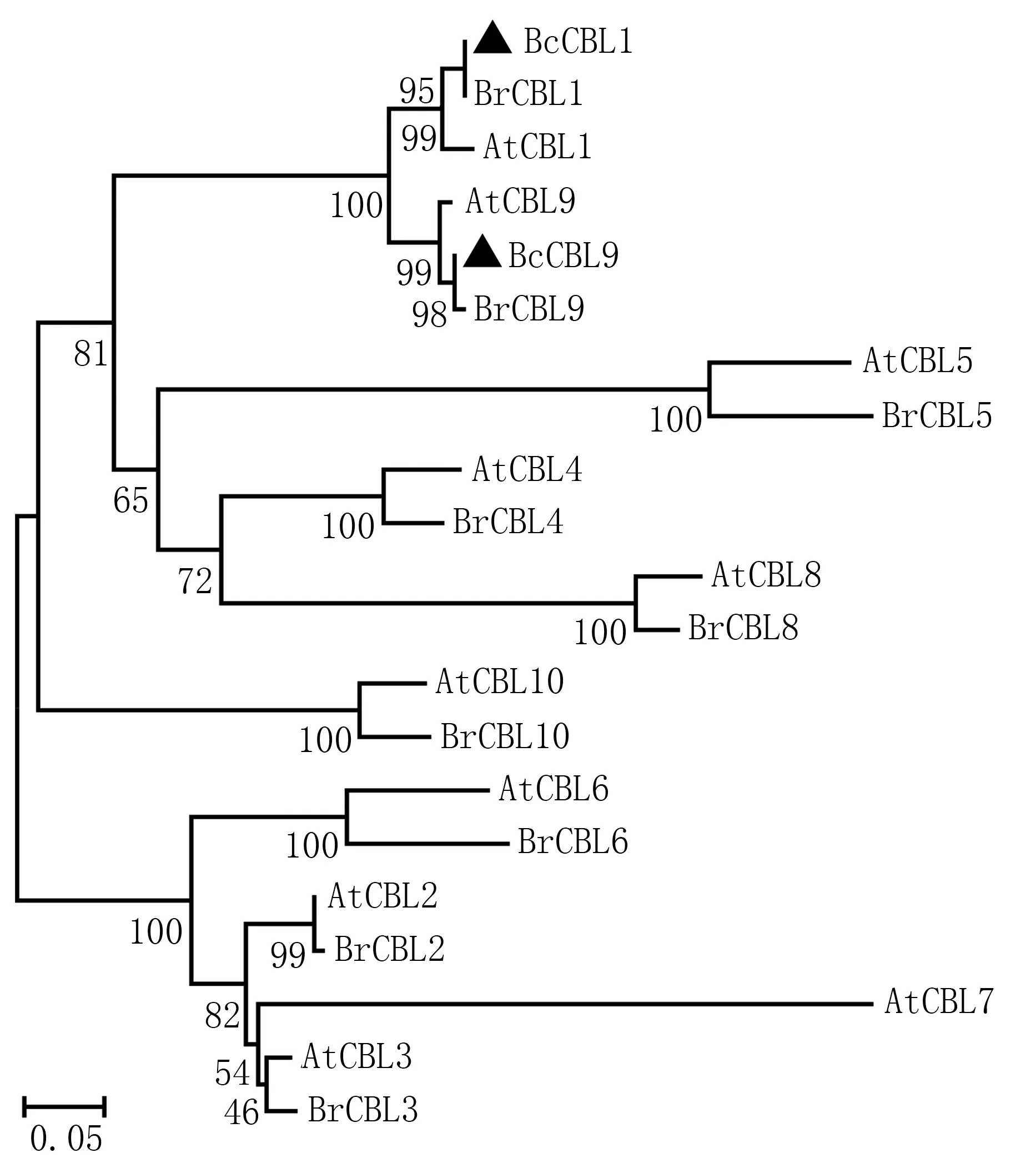
图6 BcCBL1、BcCBL9 与拟南芥、大白菜CBLs 的进化树分析
2.5 BcCBL1、BcCBL9 在菜心不同器官中的表达分析
由图7 可知,BcCBL1和BcCBL9在菜心根、茎、叶、叶柄、薹茎、花蕾、花、荚果中均有表达。BcCBL1在菜心叶中表达量最高,显著高于其他器官,其次为根、茎;在叶柄、薹茎、花蕾、花、荚果中表达量相对较低,且器官间无显著差异。BcCBL9在菜心荚果中表达量最高,其次为薹茎,两者间差异显著且均显著高于其他器官;在叶、叶柄、花、根、茎中表达量相对较低,在花蕾中的表达量最低,显著低于其他器官,仅为荚果中表达量的3.33%。
2.6 BcCBL1 和BcCBL9 对不同氮素形态的响应
由图8 可知,BcCBL1、BcCBL9表达量受氮素形态及其水平影响,二者表现出不同的表达模式。BcCBL1在低浓度氮条件表达量较高,表达量有随氮浓度增加而明显下降的趋势;在8 mmol/L NO-3(或NH+4)条件下,菜心根和叶中的BcCBL1表达量也较高,为1 mmol/L NO-3(或NH+4)条件下的5.92%~41.41%。BcCBL1表达还受不同氮素形态影响,在相同浓度条件下,NH+4处理的菜心根中BcCBL1表达量最高,NO-3处理的次之,NH4NO3处理的最低(图8A);在菜心叶中,BcCBL1表达也呈现出与根中类似的变化规律(图8B)。
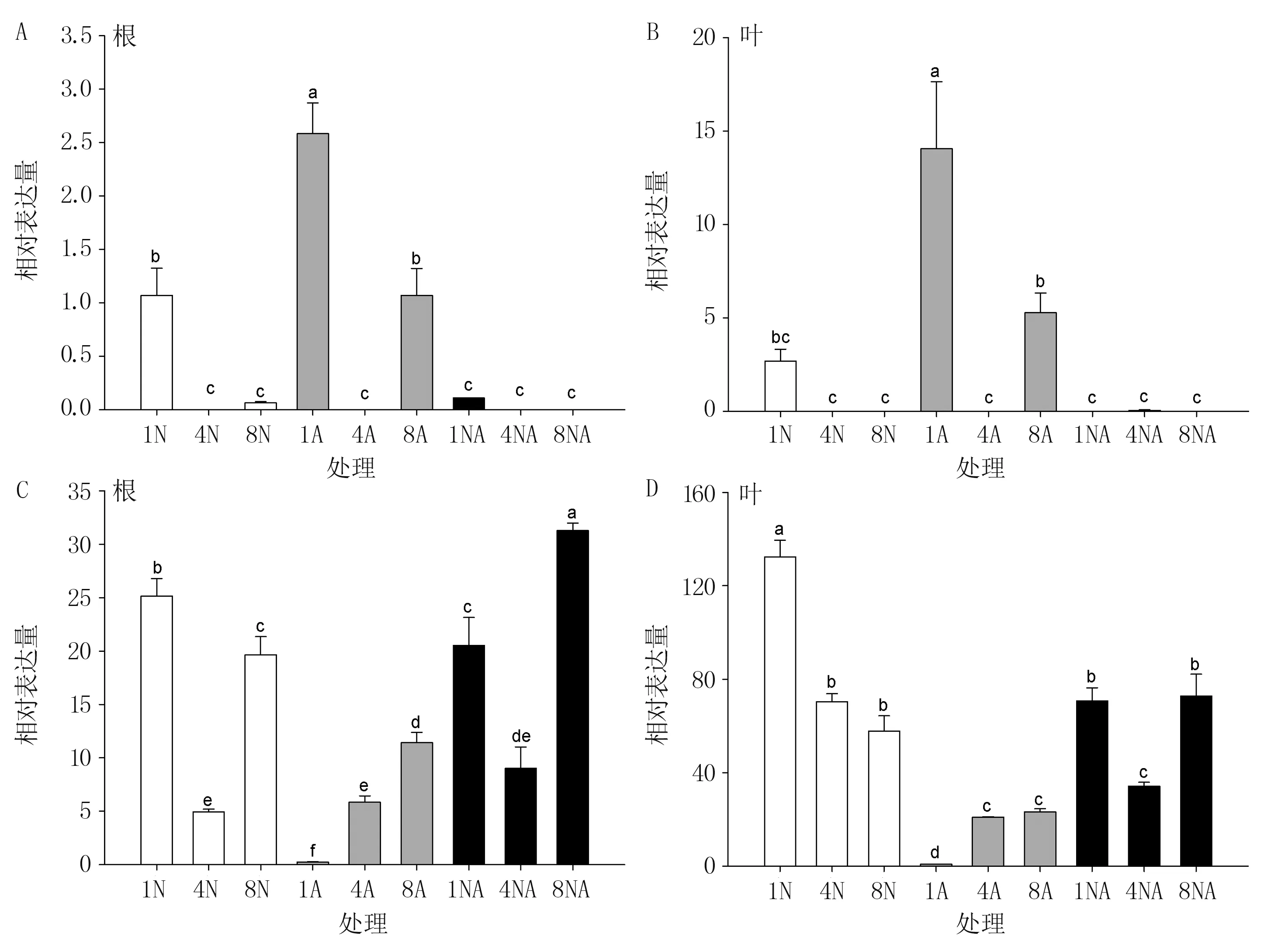
图8 BcCBL1(A、B)和BcCBL9(C、D)对不同氮素形态的响应
由图8C 看出,在菜心根中,BcCBL9表达量随着NH+4浓度增加显著增加,8 mmol/L NH+4处理下最高,分别是中、低浓度NH+4处理下的1.96 倍和48.16 倍;而在NO-3和NH4NO3处理下,随其浓度增加,BcCBL9表达量均呈现出先下降后上升的趋势,且不同浓度处理间差异显著,但表达量最高值分别出现在低浓度和高浓度处理时。 在菜心叶中(图8D),BcCBL9表达水平随NO-3浓度增加而降低,中、高浓度处理间表达量差异不显著,但显著低于低浓度处理;在NO-3和NH4NO3处理下,Bc-CBL9表达水平随浓度的变化趋势与根系中相似,但变化幅度略小,其中,中浓度与高浓度NH+4处理间、低浓度与高浓度NH4NO3处理间差异不显著。
此外,与BcCBL1相比,无论在菜心根还是叶中,BcCBL9均保持较高的表达水平,暗示两基因可能在氮素吸收利用方面发挥着不同作用。
2.7 BcCBL1、BcCBL9 蛋白互作关系
在STRING 交互式数据库中输入BcCBL1、BcCBL9 蛋白序列,选择“拟南芥”为所属物种,利用拟南芥蛋白构建互作关系网络,据此推测Bc-CBL1、BcCBL9 的互作蛋白。 由图9 推测可知,BcCBL1 蛋白与丝氨酸/苏氨酸蛋白激酶家族(CIPK1、CIPK3、CIPK7、CIPK8、CIPK9、CIPK15、CIPK23、SOS2、SIP3)、钾离子通道蛋白AKT1 具有互作关系;而BcCBL9 蛋白也可与AKT1 和CIPK 家族蛋白互作,但其互作网络中未包含CIPK7 和CIPK15,此外,菜心BcCBL9 还可与免疫亲和蛋白(FKBP12)和AT2G20050 蛋白互作。
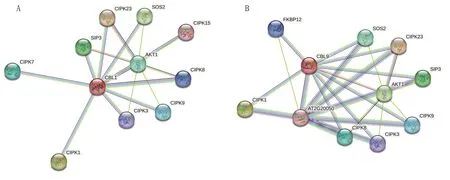
图9 BcCBL1(A)和BcCBL9(B)蛋白的互作网络
3 讨论与结论
本研究从菜心中克隆到两个完整的CBL基因——BcCBL1、BcCBL9,开放阅读框均为642 bp,均编码213 个氨基酸残基;BcCBL1、BcCBL9 蛋白均具有CBL 蛋白结合Ca2+所必需的EF-hand 结构域;与大白菜、拟南芥CBL1、CBL9 的氨基酸序列同源性均在95%以上,聚类于同一进化分支,但与其他CBL 成员的遗传距离较远。BcCBL1、BcCBL9编码蛋白均为稳定性蛋白,具有较强的亲水性,定位于细胞质膜上,无跨膜结构,无信号肽,与拟南芥AtCBL1、AtCBL9[24]和唐古特白刺Nt-CBL 的定位结果一致[11]。 CBL 定位于质膜上表明其可能通过结合膜蛋白在细胞中发挥作用[11]。BcCBL1 和BcCBL9 蛋白结构的主要组成部分均为α-螺旋,散布β-折叠延伸链、β-转角、无规则卷曲;然而,BcCBL1 为单体结构,BcCBL9 蛋白为二聚体结构,暗示两者可能发挥着不同的生物学功能。
基因在不同组织中的表达特性可能暗示其在相应表达部位的生物学功能[25]。 在已研究的植物中,多数CBL在各个组织或器官中具有不同程度表达,在某些组织中具有表达优势[8]。 本研究结果表明,BcCBL1和BcCBL9在菜心根、茎、叶、叶柄、薹茎、花蕾、花、荚果中均有表达,其中,Bc-CBL1在叶中的表达量远高于在其他组织中,而BcCBL9在荚果中的表达量显著高于在其他组织中,暗示两基因可能分别主要在菜心叶和荚果生长发育过程中发挥作用。
研究报道,CBL1/9 可与CIPK23 形成CBLCIPK 复合体参与拟南芥氮信号通路调控[18,19],并可响应低温、高盐、干旱、低钾等多种逆境胁迫,在植物生长发育过程和非生物胁迫中具有重要作用[13,20]。 本研究结果表明,BcCBL1、BcCBL9 确实可响应外界氮素变化,二者的表达水平不仅受不同氮素形态影响,也受氮素水平影响,但二者呈现出不同的变化趋势。 其中,BcCBL1在低浓度(1 mmol/L)单一氮源(NO-3或NH+4)条件上调表达,而在中(4 mmol/L)、高浓度(8 mmol/L)或混合氮源(NH4NO3)条件下调表达,甚至不表达;BcCBL9在低浓度NH+4条件下表达量低,在中、高浓度NH+4条件下表达量高,而在NO-3和NH4NO3处理时,BcCBL9在低/高氮浓度下表达水平较高,在中等浓度下表达量较低。 这与AtCBL1/9受低浓度NO-3诱导上调表达而在高浓度NO-3时下调表达[18]的结论一致。Straub[24]报道,拟南芥AtCBL1表达依赖于NH+4,缺氮后恢复供2 mmol/L NH+4可诱导其表达,供NH+430 min 时,AtCBL1表达量达到峰值,随后开始下降;而AtCBL9表达量在供NH+430 min 后才开始增加,随后基本无明显变化。 本研究主要对供不同浓度不同形态氮素2 h后BcCBL1、BcCBL9基因在菜心中的表达情况进行分析,并未比较不同供氮时间对二者表达量的影响,可在今后研究中增加该项目。
通过STRING 交互式数据库,利用拟南芥CBL1、CBL9 蛋白构建互作蛋白网络,据此推测菜心的BcCBL1 与CIPK1、CIPK3、CIPK7、CIPK8、CIPK9、CIPK15、CIPK23 等CIPK 家族成员及钾离子通道蛋白AKT1 互作; 而BcCBL9 虽可与AKT1、CIPKs 互作,但CIPK 成员不包含CIPK7 和CIPK15, 此 外, BcCBL9 还 可 与 FKBP12 和AT2G20050 蛋 白 互 作。 STRING 数 据 库 对AT2G20050 蛋白注释为含有蛋白磷酸酶2C 和环核苷酸结合/激酶结构域蛋白,参与调控蛋白质磷酸化。AtCBL1/9受低浓度NO-3诱导表达,促进其与CIPK23 形成复合体以调控AtNRT1.1 磷酸化水平,从而促进NO-3运输[18]。 在拟南芥中,AtCBL1 与AtCIPK23 形成CBL-CIPK 复合体,参与调控AtAMT1.1 和AtAMT1.2 蛋白磷酸化水平,从而调控拟南芥根系对NH+4的吸收,而AtCBL9并未参与调控[19,21,24]。 本研究发现菜心BcCBL1和BcCBL9表达均受不同氮素形态和氮素水平影响,二者在不同氮素形态下如何调控氮素吸收利用,是否存在功能冗余现象,仍需进一步研究。
综上,本研究分离得到的BcCBL1、BcCBL9基因属于菜心CBL 基因家族成员,具有组织表达特异性,受氮素不同形态不同水平影响,但两者表达模式不同,可能参与调控不同氮素条件下的氮吸收与利用过程,具体作用机制还需进一步探究。在今后研究中,可将氮素供应时间进一步细化,观察BcCBL1、BcCBL9基因在不同供氮时间下的表达模式,再利用VIGS 对基因进行沉默,验证其功能。 本研究结果可对进一步探究菜心氮素吸收利用分子机制提供一定的理论依据。
