血清miR-146b、ICAM-1与急性呼吸窘迫综合征患者疾病严重程度、预后的关系▲
2023-08-11郦文捷潘永良黄晓敏
郦文捷 潘永良 黄晓敏 顾 俊
(1 南通大学附属医院呼吸与危重症医学科、南通大学医学院,江苏省南通市 226001;2 南通大学附属丹阳医院老年科,江苏省丹阳市 212300)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种以肺泡渗透性增加和持续严重低氧血症为特征的危重疾病,是急诊ICU(emergency ICU,EICU)患者死亡的主要原因之一[1]。尽管关于ARDS发病机制和治疗手段的研究已取得重大进展,但ARDS的原发疾病多样、致病环节多、发病机制复杂,病死率仍高达40%~50%[2]。因此,早期评估ARDS患者病情严重程度和预后意义重大。研究表明,炎症反应在ARDS发生与发展过程中扮演重要角色[3]。miRNA能通过剪切mRNA和抑制蛋白表达调控靶基因转录,在炎症反应和免疫应答中发挥重要的调控作用[4]。研究表明,miR-146b能通过抑制髓样分化因子88/核因子κB(nuclear factor kappa B,NF-κB)信号通路,减轻肺炎患儿的炎症程度[5]。细胞间黏附分子(intercellular adhesion molecule,ICAM)-1是一种跨膜糖蛋白,能促进组织中受炎症影响的效应器-靶细胞的相互作用[6]。本研究探讨ARDS患者血清miR-146b、ICAM-1水平与其疾病严重程度和预后的关系。
1 资料与方法
1.1 临床资料 选取2019年1月至2021年5月南通大学附属丹阳医院收治的186例ARDS患者作为研究对象。男性131例、女性55例,年龄28~76(52.68±4.47)岁,体质指数18~26(22.44±2.59)kg/m2;合并症:高血压34例、糖尿病18例、冠心病8例;病因:手术7例、肺挫伤13例、多发伤22例、重症肺炎18例、严重感染126例。纳入标准:(1)符合《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)》[7]中的ARDS诊断标准;(2)年龄18~80岁;(3)临床资料完整。排除标准:(1)合并心源性肺水肿、慢性阻塞性肺疾病、肺结核、肺心病、肺栓塞等疾病者;(2)合并血液系统、免疫系统疾病者;(3)心、肝、肾等重要脏器损害者;(4)妊娠及哺乳期妇女;(5)合并恶性肿瘤者。本研究已经过南通大学附属丹阳医院医学伦理委员会批准,患者及家属均对本研究知情并签署知情同意书。
1.2 方法
1.2.1 收集资料:收集患者基线资料,包括性别、年龄、体质指数、合并症、病因、机械通气时间、EICU入住时间、入院时心率。
1.2.2 生化指标和ICAM-1的检测:(1)于患者入院后6 h内,使用Radiometrie公司ABL80型动脉血气分析仪测定PaO2水平,计算氧合指数,氧合指数=PaO2/吸氧浓度;使用Philips公司M3012AC10型脉搏指示连续心排血量监测仪测量血管外肺水指数(extravascular lung water index,EVLWI)。(2)采集患者入院时静脉血3 mL,以3 000 r/min离心10 min (离心半径为8 cm),取上清液备用。取部分上清液,采用ELISA测定血清肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-6、IL-10、ICAM-1水平,所有操作严格按照上海梵态生物科技有限公司提供的试剂盒(批号:FT-P32761R、FT-P31372R、FT-P31375R、FT-P37980R)说明书进行。
1.2.3 实时荧光定量PCR检测miR-146b表达水平:取另一部分上清液,采用TRIzol试剂(南京诺唯赞生物科技股份有限公司,批号:R401-01)提取血清总RNA,用超微量分光光度计检测RNA浓度和纯度,用TaKaRa反转录试剂盒(北京麦瑞博生物科技有限公司,批号:RR001A-1)将RNA反转录合成cDNA后进行实时荧光定量PCR扩增反应。miR-146b正向引物序列为5′-ACACTCCAGCTGGGTGAGAACTGAATTCCA-3′,反向引物序列为5′-TGTCGTGGAGTCGGCAATTC-3′;内参U6正向引物序列为5′-CTCGCTTCGGCAGCACATATACTA-3′,反向引物序列为5′-ACGAATTTGCGTGTCATCCTTGC-3′。反应体系(共20 μL):1 μL cDNA,2 μL正向引物,2 μL反向引物,10 μL SYBR Green Master Mix,5 μL ddH2O。反应条件:95 ℃预变性5 min;95 ℃变性15 s,62℃ 退火及延伸40 s,共40个循环。采用2-ΔΔCt法计算miR-146b相对表达水平。
1.3 ARDS严重程度和预后评估 于患者入院时,根据2012年柏林标准[8]评估其疾病严重程度:轻度指氧合指数>200 mmHg,中度指氧合指数处于100~200 mmHg,重度指氧合指数≤100 mmHg。根据疾病严重程度将患者分为轻度组(n=45)、中度组(n=58)、重度组(n=83)。患者入院后根据《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)》[7]进行治疗,根据治疗28 d后的预后情况将其分为死亡组(n=52)和存活组(n=134)。
1.4 统计学分析 采用SPSS 26.0软件进行统计学分析。计数资料以例数和百分比表示,组间比较采用χ2检验;正态分布的计量资料以(x±s)表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用Bonferroni法;偏态分布的计量资料以[M(P25,P75)]表示,组间比较采用秩和检验;采用Pearson相关分析法分析指标间的相关性;采用多因素Logistic回归模型分析ARDS患者预后不良的影响因素;采用受试者工作特征(receiver operating characteristic,ROC)曲线分析血清miR-146b、ICAM-1水平对ARDS患者预后不良的预测价值。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同疾病严重程度患者的基线资料和血清miR-146b、ICAM-1、炎症因子水平的比较 3组患者的性别、年龄、体质指数、合并症、病因、入院时心率比较,差异均无统计学意义(均P>0.05)。轻度组、中度组、重度组患者的机械通气时间、EICU入住时间、EVLWI和血清ICAM-1、TNF-α、IL-6水平均依次升高,氧合指数和血清miR-146b、IL-10水平均依次降低(均P<0.05)。见表1。
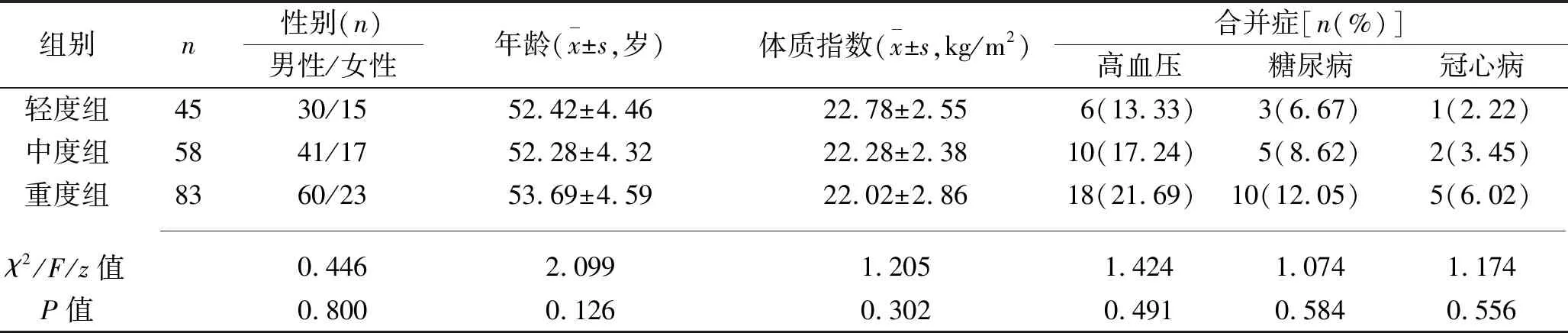
表1 不同疾病严重程度患者基线资料和血清miR-146b、ICAM-1、炎症因子水平的比较
2.2 ARDS患者血清miR-146b、ICAM-1水平与氧合指数和炎症因子水平的相关性 Pearson相关分析结果显示,ARDS患者血清miR-146b水平与氧合指数、血清IL-10水平呈正相关,与血清ICAM-1、TNF-α、IL-6水平呈负相关(均P<0.05);血清ICAM-1水平与氧合指数、血清IL-10水平均呈负相关,与血清TNF-α、IL-6水平均呈正相关(均P<0.05)。见表2。
2.3 不同预后患者的基线资料和血清miR-146b、ICAM-1、炎症因子水平的比较 死亡组患者的机械通气时间、EICU入住时间均长于存活组,氧合指数和血清miR-146b、IL-10水平均低于存活组,EVLWI和血清TNF-α、IL-6、ICAM-1水平均高于存活组(均P<0.05);两组患者其余指标差异无统计学意义(均P>0.05)。见表3。
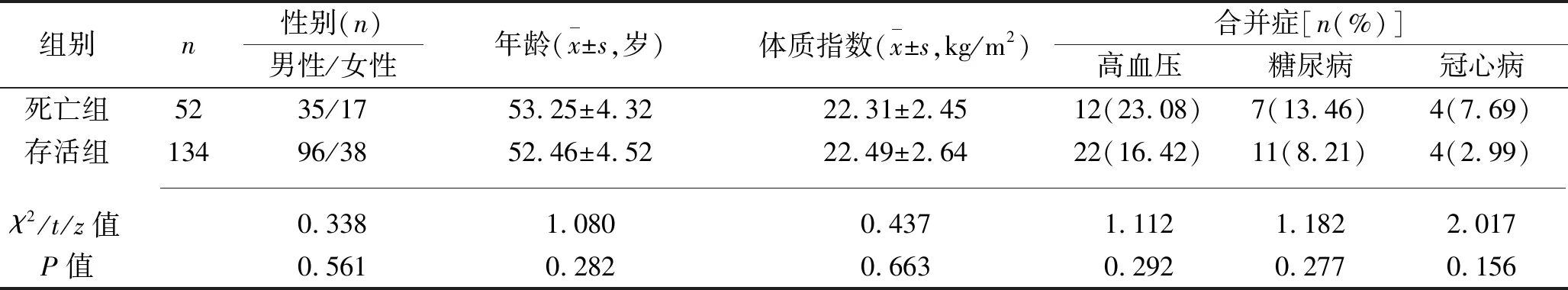
表3 不同预后患者的基线资料和血清miR-146b、ICAM-1、炎症因子水平的比较
2.4 ARDS患者预后不良的影响因素分析 以机械通气时间、EICU入住时间、EVLWI、氧合指数,以及血清TNF-α、IL-6、IL-10、miR-146b、ICAM-1水平为自变量(均以原值纳入),以ARDS患者的预后情况为因变量(死亡=1,存活=0),纳入多因素Logistic回归模型进行分析。结果显示,机械通气时间延长、EVLWI和血清TNF-α、IL-6、ICAM-1水平升高是ARDS患者预后不良的独立危险因素,氧合指数和血清IL-10、miR-146b水平升高为其独立保护因素(均P<0.05)。见表4。
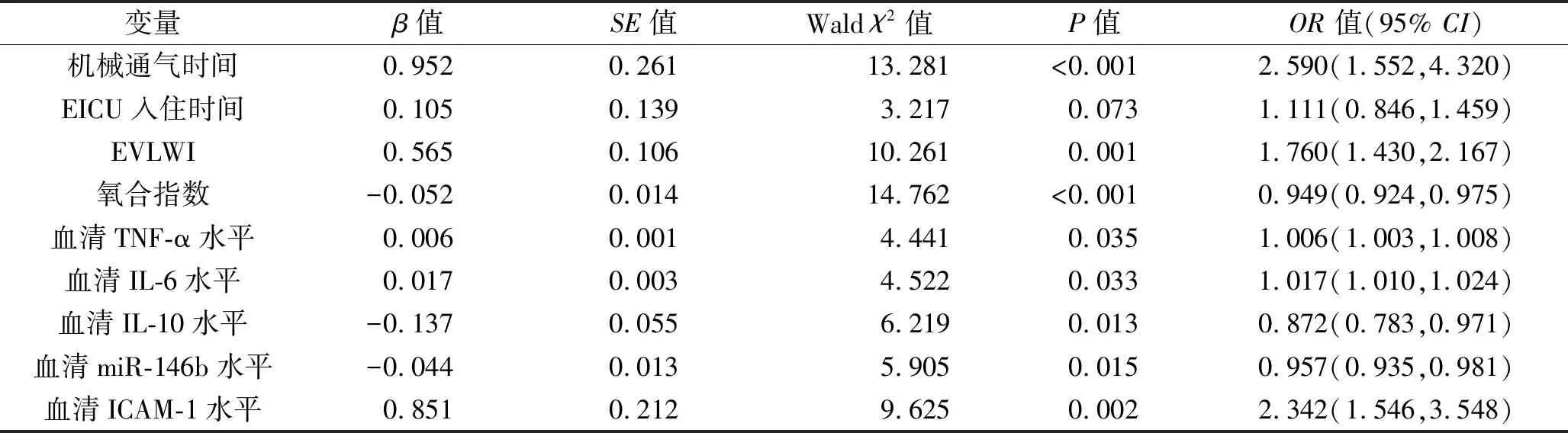
表4 ARDS患者预后不良的影响因素分析
2.5 血清miR-146b、ICAM-1水平对ARDS患者预后不良的预测价值 ROC曲线分析结果显示,血清miR-146b、ICAM-1水平分别为0.63 ng/mL、852.20 ng/mL时,预测ARDS患者预后不良的曲线下面积分别为0.802(95%CI:0.738,0.857)、0.811(95%CI:0.748,0.865),敏感度分别为76.92%、88.46%,特异度分别为74.65%、64.18%。见图1。
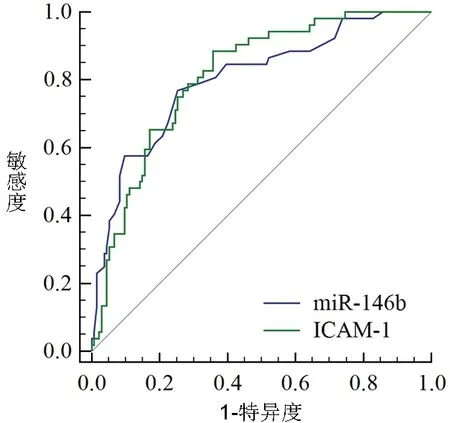
图1 血清miR-146b、ICAM-1水平预测ARDS患者预后不良的ROC曲线图
3 讨 论
ARDS是临床常见的重症呼吸系统疾病,以肺容积减少、肺顺应性降低、通气/血流值失常为主要病理生理特征,因其致病因素繁多且发病机制复杂,一直是EICU医护人员面临的难题。目前研究认为,炎症反应参与ARDS的发生和发展,肺脏在受到感染、创伤等损伤时能激活炎症反应以修复损伤,但过度的炎症反应会加剧肺泡上皮和血管内皮损害,导致肺功能持续恶化,最终引起ARDS[3]。
miRNA是一种长度为18~25个核苷酸的高度保守的非编码RNA,能根据碱基互补配对原则特异性结合目标mRNA的3′-非翻译区,间接调节基因表达,通过炎症反应参与ARDS的发生和发展[9],如miR-216a能通过调节NF-κB信号通路来缓解脂多糖诱导的ARDS[10]。miR-146b定位于染色体10q24.32,作为参与免疫炎症、癌症等多种生物学过程的miR-146成员之一,其也被认为是先天性免疫反应和适应性免疫反应的调节剂,在免疫炎症、癌症发展过程中发挥重要作用[11-12]。Zhang等[11]使用脂多糖诱导构建狼疮性肾炎细胞模型,发现肾系膜细胞中miR-146b表达受抑制,上调miR-146b表达能通过调节肿瘤坏死因子受体相关蛋白6抑制NF-κB信号通路,从而抑制脂多糖诱导的炎症损伤。Toll样受体在炎症反应的启动过程中发挥关键作用,Curtale等[12]发现,抗炎性细胞因子IL-10能诱导miR-146b表达,进而通过与Toll样受体相关的肿瘤坏死因子受体相关蛋白6、白细胞介素 1受体相关激酶1、髓样分化因子88信号通路来抑制TNF-α、IL-6等促炎性细胞因子的表达。上述研究说明miR-146b具有抗炎作用。
TNF-α、IL-6是重要的促炎性细胞因子,IL-10是重要的抗炎性细胞因子,有研究表明这三者在ARDS炎症反应中发挥重要作用[13]。本研究结果显示,轻度组、中度组、重度组患者血清TNF-α、IL-6水平依次升高,IL-10水平依次降低(均P<0.05),说明ARDS患者机体存在明显炎症反应,与既往研究[3]结果相似。氧合指数是反映器官组织能否获得足够氧气并进行氧合作用的指数,ARDS患者因顽固性低氧血症、严重呼吸窘迫等原因而出现氧合指数显著降低,因此2012年柏林标准根据氧合指数对ARDS患者进行病情分级[8]。本研究结果显示,轻度组、中度组、重度组患者的血清miR-146b水平依次降低,且ARDS患者血清miR-146b水平与氧合指数呈正相关 (均P<0.05),说明miR-146b参与ARDS的发生和发展。本研究结果还显示,ARDS患者血清miR-146b水平与血清IL-10水平呈正相关,与血清TNF-α、IL-6水平呈负相关(均P<0.05),提示miR-146b可能通过炎症反应参与ARDS的发生和发展。He等[14]通过脂多糖诱导构建ARDS小鼠模型,发现miR-146b过表达能降低肺组织和肺泡灌洗液中TNF-α、IL-1的表达,改善小鼠肺通透性。本研究结果还显示,血清miR-146b水平是ARDS患者预后的影响因素。ROC曲线分析结果显示miR-146b预测ARDS患者预后不良的曲线下面积为0.802,说明miR-146b能作为评估ARDS预后的生物标志物。
ICAM能介导内皮细胞与内皮细胞间、内皮细胞与基质间的相互接触和结合,参与细胞信号转导与活化、炎症反应、免疫应答等生物学过程[15]。ICAM-1基因定位于染色体19pl3.3-13.2,是一种位于内皮细胞表面的糖蛋白和黏附受体,在炎症刺激时内皮细胞可大量分泌ICAM-1,ICAM-1能特异性结合其受体,招募肿瘤细胞、炎症细胞、白细胞到内皮细胞,促使内皮细胞活化,增加内皮通透性,引起器官组织损伤[6]。中性粒细胞的激活和向肺泡空间的转移是ARDS炎症激活和大量促炎介质释放的关键[3]。研究表明,ICAM-1广泛表达于肺泡上皮细胞和血管内皮细胞,并在中性粒细胞招募和运输到肺部的过程中起到关键作用[16]。研究表明,ICAM-1与哮喘、类风湿关节炎等免疫炎症疾病有关[17-18]。本研究结果显示,轻度组、中度组、重度组患者的血清ICAM-1水平依次升高,且ARDS患者血清ICAM-1水平与氧合指数呈负相关(均P<0.05),说明ICAM-1参与ARDS的发生和发展。本研究结果还显示,ARDS患者血清ICAM-1水平与IL-10水平呈负相关,与TNF-α、IL-6水平呈正相关(均P<0.05),提示ICAM-1可能通过调控炎症反应参与ARDS的发生和发展。于海容等[19]通过脂多糖诱导构建ARDS兔模型,发现ARDS兔肺组织中ICAM-1的表达水平随着脂多糖干预时间的延长而升高,且随着ICAM-1表达水平的升高,肺泡炎症细胞浸润加重、间隔增厚。本研究结果显示,ICAM-1高表达的ARDS患者预后不良风险增加,ROC曲线也证实ICAM-1可作为评估ARDS预后的生物标志物。此外,ARDS患者血清miR-146b水平与ICAM-1水平呈负相关(P<0.05),说明二者参与了ARDS的发生和发展,并可作为评估ARDS患者预后的生物标志物。动物实验显示,ARDS模型大鼠肺组织中的miR-146b表达下调,ICAM-1表达上调,给予miR-146b干预后,ARDS模型大鼠肺组织中的ICAM-1表达下调,双荧光素酶报告基因实验证实miR-146b能靶向结合ICAM-1的3′-非翻译区,负向调控ICAM-1的表达[20]。该研究进一步证实了miR-146b和ICAM-1共同参与ARDS的发生和发展。
综上所述,miR-146b、ICAM-1可能通过调控炎症反应参与ARDS的发生和发展,与ARDS患者的疾病严重程度和预后相关,有望成为ARDS潜在的生物标志物和临床治疗靶点。但本研究样本量较小,研究结论还需进行多中心、大样本研究进一步验证。
