电沉积法制备丝素蛋白基水凝胶及其释药性能研究
2023-08-10方昊罗珏君李梦妍李佩珊张小宁
方昊 罗珏君 李梦妍 李佩珊 张小宁
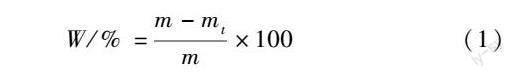

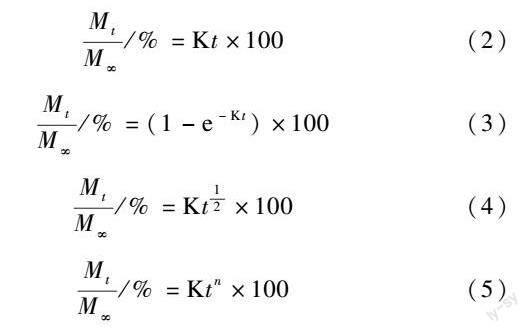



摘要: 为开发一种无毒无污染且缓释时间长的丝素蛋白(SF)基药物缓释载体,本文采用电沉积法在低电压下制备SF基水凝胶,分析了不同制备电压、溶液中不同SF质量比下制得水凝胶的宏观形貌、微观形貌、力学性能、细胞毒性、降解性能和药物缓释性能。结果表明:制备的SF基水凝胶呈乳白色,表面光滑,具有丰富致密的网络结构,抗压缩性能可随制备参数实现可控调节,不具备细胞毒性。在模拟胃液、模拟伤口渗出液和模拟体液中,SF基水凝胶的稳定性随着制备电压的增加而增强。以盐酸小檗碱为模型药物,研究发现制备得到的SF基水凝胶的释药规律符合一级动力学方程。
关键词: 丝素蛋白;水凝胶;电沉积法;药物载体;释放动力学
中图分类号: TS101.4; TQ340.64
文献标志码: A
文章编号: 1001-7003(2023)07-0001
作者简介:
方昊(2001),男,2019级生物技术专业本科生,研究方向为丝素蛋白基水凝胶的制备及应用。通信作者:张小宁,副教授,xzhang@swu.edu.cn。
自20世纪90年代以来,药物缓释体系一直是药物剂型和制剂研究中的热点。相较传统给药方式,药物缓释体系有利于延长药物作用时间、减轻患者多次用药痛苦、提高药物利用度、降低毒副作用[1],从而增强临床用药的有效性和安全性。药物缓释载体是药物缓释体系的重要组成部分[2],因此,开发药物缓释载体对提高临床用药水平具有重要意义。
近年来,多孔聚合物水凝胶用作药物缓释载体的研究备受关注[3-5]。水凝胶具有天然的三维网络状结构及良好的物理机械性能[6],能够有效载荷药物,保护药物不被降解,控制药物持续和缓慢释放[5]。丝素蛋白(Silk Fibroin,SF)作为蚕丝的主要组成蛋白,占蚕丝总质量的70%~80%[7],具有来源丰富、价格低廉、生物相容性良好、免疫原性低、可塑性强、降解性可控、无毒、无污染等特点,被视为制备水凝胶药物缓释载体的最佳原材料之一[8]。然而,载药SF基水凝胶存在药物初期突释问题,即SF基水凝胶在装载药物后会出现早期药物高浓度释放现象,不利于达到长期有效的药物缓释效果。研究表明,通过改进制备工艺、缩短凝胶化时间可以缓解突释现象[9]。
目前,促进再生SF溶液凝胶化的方法有很多[10]。相比常见的有机溶剂诱导法[11-12]和酶促交联法[13-14],电沉积法用于制备SF基水凝胶具有时间短、绿色环保、经济简便的优点[15]。电沉积法是指在电场作用下,阳极附近的水电解产生大量氢离子,促使带负电荷的SF分子聚集,与氢离子发生中和反应后沉积形成水凝胶的方法[16]。如Leisk等[17]将两个铅质电极置入SF溶液中,施加25 V直流电压3 min后,便可在阳极上制得SF水凝胶,但在25 V电压下电极表面会析出大量气泡,导致制备的SF水凝胶形状不均匀。Liu等[18]在3 V电压下制备了SF水凝胶,但制备时间长达6 h,当电压增加到6 V时仍需1 h成胶,成胶时间过长。本文前期研究发现,在再生SF溶液中加入羧甲基壳聚糖(Carboxymethyl Chitosan,CMCS)可降低SF成胶电压和成胶时间,从而提高成胶效率[16]。CMCS是壳聚糖衍生物之一,来源广泛,因其具有无毒,抗菌,生物相容性、水溶性和可降解性良好等优点,制备得到的SF基水凝胶(SF/CMCS水凝胶)在药物缓释领域具有广阔的应用前景[19]。
小檗碱(Berberine,BBR)又称黄连素,具有抗炎、抗菌等药理作用,有助于促进胃炎的治疗和伤口的愈合[20-21]。由于口服BBR吸收效果较差、肌注BBR无法长时间维持血药浓度,使用有效的药物缓释载体以提高BBR的疗效显得至关重要[22]。本文拟通过改变电沉积参数可控调节SF/CMCS水凝胶的交联程度,进而制备出具备不同缓释性能的SF/CMCS水凝胶,并以BBR为药物模型,评价各制备参数下制备得到的SF/CMCS水凝胶在不同应用场景下用作药物缓释载体的可行性。
1 试 验
1.1 材料与仪器
材料:蚕茧(四川省阆中蚕种场),羧甲基壳聚糖相对分子质量543.519 g/mol、取代度≥95%(上海瑞永生物科技有限公司),氯化钠(上海晶纯生化科技股份有限公司),粉剂PBS磷酸盐缓冲液(重庆润晨生物技术有限公司),无水氯化钙(成都市科隆化学品有限公司),无水乙醇、无水碳酸钠、盐酸(重庆川东化工有限公司),粉剂SBF模拟体液(重庆阿米达生物科技有限公司),盐酸小檗堿水合物(上海迈瑞尔化学技术有限公司),高糖培养基(DMEM)(美国HyClone公司),胎牛血清(浙江天杭生物科技有限公司),苯酚(阿拉丁科技(中国)有限公司),二甲基亚砜(DMSO)和3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)(德国Biofroxx公司)。
仪器:HZK-FA210型电子天平(福建华志电子科技有限公司),FL-2型封闭式可调节电炉(北京市永光明医疗仪器有限公司),SYG-1220型水浴锅(美国精骐有限公司),Milli-Q型纯水仪(Millipore中国有限公司),CHI760E型电化学工作站(上海辰华仪器有限公司),PHS-3E型pH值计(上海仪电科学科学仪器股份有限公司),GTM-2100型微机控制电子万能材料试验机(上海协强仪器制造有限公司),LGJ-10型真空冷冻干燥机(上海豫明仪器有限公司),D3400型数码相机(日本尼康株式会社),TM4000Plus型扫描电子显微镜(日本株式会社日立制作所),SBC-12型离子溅射仪(北京中科科仪股份有限公司),MH-Ⅰ型微量振荡器(江苏海门市其林贝尔仪器制造有限公司),SynergyH1型多功能酶标仪(美国伯腾仪器有限公司),HQH-250型智能人工气候箱(上海跃进医疗器械有限公司),LYGZ-2102C型光照恒温摇床(常州金坛良友仪器有限公司),759S型紫外可见分光光度计(上海菁华科技仪器有限公司),XDS-ⅠB型倒置生物显微镜(重庆重光实业有限公司)。
1.2 方 法
1.2.1 丝素蛋白/羧甲基壳聚糖水凝胶的制备
称取蚕茧,剪碎后,以1︰50的浴比加入0.5% Na2CO3溶液中煮沸30 min,捞出蚕茧并用去离子水反复搓洗直至无滑腻感。重复上述操作2次,在室温条件下晾干后获得丝素蛋白纤维。将丝素蛋白纤维以1︰10的浴比加入三元溶剂中,置于70 ℃的水浴锅内,玻璃棒不断搅拌,直至丝素蛋白完全溶解。将上述制备的溶液冷却后透析3 d,透析完之后进行过滤及离心。测定丝素蛋白溶液的质量分数,并将其调节至10%。
将质量分数为10%的丝素蛋白溶液分别与质量分数为4%和2%的CMCS溶液混合,使用电化学工作站的计时电流法(chronoamperometry)调控制备电压[16],分别获得4种不同的SF/CMCS水凝胶:制备电压为3 V,SF与CMCS质量比为5︰1的SF/CMCS水凝胶(记为SC-3V-5︰1);制备电压为3 V,SF与CMCS质量比为5︰2的SF/CMCS水凝胶(记为SC-3V-5︰2);制备电压为4 V,SF与CMCS质量比为5︰1的SF/CMCS水凝胶(记为SC-4V-5︰1);制备电压为4 V,SF与CMCS质量比为5︰2的SF/CMCS水凝胶(记为SC-4V-5︰2)。
1.2.2 宏观形貌观察
采用D3400型数码相机观察并记录多个制备得到的4种不同SF/CMCS水凝胶的宏观形态。
1.2.3 微观形貌观察
将4种不同的SF/CMCS水凝胶用LGJ-10型真空冷冻干燥机冷冻干燥后进行喷金处理,并通过SEM观察SF/CMCS水凝胶内部的微观形貌结构。
1.2.4 抗压缩测试
使用GTM-2100型微机控制电子万能材料试验机测量4种不同的SF/CMCS水凝胶的抗压机械性能。将试验机设定为压缩模式,将SF/CMCS水凝胶放置于基座,以1 mm/min的位移速率测定其在压缩测试下的最大应力,直至样品碎裂。使用双因素方差分析法对各组最大应力开展数据分析(*为P<0.05,** 为P<0.01,*** 为P<0.001,n=3)。
1.2.5 细胞毒性测试
以人胚肾上皮细胞(HEK-293)为模型進行MTT试验,测试4种不同的SF/CMCS水凝胶的细胞毒性。取冷冻干燥后的SF/CMCS水凝胶0.2 g置于10 mL DMEM完全培养基(含10%胎牛血清)中,使其完全沉浸,于37 ℃、5% CO2培养箱中平衡72 h。浸提完成后过滤提取液,并装入无菌试管内,置于4 ℃冰箱保存备用。配置5 mg/mL的MTT溶液(溶剂为PBS溶液)置于-20 ℃冰箱保存备用。
试验中分别加入含10%胎牛血清的DMEM完全培养基,记为完全培养基组;灭菌后的64 g/L苯酚溶液(溶剂为DMEM完全培养基),记为苯酚组;4种SF/CMCS水凝胶浸提液对HEK-293细胞进行培养。将单细胞悬液以2×105个/mL的密度接种于96孔板,每孔100 μL,于37 ℃、5% CO2环境中培养24 h,使其贴壁生长。然后舍弃培养基,加入100 μL完全培养基,再分别加入10 μL完全培养基、SF/CMCS水凝胶浸提液及苯酚溶液,培养1、3 d和5 d后使用XDS-IB型倒置生物显微镜分别拍照记录。随后加入20 μL MTT溶液,继续于5% CO2环境中培养4 h后,吸取培养液加入200 μL DMSO,再加3个空白DMSO溶液为对照,培养板于微量振荡器中震荡15 min后,使用SynergyH1型多功能酶标仪检测490 nm处各孔吸光值。使用单因素方差分析法对吸光值展开数据分析(*为P<0.05,** 为P<0.01,*** 为P<0.001,n=3)。通过各组吸光值的差异,可以反映出各组细胞密度的差异,检测4种不同SF/CMCS水凝胶的细胞毒性。
1.2.6 降解性能测试
通过查阅文献可知,模拟胃液的pH值为1.2[23],温度为37 ℃[24];模拟伤口渗出液的pH值为6.0[25],温度为32 ℃[26];模拟体液可通过购得的SBF模拟体液(粉剂)进行配置,温度为37 ℃[25]。SF/CMCS水凝胶用滤纸吸干表面水分后用电子天平准确称重,记为m,再于HQH-250型智能人工气候箱中分别浸入37 ℃下的模拟胃液、32 ℃下的模拟伤口渗出液及37 ℃下的模拟体液中进行降解试验。在指定时间取出SF/CMCS水凝胶,用滤纸吸干样品表面水分后称重,记为mt。质量损失率(W)由下式计算得出:
W/%=m-mtm×100(1)
式中:W为质量损失率,%;m为样品初始质量,g;mt为不同降解时间(t)对应的样品质量,g。
1.2.7 释药性能及机制解析
选择BBR作为药物释放研究的模型药物,分别制备以水、模拟胃液和模拟伤口渗出液为溶剂的BBR溶液标准曲线。以水为溶剂的BBR溶液标准曲线是为了对4种SF/CMCS水凝胶的载药量进行测定;以模拟胃液和模拟伤口渗出液为溶剂的BBR溶液标准曲线是为了在模拟胃液和模拟伤口渗出液环境下进行药物缓释性能测试时,对缓释液中BBR的质量浓度进行测定,并计算出BBR的释放量,从而得到一定时间内BBR的累计释放量。
将4种不同的SF/CMCS水凝胶浸泡在BBR的水溶液中,抽取真空放置30 min,重复3次,随后通过BBR溶液质量浓度的变化情况,对SF/CMCS水凝胶的载药量进行计算。将载药后的SF/CMCS水凝胶放入模拟胃液和模拟伤口渗出液中,置于恒温摇床上以100 r/min的转速进行释放,在特定时间点吸取缓释液并用759S型紫外可见分光光度计在BBR最大吸收波长345 nm处测定溶液的吸光度,通过标准曲线,测定缓释液中的BBR含量,并计算累计释放量。
分别使用零级动力学(式(2))[28]、一级动力学(式(3))[29]、Higuchi模型(式(4))[30]和Ritger-Peppas模型(式(5))[31]对药物的释放曲线进行拟合。通過比较各模型的拟合相关系数(R2),探讨释药机理。
式中:t为释放时间;Mt为t时的累计释放量;M∞为∞时的累计释放量;Mt/M∞为t时的累计释放百分率;K为常数;n是Ritger-Peppas模型中表征释放机制的特征参数。
2 结果与分析
2.1 宏观形貌分析
通过前期试验发现:当施加电压小于3 V时,SF/CMCS水凝胶无法从电极片上进行剥离;当施加电压大于5 V时,会导致SF/CMCS水凝胶表面结构粗糙,并且出现明显可见的由析氧反应生成的氧气泡造成的大孔;4%是CMCS水溶液保持稳定状态的最高质量/体积比[16]。在本文中SF/CMCS水凝胶制备条件为施加电压分别为3 V和4 V,溶液分别为10% SF和4% CMCS的混合溶液及10% SF和2% CMCS的混合溶液。
通过对4种SF/CMCS水凝胶的宏观形貌进行观察,发现皆呈乳白色,表面光滑,如图1所示。
2.2 微观形貌分析
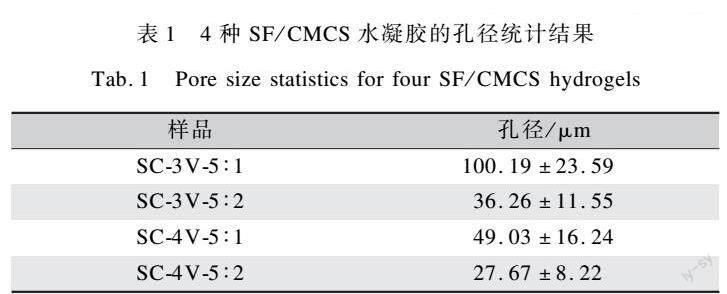
利用SEM对4种SF/CMCS水凝胶的微观结构进行观察,发现均呈现三维孔状结构,能够装载药物[1],如图2所示。对各组SF/CMCS水凝胶的孔径统计结果(表1),发现随着制备电压的升高,凝胶孔径减小,表明SF/CMCS水凝胶的交联度增加。这是由于随着制备电压的升高,阳极附近产生的氢离子增多,促进了中和反应,使得凝胶内部结构变得更加致密。此外,随着CMCS质量分数的增加,样品孔径也减小,同样表明SF/CMCS水凝胶交联度的增加。这归因于CMCS质量分数的增加使其与SF分子更充分交联,使得SF/CMCS水凝胶内部结构变得更加致密。
2.3 抗压缩性能分析
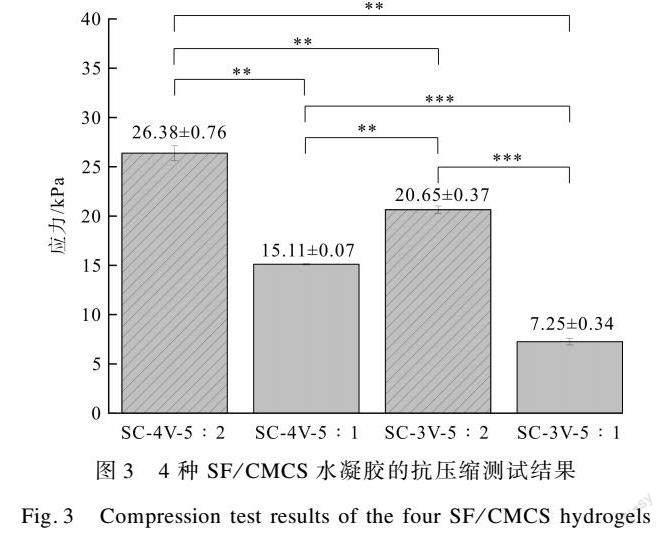
为了探究4种SF/CMCS水凝胶作为药物缓释载体时抵抗外力挤压的能力,本文对4种SF/CMCS水凝胶的抗压缩力学性能进行研究,如图3所示。由图3可见,随着CMCS质量分数的升高及制备电压的增大,SF/CMCS水凝胶的最大应力也会增大。综合微观形貌表征结果,这是随着CMCS质量分数的升高及制备电压的增大,水凝胶的孔径逐渐减小,交联度逐渐增大,水凝胶的结构变得更加致密所导致的。因此,提高制备电压和CMCS质量分数均可增强SF/CMCS水凝胶的抗压缩力学性能。
2.4 细胞毒性分析
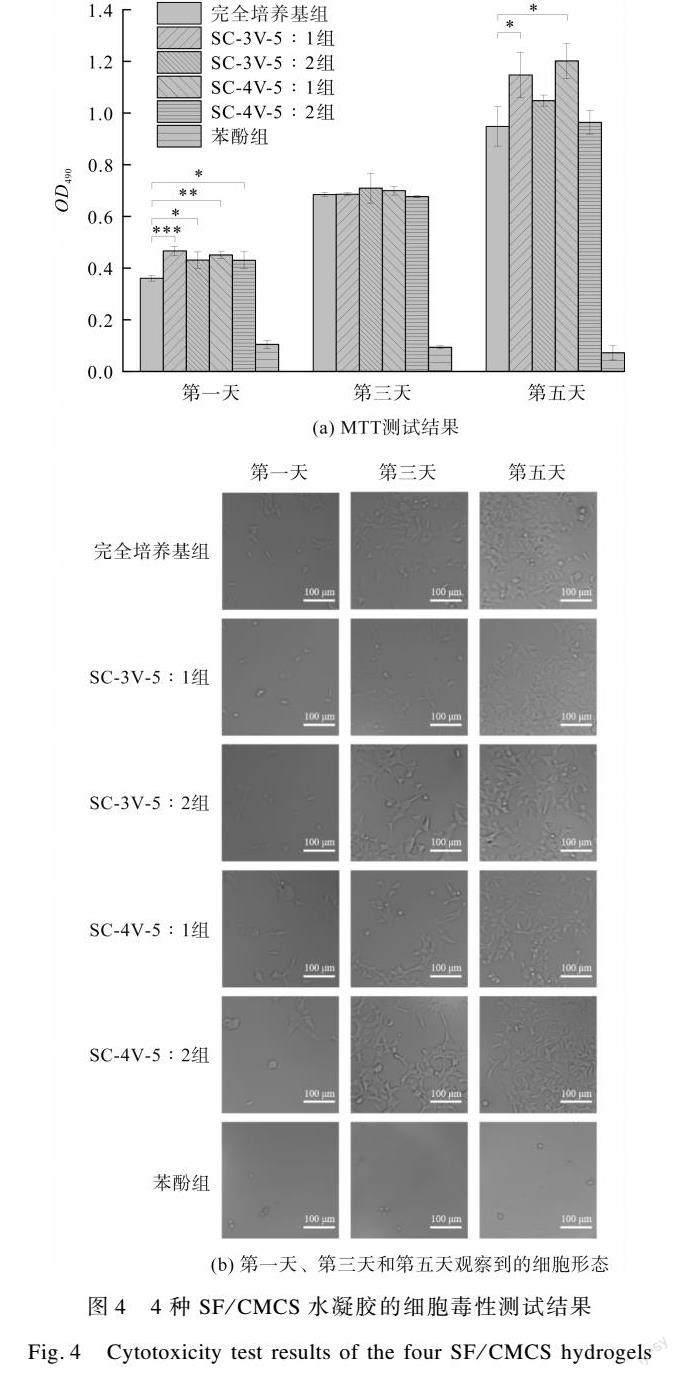
为评价不同条件下制备得到的SF与CMCS交联产物的细胞相容性,本文对4种SF/CMCS水凝胶的细胞毒性进行分析,试验结果如图4所示。由图4(a)可见,除苯酚组外,SF/CMCS水凝胶浸提液组的吸光值在第一天均显著大于完全培养基组,在第三天均与完全培养基组无显著性差异。在第五天时,SC-3V-5︰1和SC-4V-5︰1的吸光值显著大于完全培养基组,SC-3V-5︰2和SC-4V-5︰2的吸光值与完全培养基组无显著性差异。苯酚组从第一天到第五天,吸光值均显著低于完全培养基组(P<0.001)。由图4(b)可见,SF/CMCS水凝胶浸提液组和完全培养基组细胞均贴壁生长、正常增殖,而苯酚组细胞呈圆形、增殖停滞。综上所述,4种SF/CMCS水凝胶均不具有细胞毒性,且SC-3V-5︰1和SC-4V-5︰1的水凝胶浸提液能够显著地促进细胞生长。
2.5 降解性能分析
本文对4种SF/CMCS水凝胶在模拟胃液、模拟伤口渗出液和模拟体液中的稳定性分别进行了探究,在三个环境中降解率随时间变化的曲线如图5所示。在模拟胃液、模拟伤口渗出液和模拟体液三个环境中,随着CMCS质量分数的升高及制备电压的增大,SF/CMCS水凝胶的降解速率减弱。结合微观形貌的研究结果,这归因于随着CMCS质量分数的升高及制备电压的增大,水凝胶的孔径逐渐减小,交联度逐渐增大,水凝胶的结构变得更加致密,使得水凝胶的稳定性增加。值得注意的是,在模拟伤口渗出液环境中,SC-3V-5︰1水凝胶形成更加易碎的结构。即尽管SC-3V-5︰1没有完全降解,但在吸干凝胶表面水分称重过程中,水凝胶极易黏在滤纸表面,进而破碎(图5(b)),无法继续试验。因此,SC-3V-5︰1在伤口渗出液中的降解试验在72 h被迫终止。在模拟体液中,4种SF/CMCS水凝胶的降解速率增快,SC-3V-5︰1在4 h时完全降解,SC-4V-5︰2在12 h也基本完全降解。这表明在模拟体液中,4种SF/CMCS水凝胶都不适用于作为长效缓释药物载体材料。因此,在后续试验中,仅在模拟胃液和模拟伤口渗出液中对4种SF/CMCS水凝胶进行药物缓释性能的评价。
2.6 药物缓释性能分析
为了探究4种SF/CMCS水凝胶在模拟胃液和模拟伤口渗出液中是否具有药物缓释的能力,本文对4种SF/CMCS水凝胶在模拟胃液和模拟伤口渗出液中的药物缓释性能进行分析,如图6所示。由图6可见,BBR在纯水、模拟胃液和模拟伤口渗出液中的三条标准曲线,拟合度均达到0.99以上。
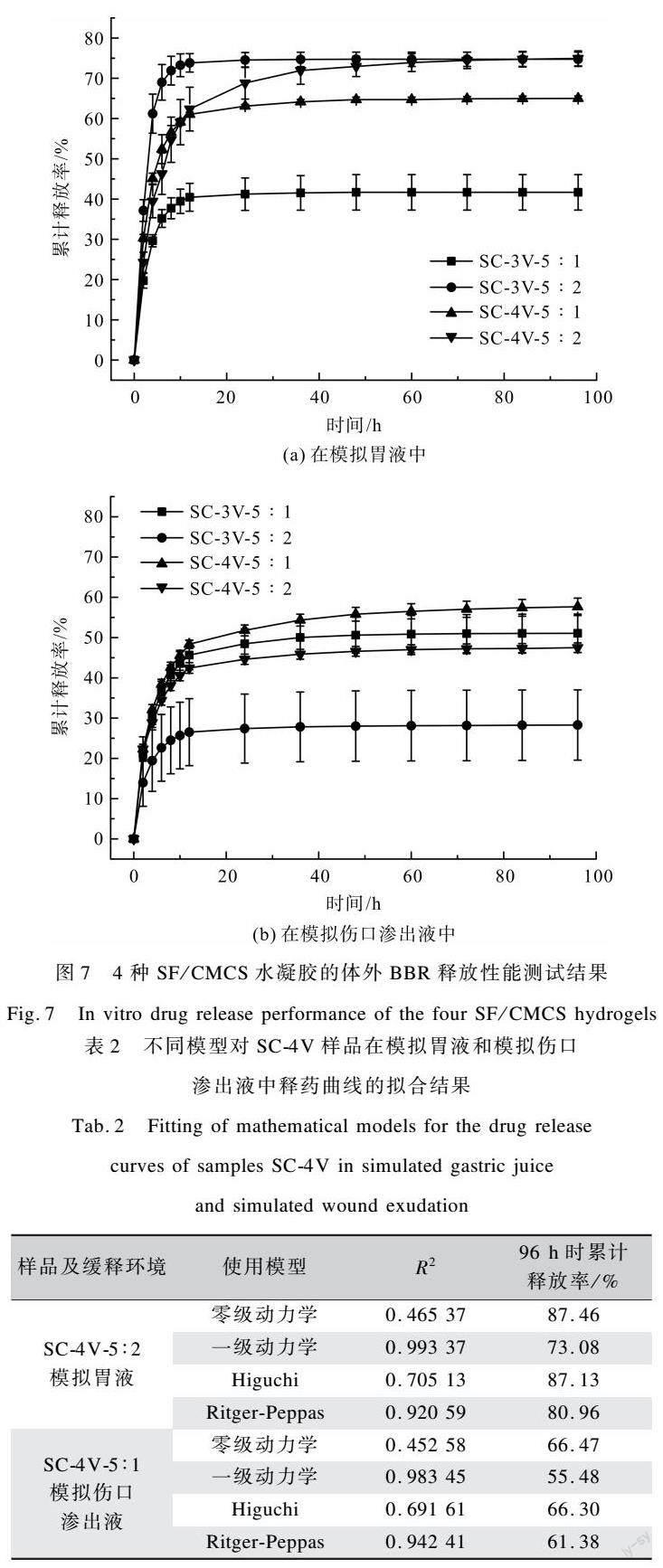
在释放的初始阶段,各组SF/CMCS水凝胶在模拟胃液和模拟伤口渗出液两种环境中均发生一定程度的突释,随着释放时间的延长,BBR释放速率逐渐减慢,曲线斜率接近零,表明SF/CMCS水凝胶的药物释放达到平衡,如图7所示。在模拟胃液中,SC-3V-5︰1、SC-3V-5︰2、SC-4V-5︰1和SC-4V-5︰2的释放曲线分别在12、12、48 h和60 h后趋于平衡状态,对BBR的释放率在96 h时分别达到41.67%、74.73%、65.01%和74.93%,如图7(a)所示。在模拟伤口渗出液中,SC-3V-5︰1、SC-3V-5︰2、SC-4V-5︰1和SC-4V-5︰2的释放曲线分别在48、12、60 h和48 h后趋于平衡状态,对BBR的释放率在96 h时分别达到51.06%、28.29%、57.65%和47.49%,如图7(b)所示。SF/CMCS水凝胶的多孔结构有利于负载药物,伴随着SF/CMCS水凝胶的降解,孔状结构被破坏进而诱导所负载药物的释放[32]。除SC-3V-5︰1组外,SF/CMCS水凝胶在模拟胃液中对BBR的释放率要高于其在模拟伤口渗出液中对BBR的释放率,这可归因于温度的升高对药物释放的促进作用[33]。相比于模拟胃液,模拟伤口渗出液使得SC-3V-5︰1组水凝胶形成更易碎裂的结构(图5(b)),这可能是其在模拟伤口渗出液中对BBR有更高释放率的原因。此外,在96 h时仍有部分负载BBR的SF/CMCS水凝胶未降解,因此在模拟胃液和模拟伤口渗出液中,水凝胶在96 h内药物累计释放率均无法达到100%。
为了研究SF/CMCS水凝胶的释药动力学,本文使用不同的模型对释药曲线进行拟合,得出了各模型的R2值,如表2所示。当R2值越趋近于1.000 00时,表示该模型对试验数据的拟合程度越好。表2结果表明,SC-4V-5︰2在模拟胃液中BBR的释放遵循一级动力学模型;SC-4V-5︰1在模拟伤口渗出液中BBR的释放同样遵循一级动力学模型。
综上所述,4种SF/CMCS水凝胶在模拟胃液和模拟伤口渗出液中均具有药物缓释能力,且随着环境的变化,累计释放率也会受到影响。在模拟胃液中,SC-4V-5︰2最适合作为药物缓释载体,96 h时药物的累计释放率为74.93%;在模拟伤口渗出液中,SC-4V-5︰1最适合作为药物缓释载体,96 h时药物的累计释放率为57.65%。相较于部分已报道的SF基水凝胶药物缓释载体,本方法制备的水凝胶展现出可比拟的缓释效果[34-35]。
3 结 论
本文采用电沉积法制备了丝素蛋白/羧甲基壳聚糖水凝胶,探究了不同制备参数下得到的水凝胶的微观形貌、抗压缩性能、细胞毒性和降解性能。并以BBR为药物模型,分析了SF/CMCS水凝膠的体外药物释放行为,探究了SF/CMCS水凝胶作为药物缓释载体的可行性。得出如下结论:
1) 4种不同的SF/CMCS水凝胶均具有三维孔状结构,且随着制备电压的升高及CMCS质量分数的增加,SF/CMCS水凝胶的孔径呈现减小趋势。
2) 4种不同的SF/CMCS水凝胶均表现出良好的抗压缩力学性能,且随着CMCS质量分数的升高及制备电压的增大,SF/CMCS水凝胶的抗压缩力学性能增加。
3) 4种不同的SF/CMCS水凝胶均不具有细胞毒性。
4) 在模拟胃液、模拟伤口渗出液和模拟体液三个环境中,随着CMCS质量分数的升高及制备电压的增大,SF/CMCS水凝胶的稳定性增加,但在模拟体液中水凝胶的降解速率过快,不适合用作药物缓释载体。
5) 4种不同的SF/CMCS载药水凝胶在浸入模拟胃液和模拟伤口渗出液时,在初期均发生一定程度的突释,随着释放时间的延长,药物释放速率逐渐减慢,4种水凝胶均具有药物缓释作用。在模拟胃液中,SC-4V-5︰2最适合作为药物缓释载体;在模拟伤口渗出液中,SC-4V-5︰1最适合作为药物缓释载体。
相较于部分已报道的SF基水凝胶药物缓释载体,本方法制备过程无毒无污染,更加绿色环保,且制备得到的水凝胶展现出可比拟的缓释效果。因此,本文在低电压下制备的SF/CMCS水凝胶在药物缓释领域具有较大的应用潜力。
参考文献:
[1]崔桓, 冯松福, 陆晓和. 将水凝胶作为药物缓释载体的研究进展[J]. 当代医药论丛, 2020, 19(4): 18-20.
CUI Huan, FENG Songfu, LU Xiaohe. Advances in the study of hydrogels as sustained-release drug carriers[J]. Contemporary Medical Symposium, 2020, 18(4): 18-20.
[2]丁维莲. 药物缓释载体材料的研究进展[J]. 广东化工, 2022, 49(11): 107-108.
DING Weilian. Study on the drug release material[J]. Guangdong Chemical Industry, 2022, 49(11): 107-108.
[3]YU A, HU Y H, MA X H, et al. Sequential drug release of co-assembled supramolecular hydrogel as synergistic therapy against Staphylococcus aureus endophthalmitis[J]. Chemical Engineering Journal, 2022, 427: 130979.
[4]SHUKLA A, SINGH A P, MAITI P. Injectable hydrogels of newly designed brush biopolymers as sustained drug-delivery vehicle for melanoma treatment[J]. Signal Transduction and Targeted Therapy, 2021, 6(1): 63.
[5]HU B, GAO M, BOAKYE-YIADOM K O, et al. An intrinsically bioactive hydrogel with on-demand drug release behaviors for diabetic wound healing[J]. Bioactive Materials, 2021, 6(12): 4592-4606.
[6]王欣雅, 吉木色, 甘秋兰, 等. IPN智能水凝胶药物缓释体系的设计及评价[J]. 材料科学与工程学报, 2021, 39(1): 147-153.
WANG Xinya, JI Muse, GAN Qiulan, et al. Design and evaluation of IPN intelligent hydrogels for sustained and controlled drug delivery system[J]. Journal of Materials Science and Engineering, 2021, 39(1): 147-153.
[7]张艳, 董照明, 席星航, 等. 家蚕脱胶蚕丝的蛋白组成成分[J]. 中国农业科学, 2018, 51(11): 2216-2224.
ZHANG Yan, DONG Zhaoming, XI Xinghang, et al. Protein components of degumming Bombyx mori silk[J]. Scientia Agricultura Sinica, 2018, 51(11): 2216-2224.
[8]FAROKHI M, MOTTAGHITALAB F, REIS R L, et al. Functionalized silk fibroin nanofiber as drug carriers: Advantages and challenges[J]. Journal of Controlled Release, 2020, 321: 324-347.
[9]李胜堂, 石学文, 徐博, 等. 丝素蛋白在组织工程药物缓释系统的研究进展[J]. 中国修复重建外科杂志, 2021, 35(9): 1192-1199.
LI Shengtang, SHI Xuewen, XU Bo, et al. Progress in the application of silk fibroin in tissue engineered drug delivery system[J]. Chinese Journal of Reparative and Reconstructive Surgery, 2021, 35(9): 1192-1199.
[10]刘迪, 许宗溥, 杨明英, 等. 丝素蛋白水凝胶的凝胶机理及改性方法研究进展[J]. 蚕业科学, 2018, 44(1): 166-171.
LIU Di, XU Zongpu, YANG Mingying, et al. Research progress on gelling mechanism and modification of silk fibroin[J]. Acta Sericologica Sinica, 2018, 44(1): 166-171.
[11]YU X J, WANG L, XU B, et al. Conjugation of CMCS to silk fibroin for tuning mechanical and swelling behaviors of fibroin hydrogels[J]. European Polymer Journal, 2021, 150(208): 110411.
[12]MAITY B, SAMANTA S, SARKAR S, et al. Injectable silk fibroin-based hydrogel for sustained insulin delivery in diabetic rats[J]. ACS Applied Bio Materials, 2020, 3(6): 3544-3552.
[13]OLIVEIRA I M, GONALVES C, SHIN M E, et al. Anti-inflammatory properties of injectable betamethasone-loaded tyramine-modified gellan gum/silk fibroin hydrogels[J]. Biomolecules, 2020, 10(10): 1456.
[14]WANG L, WANG F Y, XU B, et al. Efficient regulation of the behaviors of silk fibroin hydrogel via enzyme-catalyzed coupling of hyaluronic acid[J]. Langmuir, 2020, 37(1): 478-489.
[15]刘浩. 丝素蛋白纤维凝胶的制备及应用[D]. 青岛: 青岛大学, 2021.
LIU Hao. Preparation and Application of Fibrous Silk Hydrogels[D]. Qingdao: Qingdao University, 2021.
[16]CHEN Z Y, ZHANG X N, LIANG J W, et al. Preparation of silk fibroin/carboxymethyl chitosan hydrogel under low voltage as a wound dressing[J]. International Journal of Molecular Sciences, 22(14): 7610.
[17]LEISK G G, LO T J, YUCEL T, et al. Electrogelation for protein adhesives[J]. Advanced Materials, 2010, 22 (6): 711-715.
[18]LIU H, MING J F, GUO, X L, et al. Low voltage electric field governs fibrous silk electrogels[J]. Materials & Design, 2021, 199: 109401.
[19]候冰娜, 倪凱, 沈慧玲, 等. 自修复氧化海藻酸钠-羧甲基壳聚糖水凝胶的制备及药物缓释性能[J]. 复合材料学报, 2022, 39(1): 250-257.
HOU Bingna, NI Kai, SHEN Huiling, et al. Preparation of self-healing oxidized sodium alginate-carboxymethyl chitosan hydrogel for sustained drug release[J]. Acta Materiae Compositae Sinica, 2022, 39(1): 250-257.
[20]郭颖媛, 冯强, 杨运霞, 等. 黄连素对感染幽门螺杆菌小鼠胃黏膜上皮细胞损伤的影响[J]. 世界中医药, 2021, 16(18): 2702-2705.
GUO Yingyuan, FENG Qiang, YANG Yunxia, et al. AEffects of berberine on the injury of gastric mucosal epithelial cells in mice infected with Helicobacter Pylori[J]. World Chinese Medicine, 2021, 16(18): 2702-2705.
[21]ANWAR M A, TABASSAM S, GULFRAZ M, et al. Isolation of oxyberberine and β-sitosterol from Berberis lycium Royle root bark extract and in vitro cytotoxicity against liver and lung cancer cell lines[J]. Evidence-Based Complementary and Alternative Medicine, 2020, 2020(5): 1-9.
[22]刘悦, 任百洁, 邹馨颖, 等. 小檗碱的药理作用及有效药物载体的研究进展[J]. 海南医学院学报, 2020, 26(17): 1348-1352.
LIU Yue, REN Baijie, ZOU Xinying, et al. Research progress on pharmacological action and effective drug carrier of berberine[J]. Journal of Hainan Medical University, 2020, 26(17): 1348-1352.
[23]PAN X M, JIE L, GAN R, et al. Preparation and in vitro evaluation of enteric-coated tablets of rosiglitazone sodium[J]. Saudi Pharmaceutical Journal, 2015, 23(5): 581-586.
[24]HOMAYUN B, SUN C, KUMAR A, et al. Facile fabrication of microparticles with pH-responsive macropores for small intestine targeted drug formulation[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2018, 128: 316-326.
[25]HAMPTON M B, KETTLE A J, WINTERBOURN C C. Inside the neutrophil phagosome: Oxidants, myeloperoxidase, and bacterial killing[J]. Blood, 1998, 92(9): 3007-3017.
[26]FIERHELLER M, SIBBALD R G. A clinical investigation into the relationship between increased periwound skin temperature and local wound infection in patients with chronic leg ulcers[J]. Advances in Skin & Wound Care, 2010, 23(8): 369-379.
[27]劉小舟, 王钰杰, 刘耀祖, 等. 一种高比表面积共价有机框架材料的合成及药物缓释性能[J]. 高等学校化学学报, 2019, 40(9): 1813-1817.
LIU Xiaozhou, WANG Yujie, LIU Yaozu, et al. A covalent organic framework with high surface area for drug delivery[J]. Chemical Journal of Chinese Universities, 2019, 40(9): 1813-1817.
[28]CEREA M, MARONI A, PALUGAN L, et al. Novel hydrophilic matrix system with non-uniform drug distribution for zero-order release kinetics[J]. Journal of Controlled Release, 2018, 287: 247-256.
[29]DOKOUMETZIDIS A, PAPADOPOULOU V, MACHERAS P. Analysis of dissolution data using modified versions of Noyes-Whitney equation and the Weibull function[J]. Pharmaceutical Research, 2006, 23(2): 256-261.
[30]SIEPMANN J, PEPPAS N A. Higuchi equation: Derivation, applications, use and misuse[J]. International Journal of Pharmaceutics, 2011, 418(1): 6-12.
[31]RITGER P L, PEPPAS N A. A simple equation for description of solute release I: Fickian and non-fickian release from non-swellable devices in the form of slabs, spheres, cylinders or discs[J]. Journal of Controlled Release, 1987, 5(1): 23-36.
[32]YU L, YAO L, YANG K. Redox-and pH-responsive hydrogels: Formulation and controlled drug delivery[J]. Journal of Porous Materials, 2016, 23(6): 1581-1589.
[33]NIU C Q, LIU X Y, WANG Y Y, et al. Photothermal-modulated drug release from a composite hydrogel based on silk fibroin and sodium alginate[J]. European Polymer Journal, 2021, 146(6): 110267.
[34]陈翩翩, 黄维洁, 沈淑蓉. 新型丝素蛋白水凝膠携载西咪替丁预防酒精引起的小鼠急性胃溃疡[J]. 温州医学院学报, 2020, 50(12): 974-979.
CHEN Pianpian, HUANG Weijie, SHEN Shurong. A novel silk fibroin hydrogelcarry cimetidine in the prevention of ethanol-induced gastric ulcer in mice[J]. Journal of Wenzhou Medical University, 2020, 50(12): 974-979.
[35]ZHANG X N, CHEN Z Y, BAO H, et al. Fabrication and characterization of silk fibroin/curcumin sustained-release film[J]. Materials, 2019, 12(20): 3340.