固定化菌剂原位净化养殖水体效果及对微生物群落结构的影响
2023-08-10蔡徐依田亚雄陈潘毅葛朋彪张六六李娟英
蔡徐依,田亚雄,陈潘毅,葛朋彪,张六六,李娟英,4*
(1.上海海洋大学海洋生态与环境学院,上海 201306;2.苏州鼎兴斯沃水产养殖设备有限公司,江苏 苏州 210095;3.江苏纳克生物工程有限公司,江苏 淮安 211700;4.上海河湖生物链构建与资源化利用工程技术研究中心,上海 201702)
近年来,我国水产养殖业迅速发展,残留在养殖池塘的富含蛋白质的饲料、死亡的养殖生物和浮游动植物、养殖生物排泄物等导致养殖水体中氮、磷和耗氧性有机物等频频超标,对池塘水质、养殖生物生长以及周围的生态系统均产生了潜在的负面影响[1]。因此,改善现有养殖池塘水体质量迫在眉睫。江苏、浙江、湖南、广东和海南等地出台的《养殖尾水排放标准》中将化学需氧量(CODMn)、总氮(TN)和总磷(TP)作为控制指标。CODMn会使水体中细菌及藻类大量繁殖,诱发养殖生物病变[2];离子氨(NH+4)和非离子氨(NH3)也是诱发对虾暴发疾病的关键因素,当氨氮长时间维持在较高水平(>0.5 mg·L-1)时,凡纳滨对虾免疫力明显下降,对病原菌的易感性提高[3];TP 虽不会引起病害的发生,但过高的TP 会引起池塘水华[4],影响养殖水体健康。
目前,养殖水体的处理方法主要有原位和异位处理[5]。异位处理是将受污染的养殖水体排出池塘进行净化处理后再排放,这种方法处理周期长,并且会产生额外的处理成本以及占用土地资源[6]。而原位处理较异位修复更直接、快速、经济,不仅可以有效减少养殖尾水中污染物的排放量,也可以改善养殖用水水质,从而提高养殖水产品品质[7]。为降低养殖水体中污染物浓度,人们常采用原位加注新水,投加漂白粉或沸石等,对养殖水体进行稀释、氧化以及离子交换等各种物理和化学处理方法,但这些方法的局限性非常明显,如水质净化效果不理想、不稳定且可能带来二次污染[8]。
因此,具有良好的生态安全性、经济性的生物处理法,如生物膜法、喷洒游离微生物(生物制剂)等被用于原位处理养殖水体,但这些传统方法也常伴有成本高、出水水质不稳定等问题[9]。随着研究的深入,从传统生物处理方法中衍化而来的固定化微生物原位修复技术得到了越来越多的关注[10]。固定化微生物处理技术能高效降解或去除污水中的营养物质,如:孟壮等[11]将固定化微生物技术与纳滤组合工艺结合处理生活污水,污水中的COD 和氨氮的去除率均达到99%以上;李端林等[12]利用固定化微生物处理印染模拟废水,COD 的平均去除率可达90%以上。但是,目前关于固定化微生物原位投加缓释微生物净化养殖水质的相关研究和实践应用案例相对较少,仍处于探索阶段。因此,本文选择凹凸棒土作为固定化载体,制备固定化微生物小球,在实验室验证其颗粒性能及处理效果的基础上[13],将其添加到微孔曝气生物反应器中,原位应用于养殖池塘的尾水处理,验证其对养殖池塘水体污染物的原位净化效果,同时以底泥和水体中的微生物作为研究对象,研究固定化菌剂的添加对养殖环境微生物群落结构变化的影响,以期为固定化菌剂原位净化养殖水体提供理论指导和科学依据。
1 材料与方法
1.1 养殖池塘固定化微生物反应器的投放
将约20 kg 固定化微生物颗粒(颗粒负载微生物量理论值分别为20 亿·g-1和50 亿·g-1,购自江苏纳克生物工程有限公司)装入微孔钢管(直径约15 cm、长约250 cm)内(图1a),固定在微孔曝气设备底部曝气管上方,并在其上方安装数十片表面粗糙多孔的无菌膜挂片,从而可以在开启增氧机时,为水产动物与固定化微生物颗粒缓释微生物提供充足氧气,促使挂片上的微生物快速挂膜并迅速繁殖。选择上海市奉贤区思阳水产养殖专业合作社(30°52'20″N,121°23'18″E)内大小(每个塘水面约0.4 hm2)、环境条件接近并且对虾生长阶段一致的凡纳滨对虾养殖池塘作为实验地点,设置实验组(n=2)与对照组(n=2)两个处理。每个实验组中加入3 台装有固定化微生物的微孔曝气设备,而对照组内只有增氧设备,不添加固定化微生物。增氧机开启时长一般为14 h·d-1。

图1 固定化菌剂的曝气机示意图与池塘现场运行图Figure 1 Schematic diagram of aerator with immobilized bacterial agent and operation diagram in pond
1.2 样品的采集
整个实验覆盖2021年和2022年两个对虾养殖周期,凡纳滨对虾的完整养殖过程均进行水样采集,由于仔虾阶段几乎不投加饵料,水质变化较小,因此水样采集集中在幼虾和成虾阶段,直到产品上市。水样采集的具体时间如表1所示。

表1 实验组与对照组的水样采集Table 1 Water sample collection of experimental and control ponds
水样采集方法:使用5 点采样法对实验组和对照组水体用有机玻璃采水器采集表层水(深度为0.2 m),水样充分混合后,装入采样瓶中低温运回实验室,保存于4 ℃冰箱,尽快进行分析检测。
水体微生物群落样品采集方法:用灭菌后的有机玻璃采水器将采集的表层水(深度为0.2 m)混匀后,装入无菌采样瓶中,置于含冰袋的恒温箱带回实验室,选取无菌的0.22 μm 混合纤维素(MCE)滤膜抽滤,并将滤膜置于无菌离心管中,保存于-80 ℃冰箱内,用于提取DNA。
底泥微生物群落样品采集方法:用抓斗式采泥器采集池塘表层5 cm 沉积物样品,用无菌取样器去掉暴露在外空气部分后混匀,装入无菌离心管,并使用含冰袋的恒温箱带回实验室,置于-80 ℃冰箱保存,以备DNA提取。
1.3 微生物群落样品中总DNA的提取方法
根据E.Z.N.A.®soil DNA kit(Omega Bio-tek,Nor⁃cross,GA,英国)对底泥与水体样品中的总DNA 进行抽提。提取后用1%的琼脂糖凝胶电泳检测DNA 样品质量,并用NanoDrop2000测定DNA的浓度和纯度;同时对16S rRNA 基因V3~V4 区域进行PCR 扩增,正向引物采用338F(5' -ACTCCTACGGGAGGCAG⁃CAG-3'),反 向 引 物 为806R(5' - GGACTACH⁃VGGGTWTCTAAT-3')。每个样本设3个重复。
使用2%琼脂糖凝胶电泳检测混合后的同一样品PCR 产物,利用AxyPrepDNA Gel ExtractionKit(Ax⁃ygen Biosciences,Union City,CA,英国)回收产物;使用Tris_HCl 洗脱后,进行2%琼脂糖凝胶电泳检测。根据电泳初步定量结果,使用Quantus™Fluorometer(Promega,英国)对回收产物进行检测定量。
1.4 高通量测序
在上海美吉生物医药科技有限公司的Illumina Miseq PE300 平台进行测序分析。使用Uparse 软件,以97%的相似度对非重复序列进行聚类分析,得到一个OTU(Operational taxonomic units)聚类;使用Qi⁃ime平台对比silva数据库对样品序列进行α多样性分析,设置置信度阈值为70%;使用Qiime中Bray-Curtis计算β 多样性距离矩阵;使用R 语言(version 3.3.1)工具统计和绘制Veen 图、群落柱形图、PCoA 统计分析等。原始测序数据均已上传至NCBI 序列读取档案(SRA),登记号为PRJNA914236。
1.5 水质分析方法
采用国标法测定水体中的氨氮、CODMn和TP 含量。所有指标样品设3 个平行样,以确保实验结果的准确性。本文采用Origin 2021 软件完成数据处理及绘制,误差棒均为标准差。使用软件SPSS 23.0 独立样本T检验进行显著性分析,P<0.05为有显著差异。
2 结果与讨论
2.1 固定化菌剂曝气装置原位净化养殖水体的效果
2.1.1 对CODMn的去除效果
对虾养殖过程中,从幼虾到成虾期,CODMn呈现总体上升趋势(图2)。将两年实验组与对照组采集的水样CODMn浓度与养殖尾水排放一级标准(CODMn≤15 mg·L-1)相比,对照组水质达标率仅为20%,而实验组达标率为70%,可见固定化菌剂的投加对池塘水质改善作用明显。2021 年对虾养殖季受到“灿都”台风的影响,CODMn波动幅度较大[14],去除率不稳定(3.03%~57.05%),平均去除率为26.14%;2022 年提高了凹凸棒土固定化菌剂的负载量(从20 亿提高到50 亿)后,其对外界环境变化的适应能力增强,对CODMn的去除率也显著提升(24.56%~69.42%),平均去除率为52.49%。以往实验室中凹凸棒土固定化小球降解CODMn的去除率能稳定在70%左右,说明现场养殖的复杂环境会对固定化菌剂降解CODMn造成一定影响。王妹等[15]利用枯草芽孢杆菌调节养殖池塘水质,其中COD 的去除率仅为22.9%;王雪峰等[16]使用光合细菌与芽孢杆菌协同净化养殖水体,CODMn降解率最高为40.13%。本研究所使用的凹凸棒土固定化菌剂耦合微孔曝气的原位处理装置去除养殖水体中CODMn的优势明显。以往研究显示,芽孢杆菌是具有高活性消化酶系的异养细菌[17],其能迅速降解养殖水体中的有机物,包括残余饵料、排泄物等。因此,本实验所使用的含6 种复合芽孢杆菌的固定化菌剂,可能通过优化养殖水体中的微生物群落结构,达到了降低水体CODMn浓度的目的。

图2 固定化菌剂原位净化对养殖水体中CODMn的去除效果Figure 2 In-situ purification of CODMn in aquaculture water by immobilized bacterial agent
2.1.2 对氨氮的去除效果
养殖水体中的氨氮主要来自于排泄物、残饵、浮游生物残骸等,是影响对虾生长的敏感水质参数[18]。氨氮浓度过高会影响凡纳滨对虾的能量代谢活动,损害其鳃、肝、肾、脾和甲状腺组织,控制氨氮在0.5 mg·L-1以下可以避免其对虾的负面影响[19]。整个养殖周期中(图3),随着凡纳滨对虾的生长,逐渐增多的排泄物以及饲料残饵等导致对照组氨氮明显升高,养殖后期最高可达2.22 mg·L-1,显著高于0.5 mg·L-1。在对虾两年的完整养殖周期内,实验组氨氮浓度都显著低于对照组(P<0.05),且都保持在较低水平(<0.5 mg·L-1)。尤其投料和排泄均增加的成虾期的对比更为明显,2021 年成虾期的去除率有些许波动(31.94%~99.93%),伴随着2022年固定化颗粒负载微生物量的提高,水中氨氮浓度低于0.5 mg·L-1且状态稳定,氨氮的平均去除率也从2021 年的76.21%提升到了90.73%,与实验室小试结果接近。据分析,加入固定化菌剂颗粒提高了水体中的微生物对CODMn的降解能力,使得水体中的CODMn浓度维持在较低水平,碳源减少导致异氧细菌增殖速率下降,有助于硝化细菌的增殖[20],从而进一步促进了水中氨氮的转化[21],表现为氨氮浓度维持在较低且稳定的水平。张达娟等[22]利用游离的硝化细菌净化凡纳滨对虾养殖池塘中的氨氮去除率为88.83%,Zhang 等[23]在养殖池塘内原位使用生态基质,养殖水体中氨氮的去除率达到46.36%,两结果均低于本研究固定化菌剂原位净化氨氮的去除率。

图3 固定化菌剂原位净化对养殖水体中氨氮的去除效果Figure 3 In-situ purification of ammonia in aquaculture water by immobilized bacterial agent
2.1.3 对TP的影响磷对于维持养殖池塘生态系统的稳定有重要作用。本实验中,池塘水体TP 浓度较为稳定(图4),2021年实验组池塘水体中TP浓度范围为(0.044±0.006)~(0.088±0.030)mg·L-1,对照组TP 浓度范围为(0.012±0.030)~(0.084±0.020)mg·L-1,无明显差异(P>0.05),且均低于养殖尾水排放一级标准即总磷≤0.5 mg·L-1,可直接排放[24]。

图4 固定化菌剂原位应用养殖过程中水体TP浓度Figure 4 TP concentration in water during in-situ application of immobilized bacterial agent
2.2 固定化菌剂曝气装置投放对微生物多样性的影响
由实验组与对照组水质处理效果可以看出,固定化菌剂曝气装置的投放对养殖水体中污染物的去除效果显著,这可能与池塘微生物群落的改变密切相关。为了解固定化菌剂的添加对养殖环境(包括水体与底泥)中微生物菌群动态变化规律与水质变化的相互关系,从凡纳滨对虾养殖池塘共获取水样和泥样32 个,并对其进行16S rRNA 测序。将所测的原始序列经过去杂、拼接质控去除嵌合体后共获得有效序列26 391 条。微生物群落的多样性在维持生态功能方面有重要的作用,多样性高代表样品微生物群落功能稳定性较好,对虾患病风险低[25]。因此本文分析了固定化菌剂投放后池塘环境中微生物多样性的变化。
2.2.1 微生物的α多样性分析
本文选取Shannon指数和Chao指数(图5)表征池塘环境中微生物的多样性与丰富度[26]。实验组与对照组底泥样本在养殖过程中Shannon 指数无显著性差异(P>0.05)。而实验组的水体中因加入了固定化菌剂颗粒,颗粒微生物良好的“缓释”性能(1 g可释放约1.5×108CFU 的微生物)[13]使养殖水体中微生物多样性Shannon 指数显著高于对照组(P<0.05)。但因养殖后期对虾成熟准备上市,减少了饲料的投加,水体中微生物所需养分缺乏(CODMn下降,图2),导致实验组水体中微生物多样性在对虾收获末期偏低。同时,通过丰富度Chao 指数可以观察到,养殖期间总体保持平稳,个别强降雨事件会导致水体微生物丰富度下降,但加入固定化菌剂后实验组的底泥与水体中的微生物丰富度均显著高于对照组(P<0.05),说明对虾养殖过程中固定化菌剂曝气装置不断向水体中缓释有利于污染物降解的菌株,不仅可以提高水体微生物的多样性,同时增加了环境微生物群落丰富度[27],使得有利于降解养殖水体污染物的菌群数量增多,更好地降解养殖水体中的污染物。

图5 养殖环境中微生物群落的Shannon指数和Chao指数Figure 5 Shannon and Chao index of microbial community in aquaculture environment
2.2.2 微生物的OTU分布及β多样性分析
微生物样品测序结果构建的Venn 图如6a 所示。底泥样本中实验组和对照组获得的OTU 数分别为6 906个和6 552个,实验组和对照组底泥独有的OTU数分别为1 131 个(12.88%)和887 个(10.10%)。同时,水体样本中实验组和对照组获得的OTU 数分别为2 554个和2 221个,实验组水体和对照组水体独有的OTU 数分别为193 个(2.20%)和138 个(1.57%)。表明固定化菌剂缓释不仅增加了实验组环境微生物OTU 的数量,且独有的OTU 数也相应增加,养殖环境微生物丰富度提升,有助于水体污染物降解[28],由2.1可得实验组水质确实更优。同时实验组中底泥与水体共有的OTU数为112个,而对照组中仅共有56个。
基于Bray-Curtis 距离算法进行主坐标分析(PCoA)后,对底泥与水体中群落结构进行聚类的结果如图6b 所示。PC1 轴对微生物群落结构变化的解释率为53.20%,PC2 轴的解释率为9.03%。底泥实验组与对照组距离接近,红色与蓝色置信椭圆几乎重合,说明投加固定化菌剂对底泥微生物的影响相对较小,两者微生物组成结构相似度较高[29],群落差异较小,与上文底泥多样性指数无显著性差异吻合,这与底泥较为稳定、流动性较差的性质有关[30]。而水体中微生物组成差异较大,其中实验组水体初始值与养殖过程其余绿色点位形成绿色置信椭圆的面积大于对照组的黄色置信椭圆,表明实验组微生物变化更大。综合而言,固定化菌剂向养殖环境内缓释菌群可能增加了水体中某些特定微生物数量,对养殖环境的微生物群落结构造成影响。

图6 底泥与水体微生物OTU维恩图及柱状统计图(a)和底泥与水体微生物群落的PCoA分析(b)Figure 6 Statistical results of OTU of microorganisms in sediments and water(a)and PCoA analysis of microbial communities in sediment and water(b)
2.3 固定化菌剂曝气装置投放对微生物群落结构的影响
固定化颗粒的缓释可能会促进池塘环境中微生物群落的改变,促进特定群落的增殖或凋亡,从而改善养殖池塘水质。从门水平优势细菌相对丰度可知(图7),实验组和对照组水体中丰度大于5%的优势菌门[31]有蓝细菌门(Cyanobateria,36.76%和32.89%)、变形菌门(Proteobacteria 22.59%和20.15%)、放线菌门(Actinobacteriota,18.21% 和23.48%)、拟杆菌门(Bacteroidota,11.22%和14.02%),这与李革雷等[32]研究不同养殖模式下水体内的优势菌门一致。相较对照组水体,实验组中蓝细菌门、变形菌门等的相对丰度显著提升,放线菌门、拟杆菌门等相对丰度则显著降低。同时,添加固定化菌剂使得水体中的厚壁菌门(Firmicutes)相对丰度从对照组的0.26%提升至实验组的1.13%。养殖池塘水体中反映蓝藻数量的蓝细菌门相对丰度与以往土塘养殖研究吻合[33],对照组蓝藻相对丰度较实验组下降,而水体中TP 无显著性差异。据分析是由于对照组养殖后期一部分对虾发生了病变,减少了饲料投加,蓝藻因缺乏养分相对丰度较低,而通过测定水质后发现,对照组水体中CODMn高于实验组,说明对照组水体中的有机污染物无法被蓝藻利用。实验组中的蓝藻可通过人工打捞等方式减少。变形菌门是自然环境中最常见的菌群,在很多养殖环境中也占据优势地位,且变形菌门类细菌在反硝化过程中占主导地位[34],实验组变形菌门更高,因此实验组水体氨氮浓度稳定在较低水平。而放线菌门作为优势门其作用主要是能促使动物和植物遗骸腐烂,能有效降低废水中的耗氧性有机污染物(本文用CODMn表示)[35],但也存在致病菌[36],实验组水体中放线菌门丰度比对照组低,据分析是固定化菌剂的加入使得实验组内水体中CODMn被快速降解,CODMn浓度低导致放线菌门丰度相对降低。水体中的拟杆菌门是溶解性有机物的主要消费者[37]。以往研究表明,当养殖水体中有残留饵料和生物粪便未被及时分解时,拟杆菌门细菌含量会增加[38]。因此,对照组中拟杆菌门含量更高,其原因是池塘内溶解性有机物未被及时分解,而实验组良好的水质降低了该菌种的生存空间。

图7 底泥与水体微生物门水平下的物种丰度Figure 7 Species abundance at the level of microbial phylum in sediment and water
同时,从门水平优势细菌相对丰度可知(图7),实验组和对照组底泥中占比前3 的优势门为变形菌门(23.32% 和17.98%)、放 线 菌 门(24.25% 和29.46%)、绿弯菌门(Chloroflexi,12.85%和15.35%),这与谢芹[39]对凡纳滨对虾养殖塘底泥的研究结果一致。经对比,实验组底泥中变形菌门等的相对丰度显著提升,放线菌门、绿弯菌门等相对丰度则显著降低。同时,固定化菌剂的添加使得底泥中的厚壁菌门相对丰度从对照组的4.54%提升至实验组的5.34%。其中变形菌门与放线菌门的变化趋势与水体中微生物群落结构变化趋势一致。实验组中绿弯菌门丰度下降,据分析是因为绿弯菌门可以利用3-羟基丙酸途径固定CO2产生能量[40],说明它能在不同营养程度的环境中生存,富营养化程度越高的区域绿弯菌门越丰富,表明实验组底泥的富营养化程度低于对照组。综上,固定化菌剂反应器向养殖环境中缓释有益于降解污染物的微生物菌群,总体上改善了养殖池塘的水质,同时也优化了池塘环境中的微生物群落结构。
2.4 固定化菌剂曝气装置投放后环境微生物相对丰度变化与聚类分析
为进一步揭示固定化菌剂反应器对养殖环境微生物群落结构的影响,在属水平上选择相对丰度前50 的菌制作Heatmap 图,进行聚类分析[27]。由图8 可得,固定化菌剂的添加确实改变了实验组养殖环境内属水平上的微生物相对丰度,其中水体中norank_f__JG30-KF-CM45、芽孢杆菌属(Bacillus)、大理石雕菌属(Marmoricola)以及底泥中hgcI_clade等的相对丰度有所上升。其中芽孢杆菌属所属厚壁杆菌门,其相对丰度的上升与前文相吻合。以往研究表明,大理石雕菌属可以有效降解有机污染物[41],实验组水体CODMn浓度较低,但其所属放线菌门,而上文中实验组放线菌门丰度低于对照组,表明放线菌门中其余属相对丰度下降,说明固定化菌剂的添加优化了实验组水体微生物群落结构。同时相关研究表明,hgcI_clade 与氨氮浓度呈负相关[42],符合本文中实验组氨氮浓度低于对照组的事实。综合而言,固定化菌剂曝气装置的投放改善了养殖环境原有的微生物群落结构,同时实现了原位净化养殖水体水质。
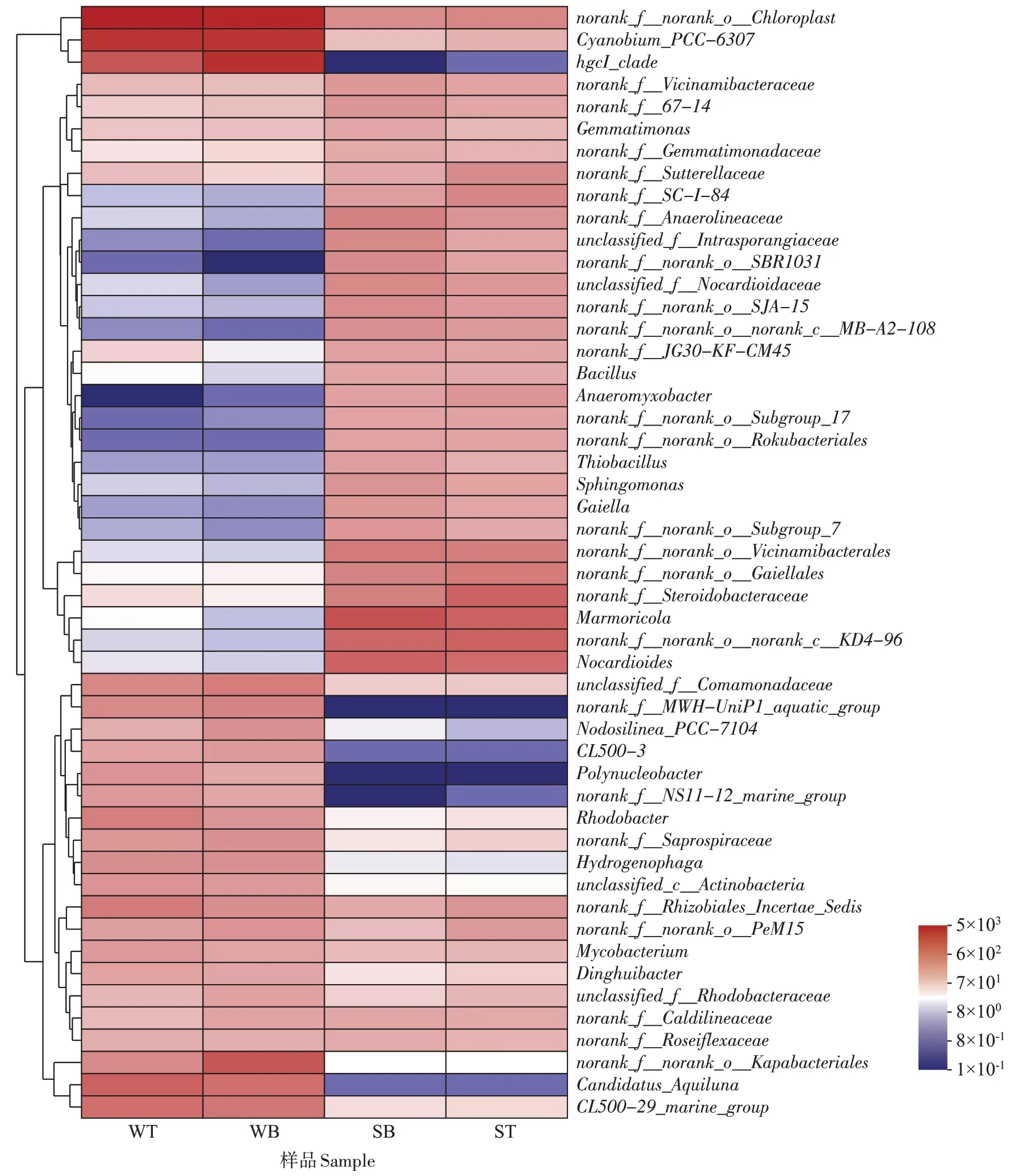
图8 底泥与水体微生物属水平的相对丰度聚类热图Figure 8 Community heatmap analysis on genus level in sediment and water
3 结论
(1)原位使用固定化菌剂能较好地去除对虾养殖水体中的CODMn和氨氮,且适当提高微生物量能使养殖过程中氨氮稳定保持在较低水平,提高抵御恶劣环境条件的能力。
(2)固定化菌剂曝气反应器的投放可以提高养殖水体中微生物的多样性,增加微生物群落丰富度;其向水体中缓释菌群增加了某些特定微生物数量,使养殖环境的微生物群落结构发生改变。
(3)添加固定化菌剂后,水体中蓝细菌门(Cyano⁃bateria)、变形菌门(Proteobacteria)等的相对丰度显著提升,放线菌门(Actinobacteria)、拟杆菌门(Bacteriid⁃ota)等相对丰度则显著降低;底泥中变形菌门(Proteo⁃bacteria)等的相对丰度显著提升,放线菌门(Actino⁃bacteria)、绿弯菌门(Chloroflexi)等相对丰度则显著降低。结果表明固定化菌剂反应器能够优化环境微生物群落结构,有利于养殖池塘水质的修复。同时属水平的相对丰度聚类分析也有相似的结果。
