LC-MS/MS法研究阿托伐他汀钙对大鼠体内丁苯酞药代动力学影响
2023-08-10贺少龙文恩辉费平霞党宏万魏世杰
贺少龙,文恩辉,费平霞,党宏万,魏世杰*
(1.宁夏医科大学总医院 药剂科,宁夏 银川 750000;2.宁夏医科大学总医院 临床药理研究室,宁夏 银川 750000;3.西安医学院第一附属医院,陕西 西安 710077)
丁苯酞(Butyphthalide,NBP)是我国药学人员自主研发的国家一类新药(商品名为恩必妥),其主要作用机制为改善脑缺血区微循环,《中国急性缺血性脑卒中诊治指南》推荐其作为脑卒中患者改善脑血循环的药物[1];阿托伐他汀钙(Atorvastatin Calcium,ATV)为国际上急性缺血性卒中的治疗和二级预防的推荐药物[2],在临床轻、中度急性缺血性脑卒中治疗中,两药联用可明显改善患者的神经功能和血管弹性[3-4],但其药代动力学相互作用仍需探讨研究。旨在建立一种简单高效测定丁苯酞血药浓度的方法,为临床血药浓度检测和药动学研究奠定理论基础;并研究ATV对大鼠体内NBP药动学参数是否存在影响,为NBP临床合理配伍应用提供参考。
1 材料
1.1 仪器
Shimadzu 30A超高液相色谱仪,日本岛津公司产品;API 4000四极杆串联质谱仪和Analyst 1.5.1分析操作软件均为美国AB公司产品;Centrifuge 5804R低温离心机,德国Eppendorf公司产品;XH-B涡旋混合器,姜堰市康健医疗器具有限公司;AE240分析天平,梅特勒-托利多仪器上海有限公司。
1.2 药品与试剂
丁苯酞对照品(纯度>99.6%,批号:101035-201502),购自中国药品生物制品检定研究院;地西泮对照品纯度>99.9%,批号:110805-200508),购自中国药品生物制品检定研究院;丁苯酞软胶囊(批号118170609,国药准字H20050299,规格0.1 g/粒),由石药集团恩必普药业有限公司生产;阿托伐他汀钙片(批号201710001,国药准字H20133127,规格10 mg/片),羧甲基纤维素钠(Sodium carboxymethyl cellulose,CMC-Na 批号:20150812),均由浙江新东港药业股份有限公司生产;市售植物油;色谱甲醇和乙腈(美国Fisher公司);实验用水为超纯水;其他溶剂均为分析纯。
1.3 实验动物
健康成年清洁级SD大鼠14只,雌雄各半,体重(250±30)g,由宁夏医科大学实验动物中心提供。动物许可证号:SCXK(宁)2016-0021。实验前12 h 禁食不禁水。
2 方法
2.1 色谱、质谱条件
色谱条件 色谱柱:Phenomenex Kinetex-C18色谱柱(50.0 mm×2.1 mm,1.7 μm);流动相:0.1%甲酸(A相)-乙腈(B相),梯度洗脱(0~0.6 min,90%A;0.6~1.2 min,90% → 7% A;1.2~2.6 min,7% A;2.6~3.0 min,7% → 90% A;3.5 min停止);柱温:40 ℃;流速:0.3 mL·min-1;进样量:3 μL。
质谱条件 电喷雾电离源(ESI),正离子模式多反应监测(MRM);离子源喷雾电压:5.5 kV;源温:500 ℃;雾化气:276 kPa;辅助加热气:276 kPa;气帘气:69 kPa;碰撞气:55 kPa。NBP和内标(地西泮)在MRM 模式下的定量监测离子对分别为m/z 191.1→145.1(NBP),m/z 285.6→193.1(内标)。
2.2 溶液配置
NBP、地西泮储备液和工作液:分别精密称取NBP对照品、地西泮适量,用甲醇溶解,配置成质量浓度为1 mg·mL-1的标准储备液。取一定量的内标(地西泮)储备液,用甲醇稀释制备内标工作液(10 ng·mL-1),置于-20 ℃冰箱中保存备用。
NBP油溶液:取NBP软胶囊6粒(规格0.1 g/粒),使用注射器将胶囊内全部药液移出,用植物油将收集的药液稀释成30 mg·mL-1NBP油溶液备用。
ATV混悬液:精密称取ATV原料药12.011 mg,用0.25% CMC-Na溶液配置ATV(1 mg·mL-1)混悬液。
2.3 分组给药方法及血样采集
采用随机平行对照实验设计,将雌雄各半共14只健康成年SD大鼠随机分为对照组(A组)和实验组(B组),每组7只,单次灌胃给药。A组灌胃给予NBP油溶液(70 mg·kg-1)+0.25% CMC-Na溶液;B组灌胃给予NBP油溶液(70 mg·kg-1)+ ATV混悬液(用0.25% CMC-Na配制,8 mg·kg-1)。单次给药前(0 h)和给药后0.083,0.167,0.25,0.5,1,1.5,2,3,4,6,8,12,24 h采集血样,每次眼眶采血0.3 mL至肝素钠涂壁的EP管中,4 000 r·min-1离心5 min,移取上层血浆置于-70 ℃低温冷冻冰箱中备用。
2.4 血浆样品处理
准确移取大鼠血浆100 μL置1.5 mLEP管中,加内标(地西泮1 mg·mL-1)20 μL,旋涡振荡1 min,加乙腈300 μL,旋涡混合振荡3 min,在4 ℃下,以1.4×104r·min-1离心10 min,取上清液3 μL进样分析。
2.5 方法学评价
2.5.1 专属性
分别取不同的来源的6份空白大鼠血浆100 μL,除不加内标地西泮溶液外,其余步骤按“血浆样品处理”项下操作,进样后得到空白样品的色谱图。另取一定质量浓度的NBP、地西泮标准溶液加入到空白血浆中,采用上述相同步骤处理。
2.5.2 标准曲线及定量下限
取大鼠空白血浆190 μL,依次加入标准系列溶液10 μL,配制成NBP质量 浓度为5,10,20,50,100,500,1 000 ng·mL-1的标准含药血浆,按“血浆样品处理”项下操作。以待测物的峰面积与内标峰面积之比(A/Ai)为纵坐标Y,待测物浓度(c)为横坐标X用加权最小二乘法进行线性回归,计算标准曲线。
2.5.3 精密度与回收率
取大鼠空白血浆190 μL,标准系列溶液10 μL依次加入,配制成NBP质量浓度为10,100,800 ng·mL-1的标准含药血浆,每个浓度6份平行样本,按“血浆样品处理”项下操作。同法连续操作3 d,计算日内、日间精密度和绝对提取回收率。
2.5.4 基质效应
按“血浆样品处理”项下方法操作,处理来源不同的6份空白大鼠血浆,依次加入低、中、高3个质量浓度的NBP对照品溶液和内标溶液,将得到的NBP和内标峰面积除以相应浓度的NBP对照品溶液及内标溶液直接同体积进样得到的峰面积,计算血浆中内源性物质对NBP和内标的绝对基质效应,再以NBP的绝对基质效应除以内标的绝对基质效应,得到NBP的内标归一化的基质效应。
2.5.5 稀释因子试验
将浓度为4 000 ng·mL-1NBP溶液稀释5倍后其测定值乘以相应的稀释因子后与对应的理论值做比较。
2.5.6 稳定性
用大鼠空白血浆配制含NBP质量浓度为10,100,800 ng·mL-1各6份,室温条件下放置24 h,按“血浆样品处理”项处理进样,考察室温放置24 h血浆样本的稳定性。
2.6 统计学处理
实验数据的结果以表示,运用DAS 2.0软件计算药代动力学参数,用11.0版SPSS统计软件进行统计分析。
3 结果
3.1 方法学验证
3.1.1 专属性
待测物NBP和内标地西泮的色谱图如图1所示,在本测定条件下,NBP和内标的保留时间分别为2.10 min和2.05 min,空白血浆中的内源性物质不干扰NBP和内标的测定。
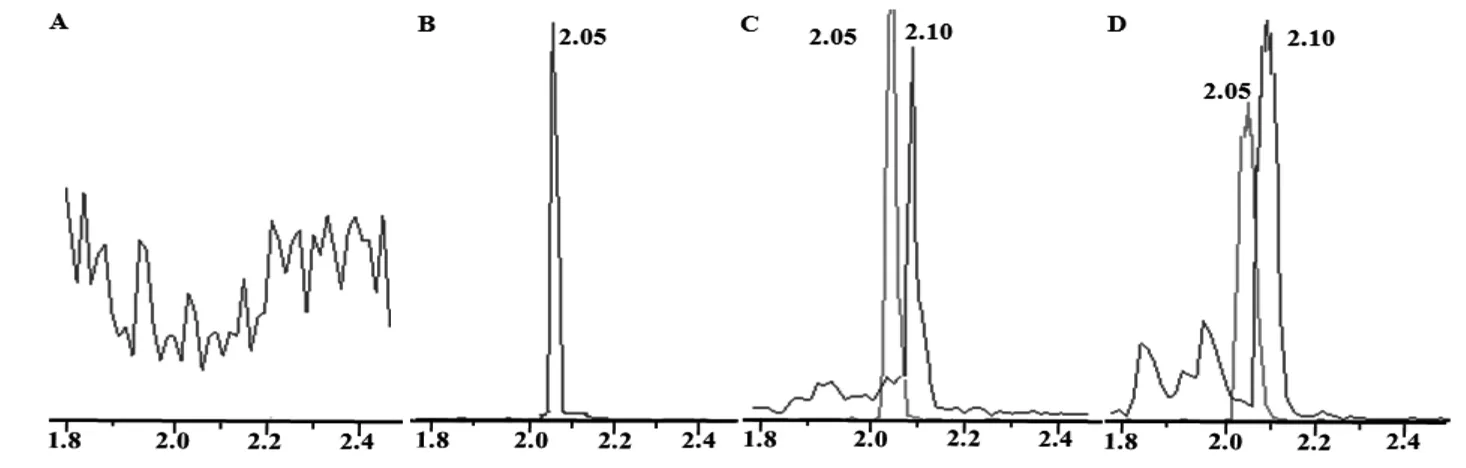
A: 空白血浆大鼠体内的药动学参数改变;B: 空白血浆+地西泮;C: 空白血浆+NBP;D: 灌胃NBP 0.5 h后采集的大鼠血浆样品图1 待测物NBP和内标地西泮的色谱图
3.1.2 线性范围
NBP的线性范围为5~1 000 ng·mL-1,定量下限为5 ng·mL-1,定量下限的相对偏差(RE)在-3.4%~7.2%,精密度RSD为11.43%,得到线性回归方程:Y=0.012 7X+0.266(r=0.997 3),结果表明待测物在浓度范围内具有良好的线性。
3.1.3 精密度与准确度
表1结果显示,测得NBP的三个浓度的质控样品相对回收率均>85%,日内和日间精密度RSD均小于15%,提示该方法准确、可靠、重现性较好,可以用于血浆中NBP含量测定。
表1 血浆中NBP的精密度及回收率
3.1.4 基质效应与稀释效应
质量浓度为10,100,800 ng·mL-1的NBP血浆样品经内标归一化的基质效应分别为(99.9±0.11)%,(93.6±0.05)%和(96.1±0.03)%;大鼠血浆中内标的基质效应为(84.8 ± 2.4)%,生物样品的基质效应不影响待测物浓度测定,符合定量要求。稀释效应试验结果表明,待测物实际值与测定值RE和RSD分别为-3.13%和3.73%,提示待测血浆药品超过标准曲线定量上限时,将样品稀释5倍后测定,结果仍然可靠。
3.1.5 稳定性
低、中、高浓度的NBP大鼠血浆样品在室温下放置24 h后的RSD分别为13.54%,7.87%和9.05%,说明含NBP血浆样品在室温条件、24 h内测定分析过程稳定性良好。溶液稳定性、冻融稳定性、长期稳定性已有文献报道,故未重复验证[5-6]。
3.2 药动学相互作用
3.2.1 血药浓度-时间曲线
A组和B组单次灌胃给药后丁苯酞的平均血药浓度-时间曲线见图2 。
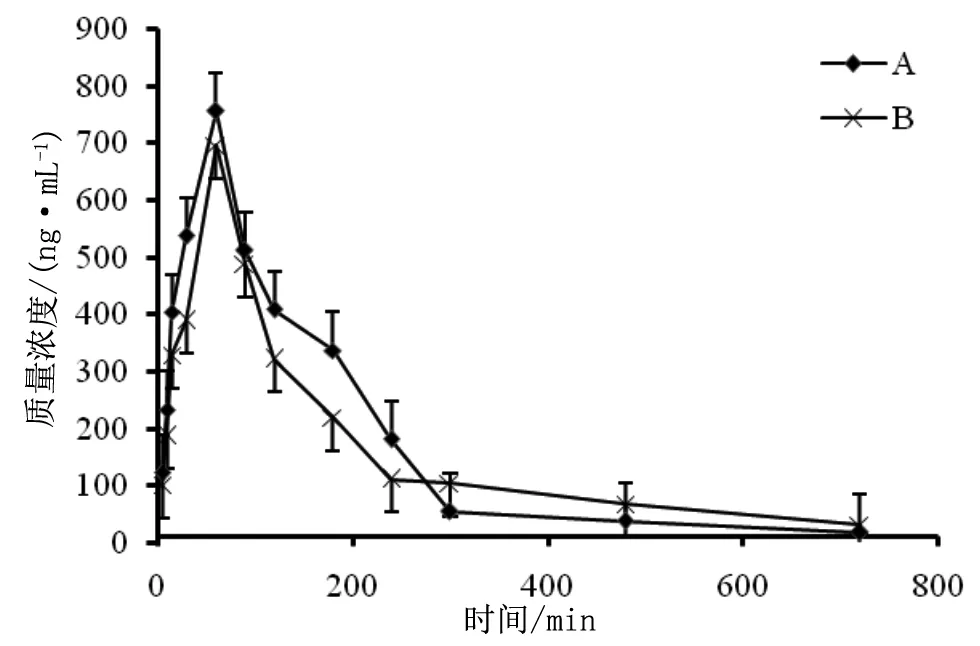
A组:NBP;B组:NBP+ATV
3.2.2 药代动力学参数
采用DAS 2.0软件计算NBP药动学参数,结果表明ATV与NBP联合使用会导致后者在大鼠体内的药动学参数改变。ATV引起NBP药动学参数改变:Vz增加、t1/2、MRT0-t延长,见表2。
表2 NBP在大鼠体内的药代动力学参数
4 讨论
本研究采用HPLC-MS/MS法可在3 min内测定丁苯酞血药浓度,采用乙腈沉淀蛋白,检测效率高,操作简单,回收率高,能满足临床血药浓度快速检测和相关药动学研究的需要。
药动学相互作用可以发生在药物进入机体内的吸收、分布、代谢和排泄等阶段[7-8]。本研究显示NBP在两组大鼠体内主要药动学参数Cmax、AUC0-t和Vz值改变无统计学差异,表明ATV对NBP吸收和组织分布影响不大。药物体内代谢性相互作用主要由肝脏CYP450酶系介导,NBP在大鼠及人体内主要经过CYP2E、CYP3A和CYP2C代谢[9];ATV在体内主要经过CYP3A代谢,部分经过CYP2C代谢[10]。研究结果显示:单次NBP灌胃给药与联合使用后,联合用药组使得药物滞留时间延长,其在体内暴露增多,这可能与ATV和NBP两药竞争共同的代谢酶有关。在临床应用时,两药联合应注意调整剂量。
目前多种药物联合使用在临床治疗中非常普遍,尤其NBP作为一类新药上市后药物相互作用研究较少,并且相互作用机制复杂多样[11]。对于长期同服NBP及ATV的脑梗患者,本研究初步表明ATV可能与NBP竞争共同作用代谢酶CYP3A和CYP2C,从而产生体内药物代谢相互作用,引起NBP药理作用的改变。但研究结果来自于动物单次给药实验,其在人体的药代动力学相互作用有必要进一步设计探究。
