氧化石墨烯/二氧化硅纳米材料吸附铬离子的性能研究
2023-08-10吴新华肖洁刘久逢刘军
吴新华,肖洁,刘久逢,刘军
(湖南化工职业技术学院,湖南 株洲 412000)
重金属Cr作为毒性最强的微量元素,由于泄漏、储存不良,被释放到环境中,从而造成严重的重金属污染。许多 研究者尝试使用传统技术处理废水,如活性炭吸附、膜分离、反渗透、离子交换、石灰凝固和化学沉淀等[1-3]。但这些理化方法仍存在有毒金属污泥产生、运行成本高、低浓度性能低等缺点。吸附法基于低成本、高效以及简单易用等因素,被认为是最具有前途、最环保的水处理方法之一[4-7]。石墨是最受欢迎的一种天然矿物。石墨含有sp2杂化碳元素层。碳原子的单层牢固排列在二维蜂窝晶体框架中称为石墨烯。石墨烯是一种很有前途的新型碳材料,由于良好的化学稳定性,显著的孔隙体积,大的理论比表面积,因此作为一种特殊吸附剂而受到人们的广泛关注[8-11]。
本研究报道了一种新的、简单的氧化石墨烯/二氧化硅合成方法,研究了新型纳米复合材料的吸附性能。采用改性的hummers法[12]制备氧化石墨烯,合成了氧化石墨烯/二氧化硅(GO/SiO2)纳米复合材料。并采用X射线衍射(XRD)和傅里叶变换红外光谱(FTIR)进行了表征。从吸附时间、吸附剂剂量、溶液pH值三个方面考察其对Cr(VI)吸附性能的影响。采用动力学研究了复合材料对Cr(VI)的吸附性能。
1 实验材料和方法
1.1 材料
石墨粉(纯度超过99.5 %,平均粒径小于50 mm)、硫酸、磷酸和盐酸,均为分析纯。过氧化氢、高锰酸钾、二氧化硅纳米颗粒(杂质超过99.5%,平均粒径小于20)、氢氧化钠和十二烷基硫酸钠等从西格玛奥尔德里奇公司获得并应用。此外,所有实验中都消耗了去离子水,所有其他化学品和溶剂都处于分析阶段。
1.2 实验方法
1.2.1 氧化石墨烯(GO)的制备
在三口烧瓶中加入0.375 g石墨粉,冰浴中缓慢加入45 mL硫酸和5 mL磷酸。15 min后加入2.25 g高锰酸钾,搅拌3 h后, 30 ℃ 超声1 h,冷却至室温后,再加入含有1.5 mL 30%过氧化氢的60 mL去离子水,当混合溶液变为深黄色,将所得产物用5%的盐酸洗涤,离心至中性, 50 ℃的真空烘箱中干燥至恒重,待用。
1.2.2 GO/SiO2纳米复合材料合成
将适量氧化石墨烯加入到含有1% 十二烷基硫酸钠(SDS)的水溶液中搅拌至均一状态,待用。将二氧化硅纳米颗粒通过超声波搅拌分散在乙醇中,待用。保持1∶1体积比例的乙醇/水和2∶1体积比例的石墨烯/二氧化硅纳米颗粒混匀两种溶液,在T=85 ℃下搅拌6 h。洗涤,离心分离,放置在T=50 ℃的真空烘箱中,烘干至恒重,待用。
1.2.3 样品的测试
采用傅里叶红外光谱仪(美国Thermo Scientific Nicolet iS5)进行IR测试 ;采用X射线衍射仪(荷兰Panalytical X'Pert Pro MPD)对样品进行XRD测试。采用上海美普达UV1800紫外-可见分光光度计测定金属Cr(VI)的含量。
1.2.4 Cr(VI)离子的吸附性能测试
配置一定浓度的Cr(VI)水溶液,模拟废水进行静态吸附实验。以GO/SiO2纳米复合材料作为吸附剂(粉末)在培养箱摇床中进行Cr(VI)吸附振荡。转速设置为150 r/min。持续预定一定时间后,对所得到的悬浮样品进行过滤,通过紫外-可见分光光度计方法在664 nm处测定Cr(VI)离子浓度。污染物的吸附量计算如下:
其中:Qe为吸附量,mg/g,C0和Ce分别为污染物的初始浓度和平衡浓度,mg/L;m为氧化石墨烯/SiO2吸收剂的质量,g;V为Cr(VI)溶液的体积,L。
2 实验结果与讨论
2.1 FTIR红外光谱分析
为了解GO/SiO2内部结构, 图1为GO、GO/SiO2的IR,由图可见,GO/SiO2中816 cm-1为Si-O键对称伸缩振动和弯曲振动,972 cm-1是Si-OH的弯曲振动吸收峰, 1 093 cm-1出现强而宽的吸收带,这是Si-O-Si反对称伸缩振动, 1 635 cm-1附近的峰是水的H-O-H弯曲振动峰,3 445 cm-1是水中-OH反对称伸缩振动峰。GO中1 053 cm-1处的宽吸收峰是吸收的水分子中的羟基峰;1 726 cm-1处是-C=O的伸缩振动峰。这说明GO表面含有较多的羟基,羧基,羰基等易改性的含氧官能团,1 619 cm-1出现比较宽的吸收峰是GO吸收的片层间水分子的变形振动峰,说明SiO2与GO表层官能团通过羟基发生了部分键合。

图1 GO和GO/SiO2红外光谱图
2.2 XRD表征分析
氧化石墨烯和氧化石墨烯/二氧化硅的XRD光谱见图2。由图可见GO的XRD图谱显示在2θ=10.57°时有强度较大,且尖锐的衍射峰,这与石墨烯的石墨层高度有序的结构相对应,代表此时结晶度很高。GO/SiO2的谱图显示, 2θ=10.57°处峰减弱,而且随着二氧化硅含量的增大最后消失,反而在9.82°和21.8°处出现了矮而宽的衍射峰,这说明GO高度有序的结构被破坏掉,二氧化硅与氧化石墨烯通过化学键成功复合。
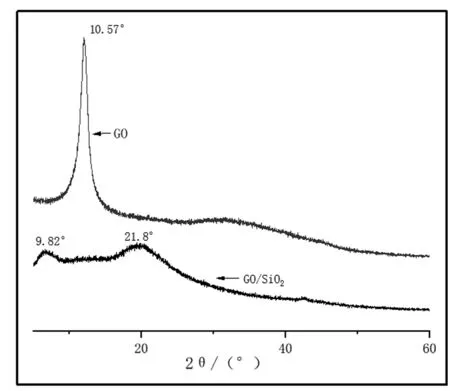
图2 GO和GO/SiO2的XRD图谱
2.3 GO/SiO2复合材料吸附性能研究
2.3.1 Cr(VI)离子的初始浓度对吸附性能的影响
吸附过程中金属离子初始浓度的影响是研究吸附过程的主要因素之一。在本研究中, Cr(VI)离子的初始质量浓度在10~150 mg/L之间。由图3a可以看出,随着Cr(VI)初始浓度的增加,GO/SiO2对金属离子吸附量逐渐增加,当金属离子初始浓度增大到一定程度,吸附量达到稳定。
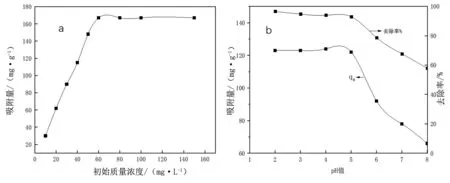
图3 Cr(VI)离子初始质量浓度(a),pH值(b)对GO/SiO2复合材料吸附量、 去除率的影响
2.3.2 pH值对吸附过程的影响
随着溶液的pH值(2~8)从酸性变化到碱性,溶液中Cr(VI)的形式分别是H2Cr2O7、HCr2O7-、Cr2O72-和CrO42-。pH值=2~8 时,Cr(VI)吸附量变化情况如图3b所示。在不同pH值时,复合材料对Cr(VI)的吸附容量也不相同。当pH值大于4时,吸附容量从123 mg/g下降到66 mg/g,吸附率从96%降到52%。GO/SiO2的吸附过程主要是因为GO纳米片上羧基官能团(-COO-)的存在,通过静电作用与带正电荷的Cr(VI)离子相结合;由于Cr(VI)在不同pH值中的形式不同,表面相互作用和络合是控制吸附过程的主要因素。
2.4 动力学分析
吸附过程中初始浓度、吸附时间的影响是研究吸附过程的重要因素。本研究中, Cr(VI)离子的初始浓度在20~100 mg/L之间。为全面考察吸附的整个过程,采用准一级和准二级两个动力学模型,研究了GO/SiO2纳米复合材料对Cr(VI)离子吸附机理。两个动力学模型方程如下: 准一级动力学模型:
(1)
准二级动力学模型:
(2)
qe:平衡吸附量,mg/g;qt:时间为t时吸附量,mg/g。
K1,K2:准一级和准二级动力学吸附速率常数;t:吸附时间,min。
准一级和准二级模型拟合数据见表1,不同Cr(VI)初始浓度下,准一级和准二级模型拟合数据见表1,准一级和准二级动力学曲线模型拟合的相关系数(R2)都大于0.99,这说明,吸附过程既有化学吸附也有物理吸附。但相比于准一级模型,准二级模型线性更加高,R2接近1,当Cr(VI)初始质量浓度为100 mg/L时,二级模型的吸附容量拟合值为181.81 mg/g,与实验值非常接近,由此可知,复合材料对Cr(VI)吸附更加符合准二级动力学模型, Cr(VI)离子在GO/SiO2表面的吸附以化学吸附为主导地位。

表1 准一级和准二级吸附常数的动力学参数
2.5 吸附等温线分析
为进一步了解Cr(VI)离子与吸收剂(GO/SiO2)相互作用机理。采用四种吸附等温线模型,即朗缪尔模型(Langmuir)、弗罗因德利克(Freundlich)、弗洛里哈金斯(Flory-Huggins)和特姆金(Temkin)模型进行拟合。朗缪尔模型考察吸附的层间相互作用,确定吸附质在均匀吸附剂表面的单层覆盖范围。朗缪尔等温线方程的线性形式如下:

(3)
分离因子,RL,是一个无量纲常数,由下式计算:
(4)
分离因子等于1,则等温线是线性的,如果为0.1,则表示不理想的吸附条件,RL=0表示不可逆的吸附过程。本研究计算出的RL值在0.003~1.00范围内,表明GO/SiO2纳米材料对Cr(VI)离子吸附是有利的(0 qe:平衡吸附量,mg/g;Ce:平衡浓度,mg/L;此外,b:Langmuir等温线常数;qm(mg/g)吸附剂的最大吸附容量。朗缪尔(Langmuir)模型的结果见表2,实验数据与朗缪尔模型结果之间的关系良好。 表2 GO/SiO2纳米复合材料对Cr(VI)等温吸附参数 弗洛里-哈金斯(Flory-Huggins)多层吸附等温线方程如下: qe=KfCe1/n (5) (6) 根据表2数据可计算出常数Kf和1/n。 Flory-Huggins吸附等温线研究并确定吸附剂表面被吸附分子覆盖度。其方程如下: (7) 表面覆盖度:θ=(1-Ce/Co),Ka:平衡吸附常数。绘制对数logθ/C0和log(1-θ)曲线图,根据斜率和截距计算出Ka和n。 Temkin等温方程如下: (8) (9) qe=BlnAT+BlnCe (10) AT:平衡结合常数(L/g);bT和R:通用气体常数。T:温度(K);B:与常数相关的吸附热(J/mol)。绘制qe与ln Ce曲线图,从图的斜率和截距中得到Temkin常数值AT和bT。研究结果见表2,由表可见, GO/SiO2纳米复合材料对Cr(VI)离子的吸附,Flory-Huggins的R2的值很低, Langmuir的R2的值最高,线性关系最好,说明GO/SiO2纳米复合材料对Cr(VI)离子的吸附属于单层吸附,符合Langmuir模型。 原料吸附、GO/SiO2纳米复合材料与其他吸附剂的最大吸附容量比较见表3。由表可见,GO中加入纳米SiO2,有效提高了Cr(VI)的吸附容量。SiO2和GO纳米颗粒在吸附过程中,由于团聚作用表现出较低的吸附能力,而在纳米复合材料中,它们固定在氧化石墨烯表层,在去除Cr(VI)方面表现出较高的活性。另外,与其他吸附剂相比较也表现出更高的吸附能力。 表3 不同吸附剂最大吸附量的比较 采用新的方法合成了一种GO/SiO2复合纳米材料,用FITR和XRD研究了该纳米复合材料的结构。通过模拟废水,探讨了GO/SiO2复合纳米材料去除Cr(VI)的性能。研究结果表明,GO/SiO2复合纳米材料处理被铬(VI)离子污染的废水时的吸附容量较高。采用朗缪尔坦金、弗洛里-哈金斯、弗伦德里希和特姆金等温线模型,对吸附动力学进行了研究,结果表明:朗缪尔模型与GO/SiO2复合纳米材料吸附Cr(VI)离子实验数据具有较好的一致性。吸附过程符合准二级动力学模型,以化学吸附占主导地位。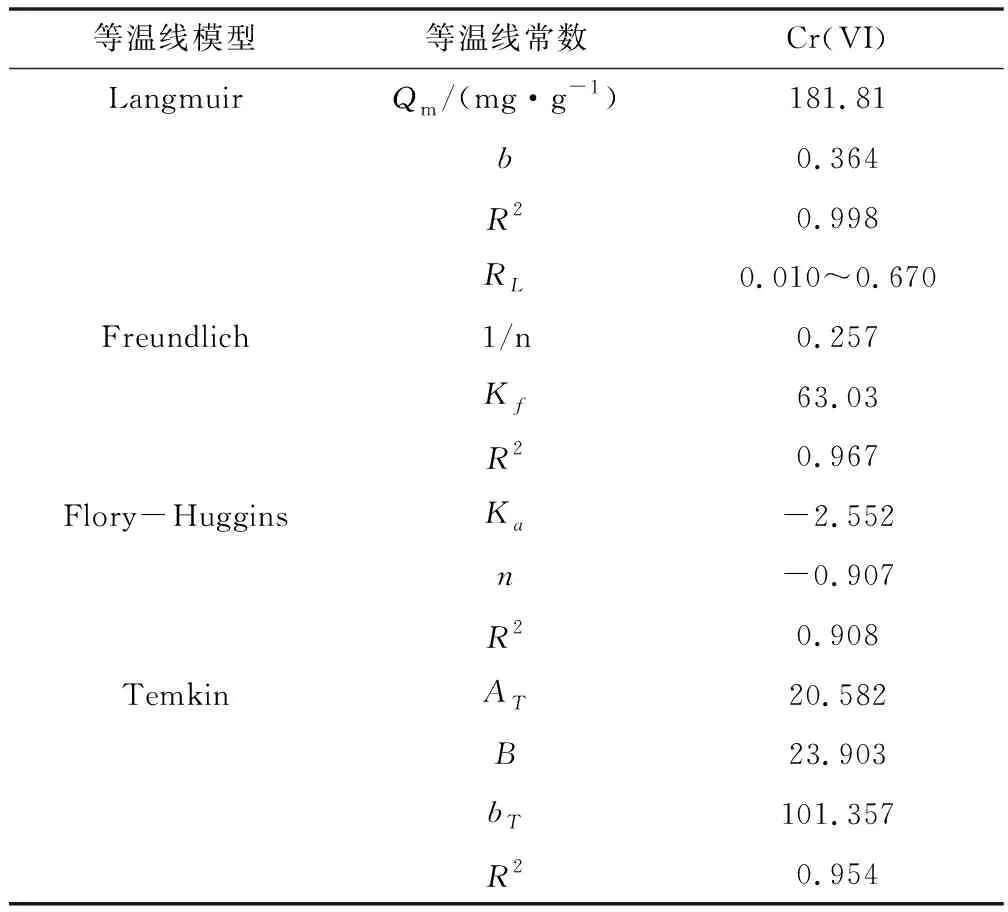


3 结论
