七叶皂苷影响急性心肌梗死心肌损伤的机制研究
2023-08-09马旭辉方天富岑明秋俞佳
马旭辉 方天富 岑明秋 俞佳
急性心肌梗死(acute myocardial infarction,AMI)是一种严重威胁人类生命健康的心血管疾病,发病快且死亡率高[1]。AMI 发生时,冠状动脉急性闭塞造成心肌缺氧、营养物质丢失,导致心室重塑甚至心力衰竭[2]。同时,AMI 触发的缺氧微环境会诱导广泛的心肌细胞凋亡,进一步加重心脏损伤[3-4]。因此,减少心肌细胞凋亡可能是改善AMI 患者预后的重要策略。七叶皂苷是从七叶树科植物天师粟的干燥成熟种子中提取得到的五环三萜皂苷,在多个癌细胞模型中表现出抗癌作用,包括肺腺癌、肝细胞癌和白血病[5]。此外,七叶皂苷还具有清除自由基、促进血管舒张的生物学功能[6]。过去研究表明,七叶皂苷可降低血管通透性,抑制缺氧引起的血小板内皮细胞黏附分子的积累,进而保护缺氧引起的组织损伤[7]。由此推测七叶皂苷可能对调控AMI 的进展有一定作用,但目前关于七叶皂苷和AMI 关系的研究还很少。本研究通过动物和细胞实验探究七叶皂苷参与调控AMI 心肌损伤的机制,以期为寻找AMI 治疗新药物提供参考。
1 材料和方法
1.1 材料
1.1.1 实验动物和细胞 2 月龄雄性SD 大鼠60 只,由杭州医学院实验动物中心提供,饲养于杭州医学院实验动物中心SPF 级动物房,温度(24±2)℃,湿度45%~55%,12 h 光照。实验前大鼠适应性喂养1 周,自由饮食和饮水。大鼠心肌细胞H9C2 株(批号:CL-0089)购自普诺赛生命科技有限公司(武汉),使用含10% FBS和1%青链霉素混合液的DMEM 培养基,在37 ℃、5% CO2细胞培养箱中培养,正常传代。
1.1.2 主要试剂 七叶皂苷(批号:6805-41-0)购自德国默克生物公司;miR-140-5p 模拟物由吉玛基因合成;B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)(批号:ab196495)、B 淋巴细胞瘤-2 相关X 蛋白(Bcl-2-associated X,Bax)(批号:ab32503)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(批号:ab8245)抗体均购自艾博抗(上海)贸易有限公司;2,3,5-三苯基氯化四氮唑(2,3,5-Triphenyltetrazolium chloride,TTC)染色液(批号:G3005)、细胞增殖和毒性检测(cell counting kit-8,CCK-8)试剂盒(批号:CA1210)、原位末端标记法(TdT-mediated dUTP nick end labeling,TUNEL)细胞凋亡检测试剂盒(批号:T2190)均购自索莱宝科技有限公司(北京);改良Eagle 培养基(dulbecco's modified eagle medium,DMEM)(批号:C11995500BT)、Invitrogen TRIzol(批号15596018)购自赛默飞世尔科技(中国)有限公司;miRNA 第一链cDNA 合成(茎环法)试剂盒(批号:B532453-0020)购自生工生物工程(上海)股份有限公司;HieffqPCR SYBRGreen Master Mix PCR 试剂盒(批号:11201ES08)、BCA 蛋白浓度测定试剂盒(批号:20201ES76)均购于翊圣生物(上海)科技有限公司。
1.2 方法
1.2.1 实验动物分组和处理 60 只大鼠随机分为4组:假手术组、AMI 组、AMI+低剂量七叶皂苷(LE)组和AMI+高剂量七叶皂苷(HE)组,每组15 只(造模死亡率较高,最终每组取6 只)。按6 mg/kg 的剂量腹腔注射舒泰麻醉,行气管插管,连接小动物呼吸机,呼吸频率80 次/min,吸气/呼气时间比1∶2。连接心电图监测。左侧开胸,暴露心脏,在冠状动脉起始部2~3 mm 处结扎左冠状动脉前降支(left anterior descending,LAD)。观察标准Ⅱ导心电图,出现ST 段和(或)T 波抬高或降低,心脏局部颜色变暗等心肌缺血变化作为结扎成功的标志,关胸。假手术组只开胸,不做LAD 结扎处理。七叶皂苷用0.9%氯化钠溶液溶解,建模前LE 组和HE 组大鼠分别给予2、10 mg/kg 七叶皂苷灌胃7 d,另两组等量0.9%氯化钠溶液灌胃。本研究涉及的动物实验已通过动物伦理委员会审查通过,批准文号:ZJCLA-IACUC-20020109。
1.2.2 细胞处理和分组 取H9C2 细胞,调整密度为2×105个/mL 接种至12 孔板,加入20 nmol/L 无血清培养基配置的miR-140-5p 模拟物,0.5 μL/孔,使用无血清培养基培养6 h,换新鲜DMEM 培养基。七叶皂苷用磷酸盐缓冲液配制成10 mmol/L 母液,使用时按需(10 μmol/L)加入到培养基中。根据处理将细胞分为对照组、低氧组、七叶皂苷组、模拟物组。对照组正常培养;低氧组细胞置于含1% O2的低氧培养箱;七叶皂苷组加入10 μmol/L 七叶皂苷,低氧培养;模拟物组细胞经miR-140-5p 模拟物转染后加入10 μmol/L 七叶皂苷,转至低氧培养箱培养,培养24 h 后进行后续检测。
1.3 检测指标
1.3.1 大鼠心功能检测 采用超声心动图检测。大鼠麻醉后连接超声诊断仪,连接Ⅱ导心电图,在LAD 结扎后,检测心功能指标。探头置于胸骨左侧,与胸骨中线成10°~30°,显示胸骨左室长轴切面,探头顺时针旋转90°显示左室短轴切面。由二维图像引导取M型曲线并进行测量。显示胸骨旁左室长轴切面后,探头略向左偏即显示肺动脉长轴切面。在胸骨旁左室长轴切面和肺动脉长轴切面上进行二尖瓣、主动脉瓣和肺动脉各瓣口的多普勒血流检测,利用SteeringAngle 功能,使多普勒角度尽量小,分别为18°、50°和2°。测量各组大鼠左心室舒张末期内径(left ventricular end diastolic diameter,LVEDd)、左心室收缩末期内径(left ventricular end-systolic dimension,LVESd)、射血分数(ejection fraction,EF)和左室短轴缩短率(left ventricular short-axis shortening rate,FS)。
1.3.2 大鼠心肌梗死面积检测 采用TTC 染色法。超声心动图检测结束后通过颈椎脱臼法处死大鼠,分离心脏,4 ℃PBS 溶液洗净,-20 ℃冷冻30 min。取心脏组织进行切片,厚度约2 mm。将切片放入TTC 染色液中37 ℃避光孵育30 min,每隔10 min 翻动1 次,使其充分染色。取出心脏切片,用PBS 洗2~3 遍后拍照。心脏非梗死区染为红色,梗死区呈灰白色。选择每一切片的尾侧面用PhotoShop 软件进行分析,测量每片的梗死面积和总面积。
1.3.3 大鼠心肌组织和H9C2 细胞中Bcl-2、Bax 蛋白表达水平的检测 采用Western blot 法。使用蛋白裂解液提取心肌组织和H9C2 细胞蛋白并检测蛋白浓度,并通过BCA 蛋白浓度测定试剂盒完成蛋白定量。使用聚丙烯酰氨凝胶电泳分离蛋白质,转移到PVDF膜,用5%脱脂牛奶室温封闭1.5 h,缓冲液洗3 次,每次5~10 min,加入Bcl-2、Bax 一抗,4 ℃冰箱里孵育过夜。用TBST 洗3 次,每次10 min,加入山羊抗兔IgG 二抗,室温下孵育2 h,用TBST 洗3 次,每次10 min。使用蛋白印迹HRP 化学发光检测试剂盒,使蛋白条带可视化。使用Image J 软件进行蛋白质灰度分析,以GAPDH 为参照,计算Bcl-2、Bax 蛋白相对表达水平。
1.3.4 大鼠心肌组织和H9C2 细胞中miR-140-5p 表达水平检测 采用qRT-PCR 法。利用Invitrogen TRIzol提取心肌组织和H9C2 细胞的RNA,使用超微量分光光度计测定RNA 浓度。采用miRNA 第一链cDNA 合成(茎环法)试剂盒逆转录miRNA,使用HieffqPCR SYBRGreen Master Mix PCR 试剂盒检测miR-140-5p 的表达水平,以U6 为内参,据2-ΔΔCt法计算mRNA 的表达水平。引物序列见表1。
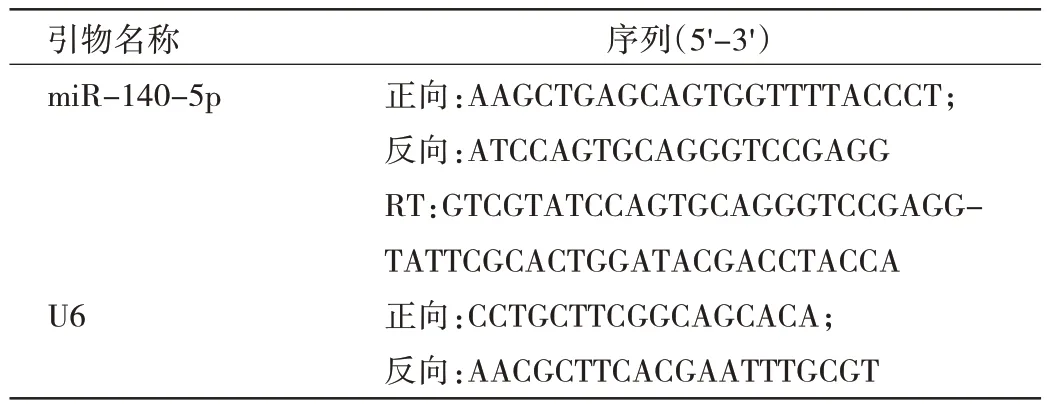
表1 引物序列
1.3.5 H9C2 细胞活性检测 采用CCK-8 法。取各组H9C2 细胞,加入10 μL/孔CCK-8 溶液,37 ℃培养2 h,酶标仪测定各组细胞在450 nm 处的吸光度值,计算细胞活性。
1.3.6 H9C2 细胞凋亡检测 采用TUNEL 染色法。取各组H9C2 细胞,用4%多聚甲醛(室温)固定20 min,PBS 清洗,加入Triton X-100 处理细胞20 min。PBS 洗2 遍,加入150 μL TUNEL 反应液,在37 ℃条件下处理60 min。然后用DAPI 染核5 min,PBS 洗2 遍,使用荧光显微镜观察,检测相对荧光强度。相对荧光强度越大,表明细胞凋亡程度越高。
1.4 统计学处理 使用GraphPad prism 8.0 统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t法。P<0.05 为差异有统计学意义。
2 结果
2.1 4 组大鼠心功能比较 与假手术组相比,AMI 组大鼠LVEDd 和LVESd 显著增大,EF 和FS 显著降低,差异均有统计学意义(均P<0.05),表明AMI 模型构建成功。与AMI 组相比,LE 组和HE 组大鼠LVEDd 和LVESd 显著减小,EF 和FS 显著升高,差异均有统计学意义(均P<0.05);相比LE 组,HE 组变化更显著,提示七叶皂苷浓度越高,心功改善效果越显著。见表2。
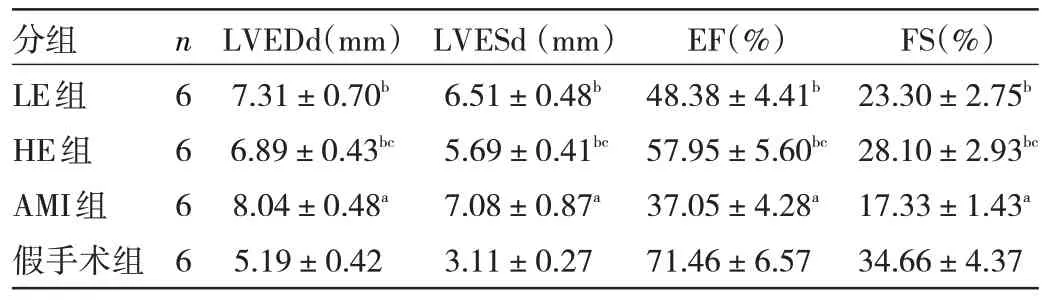
表2 4 组大鼠心功能指数比较
2.2 4 组大鼠心肌组织Bax 和Bcl-2 蛋白相对表达水平的比较 与假手术组相比,AMI 组中Bax 蛋白相对表达水平上调,Bcl-2 蛋白相对表达水平下调,差异均有统计学意义(均P<0.05),提示细胞凋亡加剧。相比AMI 组,LE 组和HE 组Bax 蛋白相对表达水平下调,Bcl-2 蛋白相对表达水平上调,差异均有统计学意义(均P<0.05);相比LE 组,HE 组变化更显著。提示七叶皂苷可抑制AMI 大鼠心肌组织凋亡,且呈浓度依赖性。见图1。
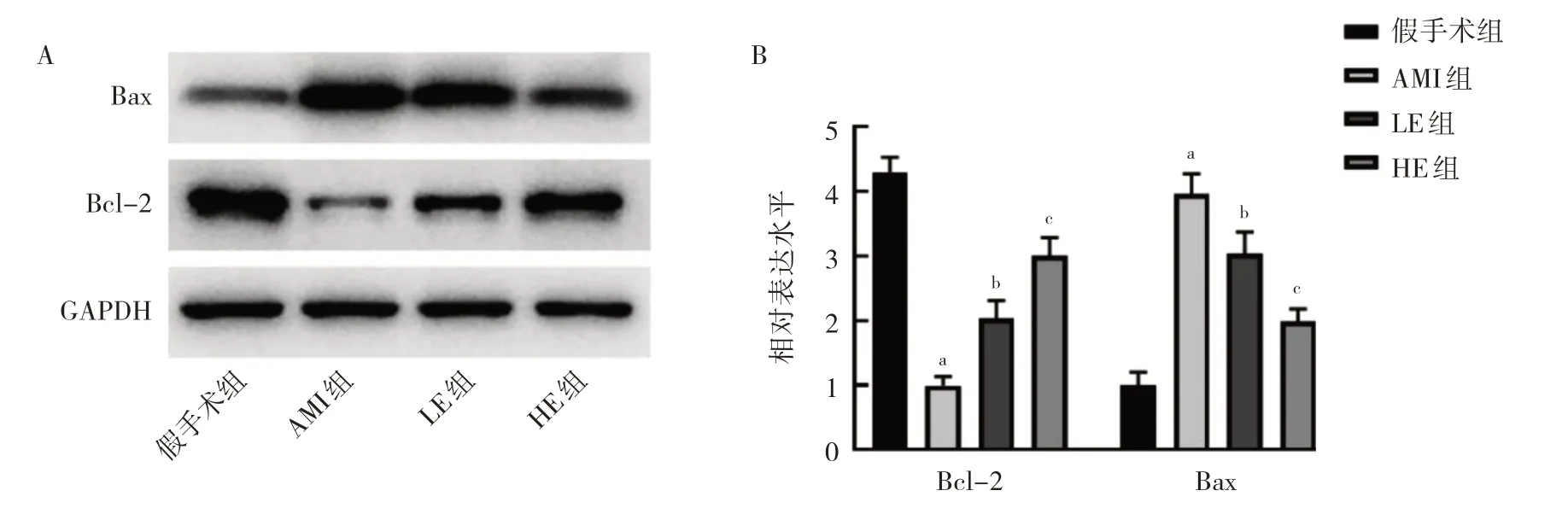
图1 4 组大鼠心肌组织中Bcl-2、Bax 蛋白相对表达水平的比较(A:蛋白电泳图;B:Bcl-2 和Bax 蛋白相对表达水平)
2.3 4 组大鼠心肌梗死面积和miR-140-5p 表达水平比较 假手术组大鼠心肌无梗死区域,AMI 组心肌梗死面积较大。相比AMI 组,LE 组和HE 组心肌梗死面积减少;相比LE 组,HE 组梗死面积更小,提示具有浓度依赖性,见图2A(插页)。与假手术组相比,AMI 组miR-140-5p 表达水平显著增加,与AMI 组相比,LE 组和HE 组miR-140-5p 表达水平显著降低,与LE 组相比,HE 组miR-140-5p 表达水平进一步降低,差异均有统计学意义(均P<0.05),推测七叶皂苷可能通过下调miR-140-5p 表达水平改善AMI 大鼠的心肌损伤,见图2B(插页)。
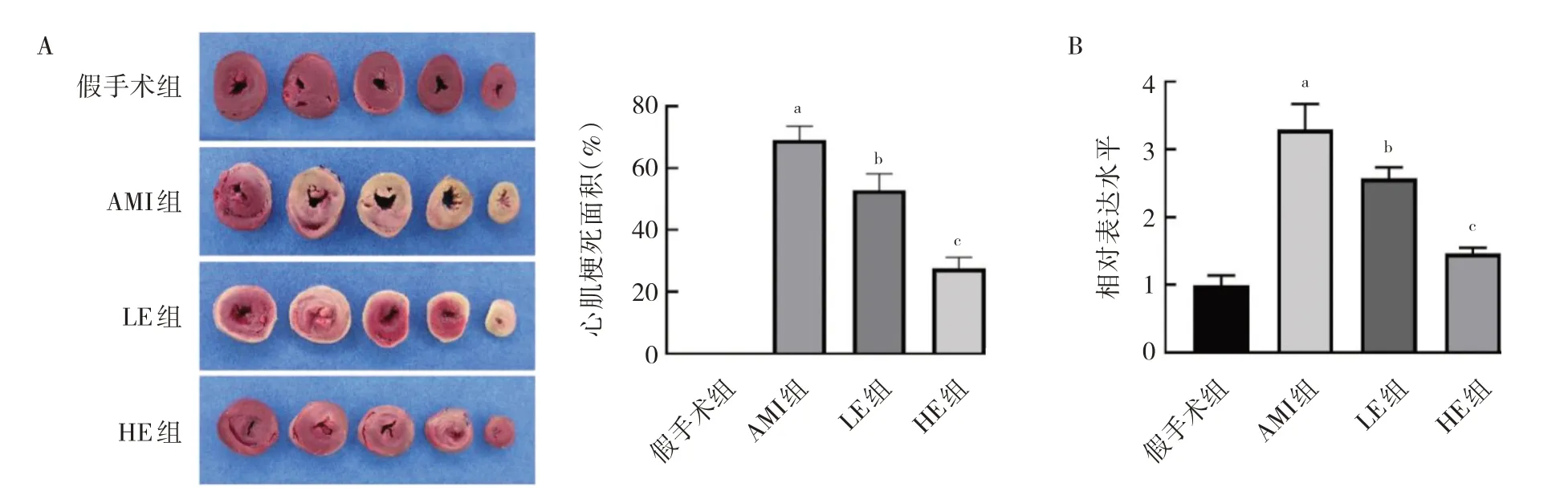
图2 4 组大鼠心肌梗死面积和miR-140-5p 表达水平比较(A:心脏切片观察;B:梗死面积;C:miR-140-5p 表达水平)
2.4 4 组H9C2 细胞活性和miR-140-5p 表达水平比较 相比对照组,低氧组细胞活性显著降低(图3A);相比低氧组,七叶皂苷组细胞活性显著上升;相比七叶皂苷组,模拟物组细胞活性显著降低,差异均有统计学意义(均P<0.05),见图3A。 相比对照组,低氧组miR-140-5p 表达水平显著升高;相比低氧组,七叶皂苷组miR-140-5p 表达水平显著降低;相比七叶皂苷组,模拟物组miR-140-5p 表达水平显著升高,差异均有统计学意义(均P<0.05),见图3B。提示七叶皂苷通过抑制miR-140-5p 表达促进细胞活性。

图3 4 组细胞活性和miR-140-5p 表达水平比较(A:细胞活性;B:miR-140-5p 表达水平)
2.5 4 组H9C2 细胞凋亡和Bcl-2、Bax 蛋白相对表达水平比较 相比对照组,低氧组Bcl-2 蛋白相对表达水平降低,Bax 升高;相比低氧组,七叶皂苷组Bcl-2 蛋白相对表达水平升高,Bax 降低;相比七叶皂苷组,模拟物组Bcl-2 蛋白相对表达水平降低,Bax 升高,差异均有统计学意义(均P<0.05),见图4A(插页)。相比对照组,低氧组细胞相对荧光强度显著升高,相比低氧组,七叶皂苷组相对荧光强度显著降低,差异均有统计学意义(均P<0.05);相比七叶皂苷组,模拟物组相对荧光强度显著升高,差异有统计学意义(P<0.05),见图4B(插页)。提示七叶皂苷对细胞凋亡的改善作用能被miR-140-5p 模拟物逆转。

图4 4 组细胞凋亡水平比较(A:Bcl-2 和Bax 蛋白电泳图和表达水平比较;B:细胞凋亡检测和比较)
3 讨论
AMI 是世界范围内死亡的主要原因,尽管再灌注能够成功地减少梗死面积和改善总体预后,但AMI 仍然是心力衰竭发病率和死亡率增加的主要原因[8]。研究认为,心肌细胞的突然大量丢失超过心肌的有限再生时会进一步加重缺氧诱导的心肌损伤[9]。AMI 诱导心肌细胞凋亡的机制是多方面的,包括炎症和氧化应激。但是目前AMI 胁迫心肌细胞凋亡的机制还不完全清楚,也没有高效的药物干预此过程。因此,探索AMI 诱发心肌细胞凋亡机制,开发抑制心肌细胞凋亡的有效药物对于AMI 的治疗具有重要意义。本研究成功构建了AMI 动物和细胞模型,发现AMI 大鼠心功能下降,主要表现在LVEDd 和LVESd 增加,EF 和FS 降低,心脏组织出现大面积梗死区,促凋亡蛋白Bax 表达上调,抗凋亡蛋白Bcl-2 表达下调。同时还发现,在低氧诱导的H9C2细胞中,细胞活性降低,凋亡水平升高。
许多研究描述了七叶皂苷在卵巢、神经系统、皮肤等各种组织病理生理中的作用,也研究了它在肿瘤中的作用。Selvakumar 等[10]认为,七叶皂苷在帕金森病中具有抗凋亡和抗氧化应激作用,可以改善帕金森患者的运动功能。Wang 等[11]认为,七叶皂苷对视网膜色素上皮细胞有抗氧化应激作用。Cheng 等[12]认为,七叶皂苷可调节卵巢癌细胞凋亡。最近的数据证实了七叶皂苷在降低发炎组织的血管通透性方面的抗炎特性,从而抑制水肿形成[13]。在体内,七叶皂苷可通过减轻体质量、改善糖脂代谢、部分拮抗低度炎症和改善胰岛素抵抗来预防或治疗肥胖[14],减轻糖尿病大鼠心脏自主神经病变[15]。此外,七叶皂苷通过NF-κB 信号通路抑制H2O2诱导的H9C2 细胞凋亡、氧化应激和炎症反应[16]。本研究发现,在AMI 动物和细胞模型中,心肌细胞损伤都十分显著,七叶皂苷处理后,心肌损伤有所改善,且七叶皂苷浓度越高,改善效果越明显。
微小RNA(microRNA,miRNA)是一类高度保守的非编码RNA,是转录后主要的调控因子,几乎参与所有细胞过程。越来越多的证据表明,miRNA 是心脏病生理和病理过程中的关键调节因子[17]。如miR-27a-5p 可通过抑制Atg7 减轻缺氧诱导的大鼠心肌细胞损伤[18],miR-21 通过蛋白激酶B(protein kinase B,PKB,又称AKT)/哺乳动物雷帕霉素靶蛋白(mamamalian target of rapamycin,mTOR)通路减少细胞凋亡,缓解缺氧/复氧诱导的H9C2 细胞损伤[19]。此外,miR-223 通过Akt/mTOR 通路靶向DNA 修复酶(poly-ribose polymerase,PARP)-1,缓解缺氧诱导的大鼠心肌细胞过度自噬和凋亡[20]。miR-133a 是心脏中最丰富的miRNA之一,多项研究表明,miR-133a 参与了心肌梗死的早期病理以及随后的心脏重塑[21]。miR-208 通过靶向抑制程序性细胞死亡因子(programmed cell death,PDCD)4 抑制急性心肌梗死小鼠心肌组织凋亡[22]。miR-122-5p 的循环细胞外囊泡穿梭以Bcl-2 依赖性方式调节心肌细胞的活力和凋亡[23]。这些研究提示miRNA 可能成为缺血性心脏病治疗的潜在靶点。本研究发现,miR-140-5p 在AMI 动物和细胞模型中都呈现高表达,但经过七叶皂苷治疗后,不仅心肌损伤有所改善,还能降低miR-140-5p 的表达水平,并且呈现浓度依赖性。近年研究表明,miR-140-5p 的异常表达与心脏疾病相关。miR-140-5p 不仅参与调控糖尿病心肌病心肌细胞凋亡[24],还能靶向Bcl-2 L1 促进心肌细胞凋亡[25]。本研究转染miR-140-5p 模拟物,结果发现七叶皂苷对低氧诱导H9C2 细胞损伤的改善作用被逆转,表明七叶皂苷可能通过抑制miR-140-5p 表达,改善AMI 心肌损伤。
综上,本研究发现七叶皂苷通过调控miR-140-5p参与AMI 心肌损伤。本研究结果为探索AMI 诱发心肌细胞凋亡机制,开发有效抑制心肌细胞凋亡靶向药物提供理论依据,对AMI 防治具有重要意义。
