四川凉山苦荞种子携带真菌多样性分析
2023-08-07白凯红阿别小兵许晓丽蒋娜李健强罗来鑫
白凯红 阿别小兵 许晓丽 蒋娜 李健强 罗来鑫
(中国农业大学植物病理学系/农业农村部有害生物监测与绿色管理重点实验室/种子病害检验与防控北京市重点实验室,100193,北京)
苦荞(Fagopyrum tataricum)又名鞑靼荞麦,是蓼科(Polygonaceae)荞麦属(Fagopyrum)的一年生双子叶草本植物,是荞麦主要栽培种之一[1-2],主要分布在四川、云南和贵州等地区[3],其中四川省凉山地区是我国荞麦起源中心之一,被誉为“苦荞麦之乡”,拥有全国乃至全世界最丰富的苦荞种质资源,是苦荞种类最多样、种植面积最广泛、分布最集中的地区[3-5]。苦荞作为当地的主要粮食之一,在凉山地区的17 个县均有种植,其中越西、昭觉、喜德、冕宁和美姑等县是苦荞的主产区[6-7]。
截至目前,已报道的荞麦真菌性病害共有14种,包括白粉病、立枯病、霜霉病、核盘菌根霉病、叶斑病、枯萎病、坏斑病、褐斑病、白霉病、斑枯病、轮纹病、灰霉病、壳二孢疫病和镰刀菌根腐病[2],这些病害使荞麦的产量与品质受到极大的影响。这些病害大多危害荞麦叶部和根部,但对病原菌初侵染来源并未有太多涉及,对荞麦种子携带真菌的状况更是鲜有报道。种子携带病原物不仅是直接引起作物田间病害流行的重要初侵染来源之一,而且也是病害跨地区远距离传播的重要途径之一[8]。发展种子健康检测技术等是通过种子处理的方法降低种子携带病原物的基础,可最大限度控制种传病害的传播,实现增产增收。种子健康检测技术主要有直接检测和洗涤检测、琼脂培养检测、免疫血清学检测和分子生物学检测等[9],近年来检测通量大、成本低和速度快的高通量测序技术被广泛应用,但在荞麦种子健康检测中还未见报道。
本研究同时运用分离培养法和基于18S rRNA基因扩增子测序法,对凉山主要产区的苦荞种子内部及外部真菌进行检测,旨在明确凉山州苦荞种子携带真菌的多样性,为种子处理和病害防治提供理论基础。
1 材料与方法
1.1 供试材料
苦荞种子样品采自四川省凉山州越西县尔赛乡依达村、越西县尔赛乡洪洛村、越西县尔赛乡花古村、昭觉县谷曲乡新凉村、昭觉县洒拉地破、昭觉县解放沟、喜德县博洛拉达乡博洛村、喜德县博洛拉达乡火普村、冕宁县回坪乡庙高山村、普格县五道箐乡采洛洛博村、美姑县觉罗乡地莫村和盐源县干海乡滑泥村。46 份苦荞种子用于种子内部及外部真菌检测,其中选取不同地方的13 份种子用于18S rRNA 基因扩增子测序,其中种子样品MNCQ-1、MNCQ-4、PGEL-1、YYQK-6、YYCQ-3、MGYQ-2、MGXQ-2、MGCQ-2 为已知品种,分别是川荞1号、川荞4 号、额拉、黔苦6 号、川荞3 号、云荞2 号、西荞2 号、川荞2 号,具体信息见表1。

表1 四川省凉山州苦荞种子样品信息Table 1 The information of tartary buckwheat seeds from Liangshan of Sichuan province
1.2 分离培养法检测
1.2.1 外部真菌检测 从46 份苦荞种子样品中,各随机选取100 粒种子置于50mL 灭菌三角瓶中,并加入10mL 无菌水,置于摇床上振荡30min(120转/min)后,吸取1mL 上清液,进行10 倍系列梯度稀释并在PDA 培养基上进行涂板。涂布后的培养基平板封口后置于25°C 培养箱中培养2d 后开始观察记录,并进行真菌的分离与纯化。
1.2.2 内部真菌检测 从46 份苦荞种子样品中,各随机选取100 粒种子用1% NaClO 溶液进行消毒处理10min 后,用灭菌水进行3 次洗涤,用灭菌的吸水纸吸去种子表面的水分,风干后将种子摆在直径9cm 的PDA 培养基平板上,每皿摆放10 粒种子,置于25℃培养箱中进行培养2d 后开始观察记录,并进行真菌的分离与纯化。
1.2.3 形态学鉴定 在载玻片上滴加10μL 无菌水,用接种针挑取少量真菌培养物,置于载玻片的无菌水中,并使其尽量分散,盖上盖玻片,利用Olympus 1X 71 倒置显微镜对菌丝和孢子形态进行观察。
1.2.4 分子生物学鉴定 用CTAB法对真菌总DNA进行提取,利用通用引物ITS4/ITS5(TCCT CCGCTTATTGATATGC/GGAAGTAAAAGTCGTA ACAAGG)[10]扩增18S rRNA 基因序列。PCR 体系(25.00μL)为16.85µL ddH2O、2.50µL 10×rTaqDNA 聚合酶缓冲液、2.40µL dNTPs(每种均为2.5mmol/L)、1.00µL 上游引物(10μmol/L)、1.00µL下游引物(10μmol/L)、0.25µLrTaqDNA 聚合酶(2.5U/µL)、1.00µL DNA 模板。PCR 反应程序为95°C 预变性10min;95°C 变性30s,55°C 退火30s,72°C 延伸1min,35 个循环;72°C 延伸10min。将符合目标条带的样品送北京博迈德科技发展有限公司进行测序,并将所得序列在NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)数据库中进行同源性比对。
1.3 18S rRNA 基因扩增子测序法检测
1.3.1 样品预处理 检测种子外部携带真菌是将100 粒苦荞种子置于灭菌的50mL 离心管,加入10mL 灭菌水,涡旋震荡5min,种子洗脱液转移至新管中备用;对于内部寄藏真菌的检测:随机称取0.3~0.5g 种子,并用1% NaClO 溶液进行消毒处理10min 后,用灭菌水洗涤3 次,用灭菌的吸水纸吸去种子表面的水分,风干后将种子用液氮速冻后研磨成粉末备用。
1.3.2 DNA 提取和文库构建 利用DNA 提取试剂盒Omega-soil DNA Kit(Omega Bio-Tek)对基因组DNA 进行抽提,利用扩增18S rRNA 的引物SSU0817F/SSU1196R(TTAGCATGGAATAATRRA ATAGGA/TCTGGACCTGGTGAGTTTCC)[11]进行PCR 扩增,以检测是否满足后续扩增子测序要求。满足要求后,通过文库构建,进行Miseq 测序。
1.4 数据处理
测序平台得到的下机数据(Raw Data)需要经过数据拆分、去引物序列、PE Reads 拼接、Tags 质量及长度过滤和截取以及去嵌合体后获得最终的有效数据(Effective Tag),之后进行物种注释和分析:利用Uparse(http://www.drive5.com/uparse/)和Usearch(http://www.drive5.com/usearch/)进行OTU(Operational Taxonomic Units)分析,采用RDP classifier 贝叶斯算法对97%相似水平的OTU 代表序列进行分类学分析;利用Mothur(version v.1.30.2 https://mothur.org/wiki/calculators/)进行Alpha 多样性分析;利用Qiime 和R 语言(version 3.3.1)进行Beta 多样性分析,明确物种的丰富度和多样性。
2 结果与分析
2.1 分离培养法对苦荞种子携带真菌的检测与鉴定
对苦荞种子携带的真菌进行分离培养,从种子内部共获得786 株分离物,种子外部共获得594 株分离物。经形态学和分子生物学鉴定,从种子内部获得的786 株分离物隶属于15 个属,分别为葡萄座腔菌属(Botryosphaeria)、梭孢壳属(Thielavia)、炭疽属(Colletotrichum)、平脐蠕孢属(Bipolaris)、弯孢属(Curvularia)、链格孢属(Alternaria)、裂褶菌属(Schizophyllum)、曲霉属(Aspergillus)、拟茎点霉属(Phomopsis)、镰刀菌属(Fusarium)、木霉属(Trichoderma)、茎点霉属(Phoma)、Myrmaecium、毛壳菌属(Chaetomium)、拟盘多毛孢属(Pestalotiopsis);从种子外部获得的594 株分离物隶属于12 个属,分别为横梗霉属(Lichtheimia)、青霉属(Penicillium)、链格孢属(Alternaria)、裂褶菌属(Schizophyllum)、曲霉属(Aspergillus)、拟茎点霉属(Phomopsis)、镰刀菌属(Fusarium)、木霉属(Trichoderma)、茎点霉属(Phoma)、Myrmaecium、毛壳菌属(Chaetomium)、拟盘多毛孢属(Pestalotiopsis)。因此,从苦荞种子中共鉴定得到17 个属的真菌,分别为葡萄座腔菌属(Botryosphaeria)、平脐蠕孢属(Bipolaris)、梭孢壳属(Thielavia)、拟茎点霉属(Phomopsis)、Myrmaecium、炭疽属(Colletotrichum)、茎点霉属(Phoma)、毛壳菌属(Chaetomium)、拟盘多毛孢属(Pestalotiopsis)、木霉属(Trichoderma)、曲霉属(Aspergillus)、青霉属(Penicillium)、横梗霉属(Lichtheimia)、链格孢属(Alternaria)、弯孢属(Curvularia)、裂褶菌属(Schizophyllum)、镰刀菌属(Fusarium)。具体分离物的菌落形态和孢子形态如图1 所示,且上述真菌的18S rRNA 基因序列与NCBI 上已知对应属的真菌序列的比对结果相似度均在99%以上。

图1 苦荞种子携带的部分真菌分离物在PDA培养基上的菌落形态及孢子形态Fig.1 The colony morphology and its spore morphology of tartary buckwheat seeds carrying fungal isolates on PDA medium
苦荞种子真菌分离物的分离频率和优势菌群统计结果如图2 所示,内部寄藏的真菌分离物中镰刀菌属(Fusarium)的分离频率最高,为34.4%,拟茎点霉属(Phomopsis)、青霉菌属(Penicillium)和曲霉属(Aspergillus)分别为27.1%、18.3%和17.1%,其他菌群为3.1%(图2a)。外部携带的真菌分离物中优势真菌为链格孢属(Alternaria),占比36.2%,裂褶菌属(Schizophyllum)、木霉属(Trichoderma)和葡萄座腔菌属(Botryosphaeria)的分离占比分别为22.1%、15.9%和14.2%,其他菌群为11.6%(图2b)。

图2 基于分离培养法对供试苦荞种子携带真菌的优势菌群分析Fig.2 Analysis of dominant microflora from tartary buckwheat seeds based on isolation and culture method
2.2 基于18S rRNA 基因扩增子测序结果
2.2.1 OTU 分析 基于18S rRNA 基因扩增子测序法,13 份供试苦荞种子携带真菌群落物种分类统计结果如下,内部寄藏真菌序列被划分为1 个域(Domain)、5 个界、7 个门、19 个纲(Class)、27 个目(Order)、35 个科、39 个属、42 个种,共48 个OTUs;外部携带真菌序列被划分为1 个域、5 个界、8 个门、21 个纲、31 个目、38 个科、41个属、45 个种,共57 个OTUs。
2.2.2 Alpha 多样性分析 对于Alpha 多样性分析,Ace 指数越高,表示菌群物种种类越丰富。结果(图3a)表明,供试种子内部真菌的多样性为MNCQ-1(冕宁县)>ZJ-5(昭觉县)>PGEL-1(盐源县)>XD-10(喜德县)>ZJ-1(昭觉县)>MGYQ-2(美姑县)>YYCQ-3(盐源县)>ZJ-10(昭觉县)>MGXQ-2(美姑县)>YYQK-6(盐源县)>MNCQ-4(冕宁县)>MGCQ-2(美姑县)>YX-7(越西县);外部真菌群落多样性为PGEL-1(盐源县)>MNCQ-4(冕宁县)>MGCQ-2(美姑县)>MNCQ-1(冕宁县)>XD-10(喜德县)>YYCQ-3(盐源县)>MGXQ-2(美姑县)>MGYQ-2(美姑县)>ZJ-1(昭觉县)>ZJ-5(昭觉县)>YYQK-6(盐源县)>ZJ-10(昭觉县)>YX-7(越西县)(图3b)。同一地区的不同供试苦荞种子无论在内部寄藏还是外部携带真菌的丰度都存在明显差异,同一样品种子内部与外部真菌的丰度也有所不同。

图3 基于18S rRNA 基因扩增子测序对供试的13 份苦荞种子携带真菌的Alpha 多样性的评估结果Fig.3 Alpha diversity estimators of 13 tartary buckwheat seeds carrying fungi by 18S rRNA amplicon sequencing
对苦荞种子内部寄藏和外部携带真菌的物种组成进行分析,结果如图4a 所示,种子内部寄藏真菌主要有核盘菌属(Sclerotinia)、隐球菌属(Cryptococcus)、枝孢菌属(Cladosporium)、Boeremia、短梗霉属(Aureobasidium)和旋孢腔菌属(Cochliobolus),另外还有未鉴定到属的群落,有胚植物亚界(Embryophyta)、发菌科(Trichocomaceae)、座囊菌纲(Dothideomycetes)、银耳目(Tremellales)等;外部携带真菌的物种组成如图4b 所示,有核盘菌属(Sclerotinia)、枝孢菌属(Cladosporium)、隐球菌属(Cryptococcus)、Boeremia、短梗霉属(Aureobasidium)和球腔菌属(Mycosphaerella),另外还有未鉴定到属的菌群如下,发菌科、银耳目、座囊菌纲和Cystofilobasidiaceae等。在种子内部寄藏和外部携带真菌中均能鉴定到核盘菌属(Sclerotinia)、隐球菌属(Cryptococcus)、枝孢菌属(Cladosporium)、Boeremia和短梗霉属(Aureobasidium),其中核盘菌属(Sclerotinia)在所有鉴定到的菌群中占比最高,且在13 份供试苦荞种子中均能检测鉴定到。

图4 基于18S rRNA 基因扩增子测序对供试的13 份苦荞种子携带真菌的物种组成分析结果Fig.4 Community analysis of 13 tartary buckwheat seeds carrying fungi by 18S rRNA amplicon sequencing
2.2.3 Beta 多样性分析 13 份苦荞种子样品内部寄藏真菌的样本层级聚类分析结果如图5a 所示,有的同一地区的样品会聚在一起,例如来自于昭觉县的样品ZJ-1、ZJ-5 和ZJ-10;来自冕宁县的样品MNCQ-1 和MNCQ-4。有的同一地区的样品并没有聚类在一支,例如来自美姑县的样品MGCQ-2、MGXQ-2 和MGYQ-2;来自盐源县的样品YYQK-6 和YYCQ-3。13 份样品中来自越西县的样品YX-7 与其他样品的差异性最大,来自盐源县的样品YYQK-6 与来自美姑县的样品MGXQ-2 差异性最小。外部携带真菌的样品层级聚类分析结果如图5b 所示,不同种子样品外部携带真菌的差异性大,即使来自同一个地方的样品也没有聚到一支,其中13 份样品中来自越西县的样品YX-7与其他样品的差异性最大,来自盐源县的样品YYCQ-3 与普格县的样品PGEL-1 的差异性最小。苦荞种子内部寄藏真菌PCA 分析结果如图5c 所示,来自冕宁县、美姑县、昭觉县的种子样品能聚到一起,说明这些地点样品真菌群落多样性相近,而来自盐源县的种子样品并没有聚到一起,说明真菌群落多样性差异大。其中来自越西县的样品与其他差异性最大,来自昭觉县和喜德县的种子样品菌群多样性相近,喜德县种子样品同时与美姑县样品相近,美姑县样品又与盐源县样品相近,盐源县样品与冕宁县的样品相近。苦荞种子外部携带真菌群体多样性分析结果如图5d 所示,来自同一个地区的不同种子样品并没有聚类到一起,说明携带真菌的群落差异性大,其中来自越西县的样品与其他种子样品群落多样性差异性最大。
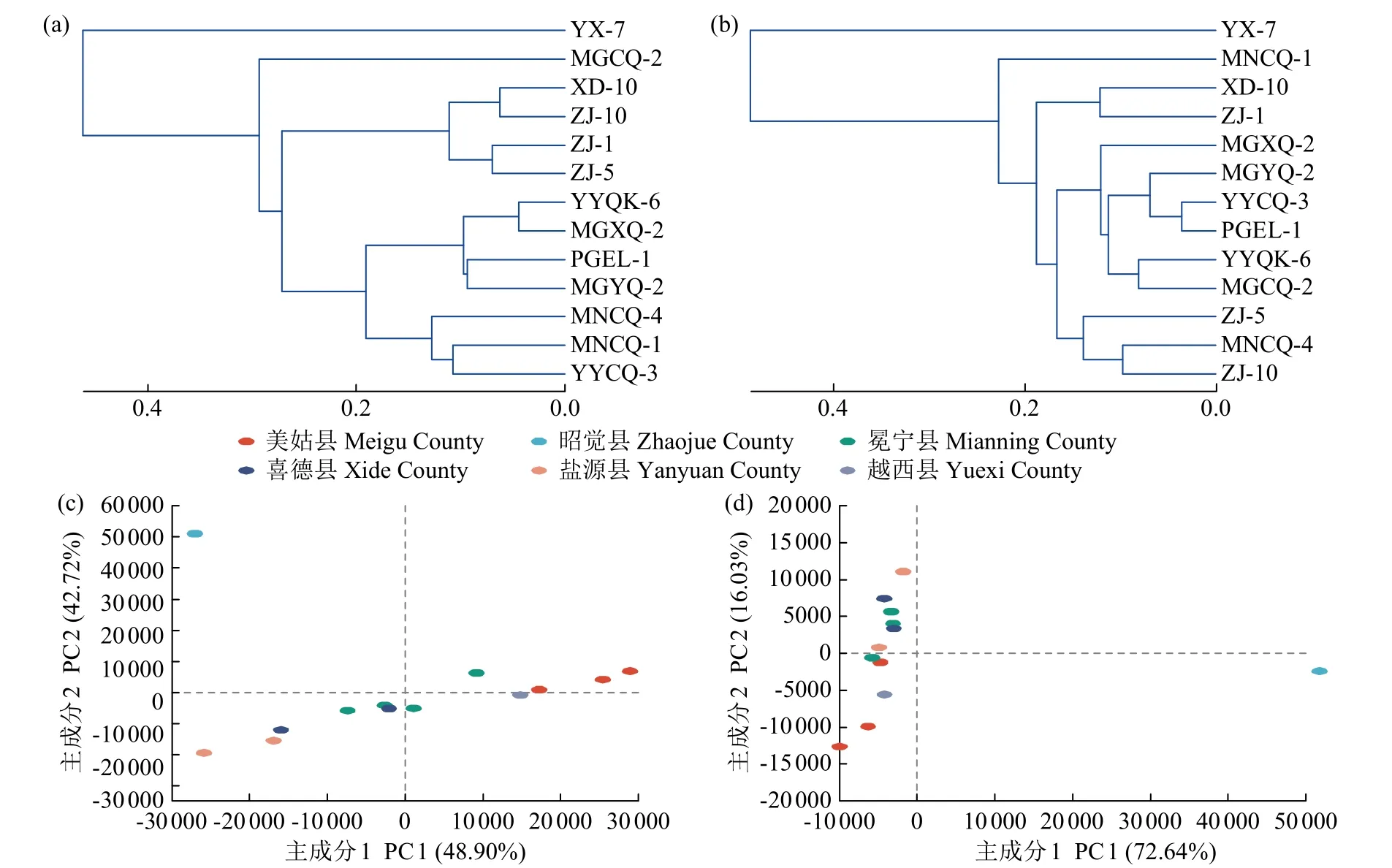
图5 基于18S rRNA 基因扩增子测序对供试的13 份苦荞种子携带真菌的样本层级聚类分析Fig.5 Sample hierarchy clustering analysis of 13 tartary buckwheat seeds carrying fungi by 18S rRNA amplicon sequencing
3 讨论
从本研究鉴定得到的真菌分离物可以看出,除了引起荞麦轮纹病的茎点霉属(Phoma)、荞麦根腐病的镰刀菌属(Fusarium)与叶斑病的链格孢属(Alternaria)外[12-14],其余属均未见报道,原因可能是已有报道主要以叶片和根部的真菌病害为研究对象,关于种子携带的包括病原菌在内的真菌类群研究较少,但本研究新发现的真菌分离物是否为苦荞的病原菌还有待于进一步研究验证。
基于18S rRNA 基因扩增子测序从种子内部共获得39 个属,从种子外部共获得41 个属。其中核盘菌属(Sclerotinia)同时为苦荞种子内部寄藏真菌与外部携带真菌的优势菌群,有研究[15-16]报道,Sclerotinia sclerotiorum能引起荞麦的根腐病。在传统分离培养法中鉴定到的链格孢属和镰刀菌属,在18S rRNA 基因扩增子测序中并没有鉴定到,可能是由于核盘菌属等其他优势菌群扩增时掩盖了丰度极低的菌群。相反,在分离培养法中并未鉴定到核盘菌属,推测可能是因为PDA 培养基上核盘菌属生长缓慢,被生长快速的菌所覆盖,因此没有被检测到。由于高通量测序法的测序通量大,能鉴定到更多属,而分离培养法能检测到丰度极低的菌,因此如果想知道群落的多样性,高通量测序与分离培养法结合是更准确的检测方法。
18S rRNA 基因扩增子测序聚类结果表明,来自昭觉县与喜德县的种子样品真菌群落多样性相似,来自盐源县与冕宁县的种子样品真菌群落多样性相似,推测是因为地理上喜德县和昭觉县相邻,盐源县和冕宁县相邻,可能是由于种子的流动性或病原菌孢子在风力等作用下的传播,产生交叉污染,致使2 个地方种子携带真菌的多样性相似。另外,越西县虽然与冕宁县、喜德县、昭觉县、美姑县相邻,但菌群多样性与其他地方差异大,具体原因还需要对品种进行鉴定,并对地形和种子贸易进行研究,看是否由于山脉阻挡了病原物的传播或种子贸易限制了种子的流动性,致使群落的差异性大。
4 结论
基于分离培养法和18S rRNA 基因扩增子测序法对我国苦荞主产区四川凉山州有代表性的46 份苦荞种子的检测结果表明,镰刀菌属(Fusarium)和链格孢属(Alternaria)分别是种子内部和外部能够分离培养得到的优势菌群,核盘菌属(Sclerotinia)则是扩增子测序法得到的苦荞种子内、外部优势菌群,不同方法分析得到的优势菌群存在一定差异,扩增子测序法得到的总真菌类群大于分离培养法。2种方法检测得到的多个真菌属均为潜在的苦荞病原菌,且部分属在荞麦上未见报道。不同地区的种子样品、同一地区的不同样品、及同一样品的种子内部与外部带菌情况均在多样性上存在差异。
