激素调控种子休眠与萌发分子机制研究进展
2023-08-07莘晓月
莘晓月,刘 鹏
(扬州大学 a. 农学院,江苏省作物遗传生理国家重点实验室,植物功能基因组学教育部重点实验室,江苏省作物基因组学与分子育种重点实验室;b. 农业科技发展研究院,教育部农业与农产品安全国际合作联合实验室,江苏 扬州 225009)
种子休眠和萌发是截然不同但又紧密联系的生理过程,从休眠到萌发的转变不仅是植物生命周期中关键发育期,而且对农业生产也有很大影响[1]。种子休眠和萌发受到植物体内多种内源激素和环境因子的精确调控[2]。通过突变体材料和分子生物学研究技术,科学家们发现脱落酸(abscisic acid,ABA)和赤霉素(gibberellins,GAs)是调控种子休眠和萌发的主要激素。越来越多的研究表明,生长素(auxin)、细胞分裂素(cytokinin,CTK)、乙烯(ethylene,ETH)、油菜素内酯(brassinosteroids,BRs)、茉莉酸(jasmonic acid,JA)等激素在调控种子休眠和萌发中同样扮演着重要角色。本文主要总结了激素调控种子休眠和萌发的分子机制,以及不同激素之间相互作用机理的研究进展。
1 种子休眠
种子休眠对植物生存至关重要,它能确保种子仅在最适环境条件下才会发芽。种子休眠是种子植物在长期进化过程中产生的适应性性状,使植物能够在环境胁迫条件下得以生存[3]。大多数作物经过长期驯化种子休眠水平较低,以保证播种后出苗率较高。种子休眠期缺失会导致穗发芽,造成粮食作物减产和食用品质下降,是影响粮食作物的重要灾害[4]。
1.1 DOG1基因在种子休眠中的作用
研究发现,种子休眠属于数量性状。拟南芥DOG1(DELAY OF GERMINATION-1)基因是调控种子休眠的主效基因,并与ABA协同作用来抑制种子萌发[5]。研究发现,DOG1和ABA信号通路之间存在交叉调控[6]。DOG1与蛋白磷酸酶(protein phosphatase 2C,PP2C)成员AHG1/AHG3(ABA HYPERSENSITIVE GERMINATION1/3)相结合并抑制其磷酸酶活性,从而增强ABA信号,维持种子休眠水平[7]。拟南芥dog1突变体中种子内源ABA含量降低,而GAs含量增多,种子不再进入休眠期[8]。DOG1基因通常在发育中或成熟的种子中表达,它的转录水平受多种因素影响,包括可变剪接、顺式反义非编码转录本(asDOG1)、microRNAs等[7]。在种子成熟期,DOG1蛋白不断累积,其蛋白水平与种子的休眠程度高度相关。种子发育晚期通常富集了大量RFO(raffinose family oligosaccharides)、种子贮存蛋白、热激蛋白和LEA(late embryogenesis abundant)蛋白,这些物质对维持种子休眠是必需的[9]。拟南芥dog1-1突变体转录组分析发现,ABA信号通路的关键基因ABI5和ABF4表达水平显著降低,此外,编码LEA蛋白和热激蛋白基因的表达水平也下调。遗传分析表明,DOG1通过正调控ABI5及其他转录因子表达水平,进而影响LEA蛋白和热激蛋白的累积[10]。dog1-1突变体代谢组分析发现,RFO含量与野生型相比明显降低,表明DOG1蛋白水平对种子中贮存物的累积是必需的[7]。
多种转录因子通过与DOG1基因的启动子结合调控其转录[7]。据报道,4个拟南芥转录因子LEC1(LEAFY COTYLEDON1)、ABI3、FUS3(FUSCA3)和LEC2在种子发育过程中起关键调控作用[11-17]。其中ABI3、FUS3和LEC2蛋白都含有植物特异的B3 DNA结构域,该结构能够专一性识别存在于种子成熟相关基因启动子区的RY [CATGCA(TG)]基序[11,18-19]。起初研究人员发现LEC1虽然影响DOG1基因的表达,但是LEC1并不与DOG1启动子相互作用[20]。研究证实,在拟南芥种子成熟阶段bZIP67是DOG1表达的直接调节因子,LEC1通过调控bZIP67转录影响DOG1基因的表达,从而明确了LEC1在种子休眠建立中的作用[21]。LEC1负责直接激活bZIP67表达,LEC1功能缺失突变体中bZIP67和DOG1的表达均下调[22]。同时ABI3、FUS3和LEC2也会影响bZIP67表达。bZIP67通过识别G-box顺式作用元件与DOG1启动子结合,促进DOG1转录,从而建立种子休眠[21]。在DOG1启动子序列中存在一个RY基序[23],ChIP实验证实FUS3与DOG1启动子中RY序列结合[24-25],调控DOG1表达。
组蛋白修饰会改变染色质的活性状态,从而影响种子休眠相关基因的表达,因此,组蛋白修饰在调控种子休眠过程中同样发挥重要作用。当种子解除休眠时,DOG1基因上的组蛋白修饰发生明显变化,其中H3K4me3修饰减少,而H3K27me3修饰增加,同时DOG1表达降低[21]。拟南芥HUB1(histone monoubiquitination 1),也称RDO4(reduced dormancy-4),该基因编码C3HC4锌指蛋白。研究表明,HUB1是体内组蛋白H2B单泛素化所必需的,它作为E3连接酶通过催化组蛋白H2B单泛素化,组蛋白H3K4和K79位点的甲基化修饰水平随之增加,DOG1、ABI4等休眠相关基因的表达增强,因此,HUB1是种子休眠的正向调控因子[26-27]。拟南芥组蛋白去甲基化酶LDL1(lysinespecific demethylase like 1)和LDL2通过下调组蛋白H3-Lys4甲基化水平,抑制DOG1、ABI2、ABI3等基因的表达,因此,LDL1和LDL2负向调控种子休眠[28]。此外,拟南芥KYP/SUVH4是组蛋白甲基转移酶,负责H3K9甲基化。在种子吸胀阶段KYP/SUVH4的转录水平达到峰值,抑制休眠相关基因的转录[29]。
1.2 ABA在种子休眠中的作用
ABA对诱导和维持种子休眠有重要作用[30]。在种子成熟过程中,ABA正向调节种子贮藏物的积累,且抑制胚生长,同时诱导种子耐干性和种子休眠。在ABA缺失的拟南芥突变体中,其种子萌发比野生型快[31]。
当ABA合成途径基因过量表达时,其种子保持深度休眠。由NCED催化的氧化裂解反应是ABA合成的限速步骤,在拟南芥中鉴定到5个NCED基因,它们在种子发育不同时期或不同部位中特异表达[30,32];NCED基因过量表达株系中ABA含量增加进而诱导休眠[30]。拟南芥突变体nced2569和nced259种子发育阶段大部分黄氧素由胚乳中的活性NCED6催化生成,随后黄氧素进一步被催化形成ABA[31]。
ABA分解代谢基因突变体累积了较高含量ABA,从而导致种子休眠。由CYP707A编码的8′-羟化酶是ABA代谢途径中的关键酶[33-34]。拟南芥CYP707A家族有4个成员,CYP707A1-CYP707A4。其中CYP707A2基因在种子吸胀过程中表达上调,并且在外源ABA存在下表达增强[33]。cyp707a2突变体的种子在吸水后积累的ABA含量约是野生型种子的6倍,表明该基因负责ABA的分解代谢[33]。拟南芥中CYP707A1主要在种子成熟中期负责降解ABA,而CYP707A2则主要在种子成熟后期和种子吸胀过程中发挥作用[35]。进一步发现,CYP707A2基因在中晚期的胚胎和胚乳组织中均有表达,表明在2种组织中发生的ABA降解对解除休眠有重要意义[35]。
除了ABA合成分解途径外,ABA信号途径组分也影响种子休眠。ABA信号感知与转导依赖PYR/PYL/RCAR-PP2C-SnRK2s核心组分[36],ABA通过细胞内受体PYR/PYLs/RCARs[37]的识别发挥作用;当ABA含量增加时,ABA与受体PYR/PYLs/RCARs形成复合物,进而与PP2C相结合,抑制其磷酸酶活性。SnRK2通过自身磷酸化保持活性状态,从而发挥激酶活性激活下游转录因子,促进ABA信号应答基因的表达,开启ABA信号通路[38]。ABI1和ABI2基因编码PP2C蛋白。在拟南芥abi1-1和abi2-1显性失活的突变体中,由于突变的蛋白和受体不再相互作用,种子休眠程度降低[39-40]。另一个拟南芥蛋白磷酸酶HONSU是休眠的负调控因子,它抑制ABA信号传导,同时激活GA通路,说明在种子休眠中HONSU是关联ABA和GA信号途径的关键因子[41]。但是,RDO5 (reduced dormancy 5)磷酸酶突变,不改变ABA含量和敏感性,种子休眠程度大幅降低[42-43];进一步研究发现,RDO5参与的种子休眠主要通过调控RNA结合蛋白APUM9(ArabidopsisPUMILIO 9)和APUM11基因的转录实现的[43]。SnRK2s也是ABA信号途径调控因子之一,在种子发育和萌发阶段拟南芥的SnRK2.2、SnRK2.3和SnRK2.6在细胞核中表达,这3个基因同时突变后,影响种子休眠,内源ABA含量上升[44-45]。
位于ABA信号转导途径的转录因子也是调控种子休眠的关键因子,其中拟南芥ABI3、ABI4和ABI5相关的转录因子研究较为深入。ABI3是保持种子休眠的正调控因子[46]。ABI3转录因子含有植物特有B3结构域,通过与启动子区的种子特异调控元件Ry/Sph结合激活基因表达。拟南芥abi3突变体的种子萌发时对ABA不敏感[47]。研究报道,ABI3的表达受DEP(Despierto)的调控,dep基因功能缺失后种子完全丧失休眠,推测DEP基因影响种子萌发过程中对ABA的敏感程度[48]。WRKY41在种子中特异表达,通过直接与ABI3启动子区W box结合,增强ABI3基因的转录水平,从而增强拟南芥种子休眠[49]。ABI3通过与ODR1(reversal of RDO5)启动子中RY基序结合从而直接抑制其转录。拟南芥ODR1与水稻锌指蛋白Sdr4高度同源[50],在细胞核中ODR1与bHLH57能相互作用。ODR1表达受抑制后,不再与bHLH57形成复合物,使得bHLH57能诱导ABA合成酶关键基因NCED6和NCED9表达,导致ABA水平上升。因此,ABI3-ODR1-bHLH57-NCED6/9模块通过影响ABA生物合成和信号传导调控种子休眠[30,51]。
ABI4属于APETALA2/乙烯反应因子家族转录因子,受ABI4调控的基因启动子区均有CE1(coupling element 1)元件[52]。已有研究表明,在种子萌发过程中ABI4调节ABA的生物合成[53]。拟南芥ABI4基因也是通过筛选对ABA不敏感的萌发突变体被鉴定出来的[30]。abi4突变体的种子休眠程度降低,是因为ABI4缺失导致CYP707A基因表达水平增加,造成ABA含量下降[53]。ChIP实验发现,ABI4通过与CYP707A1/2启动子结合而抑制其转录,导致ABA含量增加[2]。MYB96是响应ABA应答的R2R3型MYB转录因子,它能够诱导ABI4基因的表达。MYB96虽然上调ABA合成基因的转录,但是MYB96仅与NCED2和NCED6的启动子结合,推测MYB96间接调控其他的ABA合成基因[54]。此外,钙离子还通过控制ABI4转录来调节种子萌发[55]。值得注意的是,ABI4也受转录因子SPT(Spatula)的调控,SPT表达水平在种子成熟过程中增加,表明SPT-ABI4模块在休眠建立和维持期间起关键作用[56]。也有研究表明,ABI4负调控GA合成基因,但还需进一步实验证实[53]。
ABI5属于bZIP转录因子家族,在ABA信号转导中处于核心位置,它通过与保守ABA应答元件(ABRE,PyACGTGG/TC)结合启动受ABA诱导基因的表达,从而抑制种子萌发[57]。在成熟的种子中,ABA含量维持在较高水平,ABI5激活晚期胚胎富集蛋白LEA基因的表达,使ABI5和LEA蛋白大量累积,增强种子耐干燥特性[58]。活性的ABI5蛋白需要被磷酸化,实验表明,拟南芥激酶SnRK2.2、SnRK2.3和SnRK2.6通过磷酸化ABI5的特定残基Ser42启动下游基因的表达[44]。光信号介导的种子萌发也是通过调控ABI5转录来实现的[59]。研究发现,拟南芥ABI5启动子区存在多种受光调节的转录因子结合位点。这些结合位点已被实验证实与转录因子结合,例如T/G box(CACGTT)位点与BBX21结合,GT1基序(GGTTAA)与BBX19结合,G-box(CACGTG)位点分别与转录因子PIF1(phytochrome-interacting factors 1)、HY5(elongated hypocotyl 5)和SPT结合[59-61]。PIF1是与光受体色素蛋白相互作用的转录因子,直接激活ABI5基因表达[62]。因此,ABI5是整合多种信号途径调控种子休眠与萌发的核心元件。
2 种子的萌发
种子萌发对植物的生长至关重要,是植物生命周期的开始,是作物产量的先决条件。种子内源ABA和GAs激素相对含量及其信号传递组分是决定种子萌发的关键因素[63]。在种子吸水萌发时,GAs开始合成[64]。研究发现,拟南芥种子吸水初期ABA含量迅速下降,导致ABI5在转录水平和蛋白水平都相应下降,在吸水后的12~24 h甚至检测不到。此时,若添加外源ABA或环境渗透压突然变化诱导合成ABA,ABI5能重新合成并迅速富集,从而延迟胚的发育并阻止胚乳弱化和种皮破裂。然而,这种ABA依赖的抑制效应仅仅发生在种子吸水后48 h内[65]。
GAs是重要的植物生长促进型激素,它能促进细胞伸长。GA缺失突变体植株严重矮化。GAs在促进拟南芥、番茄等种子萌发方面主要有2个作用:首先,GA对于种胚克服周围组织(如糊粉层和种皮)的机械束缚是必需的[66],拟南芥GA缺陷突变体的种子不能萌发,只要去除包裹在种胚周围组织的束缚,种胚就可以继续发育成矮化植株,说明GA能够削弱周围组织对种胚的物理约束而促进胚根伸长[66];其次,GA增加了种胚的生长潜能,拟南芥GA缺陷突变体中种胚的生长速率大大降低。在番茄种子中已鉴定出受GA诱导的与细胞壁松弛相关的基因,如编码内切甘露聚糖酶、木葡聚糖内切转糖基酶/水解酶基因等,其中一部分基因在胚根周围的珠孔胚乳帽中特异性表达[67-68]。
Ogawa等[69]研究了拟南芥种子萌发过程GA合成基因和GA含量的变化特征,该研究团队发现GA4可能是种子萌发时胚芽中主要的活性GA分子;在种子吸水后的24~32 h检测到GA4水平显著增加,此时观察到胚根刚刚开始伸长,这一发现证实GA在种子萌发后期起关键作用。与GA4水平增加一致,在种子吸水后,GA生物合成相关基因的表达水平也上调,不同GA合成酶表达谱不同[70]。AtKO1(ent-kaurene oxidase 1)和AtGA3ox1 (GA 3-oxidase 1)基因在吸水后表达水平逐渐增强,8 h达到最高值,随后表达水平下降[71]。编码GA3-氧化酶的2个基因AtGA3ox1和AtGA3ox2展示出不同的表达模式。AtGA3ox2的表达趋势与GA4含量的变化趋势相一致,表明该基因主要负责合成活性GA分子[72]。
拟南芥GA信号转导途径组分已经得到分离鉴定。GA与其受体GID1(GA-insensitive dwarf 1)结合,促进萌发抑制因子RGL2(RGA-LIKE 2)与F-box蛋白SLY1(SLEEPY1)相互作用,导致RGL2被泛素标记,随后被蛋白酶体识别和降解[73-74]。RGL2蛋白在N端具有高度保守的DELLA结构域,在拟南芥中还存在其他4种DELLA蛋白——GAI(GA-insensitive)、RGA(repressor-of-GA1-3)、RGL1和RGL3[75]。进一步研究发现,在光照条件下,rgl2功能突变后在较低GA水平下(在GA生物合成抑制剂处理时或在自身不能合成GA的突变体材料中)种子能正常萌发,而在黑暗条件下,GAI和RGA蛋白的抑制功能是必要的,因为在ga1-3背景下只有三重突变体gai/rga/rgl2种子才能萌发,这表明RGL2蛋白是GA介导种子萌发的关键抑制因子[76]。当体内GA含量低时,RGL2蛋白累积使RING-H2型锌指蛋白XERICO表达,进而增强ABA生物合成,导致种子萌发受抑制。相反,高水平ABA不仅促进ABI5蛋白的富集和活性,而且诱导RGL2基因高表达。用GA生物合成抑制剂处理rgl2突变体种子,萌发过程中检测到较低的ABI5水平,推测rgl2基因突变引起内源ABA含量下降,从而使ABI5基因表达水平下降,最终实现种子萌发[77]。进一步实验证实,DELLA蛋白中只有RGL2蛋白影响ABI5基因的表达[77]。
研究表明,GID1和SLY1正向调控种子萌发。拟南芥存在3个GA受体——GID1a、GID1b、GID1c[78]。gid1abc三重突变体不能萌发,表明GA受体在调控种子萌发中发挥重要作用。SLY1也是GA信号正调控因子。SLY1功能缺失的拟南芥突变体植株矮小,种子高度休眠[79]。尽管sly1突变体比ga1-3或gid1abc突变体积累更多的DELLA蛋白,但它们表现出较弱的GA不敏感表型,这表明虽然DELLA蛋白水平较高,但sly1突变体中仍进行着GA信号转导。sly1-2突变体种子可以通过2种机制来恢复其萌发,即过量表达GID1基因和延长后熟过程。在sly1-2突变体中,分别过表达GID1a、GID1b和GID1c(GID1-OE)后,能够部分恢复sly1-2种子萌发表型,这是由于GID1的过表达导致细胞内GID1-GA-DELLA复合物增加,相应降低DELLA蛋白水平,表明在没有SLY1介导DELLA降解的情况下GID1可以使DELLA阻遏物失活[80-81]。进一步发现,相比GID1a-OE和GID1c-OE,GID1b-OE恢复sly1-2种子萌发的能力更强,可能是因为GID1b对GA和DELLA具有更高的亲和力[81]。通常erecta野生型种子后熟期是2周,而sly1-2突变体需要1~2 a的后熟期才能解除休眠。sly1-2突变体后熟过程导致GAs激素水平上升和GID1b蛋白水平升高,通过形成GID1-GA-DELLA复合物使DELLA失活。以上结果表明,拟南芥sly1突变体中的DELLA抑制可以通过非蛋白水解机制解除[82]。
3 其他植物激素对种子休眠和萌发的影响
研究发现,除ABA和GAs外,IAA、ETH、BR、CTK、JA等都参与种子休眠和萌发的调控[83]。
生长素对种子休眠有正向调控作用,以依赖ABA的方式影响种子休眠,在高盐的条件下,外源生长素能够抑制拟南芥种子萌发[84]。早期研究发现,IAA处理能延缓小麦种子萌发和抑制穗发芽[85]。过量表达生长素合成基因iaaM时,转基因拟南芥植株表现为较高的IAA含量,其种子休眠程度较高。反之,当生长素合成基因(yuc1/yuc6)或其信号转导组分(tir1/afb3和tir1/afb2)突变后,种子的休眠程度大大降低[2]。遗传分析表明,ABI3是生长素介导的调控种子休眠和萌发所必需的。当IAA水平较低时,生长素应答转录因子ARF10和ARF16被AXR2/3抑制;因此,ARF10/ARF16不能激活ABI3基因的表达,种子不能保持休眠状态[86]。相反,当IAA水平高时,ARF10和ARF16被释放去激活ABI3基因转录,种子能维持休眠。ARF10和ARF16可能不直接结合到ABI3基因启动子序列,它们可能招募或激活其他的种子特异性转录因子激活ABI3表达,需要实验进一步鉴定ARF10/16-ABI3调控通路中缺失的组分[86]。
研究表明,ETH能打破种子休眠并促进种子萌发,抵消ABA的作用[87]。拟南芥ETH信号通路的正调节因子突变能导致种子深度休眠,而负调控因子CTR1(Constitutive Triple Response 1)突变后种子能快速萌发[88]。多项研究已证实,ETH负调控ABA生物合成和信号途径,而且ETH可能通过不依赖ABA/GA途径影响种子萌发。拟南芥组蛋白去乙酰复合物组分SNL1(sin3-like 1)结合组蛋白去乙酰化酶HDA19,调控组蛋白H3K9K18的乙酰化水平,影响基因转录[89]。SNL1/SNL2功能缺失影响ABA和ETH相关基因的表达,增强ETH对ABA的拮抗作用,降低种子休眠[90]。然而,拟南芥ETH受体ETR1(ethylene response 1)和ETR2突变体在盐胁迫下响应ABA应答时表现为相反的表型,etr1-6功能缺失突变体的萌发情况比野生型好,而etr2-3功能缺失突变体的萌发情况比野生型差[91]。因此,ETR1和ETR2在植物细胞中同时具有依赖ETH和独立于ETH通路的2种机制,进而影响盐胁迫处理下种子的萌发。
BRs是一种促进生长的植物激素。对拟南芥BR缺失突变体的研究发现,BR可拮抗ABA对种子萌发的抑制,促进种子发芽[92]。MFT(mother of FT and TFL1)在ABA和BRs调控种子萌发中发挥重要作用[93]。拟南芥中多个BR信号组分通过调控ABI5将BR信号途径与ABA信号途径相关联。BIN2(brassinosteroid insensitive 2)是BR信号的关键抑制因子,它具有激酶活性[94]。在ABA存在下,通过磷酸化使ABI5蛋白保持稳定,进而参与ABA信号介导的种子萌发过程。而活性BRs会抑制BIN2和ABI5的互作[95]。BZR1是BR信号通路的核心转录因子,BZR1可以结合在ABI5启动子的G-box区,抑制ABI5表达并导致植物对ABA不敏感[96]。BES1是BZR1的同源蛋白,它可以直接通过与ABI5蛋白相互作用,影响ABI5的转录调控活性,导致ABI5调控的下游基因表达水平降低,对ABA处理不敏感,最终促进种子萌发[97]。
CTK的作用是促进细胞分裂[98]。拟南芥种子萌发时能够下调ABI5转录并诱导ABI5蛋白降解,实现拮抗ABA的作用[99-100],说明ABI5是关联CTK-ABA通路的重要因子。尽管CTK正调控种子萌发,但是CTK受体功能缺失的突变体休眠程度降低,说明CTK调控种子萌发的机制比较复杂[101]。SA是经典的植物防御激素,正常生长条件下,SA通过抑制受GA诱导的α-淀粉酶的表达来抑制萌发[102];然而在高盐胁迫下,SA可以减少氧化性损伤,从而促进拟南芥种子萌发[103],SA调控种子萌发的分子机制仍待解析。外源施加JA可抑制种子萌发[104],但小麦中研究发现,JA和ABA之间存在拮抗作用,即JA抑制ABA合成基因的转录,促进ABA失活基因的表达[105]。拟南芥的2个JA信号途径突变体coi1-16和jar1萌发时表现为ABA超敏感表型[106]。独角金内酯是由类胡萝卜素衍生的植物激素,它能诱导根寄生植物种子的萌发;在特定环境条件下,它通过影响内源ABA和GAs激素相对含量促进拟南芥种子萌发。研究表明,独角金内酯的关键信号通路组分会影响种子萌发,如拟南芥SMAX1和水稻OsD53[107-108]。
4 总结与展望
通过对模式植物突变体的研究,确立了激素调控种子休眠和萌发的关键基因和核心信号通路,特别是对ABA和GA调控机制的研究越来越深入,并构建了分子调控网络,如图1所示。IAA、ETH、BR、CTK、JA等通过调控ABA或GA通路中的信号组分影响种子休眠和萌发。然而,种子休眠和萌发是复杂的生物学过程,仍存在未知的科学问题需要进一步探索。
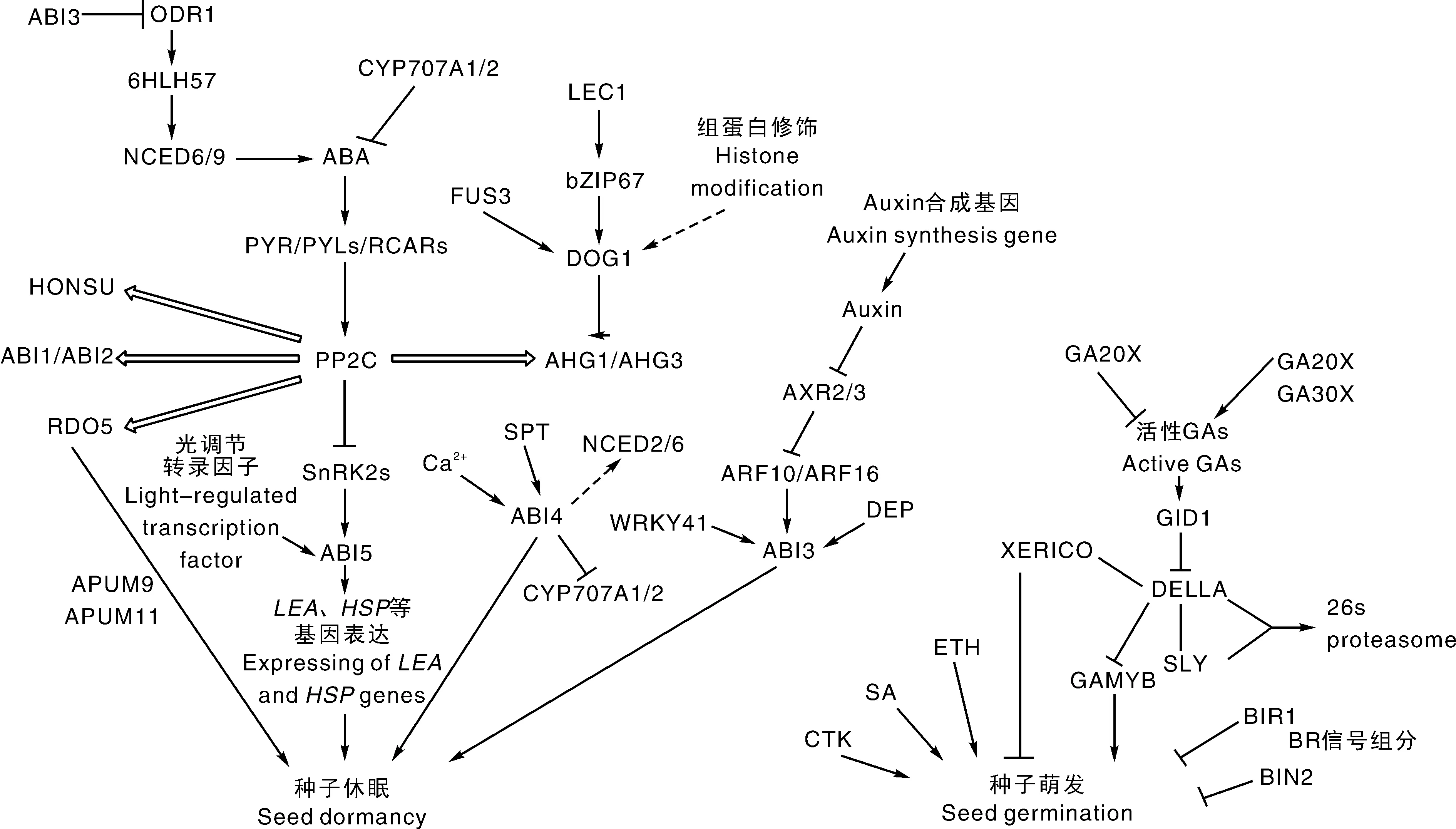
图1 激素调控种子休眠和萌发示意图Fig.1 A schematic model for seed dormancy and germination regulated by phytohormones
最近研究人员尝试从全新的角度结合多种技术手段研究种子休眠和萌发机制。研究发现,许多染色质重塑因子在调控种子休眠方面发挥作用。例如,组蛋白甲基转移酶基因KYP/SUVH4受ABA抑制,而组蛋白乙酰转移酶基因HvGNAT/MYST受ABA诱导[29]。这些研究揭示了表观遗传调控相关基因在种子成熟过程中起着关键作用,进而影响种子休眠的建立过程。由此推测,种子休眠的维持可能与染色质某些区域的特征性结构有关,即使在相关转录因子存在的情况下,由于染色质结构空间位阻的存在使萌发基因的调控序列无法与转录因子结合,因此,基因也不能被转录。相反,休眠解除通常需要冷分层或后熟处理,在这一过程中种胚染色质结构发生改变,使促进萌发的基因可发生转录。Dorone等[109]通过筛选拟南芥干种子中表达水平较高的蛋白编码基因,鉴定到FLOE1蛋白,它在种胚发育过程中基因表达逐渐增强,在种子成熟干燥后达到峰值;FLOE1蛋白能够感受环境水分变化,引发可逆的水合依赖性相分离(即在弥散、液滴和固体凝胶态之间的转换),进而调节种子萌发。FLOE1蛋白的发现为研究种子萌发提供了新的思路,也为抗旱作物设计并应用于农业生产提供了新的方向。此外,田志喜团队与合作者利用全基因组关联分析鉴定到一个控制大豆种皮绿色的G基因[110],在大豆驯化过程中G基因受到平衡选择,与大豆种子休眠减弱相关;遗传实验证明该基因在水稻和拟南芥中均参与调控种子休眠;生化实验结果表明,G蛋白可能通过与ABA生物合成蛋白NCED3、PSY相互作用,调节ABA在种子中的累积,从而影响种子休眠。G基因的研究为从驯化的角度理解种子休眠特性提供了实验依据。
未来科研人员可以从更多层面探索种子休眠和萌发的调控机制,组学技术发展和基因编辑技术的应用有助于解析种子休眠和萌发中未知的科学问题,进一步完善激素调控种子休眠和萌发的分子机制。
