奇异南星挥发油通过miR-762/NF2轴对甲状腺癌细胞恶性生物学行为的影响
2023-08-06张慧闫旺孙明华
张慧 闫旺 孙明华
甲状腺癌是最常见的内分泌系统恶性肿瘤,占每年诊断出的癌症的3.4%[1],大多数患者可通过甲状腺癌根治术和颈部淋巴结清扫术治愈,但是,在手术后仍有15%~30%患者出现复发及颈部淋巴结转移[2],患有顽固性或转移性甲状腺癌患者预后较差[3],因此探索甲状腺癌发病及进展机制对于患者综合治疗具有重要意义。微小RNA(microRNAs,miRNAs)是一类进化保守、长约22个核苷酸的非编码小RNA,可介导细胞增殖、分化及肿瘤发生等多种生物学行为[4]。研究发现,miR-762在乳腺癌细胞系及临床乳腺癌组织中高表达,可促进乳腺癌细胞增殖及侵袭,表明其可能参与癌症发展[5]。2型神经纤维瘤(Neurofibromatosis type 2,NF2)基因是一种新型抑癌基因,可编码Merlin蛋白,据报道NF2/Merlin可抑制乳头状甲状腺癌转移[6],miRNAs可通过靶向调控NF2基因表达参与多种生物学进程,但miR-762是否可靶向调控NF2基因表达参与甲状腺癌发生发展进程,尚需研究证实。奇异南星挥发油(Arisaema decipiens volatile oil,ADVO)为天南星科天南星属植物萃取物,对肺癌、肝癌和乳腺癌等细胞株具有生长抑制作用[7]。本研究拟通过体外培养人甲状腺癌细胞株TPC-1,探究ADVO对TPC-1细胞恶性生物学行为的影响及可能的作用机制,以期为ADVO临床应用于甲状腺癌的治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞株 TPC-1(人甲状腺癌细胞)购自武汉普诺赛生命科技有限公司。
1.1.2 主要试剂 奇异南星全株(经鉴定为天南星属植物奇异南星)购自广西容县;AnnexinV-FITC/PI流式细胞凋亡检测试剂盒购自南京凯基生物科技公司;Matrigel基质胶购自美国BD公司;Invitrogen Lipofectamine2000购自美国Invitrogen公司;miR-762 mimics、miR-762 mimics NC购自上海吉玛生物技术有限公司;NF2/Merlin、兔抗yes相关蛋白1(Yes associated protein 1,YAP1)、裂解半胱氨酸蛋白酶-3(Cleaved cysteine protease-3,C-caspase-3)、E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)抗体及山羊抗兔IgG二抗购自美国Abcam公司;兔抗YAP1(phospho Ser127)多克隆抗体购自武汉艾美捷生物科技有限公司;RT-qPCR试剂盒购自北京天根生物技术有限公司。
1.2 方法
1.2.1 ADVO制备 参考文献[7],采用同时蒸馏萃取技术,以二氯甲烷为溶剂从奇异南星根茎中提取出ADVO 0.326 g。利用RPMI 1640完全培养液(含10%胎牛血清)分别制成15、30、60、120 μg/mL条件培养液。
1.2.2 细胞培养 利用RPMI 1640完全培养液复苏TPC-1细胞,于37℃、5% CO2及饱和湿度环境条件下的培养箱中培养,待细胞增殖至85%左右时进行传代,传2~3代后备用。
1.2.3 CCK-8法检测不同浓度ADVO对细胞存活率的影响 取对数期TPC-1细胞,以1×105个/mL密度接种100 μL细胞悬液于96孔板,利用RPMI 1640完全培养液(ADVO 0 μg/mL)、15、30、60、120 μg/mL ADVO条件培养液培养,各浓度均设置5个复孔,48 h后直接于各孔加入10 μL CCK-8试剂,培养箱内静置2 h,测定450 nm处各孔吸光度(OD)值,实验重复3次。细胞存活率(%)=实验组OD值/对照组OD值×100%(此处对照组为0 μg/mL ADVO培养的细胞)。
1.2.4 过表达miR-762对细胞存活率的影响 经ADVO浓度梯度筛选,60 μg/mL ADVO作用下可降低约50%的细胞存活率;接种1×105个细胞于6孔板内,利用脂质体转染试剂Lipofectamine 2000将miR-762 mimics NC、miR-762 mimics分别转染至汇合约50%的TPC-1细胞,转染过夜并收集细胞。将TPC-1细胞分为空白组(含10%胎牛血清的完全培养液常规培养)、ADVO组(60 μg/mL)、miR-762 mimics组(转染miR-762 mimics)、miR-762 mimics NC组(转染miR-762 mimics NC)、ADVO+miR-762 mimics组(60 μg/mL ADVO+转染miR-762 mimics)和ADVO+miR-762 mimics NC组(60 μg/mL ADVO+转染miR-762 mimics NC),对应培养液培养48 h,CCK-8法检测各组细胞存活率。以下实验均按此分组进行。
1.2.5 Transwell实验检测各组细胞迁移及侵袭的影响情况 转染后48 h收集细胞并重悬于不含胎牛血清的RPMI 1640培养液中,以每孔5×104个细胞密度接种于上室,下室加入200 μL完全培养基,48 h后弃去培养液,棉签拭去小室表面细胞,膜下表面侵入细胞利用1%多聚甲醛固定,室温下结晶紫染色,待Transwell 6孔板干燥后,400倍镜下观察并计数迁移细胞数量。细胞侵袭检测方法同细胞迁移,除了Transwell上室提前涂布有Matrigel基质胶。
1.2.6 流式细胞术检测各组细胞凋亡水平 各组细胞培养48 h后,收集细胞,PBS洗涤沉淀2次,将细胞以1×106个/mL重悬并加入Annexin V-FITC和PI双重染色,室温避光孵育15 min,然后将100 μL细胞悬液与400 μL结合缓冲液混合,流式细胞仪检测细胞凋亡率,重复3次。
1.2.7 生物信息学预测和双荧光素酶报告基因实验 利用Targetscan网站预测NF2基因与miR-762的3′非翻译区(3′untranslated region,3′UTR)之间的潜在结合位点。使用Lipofectamine2000将TPC-1细胞与miR-762 mimics、mimics NC分别与NF2基因野生型(Wild type,WT)或突变型(Mutant,MUT)荧光素酶报告载体共转染,48 h后,裂解细胞,12 000 r/min,4℃离心10 min,收集上清,以海肾荧光素酶为内部对照,检测荧光素酶活性。报告基因相对活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
1.2.8 RT-qPCR实验检测miR-762及NF2 mRNA相对表达水平 利用mirVanaTMmiRNA Isolation Kit分离和纯化总RNA。制备RT-qPCR反应体系,反应条件为95℃ 10 min,95℃ 15 s,60℃ 30 s 40个循环、72℃ 60 s。以GAPDH和U6分别作为内参,2-ΔΔCt法计算目的基因的相对表达量。引物序列如下并送至华大基因合成(表1)。

表1 PCR引物
1.2.9 Western blot实验检测蛋白表达情况 各组细胞培养48 h后胰酶消化、收集并洗涤细胞,用预冷RIPA裂解液裂解,4℃ 12 000 r/min离心10 min,取上清。测定蛋白浓度后加热变性,进行SDS-PAGE凝胶电泳,随后湿转蛋白至PVDF膜,洗膜3次,每次10 min,5%脱脂牛奶室温封闭2 h,Merlin、YAP1、p-YAP1、C-caspase-3、E-cadherin、Vimentin一抗(均1∶1 000稀释)于4℃孵育过夜,洗膜,IgG二抗(1∶8 000稀释)室温孵育2 h,洗膜,ECL发光液显色,并用化学发光凝胶成像系统曝光并拍照记录。Image J软件分析条带灰度值,以目的蛋白与内参GAPDH灰度值比值表示蛋白相对表达量。
1.3 统计分析
2 结果
2.1 不同浓度ADVO作用下TPC-1细胞存活率
TPC-1细胞存活率随ADVO作用浓度增大而降低(P<0.001),60 μg/mL ADVO作用浓度下的细胞存活率接近50%(图1)。

图1 不同浓度ADVO下的TPC-1细胞存活率比较Figure 1 The viability of TPC-1 cells treated with different concentrations of ADVONote:***P<0.001,when compared with the negative control group(0 μg/mL).
2.2 各组TPC-1细胞增殖情况
与空白组比较,miR-762 mimics组细胞存活率升高(P<0.001),ADVO组细胞存活率下降(P<0.001);与ADVO组比较,ADVO+miR-762 mimics组细胞存活率升高(P<0.001)(图2)。
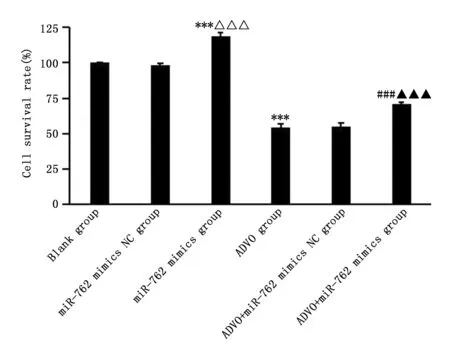
图2 各组TPC-1细胞存活率比较Figure 2 The viability of TPC-1 cells treated with ADVO,miR-762 mimics or their combinationNote:***P<0.001,when compared with the blank group;△△△P<0.001,when compared with the miR-762 mimics NC group;###P<0.001,when compared with the ADVO group;▲▲▲P<0.001,when compared with the ADVO+miR-762 mimics NC group.
2.3 各组TPC-1细胞凋亡情况
与空白组比较,miR-762 mimics组细胞凋亡率降低(P<0.001),ADVO组细胞凋亡率升高(P<0.001);与ADVO组比较,ADVO+miR-762 mimics组细胞凋亡率降低(P<0.001)(图3,图4)。
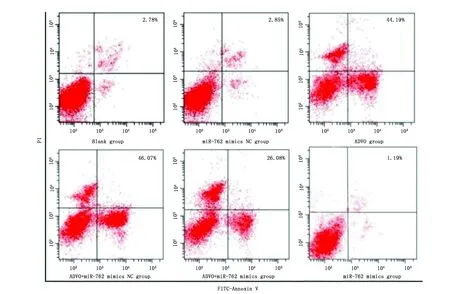
图3 流式细胞仪检测各组TPC-1细胞凋亡情况Figure 3 The apoptotic rates of were detected in TPC-1 cells by flow cytometry
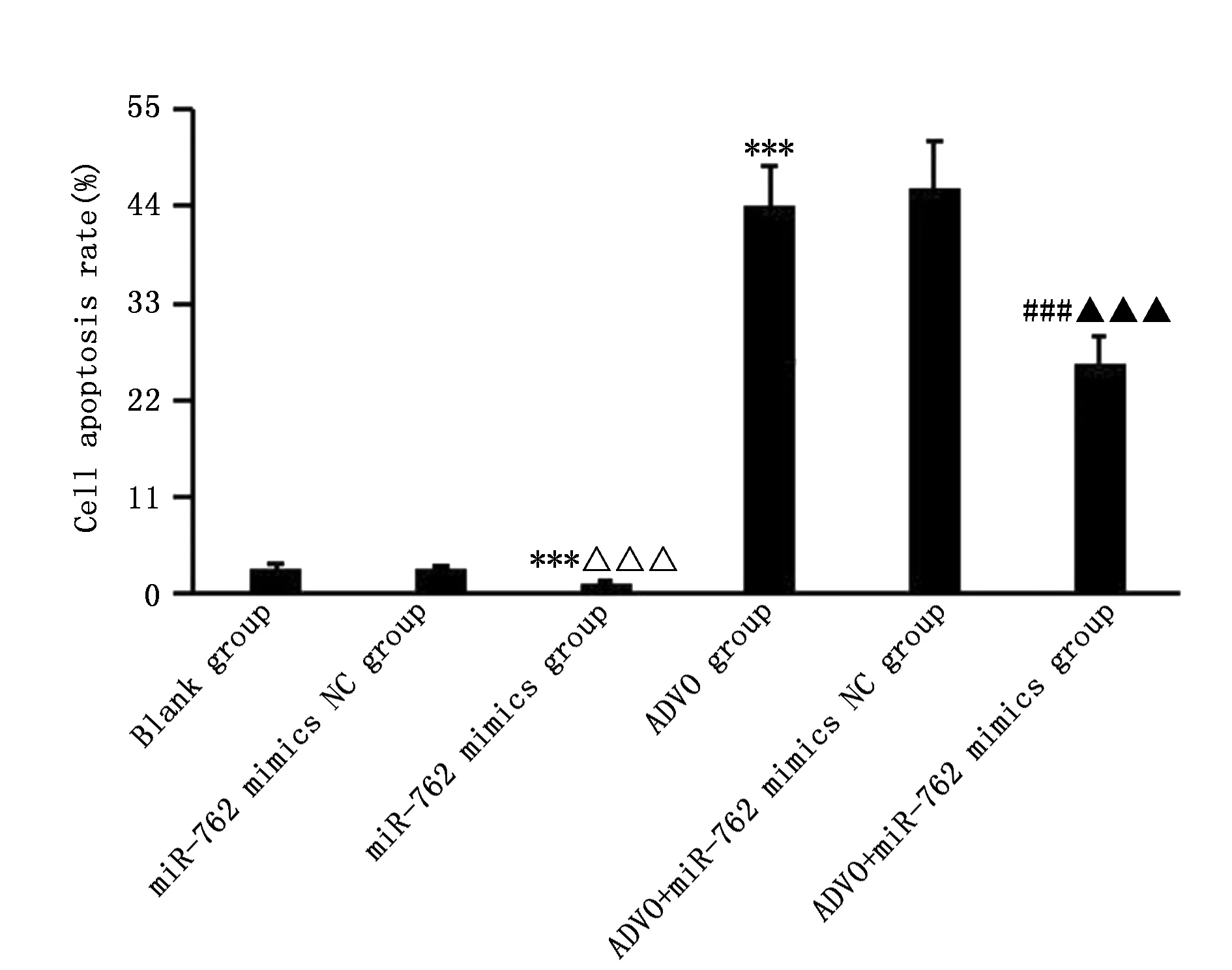
图4 各组TPC-1细胞凋亡率比较Figure 4 The comparison of apoptotic rates in TPC-1 cells treated with ADVO,miR-762 mimics,NC or their combinationNote:***P<0.001,when compared with the blank group;△△△P<0.001,when compared with the miR-762 mimics NC group;###P<0.001,when compared with the ADVO group;▲▲▲P<0.001,when compared with the ADVO+miR-762 mimics NC group.
2.4 各组TPC-1细胞侵袭及迁移情况
与空白组比较,miR-762 mimics组细胞侵袭及迁移数增加(P<0.001),ADVO组细胞侵袭及迁移数减少(P<0.001);与ADVO组比较,ADVO+miR-762 mimics组细胞侵袭及迁移数增加(P<0.001)(图5,图6)。

图5 各组TPC-1细胞侵袭及迁移情况(400×)Figure 5 The invasion and migration of TPC-1 cells treated with ADVO,miR-762 mimics or their combination(400×)

图6 各组TPC-1细胞侵袭及迁移细胞数比较Figure 6 The cellular number of migration and invasion in TPC-1 cells treated with ADVO,miR-762 mimics or their combinationNote:***P<0.001,when compared with the blank group;△△△P<0.001,when compared with the miR-762 mimics NC group;###P<0.001,when compared with the ADVO group;▲▲▲P<0.001,when compared with the ADVO+miR-762 mimics NC group.
2.5 miR-762与NF2基因的靶向关系
经生物信息学分析,NF2基因被预测为miR-762的潜在靶基因(图7)。双荧光素酶报告基因实验结果显示,与mimics NC组比较,miR-762 mimics共转染NF2-WT组的荧光相对活性显著降低(P<0.001),而共转染NF2-MUT组的荧光相对活性无显著性变化(P>0.05)(图8)。

图7 TargetScan靶基因预测结果Figure 7 The prediction results of target gene by TargetScan

图8 各组细胞荧光素酶活性相对变化Figure 8 Relative changes of luciferase activity in each groupNote:***P<0.001,when compared with the mimics NC group.
2.6 各组TPC-1细胞miR-762与NF2 mRNA相对表达情况
与空白组比较,miR-762 mimics组细胞miR-762相对表达水平升高、NF2 mRNA相对表达水平降低(P<0.001),ADVO组miR-762相对表达水平降低、NF2 mRNA相对表达水平升高(P<0.001);与ADVO组比较,ADVO+miR-762 mimics组细胞miR-762相对表达水平升高、NF2 mRNA相对表达水平降低(P<0.001)(图9)。

图9 各组TPC-1细胞中miR-762及NF2 mRNA相对表达水平比较Figure 9 The relative expression of miR-762 and NF2 mRNA in TPC-1 cells in each groupNote:***P<0.001,when compared with the blank group;△△△P<0.001,when compared with the miR-762 mimics NC group;###P<0.001,when compared with the ADVO group;▲▲▲P<0.001,when compared with the ADVO+miR-762 mimics NC group.
2.7 各组TPC-1细胞中蛋白相对表达情况
与空白组相比,miR-762 mimics组细胞Merlin、p-YAP1、C-caspase-3和E-cadherin蛋白相对表达水平降低,YAP1、Vimentin蛋白相对表达水平升高(P<0.001),ADVO组细胞Merlin、p-YAP1、C-caspase-3和E-cadherin蛋白相对表达水平升高,YAP1、Vimentin蛋白相对表达水平降低(P<0.001);与ADVO组比较,ADVO+miR-762 mimics组细胞Merlin、p-YAP1、C-caspase-3和E-cadherin蛋白相对表达水平降低,YAP1、Vimentin蛋白相对表达水平升高(P<0.05)(图10,图11)。
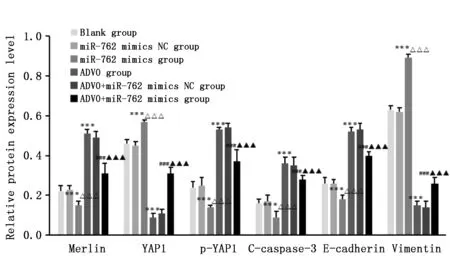
图10 各组TPC-1细胞中相关蛋白相对表达水平Figure 10 The expression of merlin,YAP1,p-YAP1,C-caspase-3,E-cadherin and vimentin proteins in TPC-1 cells in each groupNote:***P<0.001,when compared with the blank group;△△△P<0.001,when compared with the miR-762 mimics NC group;###P<0.001,when compared with the ADVO group;▲▲▲P<0.001,when compared with the ADVO+miR-762 mimics NC group.

图11 各组TPC-1细胞中蛋白表达量Figure 11 The expression of merlin,YAP1,p-YAP1,C-caspase-3,E-cadherin and vimentin proteins in TPC-1 cells in each groupNote:A.The blank group;B.The miR-762 mimics NC group;C.The ADVO group;D.The ADVO+miR-762 mimics NC group;E.The ADVO+miR-762 mimics group;F.The miR-762 mimics group.
3 讨论
甲状腺癌具有广泛异质性,大多数起源于甲状腺滤泡细胞,可细分为高分化乳头状甲状腺癌(Papillary thyroid carcinoma,PTC)和滤泡状甲状腺癌,PTC是最常见的甲状腺癌(约90%),其侵袭性亚型与多灶性、局部和远处转移及复发密切相关[8]。许多miRNAs在癌症(包括甲状腺癌)中异常表达,积极探索调节甲状腺癌进展的miRNA,探讨其分子机制并进行干预,对于甲状腺癌早期诊断、治疗及预后具有积极意义。
细胞增殖、侵袭和迁移被认为是癌细胞恶性行为的最重要生物学特征。在恶性行为背景下,研究发现miR-762表达在肌肉浸润性膀胱癌和卵巢癌中显著上调,并可显著提高癌细胞的增殖及侵袭能力[9-10]。ADVO中含有大量脂肪酸,这些成分可诱导癌细胞凋亡、抑制癌细胞生长及转移并降低患癌风险[7,11]。本研究结果显示,miR-762及AVDO对TPC-1细胞的恶性生物学行为起不同作用,miR-762过表达时,可显著促进TPC-1细胞增殖、迁移、侵袭并抑制其凋亡,AVDO单独作用时,与其效果相反,且ADVO作用于过表达miR-762组细胞时,可显著减弱miR-762的促癌作用,提示AVDO可能通过降低miR-762表达发挥抑制甲状腺癌细胞恶性生物学行为的作用。与经典转录因子相比,miRNA通过调节内源性靶基因的表达发挥作用,本研究通过生物信息学软件预测miR-762靶基因并进行荧光素酶报告基因分析验证,发现miR-762可直接与NF2基因的3′-UTR作用并抑制NF2表达,提示NF2为miR-762的潜在靶基因。NF2是一种编码Merlin蛋白的基因,能够转导细胞内和细胞外信号以调节细胞增殖、凋亡等生物学过程,并作为一种肿瘤抑制基因,与多种人类癌症有关[12]。多项研究表明,NF2基因在肿瘤转移中起重要作用,Garcia等[13]证明,NF2/Merlin失活可导致低分化甲状腺癌病理进展;You等[14]研究结果显示,NF2过表达时,可显著抑制甲状腺癌细胞增殖、迁移及侵袭,在右侧颈淋巴结转移的PTC中,NF2 mRNA表达较低。本研究发现,未处理的癌细胞中,miR-762表达水平较高,NF2 mRNA相对表达水平较低,过表达miR-762后,NF2 mRNA相对表达水平显著降低,但ADVO可通过降低miR-762表达逆转此情况,提示ADVO可能通过降低癌细胞内miR-762表达,上调其靶基因NF2水平进而发挥抗PTC-1细胞恶性生物学行为的作用。
Merlin主要通过激活Hippo通路来调节生长控制[15]。Hippo通路的核心是蛋白激酶级联反应,YAP为该级联中的效应蛋白,且仅在通路不活跃时定位于细胞核,进而控制细胞分化、组织生长、促增殖和抗凋亡基因表达;Hippo通路被激活时,YAP被磷酸化为p-YAP,p-YAP不能进入细胞核并滞留于胞质内被降解、失活,Merlin为YAP灭活剂[16]。上皮-间质转化(Epithelial mesenchymal transformation,EMT)是一种上皮细胞向间充质表型转化的细胞过程,此过程中,上皮细胞获得间充质表型,包括高迁移和侵袭、抗凋亡和降解细胞外基质的能力,同时Vimentin表达上调,E-cadherin表达下调[17]。Lai等[18]研究发现,miR-762表达上调可促进结肠癌增殖、侵袭及EMT;Zheng等[19]研究证明,Hippo信号通路可调节EMT以促进甲状腺癌发展、侵袭及转移,这与p-YAP增加和YAP表达降低有关[20]。Caspase-3为细胞凋亡途径的下游主要效应蛋白酶,其裂解提示细胞凋亡程序的激活,本研究结果显示,miR-762过表达后,Merlin、p-YAP1、C-caspase-3及E-cadherin蛋白相对表达水平显著降低,YAP1及Vimentin蛋白表达显著上调,经ADVO作用后,可逆转此情况,且ADVO作用于过表达miR-762组细胞时,可减弱miR-762效果,提示ADVO可能通过抑制miR-762表达,上调抑癌蛋白Merlin水平从而激活Hippo-YAP信号通路,降低YAP核内表达,进而抑制下游抗凋亡、促增殖及EMT等相关基因转录以发挥抑制PTC-1细胞增殖、迁移及侵袭并促进其凋亡作用。
综上所述,ADVO可抑制甲状腺癌细胞的恶性生物学行为,其作用机制可能与介导miR-762/NF2轴激活抑癌相关信号有关。但本研究仅在细胞水平上进行了探究,关于ADVO在动物水平上对肿瘤形成、发展及恶性转移的影响及机制仍待进一步论证。
