食管癌患者肿瘤异常蛋白与传统肿瘤标志物的相关性分析*
2023-08-05王会平郜赵伟王家伟张丁予
王会平,郜赵伟,陈 曦,龙 敏,和 婷,王家伟,张丁予,董 轲
(空军军医大学第二附属医院检验科,西安 710038)
食管癌(esophageal carcinoma,EC)是威胁人类健康的恶性肿瘤之一,据2020年全球肿瘤流行病统计数据(GLOBOCAN)显示,全球EC的新发病人数约60.4万,死亡人数高达54.4万[1]。我国EC也呈现高发[2],虽然近年发病率及病死率有下降趋势,但EC仍是威胁国人健康及生命的重要恶性肿瘤之一[3]。EC主要有腺癌、鳞癌两类[4],我国以食管鳞癌较为多见[5-7]。多数EC患者确诊时处于中晚期,主要是因为EC早期症状并不明显,临床也缺乏针对EC特异性的血液肿瘤标志物,因此,有必要进一步研究评估EC疗效并监测患者病情进展的标志物。研究显示,正常细胞癌变时,聚糖结构改变可造成血液肿瘤异常蛋白(tumor abnormal protein,TAP)水平升高[8-9];也有研究显示,TAP对多种肿瘤诊疗有较高的临床价值[9-14]。本文将就TAP与传统肿瘤标志物在EC中的相关性进行分析,现将研究结果报道如下。
1 资料与方法
1.1 一般资料
选取本院2021年1-3月经病理学检查确诊的EC患者,纳入患者应具备TAP及同时期传统肿瘤标志物[糖类抗原(CA)72-4、癌胚抗原(CEA)、甲胎蛋白(AFP)、铁蛋白(FRT)、CA19-9、CA125、CA50、鳞状细胞癌相关性抗原(SCC)]的检测结果,最终纳入292例患者,中位年龄65(59,70)岁,男235例,女57例。根据是否手术,将患者分为术前组与术后组,各146例。本研究经本院医学伦理委员会审查,符合伦理学要求(批件编号:TDLL-第202210-06号)。
1.2 方法
1.2.1标本采集
采集EC患者全血2 mL,乙二胺四乙酸(EDTA)抗凝,采用抗凝全血制片进行患者TAP检测;促凝管PC5005采集EC患者全血5 mL,离心后血清用于肿瘤标志物检测。
1.2.2实验室指标检测
(1)TAP检测采用浙江瑞生医疗科技有限公司的异常糖链糖蛋白检测试剂盒(凝集法),应用配套阅片仪进行图片采集及液斑面积测量,最终获取样品TAP检测值(正常范围:< 121 μm2)。(2)传统肿瘤标志物检测主要采用美国罗氏Cobas 8000 e801全自动化学发光免疫分析仪(化学发光免疫法),测定指标包括CA72-4(正常范围:0~6.9 U/mL)、CEA(正常范围:0~5 ng/mL)、AFP(正常范围:0~7 ng/mL)、FRT(正常范围:男性30~400 μg/L,女性13~150 μg/L)、CA19-9(正常范围:0~27 U/mL)、CA125(正常范围:0~35 U/mL)、CA50(正常范围:<20 U/mL);采用重庆科斯迈生物科技有限公司Smart 3000开放式通用检测平台(化学发光免疫法)测定SCC水平(正常范围:<1.2 ng/mL)。
1.3 统计学处理
采用R软件进行统计分析,计量资料(肿瘤标志物水平和年龄)不符合正态分布,采用M(Q1,Q3)表示,比较使用Wilcoxon秩和检验。性别分布为计数资料,以例数或百分比表示,比较采用χ2检验。TAP、CA72-4、CEA、AFP、FRT、CA19-9、CA125、CA50、SCC的相关性采用Spearman相关性分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组性别和年龄比较
术后组年龄明显低于术前组(P<0.05),两组性别构成无明显差异(P>0.05),见表1。

表1 两组性别和年龄比较(n=146)
2.2 两组TAP及传统肿瘤标志物水平和异常率比较
与术前组比较,术后组全血TAP水平和异常率均明显下降(P<0.05),血清CA72-4、CA125水平和异常率均明显升高(P<0.05);两组血清CEA、AFP、FRT、CA19-9、CA50及SCC水平和异常率均无明显差异(P>0.05),见表2、3。
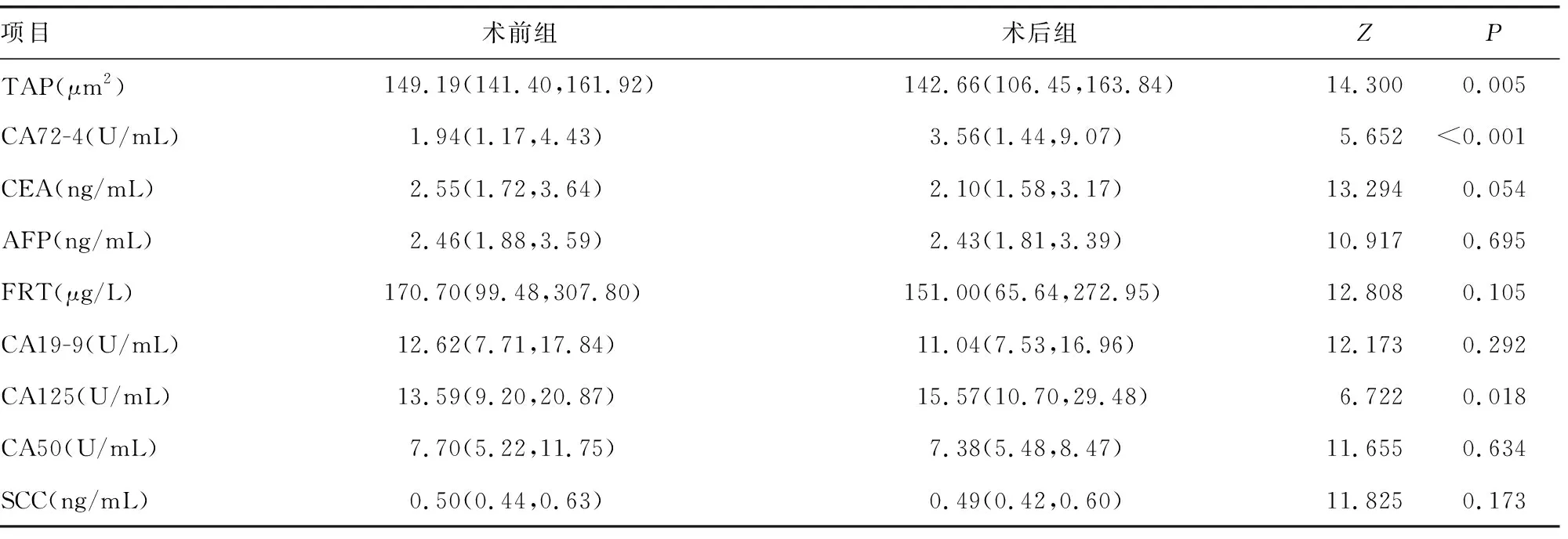
表2 两组TAP及传统肿瘤标志物水平比较(n=146)
2.3 不同肿瘤标志物间的相关性分析
利用Spearman相关性分析EC患者各项肿瘤标志物间的相关性,结果显示:在EC术前组患者中,血清CA19-9与CA50水平呈正相关(r=0.89,P<0.001)且r值最高,其他肿瘤标志物间也相关(均|r|<0.30),见图1A。在EC术后组患者中,血清CA19-9与CA50水平呈正相关(r=0.91,P<0.001)且r值最高,全血TAP水平与血清CA72-4和CA125水平亦呈正相关(均r=0.45,P<0.001),见图1B。

A:术前组;B:术后组。

表3 两组TAP及传统肿瘤标志物异常率比较[n=146,n(%)]
3 讨 论
我国EC高发,虽然自2000年开始发病率有所下降,尤以女性发病率下降趋势明显[3],但EC仍是危害我国人民健康的恶性肿瘤之一。我国EC以鳞癌为主,不良饮食生活习惯与EC发生密切相关,包括烫食、吸烟、饮酒等,此外还包括食品制备方式(霉变、炭烤、烟熏等)、水质、土壤成分和环境等因素。目前,EC的辅助检查除了内镜学检查、影像学检查外,还包含了外周血的肿瘤标志物检查。然而,2022年4月11日国家卫生健康委员会发布的《食管癌诊疗指南(2022年版)》中提到,目前缺乏特异性的EC肿瘤标志物,如循环肿瘤DNA/RNA、循环肿瘤细胞、表观遗传学标记物(非编码RNA、组蛋白修饰、DNA甲基化等)及外泌体等目前还处于研究阶段,一般不推荐用于常规临床诊疗[3]。
肿瘤标志物对不同肿瘤均有一定的灵敏度和特异度,但对EC诊断和预测的意义不大[13]。鳞状细胞癌抗原(SCC-Ag)在多种鳞癌患者血清中呈现高表达状态[15],但在良性食管瘤中常为阴性;在发展到Ⅲ期的EC患者外周血中,SCC阳性率可高达90%,因此SCC可作为EC的诊断指标[16]。TAP与肿瘤进展有关[17],作为广谱肿瘤标志物,其包括CEA、AFP、CA系列等。有文献显示,当患者的癌细胞数量达到106以上时,即可在外周血中检测到TAP的阳性表达[12],TAP检测水平可作为多种肿瘤(乳腺癌[18]、肺癌、肝癌、胃癌及EC等)的早期诊断指标[19]。通过检测外周血TAP水平,可间接反映体内肿瘤细胞的数量变化情况,为肿瘤的诊断、预后提供帮助,并且临床上已在多种肿瘤中应用多年。
本文回顾性分析了EC患者血液TAP和其他8种传统肿瘤标志物(CA72-4、CEA、AFP、FRT、CA19-9、CA125、CA50、SCC)水平,并分析了其相关性,结果显示:(1)EC术前、术后患者全血TAP(P=0.005)、CA72-4(P<0.001)、CA125(P=0.018)水平均有明显差异,其他肿瘤标志物水平在EC术前、术后患者间无明显差异(P>0.05),表明TAP、CA72-4、CA125可能作为EC的诊断及疗效监测指标。(2)EC术前患者TAP异常率明显高于EC术后患者(95.89%vs.70.55%,P<0.001),EC术前患者CA72-4(15.07%vs. 30.82%,P=0.002)、CA125(8.90%vs.17.81%,P=0.039)异常率明显低于EC术后患者,EC术前、术后患者其他肿瘤标志物异常率无明显差异(P>0.05)。全血TAP在EC术后患者中异常率下降,而CA72-4和CA125在EC术后患者血清中水平和异常率升高,可能是因为手术时肿瘤组织遭受破坏引起肿瘤标志物一过性升高。以上结果进一步表明TAP、CA72-4、CA125可用于EC的诊断及疗效监测。(3)在EC术前患者中,只有血清CA19-9与CA50水平相关性分析的r值较高(r=0.89),而其他肿标标志物间相关性分析均|r|<0.30;在EC术后患者中,血清CA19-9与CA50水平相关性分析的r值较高(r=0.91),虽然二者在EC术前、术后患者中的r值均较高,但因异常率较低,仍不宜作为EC筛查和治疗监测指标。此外,在EC术后患者中,全血TAP水平与血清CA72-4和CA125水平亦呈正相关(均r=0.45)。
综上所述,可检测EC患者的TAP、CA72-4和CA125水平,为早期诊断及后续治疗监测提供重要依据。
