烯壳氮化铁纳米磁珠用于捕获肺癌循环肿瘤细胞的初步研究
2023-08-04马文博潘逸群王群马壮王明连杨怡姝
马文博 , 潘逸群 , 王群 , 马壮 , 王明连 , 杨怡姝
1.北京工业大学环境与生命学部,北京 100124;
2.北京工业大学材料与制造学部,北京 100124
肺癌是世界上最常见的恶性肿瘤之一,40%的肺癌患者有转移现象[1],5 年生存率较低[2],转移是癌症相关死亡的主要原因[3-4]。循环肿瘤细胞(circulating tumor cells,CTCs)是存在于外周血中各类肿瘤细胞的统称[5],具有在接种于生态位组织后建立转移性生长的能力,是肿瘤最常见的转移途径[6-7]。CTC 的识别、捕获和分析已成为当前癌症研究中的关键问题[8-9]。但CTC 的半衰期小于3 h[10],且在数百万正常血细胞背景下,CTC的浓度非常低[11-12],因此,需要开发专业化的分选技术。非抗体依赖性的微流体技术分选CTC 存在捕获率低和纯度低的问题[13-14]。在乳腺癌、结肠癌和肺癌等肿瘤细胞表面的上皮细胞粘附分子(epithelial cell adhesion molecule,EpCAM)表达量远高于正常细胞[15-16],因此常采用基于EpCAM 抗体的CTC 捕获方法[17],但由于样本量需求大、制备成本昂贵等原因无法普及[18-19],且现有的免疫磁珠与细胞的生物相容性很低。
王群等[20]报道了一种全新的纳米磁珠,即本研究使用的烯壳氮化铁纳米磁珠(graphene-coated iron nitride magnetic beads,G@FeN-MB),该磁珠为多层石墨烯片包覆的氮化铁纳米磁性颗粒。内核氮化铁相较于传统的氧化铁磁性材料,既具有与纯Fe 相近的饱和磁化强度,又和氧化铁一样有很强的抗氧化性和耐腐蚀能力,在应用方面更具优势[21]。外层的石墨烯壳不仅对内部的氮化铁起到抗氧化、耐酸碱等保护作用,还具有结构稳定、生物相容性好和比表面积较高等优势,有利于细胞分选。此前,本课题组利用Hummers 法修饰G@FeN-MB,将其用于T 细胞分选[22]和特异性捕获假病毒[23]。但Hummers 法利用浓硫酸氧化磁珠,反应过于强烈,容易将表面石墨烯破坏使磁性核漏出,导致壳核结构破坏以及磁性能下降。低温等离子体法修饰磁珠具有温和可控的特点,不会对石墨烯壳造成较大破坏,目前在分选细胞领域有较大潜力,但尚未有报道显示等离子体修饰磁珠在CTC捕获方面的应用。
本研究拟采用等离子体修饰的不同基团的磁珠分别与链霉亲和素结合,由于链霉亲和素与生物素具有极高的亲和力,因此将抗体生物素化偶联至链霉亲和素磁珠进一步制备免疫磁珠,用于捕获CTC。同时,参照已有研究向小鼠或人血液样本中添加不同数量的A549 肺癌细胞[24-26],以模拟CTC在体内的存在情况,进而探讨免疫磁珠对CTC 的捕获能力。
1 材料与方法
1.1 磁性颗粒、细胞和全血
G@FeN-MB:烯壳氮化铁纳米磁珠,由北京工业大学材料与制造学部制备并提供。具有明显的壳核型结构,外壳为石墨烯碳壳,壳本身结构稳定,不易与周围环境相互作用,具有保护内核,防止内核被腐蚀等作用;内核为氮化铁材料,磁响应性优于氧化铁材料。
肺癌细胞A549由本实验室保存,昆明小鼠购自北京维通利华实验动物技术有限公司,人血液样本由健康志愿者提供。
1.2 等离子体氨化/氧化G@FeN-MB
在微波等离子体装置(北京工业大学材料与制造学部)中,使用2.45 GHZ 微波源激发等离子体,打开石墨烯的C-C 键,使石墨烯表面形成C-N键或C=O 键。通入NH3、N2等气体,激发NH3、N2等离子体,使G@FeN-MB 连接氨基等含氮基团,制备氨基烯壳氮化铁磁珠(graphene ammoniated iron nitride magnetic bead,GA@FeN-MB)。通入CO2、O2等气体,激发CO2等离子体,使G@FeN-MB连接羧基等含氧基团,制备羧基烯壳氮化铁磁珠(graphene oxide-coated iron nitride magnetic bead,GO@FeN-MB)。GO@FeN-MB 表面羧基可以与物质的氨基端相连。使用透射电子显微镜(transmission electron microscope,TEM,JEOL 公司)观察等离子体改性后的磁珠壳核结构是否完整,使用红外光谱(fourier transform infrared,FTIR,BRUKER公司)分析磁珠表面官能团。
1.3 GA@FeN-MB 与GO@FeN-MB 吸附能力比较
将1 mg 磁珠用去离子水清洗一次,用100 μL PBS溶液溶解,加入1 mL浓度为1 mg·mL-1的BSA(QIAGEN 公司),常温下在混合器上反应2 h,吸取上清,参照BCA 蛋白定量试剂盒说明书检测未吸附蛋白量。按照公式(1)计算磁珠吸附蛋白量。用纯水洗涤磁珠,检测蛋白在磁珠上的结合紧密程度。
1.4 免疫磁珠的构建
1.4.1氨基免疫磁珠的构建 利用直接吸附法将链霉亲和素(streptavidin,SA,北京索莱宝科技有限公司)与GA@FeN-MB 结合。取1 mg GA@FeNMB 用去离子水清洗一次,用100 μL PBS 溶解,加入200 μL 1 mg·mL-1SA,常温下混合反应2 h,用PBS 洗涤3 次,去除未反应的SA,然后加入1 mL浓度为1 mg·mL-1BSA溶液,4 ℃下混合反应过夜,封闭磁珠,防止非特异性吸附。将制备的氨基链霉亲和素磁珠(amino-streptavidin magnetic bead,A-SAMB)用纯水洗涤3次,溶解在900 μL PBS中,4 ℃储存备用。
按照说明书将EpCAM 抗体(ThermoFisher 公司)进行生物素化,将反应后的混合溶液加入至截留量50 kD超滤管(Millipore公司)中,加入纯水补至500 μL,4 ℃下12 500 r·min-1离心15 min,弃去外管溶液,再补纯水至500 μL,再次离心,重复3次,洗去过量生物素,3 000 r·min-1离心2 min,浓缩样本至约200 μL。
连接A-SAMB与生物素化的抗体。将200 μL生物素化的EpCAM抗体加入至900 μL的A-SAMB溶液中,置于冰上反应10 min,制备氨基免疫磁珠(amino immunomagnetic bead,AIMB)。磁吸附聚集AIMB 后用PBS 洗涤,除去未反应的生物素化抗体,并溶解在1 mL PBS中,4 ℃储存备用。
1.4.2羧基免疫磁珠的构建 通过碳二亚胺活化反应,将带有羧基的GO@FeN-MB与带有氨基的链霉亲和素偶联。具体步骤为:取1 mg GO@FeN-MB用去离子水清洗1次,用25 mmol·L-12-(N-吗咻基)乙磺酸溶液(MES,pH 5.4,北京百灵威科技有限公司)润洗2次。加入900 μL 10 mg·mL-1N-羟基琥珀酰亚胺溶液(NHS,上海共价化学科技有限公司)和1-乙基-(3-二甲基氨基丙基)碳酰二亚胺溶液(EDC,北京迈瑞达科技有限公司)。室温混合反应10 min后,吸去上清液,用MES溶液清洗磁珠3次,除去剩余的NHS、EDC 和反应副产物尿素。加入200 μL 1 mg·mL-1链霉亲和素溶液(溶于MES),常温下混合反应2 h,制备羧基链霉亲和素磁珠(carboxylic-streptavidin magnetic bead,C-SAMB),用PBS洗涤3次,去除未反应的SA。然后加入1 mL浓度为1 mg·mL-1BSA 溶液,4 ℃下混合反应过夜,封闭磁珠,防止非特异性吸附。将制备的C-SAMB洗涤3次,溶解在900 μL PBS中,4 ℃储存备用。
将EpCAM 抗体生物素化并与C-SAMB 偶联的操作同1.4.1,制备的羧基免疫磁珠(carboxylic immunomagnetic bead,CIMB)4 ℃储存备用。
1.5 荧光检测与磁珠偶联的EpCAM 抗体
本研究制备的免疫磁珠偶联顺序为“磁珠-SAEpCAM 抗体”,使用DyLight 488 标记的山羊抗小鼠的第二抗体(EarthOx 公司)与磁珠上的EpCAM抗体进行偶联,以验证磁珠是否与EpCAM 抗体连接成功。避光条件下,按照说明书向制备好并封闭完全的200 μL免疫磁珠中加入2 μL DyLight 488荧光标记的二抗,常温下混合反应1 h,用PBS 洗涤3 次,并在荧光显微镜(Leica 公司)下观察结合颗粒在吸收光谱495 nm、发射光谱521 nm 处的荧光,利用多功能酶标仪(PerkinElmer 公司)检测荧光强度。
1.6 免疫磁珠捕获细胞实验
1.6.1免疫磁珠捕获细胞并检测捕获效果 用含1% FBS 的PBS 缓冲液制备A549 细胞悬液,以1.55×105个·孔-1接种24孔板,每孔体积约为1 mL。向每孔细胞中加入1 mL 1 mg·mL-1磁珠,室温下混合反应10 min,使细胞与抗体充分结合。将24孔板放置在磁铁块上,静置等待磁力固定磁珠并与之相连的细胞,3 min 后吸出上清,上清液中的细胞保存至无菌1.5 mL EP 管中,计未捕获细胞数。采用公式(2)计算捕获细胞数,通过公式(3)计算细胞捕获效率。
免疫荧光法观察被捕获的细胞。用PBS缓冲液洗涤细胞和磁珠的聚合物沉淀,重新置24 孔板于磁铁块上,洗去游离的未捕获细胞3~4 次。加入100 μL 完全培养基重悬磁珠和与其相连的细胞,加至35 mm 共聚焦培养皿(NEST 公司)中,再加入400 μL 4%多聚甲醛(pH 7.4,Beyotime 公司),37 ℃固定细胞10 min。加入500 μL 含2%BSA 的PBS 缓冲液,室温封闭60 min。用含2%BSA 的PBS 按照1∶500 比例稀释EpCAM 抗体,然后加入至细胞中,室温孵育3 h,弃去一抗溶液,用PBS 缓冲液洗涤细胞3 次。在避光条件下,用含2% BSA 的PBS 缓冲液按照1∶100 稀释比例稀释FITC标记的荧光二抗(Proteintech Group公司),并加入至细胞中,室温孵育1 h,用PBS 缓冲液洗涤细胞3次。加入20 μL细胞核复染剂(DAPI,Beyotime 公司),在避光室温条件下孵育45 min,PBS缓冲液洗涤细胞3 次,用共聚焦激光扫描显微镜(Nikon公司)观察。
使用CCK8 试剂(Beyotime 公司)检测捕获细胞数量。用完全培养基重悬磁珠和与其相连的细胞,在96孔板中加入细胞与磁珠悬液,每孔100 μL。同时设定单纯培养基组作为空白对照。每孔各加入10 μL CCK8 试剂。将96 孔板放入培养箱中孵育2 h,酶标仪测定450 nm处的吸光值。
1.6.2免疫磁珠分选CTC细胞并检测捕获效果 参照文献将不同数量的A549 加入至小鼠或人的血液中模拟CTC[24-26]。
取昆明小鼠血于抗凝管中,2 500 r·min-1离心10 min,弃血清,用1 mL PBS 缓冲液重悬血细胞。将含有104、103、102个A549的3种不同数量的细胞溶液加入至1 mL 含106个小鼠血细胞溶液中,制备不同浓度的细胞混液。向每份细胞混液中分别加入300 μg AIMB,室温下混合反应10 min,使磁珠与细胞充分反应,在磁铁块上静置3 min,待磁珠聚集,弃上清。被磁珠捕获的细胞用PBS 缓冲液清洗3 次,用完全培养基重悬培养12 h 后,用EpCAM抗体、FITC标记的荧光二抗做免疫荧光实验,用共聚焦激光扫描显微镜观察。
取正常人血于抗凝管中,在1 mL 健康人血中分别掺入10、20、50、100、200 个A549,以制备不同浓度的细胞混液。参照说明书向细胞混液中分别加入3 mL 红细胞裂解液(北京索莱宝科技有限公司),1 500 r·min-1离心5 min,弃上清,加入1 mL PBS 缓冲液重悬细胞沉淀。向每份细胞混液中各加入300 μg AIMB,室温下震荡10 min,在磁力架上静置3 min待磁珠聚集,弃去上清液。被磁珠捕获的细胞用PBS 缓冲液清洗3 次,用完全培养基重悬培养12 h。用EpCAM抗体、FITC标记的荧光二抗及PE标记的CD45抗体进行免疫荧光实验,用共聚焦激光扫描显微镜观察并计数。共设4次重复。
1.7 统计分析
2 结果与分析
2.1 烯壳氮化铁纳米磁珠的表征
TEM结果如图1所示,GA@FeN-MB与GO@FeNMB 的壳核结构相对完整。磁珠的磁性内核氮化铁颗粒直径约为10~40 nm,石墨烯片包覆壳为多层结构,约5 nm,外层的石墨烯壳可对内部的氮化铁起到保护作用。

图1 GA@FeN-MB与GO@FeN-MB的透射电镜表征Fig. 1 Transmission electron microscopy characterization of GA@FeN-MB and GO@FeN-MB
利用红外光谱分析磁珠表面官能团,如图2A所示,GA@FeN-MB 在3 450 cm-1处有明显的吸收峰,提示存在N-H基团,且强度大于GO@FeN-MB。GO@FeN-MB在1 630 cm-1、1 100~750 cm-1、585 cm-1处有明显吸收峰,提示存在羧基C=O、C-O 振动特征峰,印证了GO@FeN-MB含有所需的羧基及其他含氧基团;GO@FeN-MB 在2 900 cm-1、2 300 cm-1、1 500~1 200 cm-1处有吸收峰,提示GO@FeN-MB存在C-H与苯环特征峰,然而GA@FeN-MB在这几处均发现明显吸收峰,说明GA@FeN-MB比GO@FeNMB 保存了更完整的二维苯六元环结构,因此GA@FeN-MB 比GO@FeN-MB 更稳定。GA@FeNMB 和GO@FeN-MB 在4 000~3 300 cm-1处高波数端,有官能团O-H 的伸缩振动吸收带,说明其亲水基团增加,水溶性增加。图2B 显示,A-SAMB 与GA@FeN-MB 相比,吸收峰变化并不明显,可见石墨烯吸附蛋白对磁珠表面官能团影响不大,但ASAMB 在2 900 cm-1、2 300 cm-1、600 cm-1有吸收峰变化,提示A-SAMB 存在C-H 与苯环特征峰,可能是因为在制备A-SAMB时,石墨烯的二维结构发生变化,部分结构变成三维。图2C 显示,C-SAMB与GO@FeN-MB相比,在3 400 cm-1处、1 630 cm-1处吸收峰略有加深,1 100 cm-1~750 cm-1处的吸收峰减少,585 cm-1处吸收峰深度有较大幅度缩小,提示GO@FeN-MB 表面羧基及含氧基团被消耗,又因连接的蛋白上有羧基与氨基基团,因此基团总量变化不大,其他官能团的吸收峰变化并不明显。

图2 烯壳氮化铁磁珠与其功能化后的SAMB的红外光谱分析Fig. 2 FTIR of the magnetic beads and their functionalized SAMBs
2.2 磁珠的吸附能力比较
对3 种烯壳氮化铁磁珠吸附蛋白能力进行比较,由图3 可知,GA@FeN-MB 的吸附蛋白量远远大于G@FeN-MB,与GO@FeN-MB 的吸附量接近,但GA@FeN-MB 的标准差小于GO@FeN-MB,这提示GA@FeN-MB 吸附蛋白性能更稳定;而洗脱蛋白量结果表明GA@FeN-MB 被洗脱下来的蛋白少于GO@FeN-MB(P<0.005),说明GA@FeN-MB 吸附的蛋白比GO@FeN-MB 更多、更牢固。虽然石墨烯表面引入氨基与羧基等基团均可提高石墨烯与分子间相互作用的范德华力,但由于链霉亲和素带负电呈酸性,易与氨基等碱性基团形成氢键与盐桥,这2 种键形成的能量通常比普通共价键低,而比范德华力要高得多,因此,GA@FeN-MB要比GO@FeN-MB吸附蛋白性能稳定。
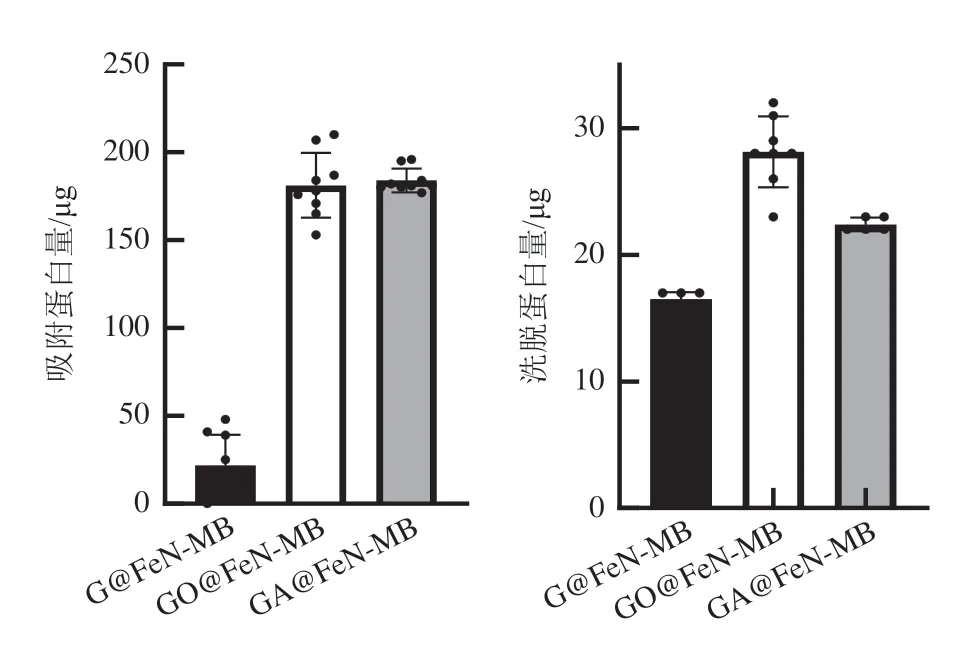
图3 3种烯壳氮化铁磁珠吸附蛋白能力比较Fig. 3 Comparison of the ability of three kinds of GO@FeNMB to adsorb proteins
2.3 验证磁珠与抗体的偶联
图4A~B 显示,2 种免疫磁珠在荧光显微镜下均可观察到绿色荧光,说明抗体与磁珠偶联成功;采用酶标仪测量免疫磁珠与对照组磁珠的荧光强度,由图4C可知,2种免疫磁珠的荧光强度远远大于对照组磁珠,且AIMB 与CIMB 的荧光强度无明显差异,提示2 种磁珠均能成功偶联EpCAM 抗体制备成为免疫磁珠。其中制备AIMB 的直接吸附法较制备CIMB的碳二亚胺法操作更为简单。

图4 2种磁珠与EpCAM抗体偶联的结果Fig. 4 Results of two magnetic beads coupled to EpCAM antibodies
2.4 免疫磁珠捕获A549肺癌细胞
将捕获后的A549肺癌细胞进行免疫荧光染色,共聚焦激光扫描显微镜显示EpCAM 阳性表达(绿色),DAPI阳性表达(蓝色)的细胞为A549(图5),且2种免疫磁珠都能捕获A549。

图5 免疫磁珠捕获细胞后免疫荧光观察结果Fig. 5 Immunofluorescence observations after cells were captured by IMB
使用CCK-8试剂检测磁珠捕获A549的能力,结果如图6所示,AIMB捕获的细胞数量大于CIMB,且免疫磁珠与其他磁珠的捕获结果有显著性统计学差异(P<0.001),提示免疫磁珠捕获A549 的能力强于未偶联抗体的磁珠。

图6 CCK-8法检测免疫磁珠捕获A549的能力Fig. 6 The CCK-8 method detected the ability of immunomagnetic beads to capture A549
如图7 所示,CIMB 的捕获效率为85.08%±2.02%,C-SAMB 的捕获细胞率为27.82%±8.47%,GO@FeN-MB 的捕获细胞率为10.08%±10.08%,CIMB的捕获效率远高于C-SAMB和GO@FeN-MB;AIMB 的捕获效率为93.34%±1.21%,A-SAMB 的捕获细胞率为29.84%±10.49%,GA@FeN-MB 的捕获细胞率为18.95%±0.40%,AIMB 的捕获效率远高于A-SAMB 和GA@FeN-MB。同时,AIMB 与CIMB的捕获效率无明显差别。
2.5 AIMB从小鼠血中分选A549肺癌细胞
使用AIMB 对小鼠血中A549 进行分选,并对分离的细胞进行免疫染色鉴定,DAPI 阳性表达(蓝色),EpCAM 阳性表达(绿色)为A549。图8显示AIMB能从小鼠血中捕获A549。

图8 免疫磁珠从小鼠细胞混液捕获A549后免疫荧光观察结果Fig. 8 Immunofluorescence observation of A549 captured from mouse cells mixture by AIMBs
2.6 AIMB从人血中分选A549肺癌细胞
图9显示,DAPI 阳性表达(蓝色),EpCAM阳性表达(绿色),CD45 阴性表达(无红色)为A549;DAPI 阳性表达(蓝色),EpCAM 阴性表达(无绿色),CD45 阳性表达(红色)为白细胞。区分A549 与白细胞后,分别计数A549 和白细胞的数量,计算捕获效率与纯度。表1 显示,AIMB 捕获A549 的效率在66.25%~81.50%之间,纯度约为50%。如图10 所示,AIMB 捕获的CTC 数量与掺入的A549 数量呈线性关系(R2=0.990 7,P<0.001)。

图9 磁珠从人血细胞混液捕获CTC后免疫荧光观察结果Fig. 9 Immunofluorescence observation of CTCs captured from human blood cells mixture by AIMBs

图10 AIMB捕获CTC数量线性关系Fig. 10 Linear relationship of AIMBs captured CTCs number
3 讨论
肺癌患者长期存活率低与肿瘤细胞扩散有关,肿瘤细胞扩散会导致肿瘤转移或复发。因此,血液中循环肿瘤细胞的检测对于预测肿瘤复发、提高生存率具有重要意义。检测血液中肺癌循环肿瘤细胞的常用技术包括抗体依赖性磁珠捕获技术和非抗体依赖性流体捕获技术,其中非抗体依赖性流体捕获技术存在纯度低的问题。抗体依赖性免疫磁珠捕获CTC 的方法具有操作简便、快捷等特点,但存在样本需求量大和制备成本昂贵等问题。因此,本研究通过改进磁珠和简化分选过程,提供了一种基于抗EpCAM 的磁性颗粒分离CTC的方法。
石墨烯是一种单层厚度的二维材料,其比表面积非常高,是同等质量三维材料的数百倍,这使得石墨烯能够有效地吸附分子。红外光谱分析结果显示,GA@FeN-MB 的二维结构比GO@FeN-MB完整,因此GA@FeN-MB 的吸附能力更好。先前研究显示,石墨烯由碳原子组成的六元环构成,具有特殊的电子结构和化学活性,使其能够与各种分子相互作用,并吸附在表面。而氨基等官能团可以提供孤对电子,使石墨烯表面具有一定的亲电性,从而与部分带正电荷的分子发生范德华力相互作用;此外,氨基等官能团还可以与一些具有酸性的分子形成酸碱配对,进一步增强吸附能力。链霉亲和素是一种糖蛋白,由多个糖基组成,糖基通常带负电,即呈酸性,因此GA@FeN-MB 的吸附能力优于GO@FeN-MB。
与其他检测CTC 的方法相比,本研究建立的方法简单、快速且成本低。首先,本研究的磁珠可现用现制,便于贮存。通常已连接抗体的磁珠存在不易保存、抗体易失活等问题,本研究的磁珠现用现制,在使用时将抗体生物素化后连接在链霉亲和素磁珠上,保证了抗体的活性,不需要特殊的保存管。其次,制备方法方便快捷。本研究所使用的试剂与材料,如链霉亲和素、PBS 缓冲液等都是实验室常见试剂。第三,整个操作过程简单,没有繁琐的步骤。AIMB 制备更简单快捷,且捕获效率不低于CIMB,因此,选用AIMB 进行小鼠或人血液CTC 的捕获实验。若在后续实验中需要去除磁珠分析CTC,直接吸附法制备的AIMB 比碳二亚胺法制备的CIMB更容易去除。
血液中主要的细胞成分是红细胞和白细胞,通过红细胞裂解液可剔除大多数红细胞。CD45是所有白细胞的共同抗原,EpCAM 是肿瘤细胞最常见的抗原,结合DAPI 对细胞核进行染色,可以区分CTC 与白细胞。通常,捕获CTC 的纯度为40%~50%[27-28],本研究结果表明,烯壳氮化铁纳米磁珠经过功能化修饰后,能有效地捕获A549肿瘤细胞,纯度为50%左右。
通常情况下,检测外周血中的CTC 需要7.5 mL以上的血样[18,29-30],而本研究建立的方法只需要1 mL 血液样本,对样本的需求量减少,这意味着更容易被志愿者和患者接受。
虽然使用EpCAM 抗体的免疫磁珠对乳腺癌CTC 的回收率为70%~82%[31],但对非小细胞肺癌CTC 的回收率无准确数值。需要注意的是,基于免疫磁珠的CTC 捕获效率可能因癌症类型、疾病阶段和所用样品制备方法等多种因素而异。将A549 细胞加入1 mL 血液样本中,用本研究建立的方法进行检测,其回收率在66.25%~81.50%之间,表明该方法有较高的灵敏度。
综上所述,本研究建立了一种简便的检测肺癌循环肿瘤细胞的方法。CTC的检测对肺癌的诊断、预后和治疗具有重要意义,烯壳氮化铁纳米磁珠这种新的材料可能在今后的肺癌临床研究中有相当大的潜在价值。
